埃索美拉唑镁肠溶微丸型片剂的制备
2018-03-09刘秀敏许卫锋
刘秀敏 许卫锋


[摘要]目的 研究埃索美拉唑镁肠溶微丸型片剂的制备方法。方法 采用流化床底喷包衣法制备埃索美拉唑镁肠溶微丸,将肠溶微丸与适合的辅料混合,采用直接压片法制备埃索美拉唑镁肠溶微丸型片剂。结果 含药层以7%的HPC-SSL水溶液为粘合剂,加入5%的埃索美拉唑镁原料和3%的滑石粉为抗粘剂,对空白丸芯上药,制备成含药微丸;隔离层以5%HPC-SSL水溶液为包衣材料,包衣增重15%~20%;肠溶材料Eudragit L30D-55/NE30D 为9∶1,增重40%,肠溶微丸/辅料(乳糖/微晶纤维素/PVPP,140∶80∶25)为1∶1时,肠溶片在0.1 mol/L盐酸中2 h耐酸力<10%,pH 6.8磷酸盐缓冲液中30 min释放度>75%。结论 通过上述方法制备的埃索美拉唑镁肠溶微丸片的释药行为较好,有望应用于工业生产。
[关键词]埃索美拉唑镁;肠溶微丸;微丸压片
[中图分类号] R944.4 [文献标识码] A [文章编号] 1674-4721(2018)1(a)-0011-05
[Abstract]Objective To Study on the preparation method of Esomeprazole Magnesium enteric-coated pellets-type tablets.Methods The enteric-coated Esomeprazole Magnesium pellets were prepared by fluid bed bottom spray coating method,the Esomeprazole Magnesium pellets were prepared by direct compression of the enteric-coated pellets and suitable excipients.Results The drug layer contained 7% of the HPC-SSL aqueous solution as the binder,adding 5% of the Esomeprazole Magnesium raw materials and 3% talc as anti-binder agent,prepared into drug-containing pellets.Isolation layer contained 5% HPC-SSL aqueous solution as the coating material,coating weight gain of 15% to 20%.The ratio of enteric materials Eudragit L30D-55/NE30D was 9∶1,the coating weight gain was 40%,enteric-coated pellets/excipients (Lactose/MCC/PVPP=140∶80∶25) was 1∶1,the enteric-coated tablets releasen in 0.1 mol/L hydrochloric acid in 2 h was less than 10%,while in pH 6.8 Phosphate buffer in 45 min was more than 75%.Conclusion The release behavior of Esomeprazole Magnesium enteric-coated pellets prepared by the above method is preferred,and it may be used in industrial production.
[Key words]Esomeprazole Magnesium;Enteric-coated pellet;Tabletting of pellet
埃索美拉唑镁是奥美拉唑的S-构型旋光异构体[1],是新一代的质子泵抑制剂(proton pump inhibitor,PPI)[2],通过抑制胃壁细胞质子泵而减少胃酸的分泌,主要用于预防和治疗与胃酸相关的疾病,包括胃食管反流性疾病[3]、糜烂性反流性食管炎、消化性溃疡[4-5]等。研究显示,其疗效明显优于奥美拉唑[6]、兰索拉唑[7]、雷贝拉唑和泮托拉唑[8]等产品,抑酸效率更高,安全性更好,个体差异更小。
本研究拟将埃索美拉唑镁制成肠溶微丸型片剂,口服后在肠道分解成肠溶微丸而起效。微丸型片剂同时具有片剂和微丸的优点[9-11],储存方便,可灵活分割剂量,且分割后仍能保持原来的释药特性;口服后在消化道内的分布均匀,可以避免局部浓度太大对消化道的刺激,降低不良反应,提高生物利用度;其在胃肠道的转运相对恒定,能够避免剂量突释现象,保证临床用药的安全性,个别单元包衣的失败不影响整体制剂单元释药行为的改变[12]。
本研究拟采用流化床底喷包衣法制备埃索美拉唑镁肠溶微丸,然后与其他辅料压制成微丸片,并对肠溶微丸及微丸片进行质量控制,验证工艺的可行性。
1仪器与试药
1.1儀器
1100型高效液相色谱仪(美国Agilent公司);ZRS-8G型智能溶出仪(天津天大天发);BS124S分析天平[赛多利斯科学仪器(北京)有限公司];PHS-3C型精密pH计(上海精密科学仪器有限公司);ZP9A型旋转压片机(辽宁天亿机械有限公司);YD-1型片剂硬度仪(天津市光学仪器厂);Mini-DPL型流化床包衣设备(重庆精工制药机械有限责任公司)。
1.2试药
埃索美拉唑镁原料(江苏中邦制药有限公司,批号:20161101);奥美拉唑对照品(中国食品药品检定研究院,批号:100367-201604,HPLC含量为99.8%);埃索美拉唑镁肠溶微丸片原研制剂(商品名:耐信,阿利斯康制药,批号:1608064);空白丸芯(上海卡乐康包衣技术有限公司);HPC-SSL(日本信越化学株式会社);滑石粉(安徽山河药用辅料有限公司);吐温80(江苏晨牌药业有限公司);尤特奇L30D-55和尤特奇NE30D(德国Degussa公司);枸橼酸三乙酯(TEC,北京精求化工有限责任公司);预胶化淀粉(安徽山河药用辅料有限公司);微晶纤维素(PH102型,美国FMC有限公司);乳糖(德国Meggle公司);交联聚维酮(巴斯夫中国有限公司);硬脂富马酸钠(国药集团化学试剂有限公司),其他试剂均为分析纯。endprint
1.3方法
1.3.1含量测定
1.3.1.1色谱条件
按照高效液相色谱法(中国药典2015年版二部附录Ⅴ D)测定,采用十八烷基硅烷键合硅胶为填充剂,以磷酸盐缓冲液(pH 7.3)-乙腈(65:35)为流动相;流速为1 ml/min;柱温为35℃;检测波长为302 nm;进样量为20 μl。
1.3.1.2溶液的制备
1.3.1.2.1对照品溶液的配制 取奥美拉唑对照品20 mg,精密称定,置于100 ml量瓶中,加乙醇10 ml和磷酸盐缓冲液(pH 11.0)稀释至刻度,摇匀,精密量取10 ml,置于50 ml棕色量瓶中,加水稀释至刻度,摇匀即可。
1.3.1.2.2微丸含量供试品溶液的配制 取微丸适量(约相当于埃索美拉唑20 mg),置于100 ml容量瓶中,加乙醇20 ml,超声处理10 min,加磷酸盐缓冲液(pH 11.0)稀释至刻度,摇匀,滤过。精密量取10 ml,置50 ml棕色量瓶中,加水稀释至刻度,摇匀,即得到。
1.3.1.2.3微丸片含量供试品溶液的配制 取微丸片10片,研细,精密称取适量(约相当于埃索美拉唑20 mg),其他步骤同微丸含量供试品溶液。分别取对照品溶液、微丸含量供试品溶液、微丸片含量供试品溶液注入液相色谱仪,按上述色谱条件检测并记录色谱图。
1.3.2耐酸力的测定[13]
按照《中国药典》2015版附录XC第二法,以0.1 mol/L盐酸溶液500 ml为溶出介质,转速为100 r/min,2 h后,将溶出介质弃去,用水冲洗溶出杯内颗粒,照“含量测定”项下方法制备样品溶液。另取奥美拉唑对照品适量,同法配制成对照品溶液,按高效液相色谱外标法测定并计算剩余药物含量,每粒含量不得少于标示量的90%。
1.3.3释放度的测定[13]
按照《中国药典》2015版附录XD第二法,以0.1 mol/L盐酸溶液500 ml为释放介质,转速为100 r/min,2 h后,在盐酸溶液中加入预热至37℃的0.235 mol/L磷酸氢二钠溶液400 ml,转速不变,继续释放。在30 min 时取样滤过,作为供试品溶液。另精密称取奥美拉唑对照品适量,配制成约20 μg/ml的溶液作为对照品溶液。按照含量测定项下的色谱条件,分别取对照品溶液和供试品溶液20 μl注入液相色谱仪,记录色谱图,按外标法以峰面积计算释放量,限度为标示量的75%,应符合规定。
2结果
2.1含药微丸的制备
取纯化水适量,边搅拌边加入处方量的HPC-SSL作为黏合剂,待溶解后,加入适量磷酸二氢钠调pH至11.0,待溶解完全后,加入处方量的滑石粉作为抗粘剂,最后加入处方量的埃索美拉唑镁原料,并配置成混悬液。称取空白丸芯20 g置流化床内,采用流化床底喷上药法,控制温度37~39℃,雾化压力0.10~0.15 MPa,风量25 Hz,流速0.6~1.0 ml/min。所制药丸于40℃烘箱过夜。
2.2隔离微丸的制备
以5%的HPC-SSL水溶液为粘合剂,与适量滑石粉混合均匀后,配制成包衣液。然后用流化床底喷工艺包衣,控制温度37~39℃,雾化压力0.10~0.15 MPa,风量25 Hz,流速0.4~0.8 ml/min。包衣增重15%,包衣结束后保持物料于38℃流化状态干燥20 min,过筛,整粒。
2.3肠溶微丸的制备
分别称取尤特奇L30D-55 90 g,尤特奇NE30D 10 g,单硬脂酸甘油酸1.5 g,枸橼酸三乙酯4.5 g,吐温800.6 g,备用。约处方量1/3的水加热至70℃以上,加入处方量的单硬脂酸甘油酯和吐温80,待其完全溶解后趁热乳化,加入剩余处方量的水,摇匀。将处方量的尤特奇L30D-55 90 g、尤特奇NE30D和枸橼酸三乙酯缓慢加入上述溶液中,即得包衣液。将包有隔离层的微丸30 g放入流化床中,采用底喷方式,控制温度30~32℃,雾化压力0.10~0.15 MPa,风量25 Hz,流速1.0~1.5 ml/min。包衣增重40%,待肠溶包衣结束后,于40℃烘箱中放置过夜。
2.4微丸型片剂的制备
将肠溶微丸与适合辅料混合均匀后,加入润滑剂,采用粉末直接压片法在10 kg压力下压制成平均片重为500 mg的异形片。
2.5处方筛选
2.5.1含药微丸处方筛选
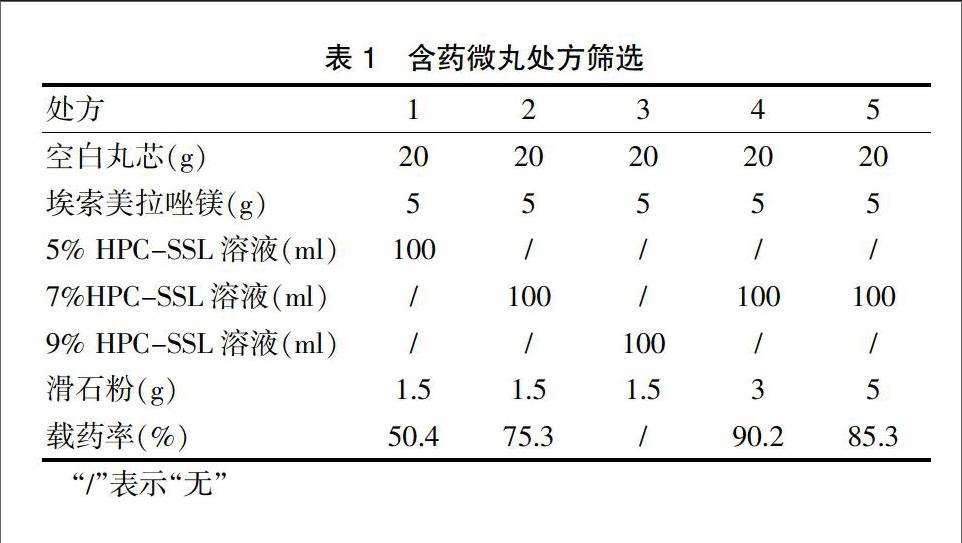
通过单因素考察,以埃索美拉唑镁的载药率[载药率(%)=微丸含药量×微丸重量/投药量×100%]作为評价指标,考察了粘合剂浓度和滑石粉的用量对含药微丸的影响,处方及结果见表1。
由试验结果可知,当粘合剂浓度为5%时,粘合剂的浓度较低,导致含药微丸的载药率偏低;当粘合剂浓度为7%时,微丸的载药率提高,但是有部分粘连,当粘合剂浓度为9%时,微丸粘连严重,无法计算载药率,因此,选择处方7%粘合剂浓度为基础处方。同时由表1可知,当提高滑石粉的用量为3 g时,含药微丸的载药率提高,当滑石粉用量为5 g时,由于抗粘剂用量过大,导致微丸的载药率降低,因此选择滑石粉用量为3 g,选择处方4为最终处方。
2.5.2隔离层增重对药物稳定性的影响
由于埃索美拉唑镁结构中含有亚砜基结构,该结构对光、湿、酸等条件十分敏感,遇酸迅速分解,而肠溶包衣材料尤特奇L30D-55显酸性,因此,为保证药物的稳定性,需在含药层和肠溶层之间包隔离层,隔离层的增重对药物的稳定性影响较大,当隔离层增重太少时,无法阻止肠溶层对药物的影响,使药物降解;如果隔离层太厚,则影响药物的释放。经过反复试验发现,隔离层增重<15%时,包肠溶材料时微丸变红,而隔离层增重>20%时,药物的释放变慢,因此,选择隔离层增重为15%~20%。endprint
2.5.3肠溶层处方筛选
Eudragit L30D-55是常用的肠溶包衣材料,由甲基丙烯酸-丙烯酸丁酯(1∶1)组成。其在酸中不溶,在pH>5.5介质中溶解。Eudragit NE30D为非pH依赖性包衣材料,有较好的延展性和韧性。根据药物的释放要求,可将Eudragit L30D-55/NE30D以一定比例混合后调整衣膜韧性[14]。通过单因素考察,考察了肠溶层材料(尤特奇L30D-55和尤特奇NE30D)的比例及肠溶层增重对埃索美拉唑镁肠溶微丸释放度的影响。
2.5.3.1肠溶材料对药物释放度的影响
分别配制Eudragit L30D-55/NE30D的质量比为10∶0、9∶1、8∶2的包衣液,对隔离微丸进行包衣,并测定耐酸力和释放度,曲线如图1所示。由图可知,随着Eudragit NE30D比例的增加,药物的释放变慢。当Eudragit L30D-55/NE30D的质量比为10∶0和9∶1时,药物释放变化不大,但当比例为8∶2时,药物释放明显变慢。Eudragit L30D-55/NE30D的质量比为10∶0时,压片后药物的耐酸力>10%,因此综合考虑,确定Eudragit L30D-55/NE30D的质量比为9∶1。
2.5.3.2包衣增重对药物释放度的影响
配制Eudragit L30D/NE30D质量比为9∶1的包衣液,包衣增重分别为30%、35%、40%、50%,并测定肠溶微丸的耐酸力和释放度,结果如图2所示。由图可知,包衣增重越多,药物在酸性介质中的释放越少。当包衣增重为30%时,药物在算中释放量(耐酸力)>10%,而当包衣增重≥35%时,微丸型片在酸性介质中的释放量<10%,但当包衣增重达到50%时,药物在肠液中的释放变慢,肠液中30 min内释放量<75%,综合考虑,选择包衣增重为40%。
2.5.4自制样品与上市样品的比较
将制得的肠溶微丸按“耐酸力”和“释放度的测定”项下方法测定片剂的耐酸力和释放度,并与上市样品(耐信)进行比较,结果见图3。
2.5.5不同辅料对片剂的影响
将肠溶微丸和片剂辅料以1∶1的比例进行压片[15]。分别以片剂常用的辅料预胶化淀粉、乳糖、微晶纤维素为稀释剂,并加入交联聚维酮为崩解剂,以硬脂富马酸钠为润滑剂,对处方进行筛选,设计的处方见表2。
分别以胶化淀粉、乳糖、微晶纤维素为辅料,按表2中处方量与埃索美拉唑镁肠溶微丸250 mg混匀,并加入交联聚维酮(PVPP)为崩解剂,0.1%硬脂富马酸钠为润滑剂。在相同压力下(10 kg)压制平均片重为500 mg的异形片。
以片剂的外观、硬度、可压性为考察指标,对片剂进行处方筛选。片面若有斑点、粘连现象即为粗糙,硬度在5 kg以下即为可压性较差,结果见表3。
由表3可知,处方6的片面比较粗糙,硬度较小,说明可压性较差,处方7加入微晶纤维素后可压性得到改善,但并不明显。处方8片面比较光滑,但是硬度还是较小,提示可压性较差;处方9和10提高了微晶纤维素的用量,片剂的片面外观和可压性均较好。
将处方9和处方10按“释放度的测定”项下方法测定片剂释放度,具体见图4。结果显示,处方9的释放度较慢,处方10的释放度较好。故最终确定处方10为最终处方。
2.5.6埃索美拉唑镁微丸片的释药特性
依照上述得到的结果制备3批埃索美拉唑镁肠溶微丸片,分别测定体外释放度,考察工艺的重现性,结果见图5,提示工艺重现性良好,3批样品体外释放曲线重合度很高,无显著性差异。
3讨论
本实验最终确立了含药层处方,以7%的HPC-SSL水溶液为粘合剂,加入5%的埃索美拉唑镁原料和3%的滑石粉为抗粘劑,配置成含药溶液,对空白丸芯进行底喷上药,制备成含药微丸;以5%HPC-SSL水溶液对含药微丸包隔离层,隔离层增重15%~20%;以质量比为9∶1的Eudragit L30D-55-Eudragit NE30D混合材料作为肠包衣材料,包衣增重为40%,以乳糖、微晶纤维素、交联聚维酮、硬脂富马酸钠为压片用辅料,与肠溶微丸按质量比为1∶1的比例压制成约500 mg的片剂。该肠溶微丸型片剂的体外释放情况满足溶出要求,制备工艺重现性好,工艺成熟,适合工业化大规模生产。
[参考文献]
[1]张闪闪,吴燕,张福成.高效液相色谱法测定埃索美拉唑镁肠溶片的有关物质[J].中国医院药学杂志,2016,36(19):1704-1708.
[2]徐桂清,毛伸,毛龙飞,等.埃索美拉唑镁的合成工艺研究[J].化学研究与应用,2017,29(5):727-732.
[3]Szucs T,Thalmann C,Michetti P,et al.Cost analysis of long-term treatment of patients with symptomatic gastroesophageal reflux disease (GERD) with esomeprazole on-demand treatment or esomeprazole continuous treatment:an open,randomized,multicenter study in Switzerland[J].J Value Health,2009, 12(2):273-281.
[4]Barkun AN,Sung JJ,Kuipers EJ,et al.Intravenous esomeprazole for prevention of peptic ulcer rebleeding in a predominantly caucasian population:results on clinical benefits and hospital resource use[J].J Gastroenterol,2009,136(5):A43-A49.endprint
[5]Song J,Guo B,Yao L,et al.The clinical study of ilaprazole on duodenal ulcer,a randomize study compared with esomeprazole[J].J Gastroenterol,2010,138(5):S166-S167.
[6]张岚.埃索美拉唑和奥美拉唑治疗反流性食管炎的比较[J].中国中医药现代远程教育,2008,6(8):839-840.
[7]R■hss K,Hasselgren G,Hedenstr■m H.Effect of esomeprazole 40 mg vs omeprazole 40 mg on 24-hour intragastric pH in patients with symptoms of gastroesophageal reflux disease [J].Dig Dis Sci,2002,47(5):954-958.
[8]Wilder-Smith CH,R■hss K,Nilsson-Pieschl C,et al.Esomeprazole 40 mg provides improved intragastric acid control as compared with lansoprazole 30 mg and rabeprazole 20 mg in healthy volunteers[J].Digestion,2003,68(4):184-188.
[9]马晓丽,吴正红,祁小乐,等.口服多元释药系统研究进展[J].药学与临床研究,2012,20(2):152-155.
[10]张媚媚,韩珂,吴传斌.微丸压片工艺研究进展[J].国际药学研究杂志,2008,35(2):128-132.
[11]Abdul S,Chandewar AV,Jaiswal SB.A flexible technology for modified-release drugs:multiple unit pellet system(MUPS)[J].J Control Release,2010,147(1):2-16.
[12]張闪闪,吴燕,徐荣.埃索美拉唑镁肠溶微丸片的制备及质量控制[J].中国新药杂志,2015,24(19):2241-2265.
[13]张文静,李明丽,樊永庆,等.埃索美拉唑镁肠溶微丸的制备[J].药学与临床研究,2014,22(1):39-42.
[14]Zhang WJ,McGinity JW.Influence of Eudragit RNE30D blended with Eudragit RL 30D-55 on the release of phenylpropanolamine hydrochloride from coated pellets[J].Drug Dev Ind Pharm,2003,29(3):357-366.
[15]陈眉眉,王成润,金一.泮托拉唑钠肠溶微丸型片剂的制备[J].药学学报,2011,46(1):96-101.
(收稿日期:2017-09-30 本文编辑:祁海文)endprint
