顶空固相微萃取-气相色谱法测定饮用水中的百菌清
2018-03-09李海燕宋晓娟尹明明李春玲
李海燕,宋晓娟,尹明明,李春玲
连云港市环境监测中心站,江苏 连云港 222001
百菌清是一种高效、广谱杀菌剂,对蔬菜、果树、豆类、小麦等多种作物的真菌病害具有良好预防作用[1-2],工业上也常用其作为防霉涂料,涂在船舶上防治水藻[3]。随着百菌清的广泛应用,其进入水环境的机会逐渐增加,对生态环境的风险也越来越大。
百菌清对人眼和皮肤均有刺激作用,少数人会有过敏反应并可能引起皮炎[4],美国环保署(USEPA)已将其列为可能使人类致癌的化学物质之一[5]。百菌清对水生生物也具有极高的毒性,且化学性质稳定,容易通过食物链在人体内达到高浓度富集。因此,国家非常重视水体中百菌清的控制,《地表水环境质量标准》(GB 3838—2002)和《生活饮用水卫生标准》(GB 5749—2006)中都规定了饮用水中百菌清的标准限值(0.01 mg/L),为了保障饮用水质的安全,建立饮用水中百菌清的分析方法具有十分重要的意义。
水样的前处理是整个分析方法的关键,发展高效、低毒的前处理手段一直都是环境监测领域的重点研究内容。目前对于水中百菌清的提取,国内已有较多研究,主要分为液液萃取和固相萃取2种方式[1-3, 6-7]。《水质 百菌清和溴氰菊酯的测定 气相色谱法》(HJ 698—2014)规定用正己烷进行萃取、电子捕获检测器(ECD)检测,样品量为100 mL时,检出限为0.07 μg/L。《水质 百菌清及拟除虫菊酯类农药的测定 气相色谱-质谱法》(HJ 753—2015)规定用固相萃取法收集500 mL水样中的百菌清,选择离子扫描测定,检出限为0.008 μg/L。这2种萃取方式都比较成熟,但也存在一定缺陷。液液萃取操作繁琐耗时,需要耗费大量的有机溶剂,对人体和环境均有较大危害;固相萃取虽然减少了有机溶剂的使用,但样品用量较大、装置昂贵、处理时间较长,且不同批次的萃取装置重现性较差。顶空固相微萃取(HS-SPME)技术是近年来逐渐发展起来的一种新型绿色的前处理技术,操作简单、用时少,整个过程可以无需使用有机溶剂,富集效率较高,对人体和环境也较为友好[8-11]。目前,该技术已广泛应用于各类样品的前处理过程,如环境水样、土壤、食品、茶叶、海水等多种介质中有机污染物的吸附[12-15],但对于水中百菌清的处理,还未有相关报道。百菌清具有一定的挥发性,如果选择合适的萃取纤维并优化萃取参数,则有可能实现HS-SPME技术对水中百菌清的高效吸附,满足饮用水监测分析的需要。
本研究建立了HS-SPME-气相色谱法分析饮用水中百菌清的方法,优化了HS-SPME的实验条件,样品的前处理过程无需繁琐的人工操作,能够实现对环境水样的快速、准确分析,对于保障饮用水及地表水中百菌清的污染控制具有十分重要意义。
1 实验部分
1.1 仪器与试剂
7890B气相色谱仪-ECD检测器(美国);顶空固相微萃取装置(瑞士);固相微萃取纤维(美国):聚丙烯酸酯(PA,85 μm),聚二甲基硅氧烷(PDMS,100 μm),聚二甲基硅氧烷/二乙烯苯(PDMS/DVB,65 μm);20 mL带有聚四氟乙烯涂层硅橡胶垫的螺纹口玻璃样品瓶(美国)。
百菌清标准溶液(100.0 mg/L,甲醇溶剂);NaCl(优级纯,300 ℃灼烧6 h后密封贮存于干燥器中备用);甲醇(色谱纯);超纯水(18.2 MΩ·cm,美国Milli-Q型超纯水净化器净化)。
1.2 实验条件
1.2.1 HS-SPME条件
萃取涂层为PDMS(100 μm),首次使用前于气相色谱进样口(260 ℃)内活化30 min。移取10.00 mL水样至20 mL顶空瓶中,加入1.0 g NaCl和0.3 mL H2SO4溶液(浓度为0.1 mol/L);萃取温度为70 ℃;搅拌速度为250 r/min;萃取时间持续30 min;解吸温度为250 ℃;解吸时间为3 min。
1.2.2 气相色谱条件
色谱柱为HP-5石英毛细管柱(30 m×0.32 mm×0.25 μm);载气为高纯氮气(99.999%);柱流速为1.5 mL/min;进样口温度为250 ℃;不分流进样;升温程序:80 ℃保持1 min,以10 ℃/min升温至220 ℃,再以20 ℃/min升温至280 ℃,保持3 min;检测器温度为300 ℃。根据保留时间定性,外标法定量。
2 结果与讨论
2.1 HS-SPME萃取条件的优化
HS-SPME处理水样时,萃取效率取决于多种因素,如萃取纤维涂层的极性与厚度、萃取的温度与时间、搅拌速度、样品的离子强度与pH、解吸时间等。我们在10.0 mL超纯水中加入百菌清标准溶液,配制成10.0 μg/L的水溶液,按一定步骤逐步优化各项萃取参数。
2.1.1 萃取涂层的选择
萃取涂层是决定HS-SPME成败的关键因素,不同极性的涂层适合分析不同极性的化合物,而不同厚度的涂层则会影响目标物的吸附容量与吸附时间。因此,首先固定其他参数,对萃取涂层进行优化,萃取温度80 ℃,萃取时间30 min,搅拌速度250 r/min,解吸时间5 min,并向10.0 mL水溶液中加入1.0 g NaCl固体和0.5 mL H2SO4溶液(0.1 mol/L),随后将百菌清水溶液分别用PA(85 μm)、PDMS(100 μm)、PDMS/DVB(65 μm)3种涂层进行萃取,得到的峰面积如图1所示。从图1可见,在3种涂层中,PDMS(100 μm)的萃取效果最好,因为PDMS为非极性涂层,根据相似相溶原理,PDMS对百菌清这类弱极性物质有较好的萃取效果,而PA则属于极性涂层,仅适合处理极性物质。此外,PDMS涂层的性质比较稳定,使用寿命较长,可广泛应用于环境水样的处理。
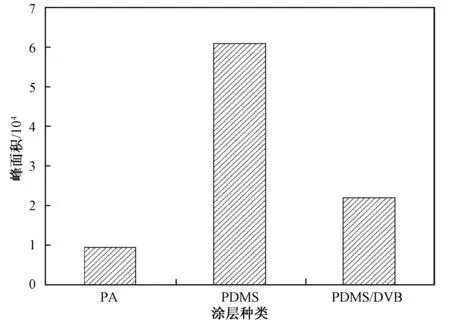
图1 萃取涂层对水中百菌清响应值的影响Fig.1 Effects of fiber categories on the extraction of chlorothalonil in water samples
2.1.2 萃取温度的选择
温度对HS-SPME的萃取效率有2个方面影响:一方面,升高温度可提高分子的运动速度,提高目标物在涂层中的附着几率;另一方面,涂层的吸附是一个放热过程,温度过高会降低目标物在涂层与水相之间的分配系数,最终导致吸附量降低。对水溶液而言,萃取温度要低于水的沸点,我们已经优化了萃取纤维,固定萃取时间30 min,搅拌速度250 r/min,解吸时间5 min,并向10.0 mL水溶液中加入1.0 g NaCl固体和0.5 mL H2SO4溶液(0.1 mol/L),在此基础上分别研究了百菌清水溶液在40~90 ℃温度范围内的萃取效果,结果如图2所示。从图2可见,温度较低时,百菌清的峰面积随着温度的升高而显著增大,即升温对萃取有利,而当温度超过70 ℃时,百菌清的峰面积开始减小,可能因为在放热过程中,温度过高反而降低了百菌清在涂层中的分配系数。因此,最终选择70 ℃作为最佳萃取温度。
2.1.3 萃取时间的选择
在HS-SPME过程中,目标物从水样扩散至涂层上需要一定的平衡时间,不同化合物由于分子量及物理化学性质的不同,所需的平衡时间也不同。在优化了萃取涂层和温度之后,将搅拌速度和解吸时间分别设为250 r/min和5 min,并向10.0 mL水溶液中加入1.0 g NaCl固体和0.5 mL H2SO4溶液(0.1 mol/L),随后讨论了10~60 min不同时间条件下的萃取效果,结果如图3所示。从图3可见,时间小于30 min时,萃取效率随着时间的延长有显著升高,而随着时间的进一步延长,百菌清的峰面积反而有所减小,说明此时已吸附的目标物又开始从涂层中脱离,导致萃取效率降低。因此,最终选择30 min作为最佳萃取时间。

图2 萃取温度对水中百菌清响应值的影响Fig.2 Effects of temperature on the extraction of chlorothalonil in water samples
2.1.4 离子强度的影响
向水溶液中加入一定量的无机盐(如NaCl、Na2SO4等),可以增大溶液的离子强度,从而抑制有机物的电离,进而降低其在水中的溶解度,使其更容易从水相中挥发出来扩散到气相中,最终会在一定程度上提高涂层的吸附效率。根据上述优化结果,我们将搅拌速度与解吸时间分别设为250 r/min和5 min,并向10.0 mL水溶液中加入0.5 mL H2SO4溶液(0.1 mol/L),随后再分别加入0~3.5 g的NaCl固体来研究离子强度的影响,结果如图4所示。从图4可见,当NaCl的加入量从0 g增至1.0 g时,百菌清的峰面积逐渐增大,随着加入量的进一步增加,峰面积反而有所减小。因此,在水样中引入一定的离子强度,能够提高百菌清的吸附效率,如果用NaCl来改变离子强度,则最佳加入量为1.0 g。
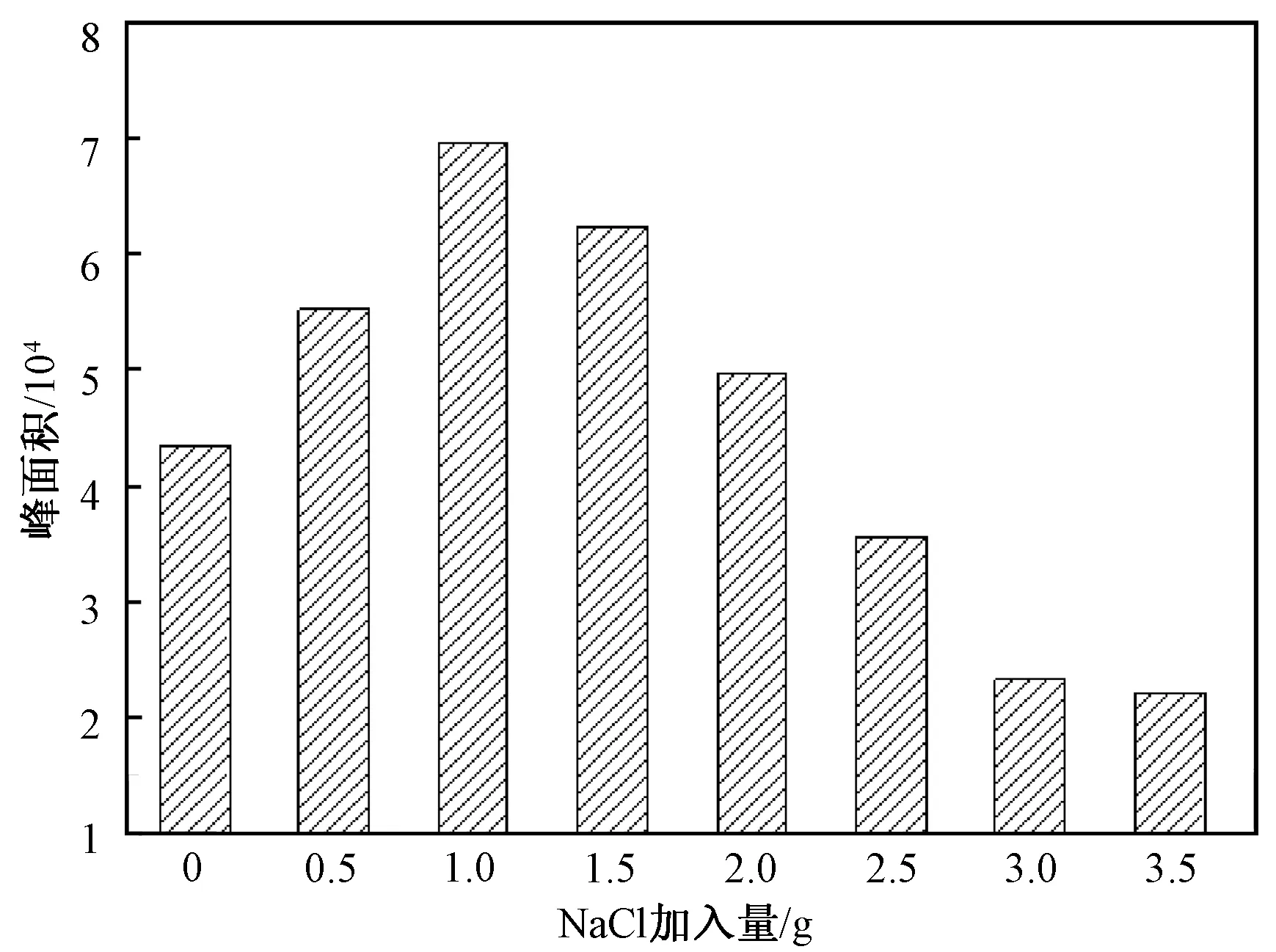
图4 离子强度对水样中百菌清响应值的影响Fig.4 Effects of ionic strength on the extraction of chlorothalonil in water samples
2.1.5 pH的影响
调节pH可以改变目标物在水样中的存在形式,影响其在气液两相间的分配系数,并最终影响吸附效率。百菌清为弱酸性物质,降低pH有利于抑制弱酸的电离,使其更容易以分子状态存在,从而可以降低百菌清在水相中的溶解度,提高气相中的分配系数,并最终提高涂层的吸附效率[16]。但酸性过强也可能会对涂层纤维造成损害,从而降低吸附效率。本研究通过加入一定体积的H2SO4溶液(浓度为0.1 mol/L)来改变水样的pH,除上述优化参数外,搅拌速度与解吸时间分别设为250 r/min和5 min,随后分别加入0~0.5 mL的H2SO4溶液来考察pH的影响,结果如图5所示。从图5可见,与中性溶液相比,一定的酸性环境能够提高百菌清的吸附效率,当H2SO4溶液的加入量为0.3 mL时,百菌清的响应值达最大,此时若进一步提高酸度,对萃取效率的影响并不显著。因此,最终选择加入0.3 mL浓度为0.1 mol/L的H2SO4溶液来调节pH。
2.1.6 搅拌速度的影响
样品的搅拌速度对萃取效率有重要影响,合理的搅拌能缩短目标物在气液两相间的平衡时间,尤其对于沸点相对较高的半挥发性化合物,一定的搅拌速度能加快化合物的挥发,从而提高涂层对气相中目标物的吸附效率。根据上述优化结果,我们将解吸时间设为5 min,随后考察了0~550 r/min等不同转速下的萃取效率,结果发现搅拌速度为250 r/min时,萃取效率可达到最佳,此时百菌清的响应值大约是静态时的25倍。但随着转速的进一步增加,萃取效率却并无显著改善。因此,最终选择250 r/min的搅拌速度。

图5 pH对水样中百菌清响应值的影响Fig.5 Effects of pH value on the extraction of chlorothalonil in water samples
2.1.7 解吸时间的影响
纤维涂层吸附目标物后,在气相色谱仪的进样口处进行解吸,随后目标物通过载气被导入色谱柱进行分离。为了保证目标物的峰形不受影响,在尽可能增强解吸程度的前提下,解吸时间应越短越好,延长时间有利于将涂层上的杂质解吸下来,但过长时间的高温也会对涂层造成损伤,影响使用寿命。在本研究中,已对其余6项参数进行了优化,解吸时间在1~5 min范围内开展条件实验,结果表明,时间设置为3 min时,可最大程度将目标物解吸下来,进一步延长时间对萃取效率并无显著影响。因此,最终将解吸时间设置为3 min。
根据第2.1节的优化结果,HS-SPME法处理饮用水中百菌清,取样体积为10.0 mL,为提高萃取效率,应当选择弱极性的PDMS(100 μm),同时向水样中加入1.0 g NaCl固体和0.3 mL H2SO4溶液(0.1 mol/L)来调节离子强度和pH,随后在70 ℃的温度下萃取30 min,期间进行搅拌,速度为250 r/min。萃取结束后,在气相色谱仪的进样口进行解吸,最佳解吸时间为3 min。如此设定HS-SPME参数,即可最大程度提高饮用水中百菌清的萃取效率。
2.2 方法性能
根据优化后的HS-SPME各项参数,对整个方法的性能进行验证。
2.2.1 线性与检出限
在10.0 mL超纯水中加入百菌清标准溶液,配制质量浓度分别为10.0、20.0、50.0、100、200 μg/L的水溶液,按照第1.2节的实验条件逐一分析,以峰面积y为纵坐标,质量浓度x(μg/L)为横坐标绘制标准工作曲线,得到10.0~200 μg/L范围内百菌清的线性方程为y=6 172x-8 228(相关系数为0.999,大于0.999),表明在优化后的实验条件下,百菌清具有良好的线性关系,能够保证定量的准确性。
在10.0 mL超纯水中添加百菌清标液,配制质量浓度为0.500 μg/L的水溶液,在优化后的实验条件下平行测定7次,计算标准偏差(S),则检出限MDL=t(n-1,0.99)×S,其中n为样品的平行测定次数,t为自由度n-1、置信度99%时的t分布(单侧)。据此得到百菌清的检出限为0.09 μg/L,对比HJ 698—2014和HJ 753—2015,该方法取样量较小,检出限虽然高于传统萃取法,但远低于饮用水中百菌清的标准限值(10.0 μg/L)。因此,可完全满足百菌清污染的定性与定量分析。
2.2.2 回收率和精密度
为了考察方法的准确性与稳定性,在10.0 mL超纯水中添加百菌清标液,配制了0.500、2.00、10.0 μg/L 3种加标水平,对方法的回收率、一日内精密度与日间精密度进行了测定。结果表明,百菌清的回收率为78.5%~87.4%,一日内精密度、日间精密度分别为1.20%~3.29%、2.17%~4.52%,说明本研究所建立的方法较为稳定、准确、可靠,可以胜任饮用水中百菌清的检测。
2.3 实际水样测定
为验证方法的可行性,分别从连云港市海州水厂、茅口水厂、茅口第三水厂等3个自来水厂的出水口采集3个水样进行分析,并同时采集全程序空白和抽样,共5个样品采至磨口玻璃瓶中,带回实验室立即分析。在本方法的检出限水平下,5个样品均未检出百菌清。为验证该方法测定实际水样的准确性和重现性,对3个水厂的出水添加百菌清标液,加标水平为0.500 μg/L,每个出水水样分别取6份进行平行加标实验,分析得到百菌清在实际饮用水中的回收率为73.5%~109.8%,6次平行实验的相对标准偏差RSD为1.32%~4.66%。说明该方法的准确性和重现性较好,能够满足实际水样的分析。
3 结论
建立了HS-SPME-气相色谱法测定饮用水中百菌清的方法。弱极性的萃取纤维PMDS(100 μm)对百菌清的吸附效果最好,水样在分析前需要加入一定量的H2SO4溶液和NaCl固体,以调节pH及离子强度,提高萃取效率。此外还优化了萃取温度、萃取时间、搅拌速度、解吸时间等其他参数,并从线性、检出限、回收率、精密度等方面对方法的性能进行了测试。该方法操作简便,准确度高,重现性好,样品用量少,无需使用有机溶剂,非常适合饮用水中百菌清的检测分析。
[1] 中国环境科学学会.中国环境科学学会学术年会论文集[C]. 北京: 中国环境科学出版社, 2013.
[2] 陈蓓蓓, 吴诗剑, 周守毅, 等. 气相色谱内标法测定水中百菌清的方法优化[J]. 环境科学导刊, 2009, 28(4): 101-104.
CHEN Beibei, WU Shijian, ZHOU Shouyi, et al. Method Optimization of Determination of Chlorothalonil in Water by Internal Standard Gas Chromatography [J]. Environmental Science Survey, 2009, 28(4): 101-104.
[3] 刘艳, 王玫, 黄春燕. 水中百菌清的气相色谱测定法[J]. 环境与健康杂志, 2010, 27(6): 524-525.
LIU Yan, WANG Mei, HUANG Chunyan. Determination of Chlorothalonil in Water by Gas Chromatography [J]. Journal of Environment and Health, 2010, 27(6): 524-525.
[4] 李学德, 花日茂, 岳永德, 等. 百菌清在水中的光化学降解[J]. 应用生态学报, 2006, 17(6): 1 091-1 094.
LI Xuede, HUA Rimao, YUE Yongde, et al. Photochemical Degradation of Chlorothalonil in Aqueous Solution [J]. Chinese Journal of Applied Ecology, 2006, 17(6): 1 091-1 094.
[5] LAWRUK T S, GUECO A M, JOURDAN S W, et al. Determination of Chlorothalonil in Water and Agricultural Products by a Magnetic Particle-Based Enzyme Immunoassay[J]. Agric Food Chem, 1995, 43(5): 1 413-1 419.
[6] 曹爱丽, 孙睿华. 气相色谱法测定地表水中百菌清和菊酯类农药[J]. 环境监测管理与技术, 2013, 25(4): 42-44.
CAO Aili, SUN Ruihua. Determination of Chlorothalonil and Pyrethroid Pesticides in Water by GC [J]. The Administration and Technique of Environmental Monitoring, 2013, 25(4): 42-44.
[7] 余彦海, 钟新林, 陈军. 在线固相萃取-双梯度高效液相色谱测定环境水体中痕量甲萘威和百菌清[J]. 中国环境监测, 2013, 29(4): 138-141.
YU Yanhai, ZHONG Xinlin, CHEN Jun. Determination of Carbaryl and Chlorothalonil in Environmental Water Using On-Line SPE and HPLC [J]. Environmental Monitoring in China, 2013, 29(4): 138-141.
[8] 张军, 张丹, 彭华, 等. 固相微萃取-气相色谱法测定水中酞酸酯类化合物[J]. 中国环境监测, 2015, 31(4): 91-94.
ZHANG Jun, ZHANG Dan, PENG Hua, et al. Determination of Phthalate Esters in Water by Solid-Phase Microextraction and Gas Chromatography [J]. Environmental Monitoring in China, 2015, 31(4): 91-94.
[9] 张俊花, 张洪林. 固相微萃取-气相色谱在水中有机污染物测定中的应用[J]. 中国环境监测, 2011, 27(4): 41-44.
ZHANG Junhua, ZHANG Honglin. The Application of Solid-Phase Micro-Extraction-Gas Chromatographic in Determination of Organic Pollutants of Water [J]. Environmental Monitoring in China, 2011, 27(4): 41-44.
[10] 沈斐, 李睿, 苏晓燕, 等. 固相微萃取-气相色谱-质谱法测定饮用水中土嗅素和2-甲基异莰醇[J]. 中国环境监测, 2013, 29(4): 125-129.
SHEN Fei, LI Rui, SU Xiaoyan, et al. Determination Geosmin and 2-Methylisoborneol in Drinking Water by Solid-Phase Microextraction-Gas Chromatography-Mass Spectrometry [J]. Environmental Monitoring in China, 2013, 29(4): 125-129.
[11] 王艳丽, 周阳. 固相微萃取-气相色谱-质谱法测定水中痕量有机磷和阿特拉津农药[J]. 中国环境监测, 2013, 29(1): 112-115.
WANG Yanli, ZHOU Yang. Determination of Organic Phosphorus and Atrazine in Water by SPME-GC-MS [J]. Environmental Monitoring in China, 2013, 29(1): 112-115.
[12] 王玉飞, 施家威, 王立, 等. 顶空固相微萃取-气相色谱法测定生活饮用水中痕量1,4-二氧六环[J]. 色谱, 2015, 33(4): 441-445.
WANG Yufei, SHI Jiawei, WANG Li, et al. Analysis of 1,4-Dioxane in Drinking Water by Headspace Solid-phase Microextraction-Gas Chromatography [J]. Chinese Journal of Chromatography, 2015, 33(4): 441-445.
[13] 程权, 杨方, 李捷, 等. 顶空固相微萃取-全二维气相色谱/飞行时间质谱法分析闽南乌龙茶中的挥发性成分及其在分类中的应用[J]. 色谱, 2015, 33(2): 174-181.
CHENG Quan, YANG Fang, LI Jie, et al. Analysis of the Volatile Components in Minnan Oolong Tea by Headspace Solid Phase Microextraction Coupled with Comprehensive Two-dimensional Gas Chromatography-Time of Flight Mass Spectrometry and the Application in its Variety Identification [J]. Chinese Journal of Chromatography, 2015, 33(2): 174-181.
[14] 周昱, 徐敦明, 陈达捷, 等. 固相微萃取-气相色谱法和气相色谱-质谱法测定茶叶中氟虫腈及其代谢残留物[J]. 色谱, 2011, 29(7): 656-661.
ZHOU Yu, XU Dunming, CHEN Dajie, et al. Determination of Fipronil and its Metabolites in Tea by Solid-Phase Microextraction Coupled with Gas Chromatography and Gas Chromatography-Mass Spectrometry [J]. Chinese Journal of Chromatography, 2011, 29(7): 656-661.
[15] 张军, 刘建福, 范勇, 等. 顶空固相微萃取-气相色谱-质谱联用分析库尔勒香梨花序香气成分[J]. 食品科学, 2016, 37(2): 115-120.
ZHANG Jun, LIU Jianfu, FAN Yong, et al. Analysis of Aroma Components ofPyrusSinkiangensis‘Korla Xiangli’ Inflorescence by Headspace Solid Phase Micro-Extraction Coupled to Gas Chromatography-Mass Spectrometry [J]. Food Science, 2016, 37(2): 115-120.
[16] DIMITRA A L, Triantafyllos A A. Optimization of Headspace Solid-Phase Microextraction Conditions for the Determination of Organophosphorus Insecticides in Natural Waters [J]. Journal of Chromatography, 2001, 922(1/2): 243-255.
