XB130基因对肝细胞癌细胞增殖的影响及其机制
2018-03-09许文芳费迎明周建康陈将南周亚娣吕秋琼
许文芳,费迎明,周建康,陈将南,周亚娣,吕秋琼
1.绍兴市立医院检验科,浙江 绍兴 312000;
2.绍兴市立医院消化内科,浙江 绍兴 312000
肝细胞癌(hepatocellular carcinoma,HCC)在全世界肿瘤发病率中居第6位,肿瘤相关死亡中居第2位[1],特别是在中国及东南亚地区,HCC的发病率和死亡率一直居高不下,形势非常严峻。HCC细胞具有很强的增殖能力,HCC进展快速、预后较差,抑制HCC细胞增殖能够有效提高HCC的综合治疗效果。然而,HCC细胞的增殖是一个多基因参与、多信号分子及通路共同调节的复杂过程,其确切机制尚未完全阐明。XB130蛋白是肌动蛋白丝相关蛋白1(actin filament associated protein 1,AFAP1)家族的新成员,又被称为肌动蛋白丝相关蛋白1L2(AFAP1L2)[2]。作为一种衔接蛋白,被酪氨酸磷酸化的XB130可活化调控磷脂酰肌醇-3-激酶(phosphatidylin-ositol 3-kinase,PIK3)/丝氨酸-苏氨酸激酶(serine-threonine kinase,AKT)通路、Rac依赖性通路等重要信号通路,参与调节细胞生存、增殖、转移和侵袭等多种重要细胞过程[3-4]。相关研究显示,抑制XB130蛋白的表达,在胃癌、食管癌及前列腺癌等多种肿瘤中,均有抑制肿瘤细胞增殖的效果[5-7]。因此,本研究通过RNA干扰技术抑制HCC细胞中XB130蛋白的表达,评估XB130蛋白缺失对HCC细胞增殖能力和细胞周期的影响,并对其下游相关的蛋白及mRNA进行检测。
1 材料和方法
1.1 主要试剂和细胞株
胎牛血清、RPMI-1640培养基及DMEM培养基均购自美国Gibco公司;各培养基加入10%胎牛血清、100 U/mL青霉素和0.1 mg/mL链霉素后使用。XB130、p-AKT、p-糖原合成酶激酶(glycogen synthase kinase,GSK)3β、cyclin D1及p-Rb一抗均购自美国Cell Signal公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗购自上海康成生物工程有限公司,HRP结合的山羊抗小鼠二抗和HRP结合的山羊抗兔二抗均购自中山生物工程有限公司,组织细胞裂解液购自美国Cell Signal公司,上样缓冲液购自美国Invitrogen公司,BCA蛋白浓度检测试剂盒购自美国Thermo Fisher Scientific Inc公司,蛋白预染Marker(protein marker 0671)购自美国Fermentas公司,PVDF膜购自美国Millipore公司,化学发光试剂盒购自美国GE Healthcare公司,ECL发光增强剂购自美国Pierce公司,胶片和显影定影液购自美国Kodak公司,Negative Control siRNA(NC-siRNA)和XB130-siRNA均购自美国Santa Cruz公司,LipofectamineTM2000和RNA抽提液TRIzol Reagent均购自美国Invitrogen公司,无血清培养基Opti-MEM transfection medium购自美国Gibco公司。用于反转录的Prime Script Reagent RT Kit购自宝生物工程(大连)有限公司,XB130、cyclin E1、c-Myc、PCNA及β-actin的引物设计也由宝生物工程(大连)有限公司完成。细胞计数试剂盒(cell counting kit-8,CCK-8)购自日本同仁化学研究所,人肝癌细胞系(Huh7、HepG2和SNU-449)和正常肝脏细胞系(HL7702)均购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。
1.2 细胞培养
Huh7和HepG2细胞置于DMEM培养基中,SNU-449和HL7702细胞置于RPMI-1640培养基中,于37 ℃、CO2体积分数为5%的恒温培养箱中培养。
1.3 XB130-siRNA转染沉默XB130表达
6孔培养板中每孔加入2×105个Huh7细胞,培养至40%~60%融合。于聚苯乙稀管中制备以下转染液:用Opti-MEM培养基稀释100 pmol XB130-siRNA或NC-siRNA至250 μL/孔,于37 ℃温箱中温育5 min;用Opti-MEM培养基稀释5 μL LipofectamineTM2000至250 μL/孔,于37 ℃温箱中温育5 min;轻轻混合上述两种液体,于37 ℃温箱中温育包埋15 min。将6孔板中的无血清培养基吸除,把转染液缓缓加入培养板中,并用Opti-MEM培养基补足转染体系至2 mL/孔,摇动培养板,轻轻混匀。于37 ℃、CO2体积分数为5%的恒温培养箱中培养6 h,吸除转染体系,换入正常培养液继续培养。24 h后检测XB130 mRNA表达水平,48 h后检测XB130蛋白表达水平,并于72 h内完成后续实验。
1.4 CCK-8检测细胞活力
96孔培养板中每孔加入5×103个Huh7细胞(XB130-siRNA转染、NC-siRNA转染和对照),于37 ℃、CO2体积分数为5%的恒温培养箱中培养特定的时间(24、48或72 h)。向每孔加入10 µL CCK-8溶液(稀释入DMEM培养基中为10%工作液),注意不要生成气泡,气泡会折光影响吸光度(D)值;然后置96孔板于37 ℃温箱中温育0.5~4.0 h,用酶标仪测定450 nm处的D值。根据D值计算相对细胞活性,V%=(处理组D值/对照组D值)×100%。
1.5 流式细胞术检测细胞周期
6孔培养板中每孔加入2×105个Huh7细胞,血清饥饿同步化24 h,然后分别用XB130-siRNA或NC-siRNA转染,48 h后用胰酶消化,离心收集细胞,PBS洗两遍,弃上清液,加入70%预冷乙醇中,吹打均匀,4 ℃固定12 h以上。然后用PBS洗涤去乙醇,洗2遍。并用含50 μg/mL溴化乙啶和0.2%Triton X-100的PBS 0.5 mL重悬细胞,加入100 μg/mL RNase A,4 ℃避光温育30 min。用流式细胞仪测定细胞周期,一般计数20 000~30 000个细胞(不少于10 000),结果用细胞周期拟和软件ModFit分析,计算G0/G1、S及G2/M期细胞比例。
1.6 蛋白[质]印迹法(Western blot)检测蛋白表达
收集细胞,加入6倍体积的细胞裂解液,冰上裂解1 h;4 ℃下,裂解混合液于12 000×g条件下离心15 min,取其上清液用蛋白质定量试剂盒BCA法定量,将蛋白样品调至等浓度,混合上样缓冲液后100 ℃蛋白变性5 min。制备10%的SD-PAGE胶,室温垂直静置30 min。安装电泳装置,上下槽中注入Tris-甘氨酸电泳缓冲液,泳道中加5 μL的蛋白标志物或10 μL(60 μg)的实验组蛋白后电泳。安装电转膜装置,注入转膜液,将蛋白电转膜至PVDF膜。将膜取出、TBS-T液稍漂洗,然后浸没于封闭液(5%脱脂奶粉的TBS液),室温封闭2 h。TBS-T液洗膜3次,每次5 min。将其浸没于p-AKT、p-GSK3β、cyclin D1、p-Rb和GAPDH的一抗液(1∶1 000稀释)中,4 ℃温育6 h。TBS-T液洗膜3次,每次5 m i n。再将其浸没于H R P标记的二抗液(1∶5 000稀释)中,室温温育2 h。TBS-T液洗膜3次,每次5 min。滴加HRP-ECL发光液发光,暗室曝光,显影定影并扫描分析。
1.7 反转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)检测mRNA表达
用T R Izol R NA试剂盒提取Huh7细胞(XB130-siRNA转染、NC-siRNA转染和对照的总RNA),取2 μg RNA,按照厂商说明用Prime Script Reagent RT Kit试剂盒进行反转录。XB130上游引物为5’-AGCACAGC ACTGGTGAAGAA-3’,下游引物为5’-GTTG CTTGTTGATGGTCACT-3’;Cyclin E1上游引物为5’-CTGGATGTTGACTGCCTTGA-3’,下游引物为5’-TCTTTGGTGGAGAAGGATGGGGTGG-3’;c-Myc上游引物为5’-GCAGCTGCTTAGACGCTGGA-3’,下游引物为5’-CGCAGTAGAAATACGGCTGCAC-3’;PCNA上游引物为5’-GTGAATTTGCACGTATATGCCG-3’,下游引物为5’-GCAATTTTATACTCTACAACAAGG GG-3’。PCR反应仪采用上海Applied Biosystems Inc公司的ABI 7900 Prism HT,数据处理采用melting curve分析,XB130、cyclin E1、c-Myc和PCNA的mRNA表达量均标准化到β-actin(上游引物为5’-TGGCACCCAGCACAATGAA-3’,下游引物为5’-CTA AGTCATAGTCCGCCTAGAAGCA-3’)。
1.8 统计学处理
2 结 果
2.1 XB130蛋白在Huh7、HepG2、SNU449和HL7702细胞中的表达差异
Western blot检测结果显示,XB130蛋白在Huh7、HepG2、SNU449和HL7702细胞中的相对表达量分别为0.66±0.10、0.78±0.11、0.83±0.08和0.32±0.06;与HL7702细胞比较,各HCC细胞中XB130的表达明显升高(P<0.01),而3种人肝癌细胞系之间差异无统计学意义(P>0.05,图1)。

图 1 Western blot检测Huh7、HepG2、SNU449和HL7702细胞中XB130蛋白的表达情况Fig. 1 The protein expressions of XB130 in Huh7, HepG2,SNU449 and HL7702 cells detected by Western blot
2.2 XB130-siRNA转染对Huh7细胞中XB130蛋白和mRNA表达的影响
Western blot检测结果显示,在空白对照组、NC-siRNA转染组和XB130-siRNA转染组Huh7细胞中,XB130蛋白的相对表达量分别为0.67±0.14、0.62±0.11和0.12±0.07;与空白对照组比较,NC-siRNA转染组细胞中XB130蛋白的相对表达量无明显变化,与NC-siRNA转染组比较,XB130-siRNA转染组细胞中XB130蛋白的相对表达量明显降低(P<0.01,图2)。
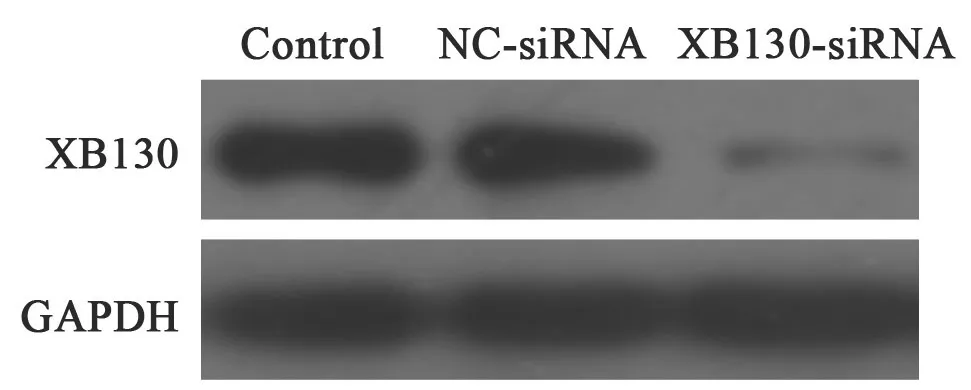
图 2 各组Huh7细胞中XB130蛋白的表达Fig. 2 The protein expressions of XB130 in the difference groups of Huh7 cells
RT-PCR检测结果显示,XB130 mRNA表达水平上的改变和Western blot的结果一致,抑制率达(77.92±4.64)%,抑制效果显著(P<0.001,图3)。

图 3 各组Huh7细胞中XB130 mRNA的表达Fig. 3 The expressions of XB130 mRNA in the difference groups of Huh7 cells
2.3 沉默XB130基因对Huh7细胞增殖能力的影响
CCK-8实验检测结果显示,XB130-siRNA转染后24、48 h,空白对照组、NC-siRNA转染组和XB130-siRNA转染组中Huh7细胞活力差异无统计学意义(P>0.05,图4);而转染后72 h,与空白对照组比较,NC-siRNA转染组Huh7细胞活力无明显差异,而与NC-siRNA转染组比较,XB130-siRNA转染组Huh7细胞活力明显降低,为空白对照组细胞活力的(69.19±2.11)%(P<0.001,图4)。
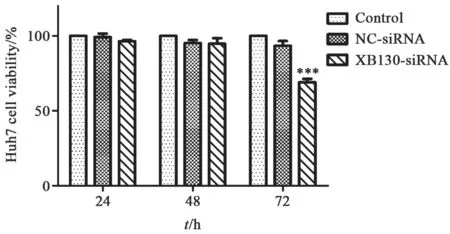
图 4 24、48和72 h时各组Huh7细胞活力Fig. 4 The viability of Huh7 cells after 24, 48 and 72 h
通过细胞计数法绘制细胞生长曲线,结果显示,空白对照组和NC-siRNA转染组168 h生长曲线差异无统计学意义(P>0.05,图5);XB130-siRNA转染组与NC-siRNA转染组比较,生长曲线于72 h开始显著降低(P<0.001,图5)。
2.4 沉默XB130对Huh7细胞周期的影响
流式细胞术检测结果显示,转染XB130-siRNA后48 h,与空白对照组比较,NC-siRNA转染组Huh7细胞不同时期细胞的比例无明显改变(P>0.05,图6);而与NC-siRNA转染组比较,XB130-siRNA转染组Huh7细胞中,G0/ G1期细胞比例明显升高(P<0.001,图6),达到(68.20±1.51)%,S和G2/M期细胞比例则降低(P<0.01,图6),分别降至(20.30±0.79)%和(11.50±0.74)%。

图 5 各组Huh7细胞生长曲线Fig. 5 The growth curves of Huh7 cells

图 6 各组Huh7细胞中不同细胞周期的比例Fig. 6 The ratio of Huh7 cells in the different cell cycle phases
2.5 沉默XB130对Huh7细胞周期相关蛋白的影响
Western blot检测结果显示,在空白对照组、NC-siRNA转染组和XB130-siRNA转染组Huh7细胞中,p-AKT蛋白的相对表达量分别为0.87±0.17、0.93±0.22和0.34±0.14,p-GSK3β蛋白的相对表达量分别为0.90±0.24、0.92±0.19和0.53±0.11,cyclin D1蛋白的相对表达量分别为0.93±0.26、0.89±0.29和0.47±0.16,p-Rb蛋白的相对表达量分别为0.90±0.23、0.92±0.28和0.58±0.17;与空白对照组比较,NC-siRNA转染组细胞中p-AKT、p-GSK3β、cyclin D1及p-Rb蛋白的相对表达量无明显变化,与NC-siRNA转染组比较,XB130-siRNA转染组细胞中p-AKT、p-GSK3β、cyclin D1及p-Rb蛋白的相对表达量明显降低(P<0.01,图7)。
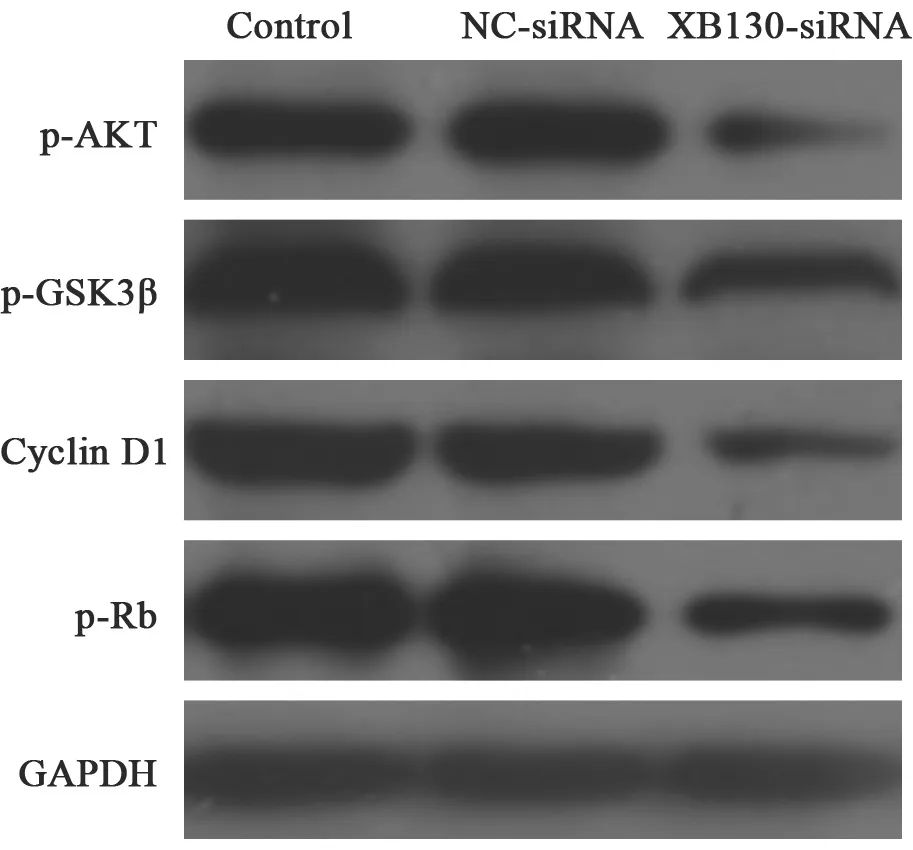
图 7 各组Huh7细胞中周期相关蛋白的表达Fig. 7 The expressions of cell cycle related proteins in different Huh7 cells
2.6 沉默XB130对Huh7细胞周期相关转录因子的影响
RT-PCR检测结果显示,转染XB130-siRNA后的Huh7细胞,其E2F/DP-1的靶基因cyclin E1、c-Myc和PCNA的mRNA表达,较NC-siRNA转染组均明显下降(P均<0.001,图8),分别降至(57.44±3.61)%、(42.05±8.83)%和(48.72±3.82)%。

图 8 各组Huh7细胞中E2F/DP-1靶基因的表达Fig. 8 The expressions of E2F/DP-1 target genes in different Huh7 cells
3 讨 论
本研究以XB130为切入点,以HCC细胞增殖为研究对象,应用siRNA干扰技术,证实了XB130在细胞增殖中的重要作用,探索了XB130调控HCC细胞周期的可能机制。
本研究结果显示,XB130蛋白在HCC细胞系中的表达较正常肝细胞明显升高,提示XB130可能和HCC发生、发展存在一定的相关性。XB130蛋白可以调节肿瘤细胞的增殖、转移和侵袭等生物学过程,促进肿瘤的发生、发展。我们通过沉默HCC细胞的XB130基因后,发现细胞增殖能力会受到明显抑制。这些结果表明,XB130可能与细胞恶性病变有关,作为一种原癌基因在HCC细胞中高表达,并对其细胞增殖发挥重要作用。
有研究报道,抑制胃癌、食管癌和前列腺癌中的XB130可引起细胞周期的G0/G1期阻滞[5-7]。为了进一步了解XB130基因调控HCC细胞增殖的机制,我们检测了沉默XB130基因后Huh7细胞周期的改变。结果发现,沉默XB130基因48 h后,G0/G1期Huh7细胞比例明显升高,说明XB130蛋白在HCC中能够促进细胞从G0期进入G1期,从而促进细胞的增殖。
XB130蛋白包含有数个酪氨酸磷酸化位点、1个Src同源结构域2(SH2)和3个SH3,故其可被酪氨酸磷酸化,进而与PI3K的亚单位p85α结合并激活下游的AKT,调控细胞周期、细胞凋亡等过程[3-4]。为了探索XB130在HCC中调控细胞增殖和细胞周期的可能机制,本研究测定了细胞中p-AKT、p-GSK3β、cyclin D1及p-Rb的蛋白表达和E2F/DP-1的靶基因mRNA表达。结果发现,p-AKT、p-GSK3β表达下降,提示在HCC中XB130基因受抑制也可以导致AKT磷酸化水平下调,并进而影响GSK3β的磷酸化水平。AKT的失活伴随GSK3β的活化,会使cyclin D1表达下降,抑制周期蛋白依赖性激酶CDK4/6的活性,导致其下游的Rb蛋白磷酸化受限,E2F/DP-1转录因子复合物难以发挥转录激活细胞周期的功能[8];而本实验结果也显示,cyclin D1和p-Rb表达下调,以及E2F/DP-1靶基因cyclin E1、c-Myc和PCNA表达下调。上述结果提示,XB130蛋白可能是通过活化PI3K/AKT通路,调控细胞周期蛋白及下游转录因子,从而影响Huh7细胞的增殖能力。
XB130在HCC细胞增殖中发挥重要作用,可以成为HCC治疗的一个新靶点。
[1] World Health Organization. World Cancer Report 2014 [R].2014.
[2] XU J, BAI X H, LODYGA M, et al. XB130, a novel adaptor protein for signal transduction [J]. J Biol Chem, 2007,282(22): 16401-16412.
[3] SHIOZAKI A, LIU M. Roles of XB130, a novel adaptor protein in cancer [J]. J Clin Bioinforma, 2011, 1(1): 10.
[4] BAI X H, CHO H R, MOODLEY S, et al. XB130-a novel adaptor protein: gene, function, and roles in tumorigenesis [J].Scientifica (Cairo), 2014: 903014.
[5] SHI M, ZHENG D, SUN L, et al. XB130 promotes proliferation and invasion of gastric cancer cells [J]. J Transl Med, 2014,12: 1-9.
[6] SHIOZAKI A, KOSUGA T, ICHIKAWA D, et al. XB130 as an independent prognostic factor in human esophageal squamous cell carcinoma [J]. Ann Surg Oncol, 2013, 20(9): 3140-3150.
[7] CHEN B, LIAO M, WEI Q, et al. XB130 is overexpressed in prostate cancer and involved in cell growth and invasion [J].Oncotarget, 2016, 7(37): 59377-59387.
[8] MASSAGUÉ J. G1cell-cycle control and cancer [J]. Nature,2004, 432(7015): 298-306.
