人参总皂苷对两种蔬菜病原菌的影响
2018-03-09雷锋杰张爱华傅俊范王壮张连学
雷锋杰,张爱华,傅俊范,王壮,张连学
(1.吉林农业大学 中药材学院,吉林 长春 130118;2.沈阳农业大学 植物保护学院,辽宁 沈阳 110161)
在自然条件下,植物无法通过主动移动逃避不利环境。然而,植物与其他生物之间其实是一种“共同进化”“互为主客体”的关系[1]。现有证据足以证明,植物次生代谢物质是植物化学防御的重要武器[2-4]。次生代谢产物在提高植物抗病能力方面起着举足轻重的作用,如糖苷生物碱在植物的新生芽、花、嫩叶、未成熟的果实中含量高,可保护这些重要器官免受其他生物的攻击[5]。
皂苷广泛存在于植物体内,是植物中重要的次生代谢产物之一,具有杀菌、化感、杀病毒、杀虫等多种生物活性,在植物抵御病虫害过程中发挥着重要作用[6]。人参皂苷作为人参的重要次生代谢成分,在抵抗病原微生物的侵害方面也有重要作用。加拿大学者Bernards对西洋参的根系分泌物进行研究发现,22 d内大约有12 mg人参皂苷被释放进土壤中,并且西洋参根际土壤中含有的人参皂苷成分对土传病原菌具有显著地影响作用[7-8]。另有研究表明,不同浓度的人参根系分泌物成分对人参致病菌如人参立枯丝核菌、菌核菌和锈腐菌菌落生长以及人参黑斑菌、锈腐菌孢子萌发的作用具有显著差异[9]。这些研究都在一定程度上反映了人参皂苷对微生物的作用效果,但对其化学防御作用却没有明确的解释。
白菜白斑病、番茄早疫菌病分别是白菜和番茄中常见的病害。其中白菜白斑病主要危害其叶片,病斑呈圆形或卵圆形,灰白色至淡褐色,边缘常有黄绿色晕圈,后期病斑半透明,薄如窗纸,有时开裂,穿孔。重时病叶黄枯[10]。而番茄早疫病又称轮纹病,病原菌为半知亚门茄链格孢菌Alternariasolani。此病侵染叶片、茎部和果实,严重时引起落叶、落果和断枝,病害流行年份造成巨大损失[11]。
因此,本实验旨在通过研究不同浓度的人参总皂苷对两种常见蔬菜病原菌菌落生长速率和孢子萌发的影响,探讨人参皂苷在白菜和番茄生长过程中对其病原微生物的化学防御作用。为进一步研究人参皂苷在蔬菜类作物防病治病方面提供理论依据。
1 材料与方法
1.1 人参皂苷溶液的配制
本实验所用人参总皂苷由吉林省人参工程技术研究中心实验室提供。
精确称量各组人参皂苷0.1 g,用蒸馏水溶解后,用容量瓶定容至10 mL,即得到浓度为10 mg·mL-1的皂苷母液,备用。
1.2 供试菌种
受试菌种包括白菜白斑菌Cercosporellabrassicae、番茄早疫菌Alternariasolani,均由吉林省人参工程技术研究中心实验室提供。
1.3 培养基
马铃薯蔗糖琼脂培养基。
1.4 实验方法
1.4.1菌落生长实验 本实验采用菌丝生长速率法测定病原菌菌落的生长速度。在无菌条件下,将预先配制好的人参皂苷母液经细菌滤器过滤后,用移液枪分别精确量取0.125 mL,0.25 mL,0.50 mL,1.00 mL加入到融化好的马铃薯蔗糖琼脂培养基(100 mL)中。充分摇匀后,将培养基倒入经高温灭菌的培养皿(d=9 cm)中,待冷凝后备用。对照组加入等量无菌水。
将供试病原菌(白菜白斑菌、番茄早疫菌)分别在不含任何添加物的正常马铃薯蔗糖琼脂培养基平板上培养2~3代以后,选择长势均匀一致的区域,用直径为9 mm的打孔器在培养基上打取菌饼,然后将菌饼移至添加有不同浓度人参皂苷的马铃薯蔗糖琼脂培养基平板中央处,有菌丝的一面向下。每个平板接种一个菌饼,每个处理三次重复,以加入等量无菌水的培养基为对照。于26 ℃恒温黑暗培养,用游标卡尺按照“三线均分法”(即用三条成60°角的直径将培养皿圆周平均分割,沿每条直径测量菌落直径)每24 h测量一次菌落直径,连续观测4~5天。菌落生长抑制率计算公式[9]如下:

1.4.2 孢子萌发实验 本实验采用孢子悬滴萌发法测定孢子萌发率[12,9]。在无菌条件下,将培养好的病原菌菌种用无菌水浸泡,并用接种针刮下菌落,收集经纱布过滤后的滤液,在显微镜下检查孢子数量,以10×10低倍镜下,每个视野30~50个孢子为宜,即制备出病原菌的孢子悬浮液。
取10 μL孢子悬浮液与稀释好的人参皂苷溶液(浓度分别为:12.5、25、50 和100 mg·L-1)等量混合后,加入双凹载玻片中。将载有悬浮液的凹玻片倒置于保湿培养皿中,25 ℃恒温黑暗培养,12 h后记录10倍目镜×40倍物镜视野下100个孢子的萌发情况,以孢子芽管长超过孢子短直径一半时即为萌发,计算孢子萌发率。每个处理3次重复。
1.5 统计分析
试验结果用Excel(2007版)软件进行数据处理,利用SPSS 17.0中的单因素方差分析(One-wayANOVA)结合LSD法对统计结果进行显著性方差分析。不同处理间不含相同英文字母表示差异显著(P<0.05),相同英文字母表示差异不显著(P>0.05)。
2 结果与分析
2.1人参皂苷对白菜白斑菌菌落生长的影响
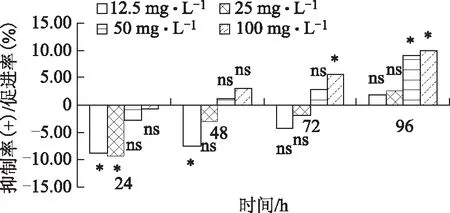
图1 人参总皂苷对白菜白斑菌生长的影响
由图1可知,总体上,各处理菌丝的生长速率随时间的延长而不断增加,但24~48 h内的增幅最大,此后逐渐降低。培养24 h后,各处理较对照均表现出促进作用,但只有低浓度的两个处理(12.5、25 mg·L-1)促进效果与对照差异显著(P<0.05)。而中高浓度(50、100 mg·L-1)处理的促进作用与对照组差异不显著;随着培养时间的增加,各处理的促进作用开始减弱,72 h时高浓度(100 mg·L-1)处理的菌落最先表现出抑制作用;培养96 h后,中高浓度(50、100 mg·L-1)的两个处理均显著抑制了白菜白斑菌的生长速度,抑制率分别为8.94%和9.93%。
2.2 人参皂苷对番茄早疫菌菌落生长的影响
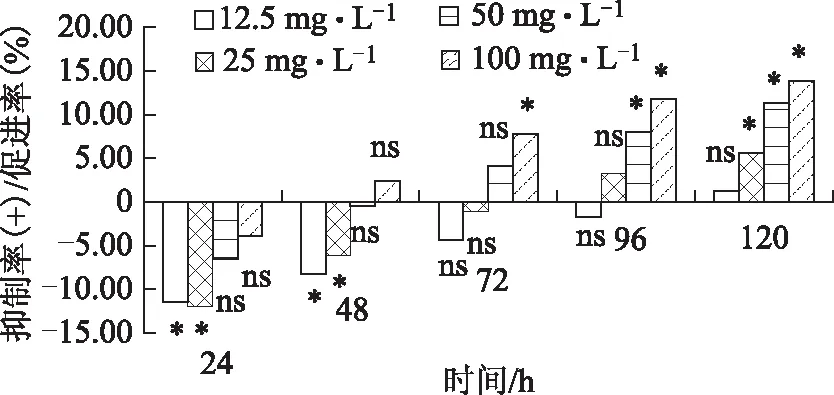
图2 人参总皂苷对番茄早疫菌生长的影响
由图2所示。各处理菌丝的总体生长速率随时间增加而增加,在培养初期增幅较大,72 h后变化不明显。在菌落生长的48 h内,12.5和25 mg·L-1两个处理较对照组均表现出明显的促进作用(P<0.05),其中24 h时,浓度为25 mg·L-1的促进率为11.93%,略高于12.5 mg·L-1的处理(11.42%);72 h时,100 mg·L-1的处理最先表现出显著地抑制作用;随着培养时间的增加,50 mg·L-1(96 h)和25 mg·L-1(120 h)依次表现出抑制作用;在实验末期(120 h),100 mg·L-1处理的抑制率达13.98%,抑制作用最为显著(P<0.05)。
2.3 人参皂苷对白菜白斑菌和番茄早疫菌孢子萌发的影响
由表1可知,人参总皂苷低浓度处理略有促进,但与对照差异不显著;中高浓度(50、100 mg·L-1)处理对白菜白斑菌的孢子萌发具有显著的抑制作用(P<0.05),抑制率分别为8.59%和9.20%。而人参皂苷对番茄早疫菌孢子萌发的影响显示,低中浓度处理能促进孢子萌发,其中25 mg·L-1促进率为10.24,中高浓度(50、100 mg·L-1)处理均对其孢子萌发具有显著的抑制作用(P<0.05),抑制率分别为6.02%和12.66%。

表1 人参总皂苷对白菜白斑菌和番茄早疫菌孢子萌发的影响
注:表中数据为3次重复的平均值±标准差;抑制率为负表示促进,抑制率为正表示抑制
3 讨论
人参皂苷是人参、西洋参的一种次生代谢产物,由苷元与糖相联构成,属于三萜类皂苷(triterpenoid saponins)[13]。三萜皂苷是一类重要的植物次生代谢产物,广泛分布于植物界中,可用作药物,同时有抗菌和抗虫害的作用,具有重要的商业价值[14]。多数萜类化合物都具有抑菌和杀菌的作用。植物为了有效地保护自身免受病原菌的侵害而长期进化产生的一系列化学防御物质[15]。从辐射松Pinusradiata中分离的二萜化合物对松树病原菌Dothistromapini有很高的抗菌活性,这些萜类化合物还能抑制孢子的萌发和菌丝体的生长[16]。日本花柏Chamaecyparispisifera的叶子和枝条中含有的二萜化合物对水稻病原菌Pyriculariaoryzae也呈现出抗菌活性[17]。Cole等[18]发现唇形科黄芩属Scutellaria中的二萜化合物不仅对Fusarium oxysporum 等病原菌具有抗菌和抑制孢子萌发的生物活性,而且还显示出对昆虫的拒食活性。
本实验的研究发现,不同浓度的人参总皂苷对白菜白斑菌、番茄早疫菌的影响结果大致相同,在培养初期(24 h)均表现出一定的促进效果(低浓度处理尤其明显),随着培养时间增加,各处理按照浓度高低的顺序先后表现出不同程度的抑制作用,并且抑制效果逐渐增强。这说明,白菜白斑菌和番茄早疫菌在培养早期可利用某些人参皂苷成分加速菌丝生长,随着培养时间增加和有益成分的消耗,某些具有抑制作用的人参皂苷开始发挥作用,阻碍病原菌的生长。
不同浓度的人参总皂苷对两种病原菌孢子萌发的作用效果相似,总体上呈低促高抑的效果,与李勇等研究的根系分泌物对人参病原菌孢子萌发的作用效果相比,人参皂苷对这两种蔬菜病原菌孢子萌发的影响较弱[9]。
[1] Michael Pollan.The Botany of Desire-a plant’s-eye view of the world[M].Random House Trade Paperbacks,2002.
[2] 高微微,佟建明,郭顺星.植物次生代谢产物的生态学功能研究进展[J].中国药学杂志,2006,41(13):961-964.
[3] 孔垂华,胡飞.植物化感(相生相克)作用及其应用.1版[M].北京:中国农业出版社,2001.
[4] 孔垂华,娄永根.化学生态学前沿.2版[M].高等教育出版社,2010:410-412.
[5] Friedman M,Levin C E,McDonald G M.α-Tomatine determination in tomatoes by HPLC using pulsed ampero-metric detection[J].J.Agric.Food Chem,1994(42):1959-1964.
[6] Gonzalez-Lamothe R,Mitchell G,Gattuso M,et al.Plant antimicrobial agent and their effects on plant and human pathogens[J].Int.J.Mol.Sci.,2009(10):3400-3419.
[7] Robert W.Nicola,Lina Yousefa,James A.Traquairb,Mark A.Bernards.Ginsenosides stimulate the growth of soilborne pathogens of American ginseng[J].Phytochemistry,2003:257-264.
[8] Nicol R W,Traquair J A,Bernards M A.Ginsenosides as host resistance factors in American ginseng(Panaxquinquefolius)[J].Can J Bot,2002,80(5):557-561.
[9] 李勇,刘时轮,黄小芳,等.人参(Panaxginseng)根系分泌物成分对人参致病菌的化感效应[J].生态学报,2009,29(1):161-168.
[10] 曹晓媚.白菜白斑病与霜霉病发病规律及防治技术.现代农村科技.2013(7):21-21.
[11] 马桂珍,王淑芳,暴增海,吴少杰,夏振强,李世东.多粘类芽孢杆菌L1-9 菌株对番茄早疫病的抑菌防病作用.中国蔬菜,2010(12):55-59.
[12] 张新虎,何静,沈慧敏.苍耳提取物对番茄灰霉病菌的抑制作用及抑菌机理初探[J].草业学报,2008,17(3):99-104.
[13] 匡海学.中药化学.1版[M].北京:中国中医药出版社.2002:252-256.
[14] 雷彩燕,李静静,闫凤鸣.植物皂苷生物合成及调控研究进展[J].中国农业科技导报,2014,16(4):50-58.
[15] Grayer J R,Harbone J B.A survey of antifungal compounds from higher plants[J].Phytochemistry,1994(37):19-42.
[16] Franich R A.Physiol Plant Path[J].Phytochemistry,1983(23):183-189.
[17] Kobayashi K,Nishino C,Tomita H.Antifungal activity of pisiferic acid derivatives against the rice blast fungus[J].Phytochemistry,1987(26):3175-3179.
[18] Cole M D,Bridge P D,Dellar J E.Antifungal activity of neo-clerodane diterpenoids from Scutellaria[J].Phytochemistry,1991(30):1125-1127.
