不同盐分水平对柽柳扦插苗根系生长及生理特性的影响
2018-03-08宋香静李胜男于一雷刘志伟
宋香静, 李胜男, 郭 嘉, 于一雷, 刘志伟, 韦 玮
中国林业科学研究院湿地研究所,湿地生态功能与恢复北京市重点实验室,北京 100091
黄河三角洲湿地是中国最年轻、最具特色的湿地,处于海陆交界地带,生境类型独特,自然灾害频繁,表现出复杂性、不稳定性和脆弱性的特征[1]。受潮汐侵蚀、河道断流、降水减少等因素影响,使得黄河三角洲地区具有较高的土壤盐分,对植物的生存与生长提出了更高的要求。柽柳(Tamarixchinensis)是柽柳科(Tamaricaceae)柽柳属(Tamarix)的落叶灌木或小乔木,可通过盐腺排泄过量盐分来调节盐平衡,适应盐渍化环境[2- 3];柽柳根系发达,对防止水土流失、维持库岸稳定性、改良土壤和维持湿地生态系统平衡具有重要作用,是黄河三角洲湿地的主要耐盐植物之一[4]。在长期适应黄河三角洲独特的湿地生境中,柽柳形成了特有的环境适应特征,以确保其在特定环境中的生存和发展。近年来,受自然因素及发展盐业、渔业等人类活动的影响,导致黄河三角洲湿地土壤盐渍化程度加剧,柽柳的生长受到严重威胁[5],且有研究表明,土壤盐分是影响柽柳生长生存的关键环境因子之一[6]。而根系是植物与土壤环境接触的重要界面,能够直接感受土壤盐分变化,并能通过自身的调节系统,使之在形态和生理上发生适应性反应,提高对养分和水分的吸收能力,以增强生存能力[7- 9]。根系对盐分条件的响应,是植株适应外界环境变化的重要模式,因此研究根系对盐分条件的适应对植被保护与恢复具有重要意义。
目前,关于滨海湿地柽柳的研究多集中于柽柳种群空间分布特征[10- 11]、柽柳叶片生理生化特征[12- 14]、柽柳群落的土壤环境特征等[2,4,15]。而对柽柳根系的研究,尤其是柽柳根系生态特性及其对盐分条件的响应研究较少。本研究在水培条件下,通过分析柽柳扦插苗根系在不同盐分水平下生长及生理生态特性,探讨根系对盐分条件的响应机理,以期为滨海湿地生态保护与恢复提供科学依据。
1 材料和方法
1.1 实验材料

图1 实验装置示意图Fig.1 Schematic diagram of experimental device
实验采用水培方法,自2016年1月至4月,共培养90 d。选取黄河三角洲滨海湿地一年生柽柳枝条,剔除枯枝和病虫害枝,剪取直径为0.6—0.7 cm的枝条15 cm长,基部斜削,顶部平齐,扦插到48 cm×35 cm×15 cm的实验方盆中,方盆上方放置泡沫板,将枝条插入有孔泡沫板上,用海绵固定(图1)。方盆中安放压缩空气泵装置,以满足根系生长对氧气的需求。枝条每盆10株,每个处理设5个重复,共30盆,300株。生根前选用纯净水配制不同浓度水平的NaCl溶液进行培养,待枝条生根后,选用改良过的1/2 Hoagland营养液配制成不同浓度水平NaCl溶液继续培养,每盆装溶液10 L,保证枝条至少1/3浸入溶液。综合本研究前期野外调查数据、前人研究结果及前人相关研究设置梯度等多个方面[1,16- 20],本研究中盐分水平设置为:0.4%、0.8%、1.2%、2.4%、3.6%,以不加盐的培养溶液作为空白对照(CK)。定期测定培养溶液中的盐分浓度,适时补充盐量,保持盐分浓度稳定,并定期更换培养溶液,满足枝条生根对养分的需求。
1.2 测定指标和方法
测定柽柳生根率、主根数、主根长、根寿命;地上部生物量及根系生物量;根中ATP合成酶活性、过氧化氢酶活性(CAT)及根中脱落酸(ABA)含量。
生根率测定采用计数法计算(式1)。主根数和主根长采用计数和测量法,其中,主根长以最长根计数,测量时间间隔为15 d。根寿命测定是在每株植物中任选两条根作标记,定期观察生长状况,记录其成活时间。生物量及生理指标测定均在培养90 d后进行统一取样测定。地上生物量(枝叶生物量干重)和根系生物量采用恒温烘干法测定。ATP合成酶、CAT活性及ABA含量采用ELISA酶测试法,其基础是抗原或抗体的固相化及抗原或抗体的酶标记。

(1)
1.3 数据处理
试验数据均采用SPSS 20.0进行单因素方差(ANOVA)分析,并用Duncan(α=0.05)分析法对数据进行多重比较。统计分析和制图通过EXCEL实现。
2 结果与分析
2.1 不同盐分水平对柽柳根系生长特性的影响
2.1.1 生根率及根系寿命
实验中对柽柳生根过程监测(图2)结果表明,随培养时间增加各水平生根率均呈上升趋势,且50 d后趋于平稳。其中,柽柳在CK和含盐量0.4%—2.4%时,10天内均可生根,而在含盐量3.6%时,培养30 d后才开始生根。整个培养过程中,柽柳在含盐量0.4%和0.8%时均保持较高生根率,高于70%;随含盐量升高,生根率则显著降低,含盐量2.4%和3.6%时,生根率均不足50%。培养结束时生根率统计计算(图3)表明,低盐条件下,柽柳生根率较高,且各水平间生根率差异不显著;含盐量1.2%时,柽柳生根率急剧降低,并随含盐量升高一直保持下降的趋势,显著低于CK(P<0.05);至含盐量达到3.6%时,不易生根。

图2 不同盐分水平下柽柳的生根过程 Fig.2 The rooting process of Tamarix chinensis under different salinity levels不同字母表示显著差异,显著水平为(P<0.05)
实验中对柽柳根寿命的监测(图4)表明,含盐量为0.8%时,柽柳根寿命最长,平均达83 d,比CK高3.5 d,但差异不显著(P>0.05),说明适量的盐分有利于柽柳根系存活;但随含盐量升高,根寿命下降,含盐量1.2%时,柽柳根寿命67.3 d;含盐量为2.4%时,柽柳根寿命47 d;含盐量3.6%条件下,根系寿命仅为35天,且均显著低于CK(P<0.05)。因此,高盐条件下不利于柽柳根系存活,柽柳根系最适宜的含盐量条件低于0.8%。
2.1.2 最长主根长及主根数
实验中对柽柳主根长测定表明(图5),不同盐分水平间柽柳主根长具有显著差异,CK处的主根长最长,平均为15.0 cm,随含盐量升高,柽柳主根长显著降低(P<0.05)。至含盐量1.2%时,柽柳主根长又显著增加,虽显著高于含盐量0.8%时,但仍低于CK时(P<0.05)。含盐量2.4%时,主根长急剧降低,相对CK时降低了90.1%(P<0.05);随含盐量升高,主根长保持持续下降趋势,至含盐量3.6%时,柽柳主根长最短,平均为0.8 cm。
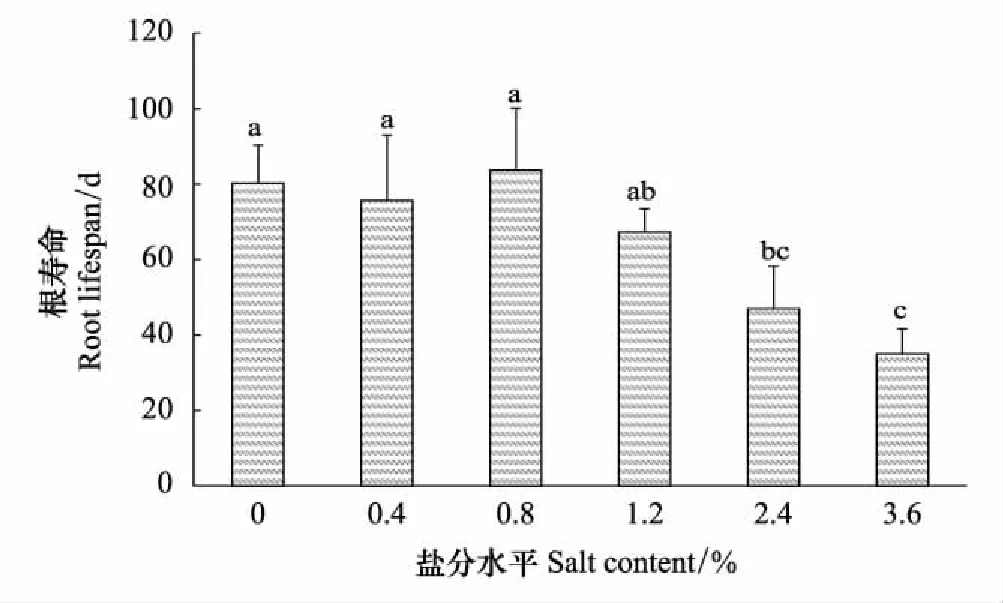
图4 不同盐分水平下柽柳的根寿命 Fig.4 Root lifespan of Tamarix chinensis under different salinity levels
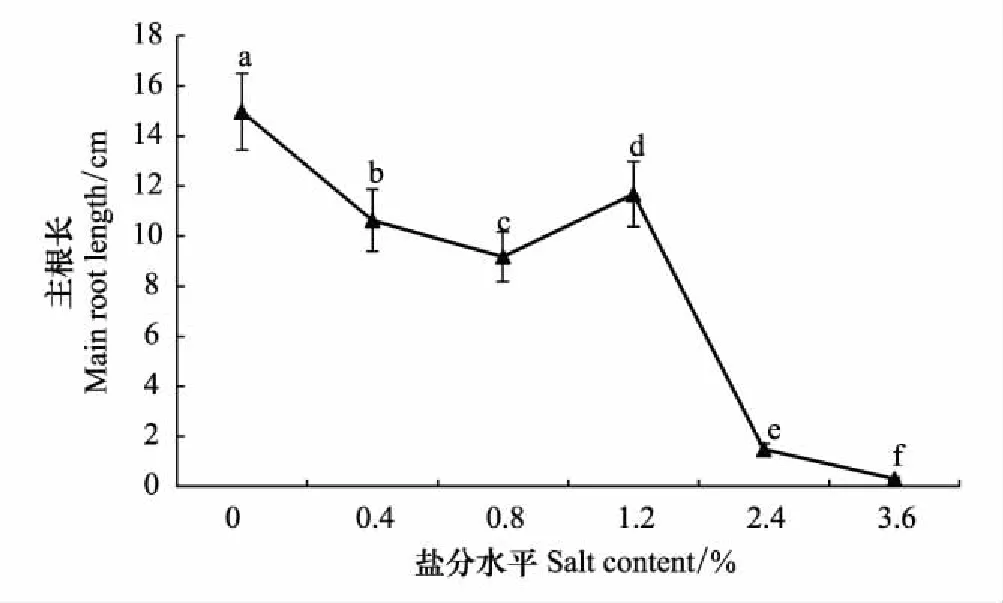
图5 不同盐分水平下柽柳的主根长 Fig.5 The taproot length of Tamarix chinensis under different salinity levels
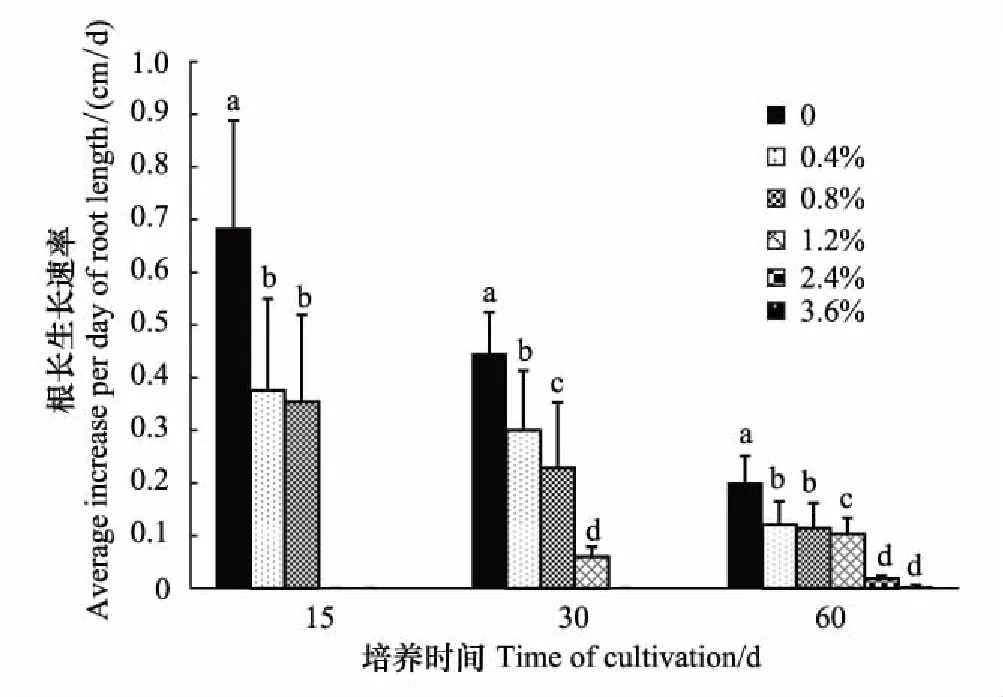
图6 不同盐分水平下柽柳主根长的平均生长速度 Fig.6 Average growth rate of taproot length of Tamarix chinensis under different salinity levels
通过对根系生长速度的观测计算(图6),随培养时间增加,高盐水平下根长生长速度逐渐上升,含盐量2.4%和3.6%时,在培养时间30 d内不生根,至60 d时才开始生长,但均不足0.1 cm/d。含盐量不足0.8%时,随培养时间增加,生长速度下降。相同培养时间下,各水平间根长生长速度具有显著差异,且随含盐量升高根长生长速度出现递减趋势,CK时最高,平均为0.7 cm/d,其余各盐分水平下均显著低于CK时(P<0.05)。
对柽柳根系主根数统计表明(图7),随含盐量升高,主根数平稳升高,含盐量0.4%时达到最大值,平均为45.8根;含盐量1.2%时迅速下降,平均为38.1根,显著低于0.8%和CK水平(P<0.05);含盐量2.4%时,柽柳主根数急剧下降,显著低于1.2%,和CK水平(P<0.05);至含盐量3.6%时,柽柳主根数减少到最小值,平均为3.6根,但与含盐量2.4%时相比差异不显著(P>0.05)。
2.1.3 地上生物量及根系生物量
对柽柳地上部和根系生物量干重测定分析表明(图8),随含盐量升高,地上生物量和根系生物量均呈先增加后降低趋势,地上生物量在含盐量1.2%时最大,为0.59 g,显著高于其他处理(P<0.05);含盐量2.4%时,相比含盐量1.2%时,地上生物量显著下降(P<0.05)。根系生物量则在含盐量0.8%时最大,为0.35 g,在1.2%时显著降低,且低于含盐量0.8%水平(P<0.05)。至含盐量3.6%时,柽柳未发芽,根系生物量最小。可见,含盐量不超过1.2%条件下,地上部生物量比例较大,但当含盐量高于1.2%时,植株分配生物量的比例开始往根系倾斜,但地上部仍高于根系;含盐量2.4%时,地上生物量和根系生物量分配比例差距减小,地上部分占60%,根系生物量占40%,当含盐量为3.6%时,柽柳只发育根系,不萌芽(图9)。
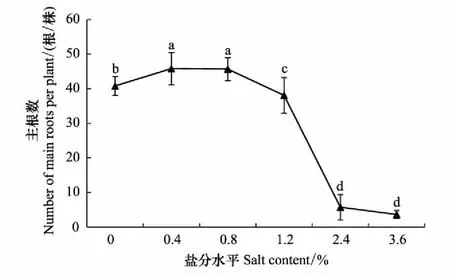
图7 不同盐分水平下柽柳的主根数 Fig.7 Number of roots of Tamarix chinensis under different salinity levels
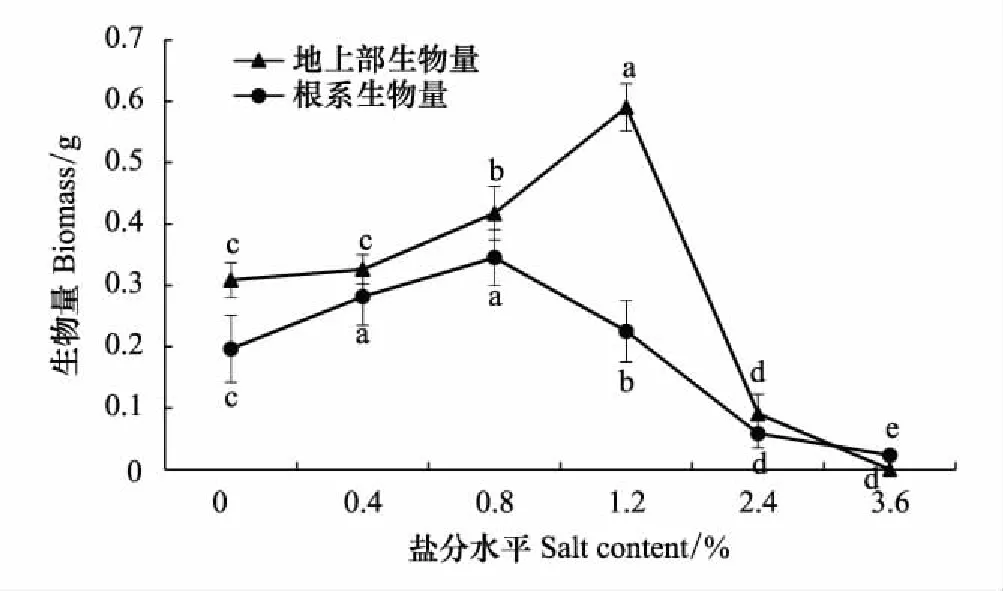
图8 不同盐分水平下柽柳的根系生物量 Fig.8 Root biomass of Tamarix chinensis under different salinity levels
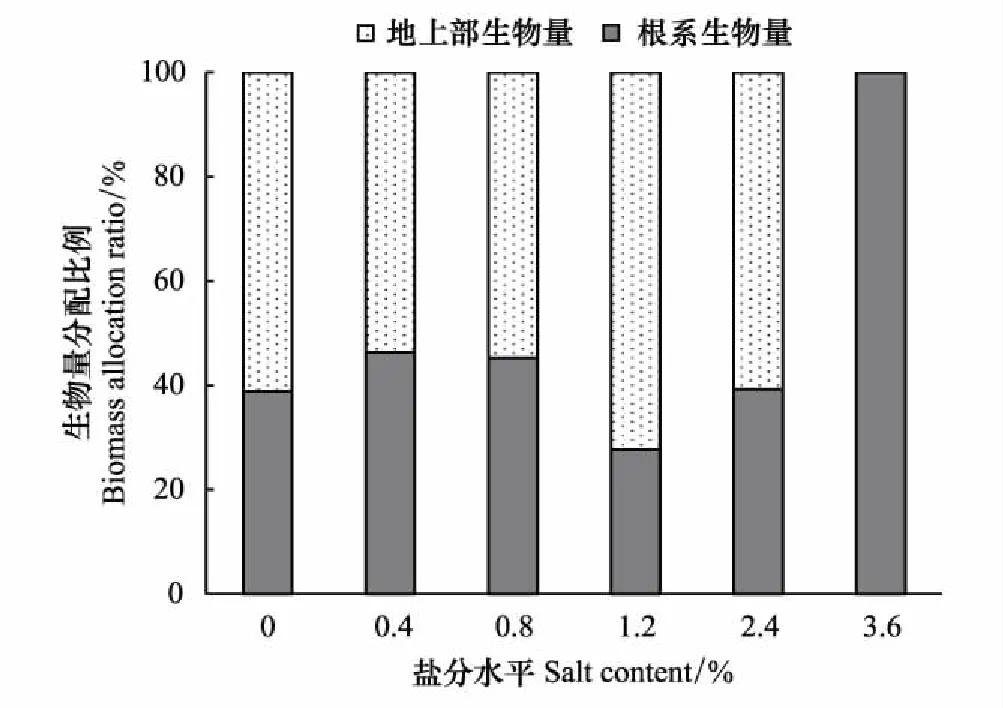
图9 不同盐分水平下柽柳的生物量分配比例 Fig.9 The biomass allocation ratio of Tamarix chinensis under different salinity levels
2.2 不同盐分水平对柽柳根系生理特性的影响
2.2.1 ATP合成酶活性
ATP合成酶常作为根系活力的指标来反映植物对环境的适应能力,环境适宜时,根系活力往往较强。试验中对柽柳根内ATP合成酶活性进行测定表明(图10),随含盐量升高,柽柳根内ATP合成酶活性呈先升高再下降趋势。含盐量0.8%时,ATP合成酶活性最高,平均为15.79 ng/mL,显著高于CK(P<0.05)。含盐量1.2%时,开始急速降低,并显著低于含盐量0.8%和CK时;随含盐量进一步增加,ATP合成酶活性保持下降趋势,至含盐量3.6%时,降至最低,平均为10.0 ng/mL,说明高盐环境会影响根内ATP合成酶的合成,导致酶活性降低;含盐量高于0.8%时,不利于根内ATP合成酶的合成。
2.2.2 过氧化氢酶(CAT)活性
过氧化氢酶(CAT)是植物在逆境条件下酶促防御系统的关键酶之一,它通过与其他氧化酶类协同作用,提高植物对外界环境的适应性。试验中对柽柳根内CAT活性测定表明(图11),随含盐量的升高,柽柳根内CAT活性先升高再下降。含盐量0.8%时,CAT活性最高,达到16.35 U/L,显著高于CK(P<0.05);含盐量1.2%时,CAT活性略有降低,但仍显著高于CK(P<0.05);随含盐量升高,CAT活性一直降低,至含盐量2.4%和3.6%时,达到较低状态,但与CK相比差异却不显著(P>0.05),其中含盐量3.6%时,CAT活性最低为11.25 U/L。说明适宜的盐分水平有利于保持根内CAT活性。
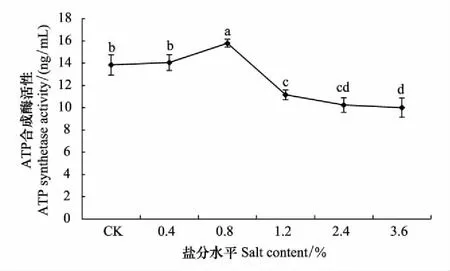
图10 不同盐分水平下柽柳根内的ATP合成酶 Fig.10 The ATP synthetase activity of root of Tamarix chinensis under different salinity levels

图11 不同盐分水平下柽柳根内的CAT活性 Fig.11 The hydrogen peroxide enzyme activity of root of Tamarix chinensis under different salinity levels
2.2.3 脱落酸(ABA)含量

图12 不同盐分水平下柽柳根内ABA含量 Fig.12 The abscisic acid content of root of Tamarix chinensis under different salinity levels
随含盐量的升高,柽柳根内ABA含量呈先升高再下降的趋势(图12)。含盐量0.4%时,柽柳根内ABA含量略有降低。含盐量0.8%时,根内ABA含量与CK相比升高了7.1%,但差异不显著(P>0.05)。当含盐量为1.2%时,柽柳根内ABA含量持续升高,达到最大值,平均为192.6 pmol/mL,但与CK相比差异不显著(P>0.05)。含盐量高于1.2%时,根内ABA含量出现急速下降,且显著低于CK时(P<0.05)。随含盐量的进一步增加,ABA含量持续降低,至含盐量3.6%时,ABA含量最低,平均为111.0 pmol/mL,但高盐水平间差异均不显著(P>0.05)。说明低盐环境对根内脱落酸的刺激作用影响不大,含盐量超过1.2%时会显著影响根内脱落酸的分泌。
2.3 不同盐分水平下生长特性与生理特性相关性分析
综合对不同盐分水平下柽柳各生长指标与生理指标进行相关性分析表明(表1),生根率与主根长呈极显著正相关关系,表明生根率越高,主根长越长;与主根数和地上生物量呈极显著负相关关系。主根数与根系生物量呈显著负相关关系。地上生物量与根系生物量呈极显著正相关关系,表明柽柳地上部生长与根系生长密切相关。主根长与ATP合成酶呈极显著正相关,表明ATP合成酶活性越强,主根长越长;与CAT活性显著正相关。根系生物量与ATP合成酶、ABA含量均呈显著负相关,表明根系生物量越低,ATP合成酶活性越强。ABA与ATP合成酶、CAT活性均有密切关系,与CAT活性呈极显著正相关关系表明,表明ABA含量越高,CAT活性越强;与ATP合成酶呈显著正相关。
3 结论与讨论
3.1 不同盐分水平下柽柳扦插苗生根与生物量分配
根是植物吸收水分和养分的重要器官,扦插生根是植株扦插成功的重要表现。本研究表明,在低盐条件下,生根率较高,含盐量超过0.8%时,柽柳生根受到抑制,生根率显著降低。说明柽柳根系对低盐环境有一定的适应能力,而高盐环境则不利于柽柳生根。本研究中,在高于海水浓度的3.6%含盐量下,柽柳仍能生根,且根系可以继续生长,维持一定的寿命,表现出对高盐环境的较强适应能力,推测可能与黄河三角洲湿地的柽柳在盐分条件上具有较宽的生态位,在含盐量0.11%—4.3%的条件下均可分布生存有关[16- 17],当然也有可能是个体差异。
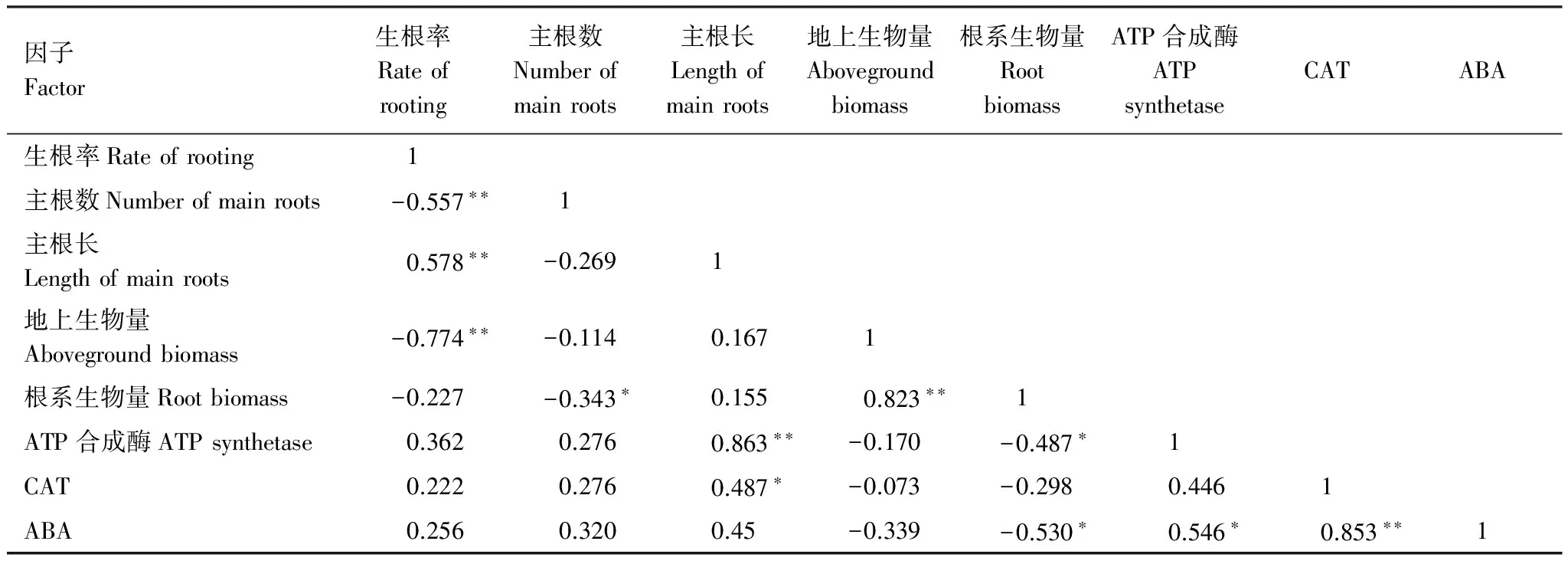
表1 生长指标与生理指标的相关系数
ATP:三磷酸腺苷 Adenosine triphosphate,CAT:过氧化氢酶 Hydrogen peroxide enzyme,ABA:脱落酸 abscisic acid.**:在0.01水平上显著相关,*:在0.05水平上显著相关
植物为适应外界环境条件的变化,生物量分配模式往往不同,以达到资源的优化配置[21- 22],生物量的分配情况反映了植物对盐环境的适应策略。前人研究表明,与地上部相比,根系生产相同单位干物质需要的能量是地上部的两倍[23]。因此,若地下部环境不利,则光合产物会倾向于较多地分配到地下部,以保证根系优先生长,促使根系发达,扩大与外界环境的接触面积,提高植物对水分和养分的吸收量,从而提高植物对外界环境变化的适应能力[24- 25]。本研究中低盐条件下,柽柳分配到地上部分的生物量高于地下部分,而在高盐条件下,柽柳分配到根系的生物量比例逐渐增加,但根系生物量仍小于地上部生物量。出现这种情况推测是由于水培条件下,培养溶液中养分相对土壤条件有限,根系吸收养分有限,根系生长受到影响[26];也有可能是由于盐分条件影响地上部光合作用,光合作用产物分配到根系的量减少[27]。
3.2 不同盐分水平下柽柳根内ABA含量变化
脱落酸(ABA)是一种重要的植物激素,在植物对逆境的适应中有着重要的作用。研究表明,高盐环境下,植株内源ABA的含量显著增加,并通过刺激气孔关闭、改变基因表达、积累渗透相溶性物质等方式增强植物耐盐能力[28- 31]。本研究中,含盐量0.4%—1.2%时,根中脱落酸逐渐增加,当含盐量高于2.4%时,根内脱落酸含量显著下降。表明低盐条件下,柽柳根系可通过刺激分泌脱落酸来提高自身抗性,但当盐分过高,脱落酸分泌受到抑制。闫艳华等[32]认为,低盐浓度下,内源ABA的含量随处理时间的延长不断升高;但高盐浓度处理时,ABA含量在1 d内迅速达到最高,之后逐渐下降。说明植株虽然能诱导ABA响应基因的表达来适应外界环境的变化,然而,随受高盐环境影响时间的延长,植株受到的伤害加重。说明不同植物在高盐环境下均会表现出类似的变化趋势,但关于脱落酸在不同盐分水平下的响应机制及调控方式有待进一步研究。
3.3 不同盐分水平下生长特征与生理特征的相关性
在盐环境条件下,植物根系最早感受盐分变化,并及时作出反应[33]。本研究中,ATP合成酶活性越强,主根长越长,表明根系活力越强,根长增长越快。CAT活性与主根长生长呈显著正相关关系,可能与过氧化氢酶在植物不同生长阶段的特异性有关,也可能是过氧化氢酶在根中表现相对活跃[34- 35]。柽柳根中不同种类的酶类及激素对根系生长的影响不同。根系生长发育过程中CAT、ATP合成酶、及ABA均对根系在不同盐分水平中生存生长起到调节作用,彼此间形成一定的协调关系。本实验中,ATP合成酶和CAT活性随根内ABA含量增高而增强,这与ABA本身对植物生长的促进作用、改变植株内部活性氧产生与清除的动态平衡等有关[36- 37]。
综上所述,不同盐分水平对柽柳根系具有重要影响,本实验从根系生长及生理方面阐述了柽柳扦插苗根系对盐环境的适应性,为黄河三角洲植被恢复提供理论依据,但柽柳根系耐盐机制方面有待进一步研究。
[1] 夏江宝, 赵西梅, 刘俊华, 赵自国, 刘庆, 陈印平. 黄河三角洲莱州湾湿地柽柳种群分布特征及其影响因素. 生态学报, 2016, 36(15): 4801- 4808.
[2] Cao D, Shi F C, Ruan W B, Lu Z H, Chai M. Seasonal changes in and relationship between soil microbial and microfaunal communities in aTamarixchinensiscommunity in the Yellow River Delta. African Journal of Biotechnology, 2011, 10(80): 18425- 18432.
[3] Xia J B, Zhang S Y, Zhang G C, Xu J W, Liu J T, Li C R, Shao H B. Growth dynamics and soil water ecological characteristics ofTamarixChinensisLour. forests with two site types in coastal wetland of Bohai golf. Journal of Food Agriculture and Environment, 2013, 11(2): 1492- 1498.
[4] Sun L K, Liu W Q, Liu G X, Chen T, Zhang W, Wu X K, Zhang G S, Zhang Y H, Li L, Zhang B G, Zhang B L, Wang B, Yang R Q. Temporal and spatial variations in the stable carbon isotope composition and carbon and nitrogen contents in current-season twigs ofTamarixchinensisLour. and their relationships to environmental factors in the Lanzhou Bay wetland in China. Ecological Engineering, 2016, 90: 417- 426.
[5] 何秀平, 王保栋, 谢琳萍. 柽柳对盐碱地生态环境的影响. 海洋科学, 2014, 38(1): 96- 101.
[6] 马玉蕾, 王德, 刘俊民, 温小虎, 高猛, 邵宏波. 黄河三角洲典型植被与地下水埋深和土壤盐分的关系. 应用生态学报, 2013, 24(9): 2423- 2430.
[7] 李峰, 谢永宏, 覃盈盈. 盐胁迫条件下湿地植物的适应策略. 生态学杂志, 2009, 28(2): 314- 321.
[8] Rich S M, Ludwig M, Pedersen O, Colmer T D. Aquatic adventitious roots of the wetland plantMeionectesbrowniican photosynthesize: implications for root function during flooding. New Phytologist, 2011, 190(2): 311- 319.
[9] Pan Y, Xie Y H, Deng Z M, Tang Y, Pan D D. High water level impedes the adaptation ofPolygonumhydropiperto deep burial: Responses of biomass allocation and root morphology. Scientific Reports, 2014, 4: 5612.
[10] Jiang Z M, Chen Y X, Bao Y. Population genetic structure ofTamarixchinensis, in the Yellow River Delta, China. Plant Systematics and Evolution, 2012, 298(1): 147- 153.
[11] Zhu Z, Zhang L Y, Gao L X, Tang A Q, Zhao Y, Yang J. Local habitat condition rather than geographic distance determines the genetic structure ofTamarixchinensispopulations in Yellow River Delta, China. Tree Genetics and Genomes, 2016, 12(1): 1- 9.
[12] 薛苹苹, 曹春辉, 何兴东, 张宁, 邬畏. 盐碱地绒毛白蜡与柽柳展叶期生理生化特性比较. 南开大学学报: 自然科学版, 2009(4): 18- 23.
[13] 朱金方, 陆兆华, 夏江宝, 陈曦, 张萌, 刘京涛. 盐旱交叉胁迫对柽柳幼苗渗透调节物质含量的影响. 西北植物学报, 2013, 33(2): 0357-0363.
[14] Liu J H, Xia J B, Fang Y M, Li T, Liu J T. Effects of salt-drought stress on growth and physiobiochemical characteristics ofTamarixchinensisseedlings. The Scientific World Journal, 2014, 2014(6): 765840.
[15] Rong Q Q, Liu J T, Cai Y P, Lu Z H, Zhao Z Z, Yue W C, Xia J B. “Fertile island” effects ofTamarixchinensis, Lour. on soil N and P stoichiometry in the coastal wetland of Laizhou Bay, China. Journal of Soils and Sediments, 2016, 16(3): 864- 877.
[16] 贺强, 崔保山, 赵欣胜, 付华龄. 水、盐梯度下黄河三角洲湿地植物种的生态位. 应用生态学报, 2008, 19(5): 969- 975.
[17] 凌敏, 刘汝海, 王艳, 罗先香, 周凤琴. 黄河三角洲柽柳林场湿地土壤养分的空间异质性及其与植物群落分布的耦合关系. 湿地科学, 2010, 8(1): 92- 97.
[18] 朱金方, 刘京涛, 陆兆华, 夏江宝, 柳海宁, 金悦. 盐胁迫对中国柽柳幼苗生理特性的影响. 生态学报, 2015, 35(15): 5140- 5146.
[19] 刘克东, 郑彩霞, 郝建卿. 甘蒙柽柳对NaCl胁迫的生理响应. 广东农业科学, 2012, 39(10): 38- 42.
[20] 徐先英, 张孝仁. 柽柳耐盐性水培试验研究. 甘肃林业科技, 1993(4): 1- 3.
[21] Wilson J B. A review of evidence on the control of shoot: root ratio, in relation to models. Annals of Botany, 1988, 61(4): 433- 449.
[22] Lloret F, Casanovas C, Peuelas J. Seedling survival ofMediterraneanshrublandspecies in relation to root: shoot ratio, seed size and water and nitrogen use. Functional Ecology, 1999, 13(2): 210- 216.
[23] Passioura J B. Root signals control leaf expansion in wheat seedlings growing in drying soil. Australian Journal of Plant Biology, 1988, 15(5): 687- 693.
[24] Gedroc J J, McConnaughay K D M, Coleman J S. Plasticity in root/shoot partitioning: optimal, ontogenetic, or both? Functional Ecology, 1996, 10(1): 44- 50.
[25] 刘莹, 盖钧镒, 吕彗能. 作物根系形态与非生物胁迫耐性关系的研究进展. 植物遗传资源学报, 2003, 4(3): 265- 269.
[26] Mou P, Jones R H, Tan Z Q, Bao Z, Chen H M. Morphological and physiological plasticity of plant roots when nutrients are both spatially and temporally heterogeneous. Plant and Soil, 2013, 364(1/2): 373- 384.
[27] 弋良朋, 王祖伟. 盐胁迫下3种滨海盐生植物的根系生长和分布. 生态学报, 2011, 31(5): 1195- 1202.
[28] 梁建生, 庞佳音, 陈云. 渗透胁迫诱导的植物细胞中脱落酸的合成及其调控机制. 植物生理学报, 2001, 37(5): 447- 451.
[29] Fujita Y, Fujita M, Satoh R, Maruyama K, Parvez M, Seki M, Hiratsu K, Ohme-Takagi M, Shinozaki K, Yamaguchi-Shinozaki K. AREB1 is a transcription activator of novel ABRE-dependent ABA signaling that enhances drought stress tolerance inArabidopsis. The Plant Cell, 2005, 17(12): 3470- 3488.
[30] 郝格格, 孙忠富, 张录强, 杜克明. 脱落酸在植物逆境胁迫研究中的进展. 中国农学通报, 2009, 25(18): 212- 215.
[31] 陈娟, 潘开文, 辜彬. 逆境胁迫下植物体内脱落酸的生理功能和作用机制. 植物生理学报, 2006, 42(6): 1176- 1182.
[32] 闫艳华, 姜国斌, 侯和胜, 金华, 马金龙, 王颖. 杨树内源激素对NaCl胁迫的响应. 西北农业学报, 2011, 20(9): 160- 164.
[33] 孙洪刚, 陈益泰. 沿海防护林四个树种根系分布对盐胁迫的响应. 生态学杂志, 2010, 29(12): 2365- 2372.
[34] 梁艳荣, 胡晓红, 张颍力, 刘湘萍. 植物过氧化物酶生理功能研究进展. 内蒙古农业大学学报: 自然科学版, 2003, 24(2): 110- 113.
[35] 陈金峰, 王宫南, 程素满. 过氧化氢酶在植物胁迫响应中的功能研究进展. 西北植物学报, 2008, 28(1): 188- 193.
[36] 李汝佳, 李雪梅. 水杨酸、脱落酸和过氧化氢对镉胁迫小麦幼苗光合及抗氧化酶活性的影响. 生态学杂志, 2007, 26(12): 2096- 2099.
[37] 刘小金, 徐大平, 杨曾奖, 张宁南. 脱落酸对檀香幼苗生长、光合及叶片抗氧化酶活性的影响. 南京林业大学学报: 自然科学版, 2016, 40(3): 57- 62.
