小兴安岭阔叶红松林地表甲虫Beta多样性
2018-03-08高梅香朱纪元倪娟平李景科林琳吴东辉
高梅香,朱纪元,倪娟平,李景科,林琳,*,吴东辉
1 哈尔滨师范大学地理科学学院, 哈尔滨 150025 2 黑龙江省普通高等学校地理环境遥感监测重点实验室, 哈尔滨 150025 3 中国科学院东北地理与农业生态研究所, 湿地生态与环境重点实验室, 长春 130012
Whittaker[1]1960年提出物种多样性的三个水平,即alpha多样性、beta多样性和gamma多样性。Alpha多样性(即特定立地或群落的物种丰富度)和gamma多样性(即多个群落的物种多样性)[1]受到较多的关注,而beta多样性在近十几年来才逐渐引起重视[2]。Beta多样性用来衡量集群内物种组成的变异性,指的是“与环境的复杂梯度或环境格局相联系的群落组成变化的幅度或群落分化的程度”[1, 2]。Beta多样性可以用来反映并揭示群落的构建过程,是格局与过程及生物多样性维持机制研究的热点之一[2],然而我们对beta多样性的认识仍然不足。
Beta多样性可以被看作是两个不同尺度(alpha和gamma多样性)编目多样性的比较度量[3],狭义的测量包括gamma多样性和alpha多样性的简单比率[4- 6],广义的测量包括分化多样性和比例多样性[6, 7]等。目前beta多样性度量方法约40多种[2],然而诸多beta多样性的不同观点都是和单一的beta多样性概念相一致的[3]。实际上beta多样性可以被分解为两个不同的组分,即空间物种转换和物种集群镶嵌[8, 9]。某些研究地点的生物区系具有较少的物种数量,而其他研究地点的生物区系具有更丰富的物种数量,当前者为后者的子集时便出现物种集群镶嵌[10,11]。作为促进集群有序解散的任何因子的后果,物种集群镶嵌反映了物种缺失的非随机性过程[12]。这里的物种缺失指的是一些物种在一些研究地点没有出现,并非指物种灭绝或分化的扩散能力[13]等潜在的机制过程。与此相反,空间物种转换指的是一些物种被其他物种替换,该现象是环境排序或空间及历史限制的后果[14]。空间物种转换和物种集群镶嵌作为beta多样性的两种格局,其分别对应的物种缺失和物种替换是两个相对立的过程,而这两种格局及组合可能由不同机制调控[15],因此分解beta多样性的空间物种转换和物种集群镶嵌组分,是揭示群落构建机制的关键步骤[16]。
识别beta多样性的空间物种转换和物种集群镶嵌已经被应用于地衣[17]、苔藓、蕨类和种子植物[18]等群落生态学的研究中,然而目前的研究较多集中于地上生态系统,地下生态系统的研究非常少见。地表甲虫是土壤生态系统的重要组成部分,其类群丰富、数量较多、活动能力较强且分布广泛,是研究地下生态系统群落格局与过程的良好实验对象[19,20]。研究表明泛滥平原步甲科群落的beta多样性主要由空间物种转换组成,并认为研究地点之间的物种转换是步甲科群落分布的重要驱动力[21]。欧洲陆地粪甲科群落beta多样性的空间物种转换仅在个别月份起主要作用,营养性状可能影响其物种转换,而生境差异可能影响其物种丧失[22]。可见空间物种转换和物种集群镶嵌的区分有助于揭示土壤动物群落构建机制,但是针对地表甲虫beta多样性的系统研究少见。本实验在东北东部山区典型的地带性阔叶红松林内,以凉水和丰林国家自然保护区为研究区,揭示地表甲虫beta多样性的空间物种转换和物种集群镶嵌特征,为地表甲虫物种分布和生物多样性调控机制研究奠定基础。
1 研究地区与研究方法
1.1 研究地区
研究区为伊春凉水(47°7′—47°14′ N, 128°48′—128°55′ E)和丰林(47°54′—48°19′ N,129°06′—129°30′ E)国家级自然保护区,该区为黑龙江省阔叶红松林典型分布区。凉水自然保护区地处小兴安岭南坡达里带岭支脉东坡,海拔280—707 m,为典型的低山丘陵地貌,土壤为地带性暗棕壤。具明显的温带大陆性季风气候,冬季严寒干燥而夏季温热多雨,年均温-0.3℃左右,年均降水量676 mm,且多集中在7—8月份。地带性植被是以红松(Pinuskoraiensis)为主的针阔混交林,主要乔木树种有青楷槭(Acertegmentosum)、水曲柳(Fraxinusmandshurica)、色木槭(A.mono)、紫椴(Tiliaamurensis)、裂叶榆(Ulmuslaciniata)、臭冷杉(Abiesnephrolepis)、红皮云杉(Piceakoraiensis)、鱼鳞云杉(P.jezoensis)等[23]。丰林自然保护区位于小兴安岭山脉中段,海拔285—688 m,属低山丘陵地貌,土壤为山地棕色森林土。气候属大陆性季风气候,年均温-0.5℃,年均降水量640.5 mm,主要集中在6—9月份。地带性植被为以红松为优势的针阔混交林,主要乔木树种有红松、红皮云杉、鱼鳞云杉、冷杉(Abiesnephrolepis)、落叶松(Larixgmelinii)、白桦(Betulaplatyphylla)、枫桦(Betulacostata)、山杨(Populusdavidiana)、紫椴(Tiliaamurensis)、黄檗(Phellodendronamurense)、水曲柳(Fraxinusmandshurica)等[24]。
1.2 样地设置与调查方法
凉水实验样地设置于2005年建立的阔叶红松林 9 hm2(300 m × 300 m)动态监测样地内[23]。丰林实验样地设置于2009年建立的阔叶红松林30 hm2(500 m × 600 m)动态监测样地内,为了使两个样地具有相同的空间幅度,本实验在30 hm2样地西北角为起点的9 hm2样地内开展调查。分别将这两个样地划分成225个20 m × 20 m的单元格,共计256个网格交叉点。
2015年8月(8月25日—9月1日)和10月(10月2日—10月9日)在凉水和丰林同时开展调查。使用陷阱法捕获地表甲虫,在每个网格交叉点20 cm圆半径内布置一个陷阱,凉水和丰林分别计450个陷阱(225个/次×2次)。当该范围内条件不允许布置陷阱时,选择在该网格交叉点50 cm圆半径内布置陷阱。使用内径约7 cm的土钻挖一个土坑,将高14 cm、内径7 cm诱捕杯置于土坑内,保持杯口与地面齐平。内置约占诱捕杯容积2/3的饱和NaCl溶液,在杯口上部距离地面约5—10 cm处支起1个一次性餐盘作为防护,将陷阱置于野外7天7夜后取回。室内手拣出所有的地表甲虫并将其置于95%医用酒精内,依据参考文献[25- 28]将地表甲虫鉴定到种,成虫与幼虫分别计数,仅将成虫用于后续处理分析。
1.3 数据处理分析
1.3.1 物种多样性、丰富度和beta多样性
步甲科(Carabidae)、隐翅虫科(Staphylinidae)、葬甲科(Silphidae)是本实验地表甲虫的重要组成部分,所以本文主要分析这几个群落。使用物种多样性和丰富度来描述地表步甲科、隐翅虫科、葬甲科及全部甲虫(entire beetles,即三个科甲虫的总和)的多样性特征。由于物种多样性和丰富度的原始数据以及转换之后的数据均不呈正态分布且方差非均质性,因此使用Wilcoxon非参数检验(wilcox.test函数,R 3.2.2)比较凉水和丰林相同月份地表甲虫物种多样性和丰富度差异显著性,以及地表甲虫在凉水或丰林不同月份之间物种多样性和丰富度差异显著性。
采用PERMDISP2方法[29]计算凉水和丰林地表步甲科、隐翅虫科、葬甲科及全部甲虫的beta多样性,Bray-Curtis距离能够较好的表达群落非相似性[29,30],本文基于丰富度矩阵的Bray-Curtis距离,利用距离组合中心点来计算beta多样性,使用R (3.2.2)软件的vegan软件包中的betadisper函数计算beta多样性。使用置换检验分别评估凉水和丰林不同月份之间相同科集群和全部甲虫beta多样性的差异显著性,并检验相同月份凉水和丰林之间相同科集群及全部甲虫beta多样性的差异显著性,使用permutest函数进行检验(置换999次),对于那些仅仅包含一个水平的数据组 (例如,丰林10月没有发现葬甲科甲虫而凉水则有发现)不进行比较检验[29,31]。
1.3.2 空间物种转换和物种集群镶嵌的分解
基于多地点的非相似性[9]被认为是分解空间物种转换和物种集群镶嵌以及二者混合状态的有效方法。Baselga[3,32]提出一种基于多地点的测量框架,根据单独来自空间物种转换的非相似性和单独来自物种集群镶嵌的非相似性,将全部非相似性分解为两个分离的部分。本文基于Sørensen非相似性计算全部beta多样性(βSOR)[3],进而将其分解为基于多地点的空间物种转换(βSIM)和物种集群镶嵌(βNES)[3]。计算公式如下:
(1)
(2)
(3)
式中,Si为样点i的全部物种数量,ST为全部调查样点的全部物种数量,bij和bji分别为成对比较时除了样地i和样地j的物种数量。βSOR为Sørensen非相似性,βSIM为Sørensen非相似性的空间物种转换成分(即Simpson非相似性),βNES为Sørensen非相似性的物种集群镶嵌成分。由于空间物种转换和物种集群镶嵌是两个分离的可加部分,所以全部beta多样性表达为:βSOR=βSIM+βNES[3,33]。首先将丰富度矩阵转换为有—无矩阵,然后在R (3.2.2) 软件的betapart软件包中,使用betapart.core和beta.multi函数计算βSOR、βSIM和βNES[33]。
2 结果
凉水8、10月分别发现地表甲虫29、16种和730、126只,丰林8、10月分别发现地表甲虫39、14种和1146、36只。8月凉水地表步甲科、隐翅虫科和全部甲虫的物种多样性和丰富度都明显低于丰林(P<0.05)。而10月凉水地表隐翅虫科和全部甲虫的物种多样性和丰富度都明显高于丰林(P<0.05)。
凉水全部甲虫、步甲科、隐翅虫科的beta多样性在8和10月间彼此差异显著(P<0.05) (图 1)。 丰林不同科及全部甲虫的beta多样性季节性差异不明显。8月份凉水步甲科的beta多样性明显低于丰林(P<0.05),葬甲科的beta多样性明显高于丰林(P<0.05)(图 1)。
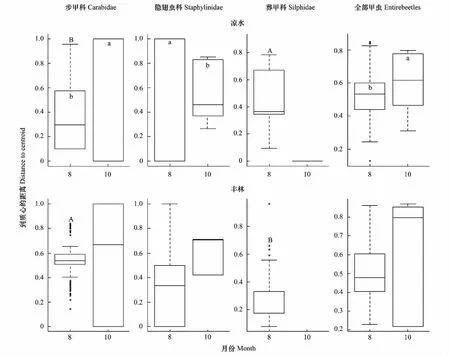
图1 凉水和丰林不同月份地表步甲科、隐翅虫科、葬甲科和全部甲虫的beta多样性Fig.1 Beta diversities of Carabidae, Staphylinidae, Silphidae and entire beetle assemblages in different months in the Liangshui and Fenglin plots图中不同大写字母表示相同月份凉水和丰林之间beta多样性差异显著(P<0.05);不同小写字母代表凉水或丰林不同月份之间beta多样性差异显著(P<0.05)
全部beta多样性被分解之后,除了凉水10月步甲科和丰林8月葬甲科,其他科和全部甲虫的空间物种转换 (βSIM)均大于0.90,而物种集群镶嵌(βNES)均小于0.10(图2)。
3 讨论
本次调查发现,丰林在8月具有更高的全部甲虫物种多样性和丰富度,而凉水则在10月更丰富。但是不同科物种多样性和丰富度表现略有差异,步甲科于8、10月在丰林更具优势,隐翅虫科于8月和10月分别在丰林和凉水更具优势,葬甲科于10月在凉水更具优势。
8月凉水步甲科的beta多样性明显低于丰林,葬甲科的beta多样性则明显高于丰林,其他集群beta多样性在凉水和丰林没有显著差异。凉水的全部甲虫、步甲科和隐翅虫科的beta多样性在8、10月间具明显的差异性,而丰林未发现两个月份间明显的差异。由于本实验仅调查了8、10月数据,不能说明凉水和丰林地表甲虫beta多样性的时间规律性,beta多样性的动态性分析有待于进一步开展。
凉水和丰林全部甲虫和各科集群的beta多样性都主要由空间物种转换组成,物种集群镶嵌的贡献很小。表明凉水和丰林全部甲虫、步甲科、隐翅虫科、葬甲科的物种组成变异几乎都是由物种替换引起,即主要由本地物种(endemics)之间较高的转换或替换引起[34]。物种集群镶嵌都非常小,说明阔叶红松林内物种缺失并不显著,这在一定程度上排除了研究尺度内(300 m)扩散限制对这些集群的重要调控作用[35]。泛滥平原地表步甲群落的beta多样性在不同年份主要由空间物种转换组成,且其强度存在明显的年际差异[21]。粪甲科群落的空间物种转换在2至4月间显著,物种集群镶嵌在12至2月间显著[36]。相关研究表明小兴安岭阔叶红松林大型和中小型土壤动物多样性不同于其他森林生境,可能是该生境较优越的环境条件导致较高的丰富度[37]。这说明生境环境差异[38-39]可能是调控阔叶红松林地表甲虫beta多样性的重要原因。另外,地表甲虫较强的空间移动能力可能使其克服环境限制而到达合适的生境地点[21],同时生物间相互作用的调控也不容忽视[40]。本文并未分析生境异质性、地形因子和空间过程等对物种集群镶嵌和空间物种转换的调控机制,相关研究还有待于进一步开展。
本实验表明凉水和丰林地表甲虫beta多样性的差异仅存在于8月步甲科和葬甲科之间。凉水和丰林地表甲虫的beta多样性主要由空间物种转换组成,物种集群镶嵌所占比例很小。
致谢:感谢程赛赛、胡媛媛、闫龙、刘俊对野外调查和样品制备的帮助,感谢东北林业大学金光泽老师及其学生对野外实验的帮助,感谢凉水和丰林国家级自然保护区对实验的帮助。
[1] Whittaker R H. Vegetation of the Siskiyou Mountains, Oregon and California. Ecological Monographs, 1960, 30(3): 279- 338.
[2] 陈圣宾, 欧阳志云, 徐卫华, 肖燚. Beta多样性研究进展. 生物多样性, 2010, 18(4): 323- 335.
[3] Baselga A. Partitioning the turnover and nestedness components of beta diversity. Global Ecology & Biogeography, 2010, 19(1): 134- 143.
[4] Jost L. Partitioning diversity into independent alpha and beta components. Ecology, 2007, 88(10): 2427- 2439.
[5] Tuomisto H. A diversity of beta diversities: straightening up a concept gone awry. Part 1. Defining beta diversity as a function of alpha and gamma diversity. Ecography, 2010, 33(1): 2- 22.
[6] Jurasinski G, Koch M. Commentary: do we have a consistent terminology for species diversity? We are on the way. Oecologia, 2011, 167(4): 893- 902.
[7] Jurasinski G, Retzer V, Beierkuhnlein C. Inventory, differentiation, and proportional diversity: a consistent terminology for quantifying species diversity. Oecologia, 2009, 159(1):15- 26.
[8] Harrison S, Lawton J H. Beta diversity on geographic gradients in Britain. Journal of Animal Ecology, 1992, 61(1): 151- 158.
[9] Baselga A, Jiménez-Valverde A, Niccolini G. A multiple-site similarity measure independent of richness. Biology Letters, 2007, 3(6): 642- 645.
[10] Wright D H, Reeves J H. On the meaning and measurement of nestedness of species assemblages. Oecologia, 1992, 92(3): 416- 428.
[11] Ulrich W, Gotelli N J. Null model analysis of species nestedness patterns. Ecology, 2007, 88(7): 1824- 1831.
[12] Gaston K J, Blackburn T M. Pattern and Process in Macroecology. Blackwell Science, 2008.
[13] Ulrich W, Almeida-Neto M, Gotelli NJ. A consumer′s guide to nestedness analysis. Oikos, 2009. 118(1): 3- 17.
[14] Qian H, Ricklefs R E, White P S. Beta diversity of angiosperms in temperate floras of eastern Asia and eastern North America. Ecology Letters, 2005, 8(1): 15- 22.
[15] Williams P H, Klerk H M D, Crowe T M. Interpreting biogeographical boundaries among Afrotropical birds: spatial patterns in richness gradients and species replacement. Journal of Biogeography, 1999, 26(3): 459- 474.
[16] Blackburn T M, Gaston K J. Some methodological issues in macroecology. American Naturalist, 1998, 151(151): 68- 83.
[17] Nascimbene J, Benesperi R, Brunialti G, Catalano I, Vedove M D, Grillo M, Isocrono D, Matteucci E, Potenza G, Puntillo D, Puntillo M, Ravera S, Rizzi G, Giordani P. Patterns and drivers of β-diversity and similarity of Lobaria pulmonaria, communities in Italian forests. Journal of Ecology, 2013, 101(2): 493- 505.
[18] Aranda S C, Gabriel R, Borges P A V, Santos A M C, Hortal J, Baselga A, Lobo J M. How do different dispersal modes shape the species-area relationship? Evidence for between-group coherence in the Macaronesian flora. Global Ecology and Biogeography, 2013, 22(4): 483- 493.
[19] Lovei G L, Sunderland K D. Ecology and behavior of ground beetles (Coleoptera: Carabidae). Annual Review of Entomology, 1996, 41: 231- 256.
[20] Rainio J, Niemelä J. Ground beetles (Coleoptera: Carabidae) as bioindicators. Biodiversity & Conservation, 2003, 12(3): 487- 506.
[21] Tonkin J D, Stoll S, Jähnig S C, Haase P. Contrasting metacommunity structure and beta diversity in an aquatic-floodplain system. Oikos, 2015, 125(5): 686- 697.
[22] Gomez-Rodrguez C, Freijeiro A, Baselga A. Dispersal and ecological traits explain differences in beta diversity patterns of European beetles. Journal of Biogeography, 2015, 42: 1526- 1537.
[23] 徐丽娜, 金光泽. 小兴安岭凉水典型阔叶红松林动态监测样地:物种组成与群落结构. 生物多样性, 2012, 20(4): 470- 481.
[24] 刘晓梅, 布仁仓, 邓华卫, 胡远满, 刘志华, 吴志伟. 基于地统计学丰林自然保护区森林生物量估测及空间格局分析. 生态学报, 2011, 31(16): 4783- 4790.
[25] 尹文英, 胡圣豪, 沈韫芬, 宁应之, 孙希达, 吴纪华, 诸葛燕, 张云美, 王敏, 陈建英, 徐成钢, 梁彦龄, 王洪铸, 杨潼, 陈德牛, 张国庆, 宋大祥, 陈军, 梁来荣, 胡成业, 王慧芙, 张崇州, 匡溥人, 陈国孝, 赵立军, 谢荣栋, 张骏, 刘宪伟, 韩美贞, 毕道英, 肖宁年, 扬大荣. 中国土壤动物检索图鉴. 北京: 科学出版社, 1998.
[26] 李景科, 张雪萍, 林琳, Flutsch G, 于强. 中国东北的葬甲科研究. 哈尔滨: 哈尔滨地图出版社, 2011.
[27] 李井科, 林琳, 张雪萍. 原色中国东北土壤甲虫图鉴(步行虫类). 哈尔滨: 哈尔滨地图出版社, 2015.
[28] 李井科, 张利敏, 张雪萍. 原色中国东北土壤甲虫图鉴(隐翅虫类, 拟步甲类). 哈尔滨: 哈尔滨地图出版社, 2015.
[29] Anderson M J. Distance-Based tests for homogeneity of multivariate dispersions. Biometrics, 2006, 62(1): 245- 253.
[30] Clarke K R. Non-parametric multivariate analyses of changes in community structure. Australian Journal of Ecology, 1993, 18: 117- 143.
[31] Anderson M J, Ellingsen K E, Mcardle B H. Multivariate dispersion as a measure of beta diversity. Ecology Letters, 2006, 9(6): 683- 693.
[32] Baselga A. The relationship between species replacement, dissimilarity derived from nestedness, and nestedness. Global Ecology and Biogeography, 2012, 21(12):1223- 1232.
[33] Baselga A, Orme C D L. betapart: an R package for the study of beta diversity. Methods in Ecology & Evolution, 2012, 3(5): 808- 812.
[34] Baselga A. Determinants of species richness, endemism and turnover in European longhorn beetles. Ecography, 2008, 31(2): 263- 271.
[35] Svenning J C, Skov F. Could the tree diversity pattern in Europe be generated by postglacial dispersal limitation? Ecology Letters, 2007, 10(6): 453- 460.
[36] Novais S M A, Evangelista L A R, Neves F S. How does dung beetle (Coleoptera: Scarabaeidae) diversity vary along a rainy season in a tropical dry forest? Journal of Insect Science, 2016, 16(1): 1- 6.
[37] 殷秀琴, 吴东辉, 韩晓梅. 小兴安岭森林土壤动物群落多样性的研究. 地理科学, 2003, 23(3): 316- 322.
[38] 顾伟, 马玲, 刘哲强, 焦玥, 王利东, 张琛. 凉水自然保护区不同林型地表甲虫物种多样性. 东北林业大学学报, 2014(1): 131- 135.
[39] Xiuqin Y, Bo S, Weihua D, Yeqiao W. A review on the eco-geography of soil fauna in China. Journal of Geographical Sciences, 2010, 20(3): 333- 346.
[40] Soininen J. A quantitative analysis of species sorting across organisms and ecosystems. Ecology, 2014. 95(12): 3284- 3292.
