母猪繁殖性能相关5个候选基因的PCR-RFLP多态性研究
2018-03-07吴华莉涂尾龙曹建国都启晶羊兆洪谈永松
吴华莉,涂尾龙,曹建国,3,都启晶,常 华,羊兆洪 ,谈永松*
(1上海市农业科学院畜牧兽医研究所,上海201106;2上海市调控生物学重点实验室,上海200241;3上海种猪工程技术研究中心,上海201302;4青岛农业大学食品科学与工程学院,青岛266109;5云南农业大学动物科学技术学,昆明650201;6淮安洪泰良种猪繁育有限公司,淮安223472)
猪总产仔数、产活仔数和出生窝重是母猪重要的繁殖性状,与众多调控基因有关。目前学者们针对猪繁殖性状相关基因开展研究,如雌激素受体(Oestrogen receptor,ESR)、含凝血酶敏感蛋白模体的去解联金属蛋白酶1基因(A disintegrin and metalloproteinase with thrombospondin motifs-1,ADAMTS1)、岩藻糖转移酶1基因(α1,2-fucosyl transferase,FUT1)、核受体辅激活蛋白 1(Nuclear receptor co-activator 1,NCOA1)和视黄醇结合蛋白4基因(Retinol-binding proteins 4,RBP4)等[1]。ESR通过与雌激素的作用促进细胞合成,参与阴道上皮细胞和子宫内膜细胞分化[2]。ADAMTS1在猪卵丘-卵母细胞复合体中表达,体外培养的作用是促进卵母细胞成熟[3]。NCOA1是类固醇受体的辅助激活剂家族成员,NCOA1和NCOA3共同作用调控胎盘的形态变化和胚胎存活[4]。FUT1基因M307位存在A/G突变,导致丙氨酸突变苏氨酸,从而显著减少FUT1酶的活性,引起GG和AG型个体对产肠毒素大肠杆菌(ETEC)F18敏感,而AA基因型则表现为抗性[5]。有研究报道证实FUT1基因AA型断奶仔猪成活率高于BB型的2倍,可作为提高断奶仔猪成活率的分子标记[6-7]。RBP4基因在囊胚扩张时期的表达量增加,并且在怀孕10—12 d的母猪子宫内膜也呈现高表达[8-9]。此外,RBP4基因也被发现是孕体植入前的主要分泌产物[10]。
本研究采用PCR-RFLP方法检测ESR、NCOA1、ADAMTS1、FUT1和RBP4基因在杜洛克、长白和大白群体中的基因型频率和等位基因频率,并分析它们与猪总产仔数(Total number born,TNB)、产活仔数(Number born alive,NBA)和出生窝重(Birth litter weight,BLW)的相关性。
1 材料与方法
1.1 试验用猪及样品
来自上海祥欣畜禽有限公司有杜洛克(100头)、大白(150头)和长白(80头),10月龄母猪,用于本试验5个基因的多态性分析。采集的猪耳组织块置于75%酒精中带回实验室。采用AXYGEN试剂盒(上海鼎盛生物科技有限公司)提取DNA并测定浓度,检测合格的样品放入-20℃冰箱保存备用。
收集生产记录包括耳号、TNB、NBA和BLW。针对每个样品对应5个基因的不同基因型和生产性能记录进行数据整理、比对和估计最小二乘均值等处理。
1.2 PCR-RFLP分析
使用特异性引物扩增5个基因的PCR产物分别进行琼脂糖检测,要求目的条带清晰明亮且无杂带,方可进行相应酶切试验。5个基因PCR扩增引物序列,染色体位置,退火温度和对应内切酶见表1。酶切体系(20μL):6μL PCR产物、5 U限制性内切酶0.5μL、Buffer 1μL和ddH2O 12.5μL。限制性内切酶购于Fermentas和宝生物工程有限公司。
1.3 统计方法
计算出每个SNP基因频率和等位基因频率,杂合度的计算公式:H=1-∑pi。
1.4 PCR产物酶切与分型
使用1.5%琼脂糖电泳检测5个基因PCR扩增产物。使用2.5%琼脂糖电泳检测酶切后产物。不同基因型分别选取3个样品进行测序。根据电泳图谱和测序结果进行基因型分型。5个基因不同基因型判定标准见表2。

表1 5个基因PCR扩增引物序列、染色体位置、退火温度和对应内切酶Table 1 The primer sequences,chromosomal locations,temperatures,and endonucleases of five genes

表2 5个基因PCR产物酶切与带型Table2 Restriction digestion patterns of five gene PCR products bp
1.5 统计分析
计算5个基因在3个猪群体内的基因型频率和基因频率。采用SPSS软件进行5个基因不同基因型TNB、NBA和BLW差异比较分析。Yijk=μ+gk+eijk,yijk表示繁殖性状(TNB、NBA和BLW),μ为群体均值,gk为基因效应,eijk为随机残差。
2 结果与分析
2.1 5个基因在3个猪群体内的基因型频率与基因频率
5个基因在3个猪群体内的基因型频率和等位基因频率见表3。

表3 5个基因在3个猪群体中的基因型频率与等位基因频率Table 3 Genotype and allele frequencies of five genes in three pig groups
ESR基因在杜洛克群体内只检测出AA型,在长白群体内,检测出AA型(0.94)和AB型(0.06);在大白群体内检测出AA型(0.54)、BB型(0.03)和AB型(0.43);在长白和大白群体内A等位基因频率均高于B等位基因频率。NCOA1基因在杜洛克群体内检测出AA型(0.59)、BB型(0.05)和AB型(0.36);在大白群体内检测出AA型(0.78)、BB型(0.05)和AB型(0.17);在长白群体内只检测出AA型;在3个猪群体内A等位基因频率均高于B等位基因频率。ADAMTS1基因在杜洛克群体内检测出AA型(0.37)、BB型(0.13)和 AB型(0.50);在长白群体内检测出 AA型(0.14)、BB型(0.40)和 AB型(0.46);在大白群体内检测出AA型(0.10)、BB型(0.46)和AB型(0.44);除了在杜洛克群体外,B等位基因频率均高于A等位基因频率。FUT1基因在杜洛克群体内检测出AA型(0.16)、BB型(0.44)和AB型(0.40);在长白群体内检测出BB型(0.79)和AB型(0.21);在大白群体内检测出AA型(0.03)、BB型(0.57)和AB型(0.40);在3个猪群体内B等位基因频率均高于A等位基因频率。RBP4基因在杜洛克群体内检测出AA型(0.68)、BB型(0.14)和AB型(0.18);在长白群体内检测出 AA型(0.41)、BB型(0.21)和 AB型(0.38);在大白群体内检测出AA型(0.25)、BB型(0.47)和AB型(0.28);除了大白猪群体外,A等位基因频率均高于B等位基因频率。表3中各基因的基因型频率经χ2检验均不显著,符合哈代-温伯格平衡定律。
2.2 5个基因不同基因型TNB、NBA和BLW在3个猪群体内差异比较
5个基因不同基因型在3个猪群体的TNB、NBA和BLW差异比较分析见表4、表5和表6。
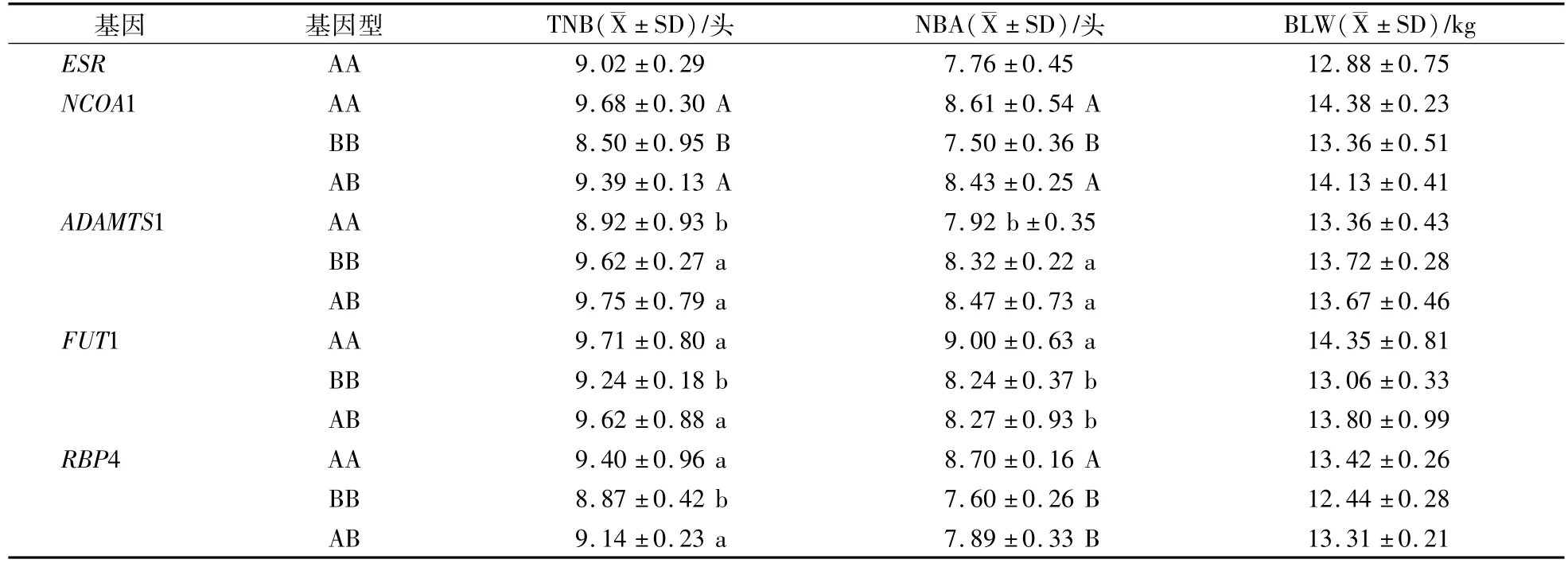
表4 5个基因对杜洛克TNB、NBA和BLW影响Table 4 The influence of five genes to Duroc TNB,NBA and BLW

表5 5个基因对长白TNB、NBA和BLW影响Table 5 The influence of five genes to landrace TNB,NBA and BLW
在长白群体内ESR基因AB型的TNB、NBA、BLW比AA型的分别高0.36头、0.44头和87 g(P>0.05);在大白群体内BB型的TNB、NBA、BLW比AA型的分别高0.36头、0.41头和98 g(P>0.05)。在大白群体内BB型的TNB、NBA和BLW最高;在杜洛克群体内只检测出AA型。
NCOA1基因在杜洛克和大白群体内TNB、NBA和BLW都表现AA型>AB型>BB型的趋势。在杜洛克群体内AA型的3个指标比BB型的分别高1.18(P<0.01)、1.11头(P<0.01)和102 g(P>0.05);在大白群体内AA型的TNB、NBA、BLW比BB型的分别高0.53头(P<0.05)、1.92头(P<0.01)和102 g(P>0.05);在长白群体内只检测出AA型。
ADAMTS1基因在杜洛克、长白和大白群体内TNB、NBA和BLW都表现AB型>BB型>AA型的趋势。在杜洛克群体内AB型的TNB、NBA、BLW比AA型的分别高0.83头(P<0.05)、0.55头(P<0.05)和31 g(P>0.05);在长白群体内AB型的3个指标比AA型的分别高0.67头(P<0.05)、0.86头(P<0.05)和107 g(P>0.05);在大白群体内AB型的3个指标比AA型的分别高0.88头(P<0.05)、0.54头(P<0.05)和56 g(P>0.05)。
FUT1基因在杜洛克和大白群体内TNB、NBA和BLW都表现AA型>AB型>BB型趋势。在杜洛克群体内AA型的TNB、NBA、BLW比BB型的分别高0.47头(P>0.05)、0.76头(P<0.05)和89 g(P>0.05);在大白群体内AA型的3个指标比BB型的分别高0.56(P<0.05)、1.06头(P<0.01)和108 g(P>0.05);在长白群体内AB型的3个指标比BB型的分别高0.17头、0.39头和104 g(P>0.05)。
RBP4基因在杜洛克、长白和大白群体内TNB、NBA和BLW都表现AA型>AB型>型BB趋势。在杜洛克群体内AA型TNB、NBA、BLW比BB型的分别高0.53(P<0.05)、1.1头(P<0.01),和98 g(P>0.05);在长白群体内AA型的3个指标比BB型的分别高0.64头(P<0.05)、0.35头和87 g(P>0.05);在大白群体内AA型的3个指标比BB型的分别高0.86(P<0.05)、1.29头(P<0.01)和107 g(P>0.05)。

表6 5个基因对大白TNB、NBA和BLW影响Table 6 The influence of five genes to large white TNB,NBA and BLW
3 讨论
3.1 ESR基因对猪繁殖性能的影响
目前国内外学者有关ESR基因对猪产仔数影响的报道中存在不同观点。普遍认为,ESR基因不同基因型的繁殖性能表现为BB>AB>AA[11-13]。ESR基因Pvu II位点B等位基因能提高猪产仔数[1]。Short等[14]提出ESR基因B等位基因来源于中国猪种,后来经过与西方猪种杂交选育而存在。Rothschild等[1]证实ESR基因等位基因B与TNB相关联,BB型初产TNB和NBA比AA型的多2.3头(P<0.01),所有胎次多1.5头(P<0.01),他也证实ESR基因对梅山猪TNB和NBA影响达到显著水平,然而该基因对杜洛克、长白和大白TNB和NBA影响不显著(P>0.05)。而Hunyadi-Bagi等[15]最新报道指出ESR基因在匈牙利大白、杜洛克和皮特兰猪群体内只检测出AA型和AB型,AA型的TNB和NBA比AB型的高。本研究结果显示,ESR基因在大白群体内BB型的TNB和NBA比AA型和AB型多,但差异不显著(P>0.05)。这与苏一等[16]、Rothschild等[17]研究证实B等位基因为优势等位基因的结果一致。本研究结果显示ESR基因在3个猪群体内AA型频率较高,且在杜洛克群体内未检测出BB型。
3.2 NCOA1基因对猪繁殖性能的影响
NCOA1基因是类固醇受体共激活剂家族成员,这类辅助激活物并不直接绑定DNA发生作用,而是通过招募核激素受体启动子来发挥作用[18]。NCOA1基因与NCOA3基因协同作用,通过调控过氧化物酶体复合物受体家族维持胎盘形成和妊娠中期胚胎存活,同时敲出这两个基因会导致胎盘形成受阻和妊娠中期的高致死率[4]。这说明NCOA1基因与胚胎存活有关。本研究检测出NCOA1基因对杜洛克和大白群体的繁殖性能影响表现为:AA>AB>BB型,在长白群体内只检测到AA型。在杜洛克和大白群体内NCOA1基因AA型 NBA比 BB型的多,达到极显著水平(P<0.01)。这与鲁慧文等[19]、李永辉[20]、Melville等[21]的研究结果一致。
3.3 ADAMTS1基因对猪繁殖性能的影响
ADAMTS1为细胞外蛋白酶,在孕酮受体激活时由颗粒细胞中合成和分泌,从而促进排卵[22-23]。ADAMTS1基因不仅参与排卵,也在体外卵母细胞成熟过程中起重要作用[24]。本研究检测ADAMTS l基因在杜洛克、长白和大白群体内AB型TNB和NBA比AA型的高,达到差异显著水平(P<0.05);在长白和大白群体内AB型BLW比AA型的高,未达到差异显著水平(P>0.05)。本研究结果显示ADAMTS l基因在3个群体的繁殖性能影响表现为AB>BB>AA趋势。这与徐珊珊等证实AB型属于优势基因型的结果一致[25]。
3.4 FUT1基因对猪繁殖性能的影响
张引红等[26]研究表明FUT1基因多态性对猪TNB影响显著(P<0.05),对NBA影响不显著(P>0.05)。Kyungtae等[7]证实FUT1基因AA型断奶仔猪成活率高于BB型的。有报道指出FUT1基因GG和AG型对ETEC F18敏感,AA型为抗性[27]。本研究结果显示AA型TNB、NBA和BLW均高于AB型和BB型。尽管FUT1基因AA型仔猪成活率较高的原因未明,但FUT1基因可以抵抗传染病的研究报道已被证实[28,5]。这可能与猪的抗病性能提高从而提高NBA有关,所以在育种过程有必要关注FUT1基因AA型的比例。
3.5 RBP4基因对猪繁殖性能的影响
RBP4基因在胚胎发育时期发挥作用[29]。大多数有关RBP4基因报道证实AA型和A等位基因对猪TNB和NBA有正向影响[30-34],但也有学者指出BB型比AA型和AB型有高的产仔数,且B等位基因来源高产仔性能的中国猪种[35-37]。在本研究结果显示:在杜洛克、长白和大白群体内AA型TNB、NBA、BLW比BB型的高,尤其在大白群体中AA型NBA比BB型的多1.1头,达到差异极显著水平(P<0.01)。RBP4基因不同基因型的繁殖性能表现为AA>AB>BB的趋势,且A等位基因是影响3个猪群体繁殖性状的优势等位基因。
3.6 5个基因对3个猪群体繁殖性能影响效应比较
本研究结果表明5个基因对3个猪群体繁殖性能影响程度存在差异,影响较大的是NCOA1和RBP4基因,其次是FUT1基因和ADAMTS1基因,最小的是ESR基因。NCOA1基因对杜洛克群体的TNB和NBA、大白群体NBA影响达到差异极显著水平(P<0.01),对大白群体TNB影响达到显著水平(P<0.05)。RBP4基因对杜洛克和大白群体NBA影响达到差异极显著水平(P<0.01),对3个猪群体TNB影响达到显著水平(P<0.05)。FUT1基因对大白NBA影响达到差异极显著水平(P<0.01),对杜洛克群体TNB、NBA和大白群体TNB影响达到显著水平(P<0.05)。ADAMTS1基因对3个群体TNB、NBA影响达到显著水平(P<0.05)。ESR基因对3个猪群体TNB、NBA影响未达到显著水平(P>0.05)。
造成差异原因可能与基因效应大小有关,NCOA1基因可以直接和间接影响猪胚胎的存活。本研究显示NCOA1基因和RBP4基因优势基因型都是AA型,这2个基因AA型频率在杜洛克、长白、大白群体中分别为0.59、1、0.78和0.68、0.41、0.25,可作为猪繁殖性能的辅助选择标记。最新研究证实FUT1基因AA型仔猪有较高的成活率[25]。本研究显示FUT1基因AA型频率在杜洛克和大白群体中分别为0.16和0.03,而在长白群体中未检测出AA型,这暗示着3个猪群体的断奶仔猪成活率或许不同,但这一推论需要进一步试验加以证实。ADAMTS l基因AB型为优势基因型,在杜洛克、长白、大白群体内频率分别为0.50、0.46和0.44,呈现中度多态,可作为猪繁殖性能的辅助选择标记。ESR基因有利基因型BB型在大白群体中频率0.03,在杜洛克和长白群体中未检测出BB型,这也可能是ESR基因对3个猪群体繁殖性能影响不大的原因。总之,5个基因的不同基因型对3个猪群体TNB和NBA影响可达到差异显著或者极显著水平,但它们对BLW影响未达到差异显著水平。
[1]ROTHSCHILD M F,JACOBOSON C,VASKE D,et al.The estrogen receptor locus is associated with amajor gene influence litter size in pigs[J].Proc Natl Acad Sci U SA,1996,93(1):201-205.
[2]SUNDARRAJAN C,LIAOW,ROY A C,et al.Association of estrogen receptor gene polymorphisms with outcome of ovarian stimulation in patients undergoing IVF[J].Mol Hum Reprod,1999,5(9):797-802.
[3]SHIMADAM,NISHIBORIM,YAMASHITA Y,etal.Down-regulated expression of A disintegrin andmetalloproteinasewith thrombospondin-like repeats-1 by progesterone receptor antagonist is associated with impaired expansion of porcine cumulus-oocytecomplexes[J].Endocrinology,2004,145(10):4603-4614.
[4]CHEN X,LIU Z,XU J.The cooperative function of NCOA1 and NCOA3 in placental development and embryo survival[J].Mol Endocrinol,2010,24(10):1917-1934.
[5]BAOW B,YE L,PAN Z Y,et al.Beneficial genotype of swine FUT1 gene governing resistance to E.coli F18 is associated with important economic traits[J].JGenet,2011,90(2):315-318.
[6]VÖGELIP,KUHN B,KÜHNE R,et al.Evidence for linkage between the swine L blood group and the loci specifying the receptorsmediating adhesion of K88 Escherichia coli pilus antigens[J].Anim Genet,1992,23(1):19-29.
[7]KIM K,NGUYEN D T,CHOIM,et al.Alpha(1,2)-fucosyltransferase M307A polymorphism improves piglet survival[J].Anim Biotechnol,2013,24(3):243-250.
[8]YELICH JV,POMP D,GEISERT R D.Detection of transcripts for retinoic acid receptors,retinol-binding protein,and transforming growth factors during rapid trophoblastic elongation in the porcine conceptus[J].Biol Reprod,1997,57(2):286-294.
[9]HARNEY JP,OTT T L,GEISERT R D,et al.Retinol-binding protein gene expression in cyclic and pregnant endometrium of pigs,sheep,and cattle[J].Biol Reprod,1993,49(5):1066-1073.
[10]TROUTW E,MCDONNELL J J,KRAMER K K,et al.The retinol-binding protein of the expanding pig blastocyst:molecular cloning and expression in trophectoderm and embryonic disc[J].Mol Endocrinol,1991,5(10):1533-1540.
[11]李明洲,张凯,李学伟,等.中国地方猪种 ESR基因 PvuⅡ多态性及其产仔数关系的研究[J].四川农业大学学报,2003,21(3):258-262.
[12]田勇,李学伟,李芳琼,等.四川省外种猪ESR基因对繁殖及生长性状的影响[J].黑龙江畜牧兽医,2004(10):12-14.
[13]张晓东,王恒,丁月云,等.安徽省4个地方猪种ESR和FSHβ基因多态性及其与产仔数的关联分析[J].安徽农业大学学报,2014,41(4):579-584.
[14]SHORT T H,ROTHSCHILD M F,SOUTHWOOD O I,et al.Effect of the estrogen receptor locus on reproduction and production traits in four commercial pig lines[J].Anim Sci.1997,75(12):3138-3142.
[15]HUNYADI-BAGIÁ,BALOGH P,NAGY K,et al.Association and polymorphism study of seven candidate geneswith reproductive traits in three pig breeds in Hungary[J].Acta Biochim Pol,2016,63(2):359-364.
[16]苏一,边连全,刘显军.猪品种 ESR和 PRLR基因的 PCR-SSCP多态性分析[J].湖北农业科学,2010,49(7):1557-1561.
[17]ROTHSCHILD M F,LARSON R G,JACOBSON C,et al.Pvu II polymorphisms at the porcine oestrogen receptor locus(ESR)[J].Anim genet,1991.22(5):448.
[18]QIN L,LIU Z,CHEN H,et al.The steroid receptor coactivator-1regulates twist expression and promotes breast cancer metastasis[J].Cancer Res,2009,69(9):3819-3827.
[19]鲁慧文,赵志超,徐梦思,等.NCOA1基因型对长白猪繁殖性能的影响[J].江苏农业科学,2012,42(9):175-177.
[20]李永辉.NCOA1基因与猪产仔性状的相关及序列分析[D].长沙:湖南农业大学,2005.
[21]MELVILLE JS,GIBBIN A M,ROBINSON JA,et al.Meishang positire QTL for prolificacy traits found at the NCOA1 locus on SSC3[C].Montpellier:Proceedings of the 7 th World Congress on Genetics Applied to Livestock Production.France.2002:19-23.
[22]RUSSELL D L,DOYLE K M,OCHSNER S A,et al.Processing and localization of ADAMTS-1 and proteolytic cleavage of versican during cumulusmatrix expansion and ovulation[J].JBiol Chem,2003,278(43):42330-42339.
[23]BREEN SM,ANDRIC N,PING T,et al.Ovulation involves the luteinizing hormone-dependent activation of G(q11)in granulosa cells[J].Mol Endocrinol,2013,27(9):1483-1491.
[24]BLAHA M,NEMCOVA L,KEPKOVA K V,et al.Gene expression analysis of pig cumulus-oocyte complexes stimulated in vitro with follicle stimulating hormone or epidermal growth factor-like peptides[J].Reprod Biol Endocrinol,2015,13:113:1-17.
[25]徐珊珊,于丽丽,乐凯.猪 ADAMTS1基因对繁殖性状的遗传效应分析[J].安徽农业科学,2008,36(24):10374-10376.
[26]张引红,周忠孝,曹果清.FUT1基因多态性及其与产仔性状的关联性研究[J].遗传,2007,29(1):52-56.
[27]MEIJERINK E,NEUENSCHWANDER S,FRIESR,et al.A DNA polymorphism influencing alpha(1,2)fucosyltransferase activity of the pig FUT1 enzyme determines susceptibility of small intestinal epithelium to Escherichia coli F18 adhesion[J].Immunogenetics,2000,52(1/2):129-136.
[28]WANG S J,LIUW J,YANG LG,etal.Effectsof FUT1 genemutation on resistance to infectious disease[J].Mol Biol Rep,2012,39(3):2805-2810.
[29]ROTHSCHILD M F,MESSER L,DAY A,et al.Investigation of the retinol-binding protein 4(RBP4)gene as a candidate gene for increased litter size in pigs[J].Mamm Genome,2000,11,(1):75-77.
[30]SPÖTTER A,MÜLLER S,HAMANN H,et al.Effect of polymorphisms in the genes for LIF and RBP4 on litter size in two German pig lines[J].Reprod Domest Anim,2009,44(1):100-105.
[31]MARANTIDISA,LALIOTIS G P,AVDIM.Retinol binding protein 4 gene and reproductive traits in pigs[J].Genet Res Int,2007,50:181-185.
[32]MESSER L A,WANG L,YELICH J,etal.Linkagemapping of the retinol-binding protein 4(RBP4)gene to porcine chromosome14[J].Mamm Genome,1996,7(5):396.
[33]孙延晓,曾勇庆,唐辉,等.猪 PRLR和 RBP4基因多态性与产仔性能的关系[J].遗传,2009,31(1):63-68.
[34]GONÇALVES ID V,GONÇALVESPB D,SILVA JC,et al.Interaction between estrogen receptor and retinol-bindingprotein-4 polymorphisms as a tool for the selection of prolific pigs[J].Genet Mol Biol,2008,31(2):481-486.
[35]KORWIN-KOSSAKOWSKA A,KAPELANSKIW,BOCIAN M,et al.Preliminary study of the RBP4,EGF and PTGS2 genes polymorphism in pigs and its association with reproduction traits of sows[J].Anim Sci Pap Rep,2005,23(2):95-105.
[36]ISLER B J,IRVIN KM,NEAL SM,etal.Examination of relationship between estrogen receptor gene and reproductive traits in pig[J].JAnim Sci,2002,80(9):2334-2339.
[37]ALFONSO L.Use ofmeta-analysis to combine candidate gene association studies:application to study the relationship between the ESR PvuII polymorphism and sow litter size[J].Genet Sel Evol,2005,37(4):417-435.
