磁共振扩散峰度成像对肺结节恶性和良性鉴别诊断
2018-03-07河南省平顶山市第五人民医院放射科河南平顶山467000
1.河南省平顶山市第五人民医院放射科 (河南 平顶山 467000)
2.同济大学 (上海 200000)
3.川北医学院附属医院放射科(四川 南充 637000)
王金良1 Sushant Kumar Das2张 川3
肺癌最常见的临床表现为孤立性肺结节或肺肿块。CT扫描和正电子发射断层摄影(PET)联合18F-FDG是常见的检测孤立性肺结节或肺肿块的非创伤性方法,且诊断准确性较高。有报道显示,18F-FDG PET成像鉴别良性和恶性结节的准确性约为90%[1]。也有文献显示[2],对于分化程度较高的肺腺癌,18F-FDG PET成像容易出现假阴性诊断,而对于炎性结节,18F-FDG PET成像可能给出假阳性结果[3]。虽然利用增强CT扫描进行肿瘤血管评估有助于区分恶性和良性结节,但对于活动性肉芽肿或多血管良性肿瘤,则可能产生假阳性结果[4]。扩散加权成像可实现肿瘤的定量评估。对于恶性肿瘤,肿瘤细胞密度上升造成的扩散受限、细胞核增大伴随大分子蛋白增多、核质比上升、与正常组织相比细胞外间隙减少,这些都是肿瘤定量评估的依据[5]。但一些研究显示,ADC值在区分孤立性肺结节(SPN)方面存在限制性,可能与磁敏感伪影有关[6]。此外,与传统的扩散成像的高斯扩散假设不同,在许多生物组织中,屏障(如细胞膜)和分隔(如细胞内和细胞外间隙)可能改变水扩散的概率密度函数,因此,水扩散不一定为高斯扩散,而常常属于非高斯扩散[7]。相反,扩散峰度成像(DKI)可定量弥散偏离高斯分布的程度(非高斯扩散)。因此,与传统的扩散加权成像(DWI)相比,能更准确的评估组织微观结构环境的复杂性[8]。但目前DKI仅用于人脑组织和小型动物脑组织研究。DKI很难在高b值下达到理想的信噪比,因此很少用于其他组织和器官。在扩散加权成像中,一般需要进行参数优化避免信噪比过低对关键扩散参数结果的影响[9]。此外,肿瘤与肺组织交界处磁敏感性差异可能造成局部磁场的非均质性,从而干扰与心肺交界处伪影相似的肺肿瘤的磁共振信号。呼吸和心脏运动也可能造成其他伪影和信号损失[10]。本文为一项前瞻性研究,目的在于评估肺DKI的可行性,并分析DKI在鉴别恶性和良性结节方面,是否比传统的DWI更具优势。
1 材料和方法
1.1 研究对象该前瞻性研究纳入患者32例,共35个肺结节(18名男性、14名女性,平均年龄65.7岁,年龄范围31-88岁)。研究对象在我院放射科接受CT扫描。其中3名患者有2个肺结节,其余29名患者为孤立性肺结节。纳入标准如下:CT扫描发现1至2个肺结节,大小为10.0~30.0mm,需要接受进一步检查;CT扫描未发现结节钙化;纳入实质性或半实质性结节,但排除单纯肺毛玻璃样病变;未接受组织学诊断;无免疫缺陷史。
1.2 设备与检查方法利用3.0-T MR扫描仪(GE Signa Discovery 750 HD,美国GE Healthcare),使用标准的32通道相控阵射频体线圈(GE Healthcare)进行MRI扫描。扩散加权成像前,采集传统的MRI图像,图像由轴位脂肪抑制的周期性旋转重叠平行线(PROPELLER)T2加权(T2W)序列(重复时间TR,3529ms;回波时间TE,73ms;激励次数NEX 2次;层厚,4.0mm;层间距,1.0mm;矩阵,352×320;视野FOV,36.0×36.0cm2)和轴位LAVA Flex T1加权(T1W)序列(TR/TE,3.8/1.1ms;NEX 1;层厚,5.0mm;层间距,1.0mm;矩阵,260×192;视野FOV,34.0×34.0cm2)组成。在T1W和T2W图像基础上,采集肺结节的横切面扩散图像。DKI方法为呼吸门控、单次激发、自旋回声、回波平面成像(EPI)DKI加轴面脂肪抑制。共采用30个扩散梯度磁场施加方向,每个方向3个b值(0、500和1000s/mm2)。其他成像参数如下:层厚/层间距6.00mm;TR/TE,8000.0/72.8ms;FOV,36.0×28.0cm2;矩阵128×128;NEX 1;持续时间6-8min(取决于患者的呼吸频率)。为了采集标准DWI图像,利用以下参数获得单次激发EPI脉冲序列:TR/TE,3000~4500/65ms;3个正交方向的弥散梯度编码;b值0和800s/mm2;FOV,36.0×28.0cm2;矩阵,128×128;NEX,1;持续时间,6-8min。
1.3 图像分析首先,肉眼辨别多向扩散图像中的伪影和失真情况。将胸廓轮廓描绘至b0图像,定量分析涡流失真,并将它们拷贝至扩散加权图像。我们未发现由弥散梯度造成的明显涡流失真。两名具有6年以上胸部MRI经验的医生。两名医生不知道病例的病理学结果,他们利用FUNCTOOL软件(Function tool 4.4,GE Healthcare)在工作站上独立进行感兴趣区(ROI)测量。观测者1进行了2次测量,而观测者2进行了1次测量。对于每次测量,参考T2W图像或CT图像,在标准DWI数据集轴位b0图像的不同层面(取决于病变的厚度)手动描绘4个ROI(取决于病变的大小,范围为40.0~65.0mm2),远离病变中的坏死或空洞。利用评估软件自动完成从DWI到DKI的转换,确保ROI面积一致,且描绘至同一个解剖学位置(图1)。计算MK和ADC值的平均值和标准差,作为4个ROI的平均值。本文主要关注MK和ADC值鉴别恶性和良性肺结节的准确性,因此没有报道其他可能从数据中得到的DKI参数。
1.4 统计学分析利用SPSS软件包(Version 20.0;SPSS Inc.)进行统计学分析。绘制工作特征曲线(ROC),确定最佳阈值,从而评估MK和ADC值鉴别恶性和良性肺部结节的能力。测量重复性指相似条件下重复测量的一致性程度。两名观测者内可重复性,即观测者1(Obs.1a和Obs.1b)重复测量间的差异,以及两名观测者间重复性,即观测者1(Obs.1a)的重复测量和观测者2(Obs.2)进行的一次测量的差异,利用ICC值和Bland-Altman图法评估。ICC值大良好。
2 结 果
组织病理学结果显示,在35例孤立性肺结节中,恶性结节20例,良性结节15例。在20例恶性结节中,鳞状细胞癌9例,腺癌7例,小细胞癌2例,转移性肺癌2例。在15例良性结节中,肉芽肿5例,结核球3例,细菌性肺炎2例,肺脓肿1例,炎性结节2例,纤维性结节1例,机化肺炎1例。病变的平均MK和ADC值,对于每次测量,恶性病变的平均MK值均显著高于良性病变,而ADC值则显著低于良性病变(P<0.05)(表1和2)。第一次测量时(Obs.1.a)恶性病变的平均MK值为(0.92±0.18)vs.(0.69±0.10),第二次测量时(Obs.1.a)恶性病变的平均MK值为(0.89±0.14)vs.(0.74±0.13);对于第一个观测者,第一次测量时恶性病变的ADC值为(1.22±0.15)vs.(1.39±0.15)×10-3mm2/s,第二次测量时恶性病变的ADC值为(1.20±0.16)vs.(1.41±0.12)×10-3mm2/s。
对于第二个观测者,恶性和良性结节的平均MK值为(0.97±0.20)vs.(0.65±0.12),而恶性和良性结节的ADC值为(1.19±0.20)vs.(1.44±0.10)×10-3mm2/s。图3为恶性和良性结节的MK值和ADC值的比较。
DKI和DWI的诊断效能,根据2名观测者的测量,MK值鉴别恶性和良性肺结节的敏感性和特异性均高于ADC值。观测者1两次测量的MK值的诊断准确性分别为85.71%和80.00%。且阈值分别为0.74和0.78;每次测量的敏感性和特异性分别为85.00和80.00%,以及86.66和80.00%。观测者1两次测量的ADC值的诊断准确性、敏感性和特异性分别为77.14、80.00和75.00%、80.00、80.00和80.00%。两次测量的ADC值的阈值分别为1.84和1.76。对于观测者2,MK值和ADC值的诊断准确性分别为82.85%和80.00%,且阈值分别为0.80和1.86。在该MK阈值下,敏感性和特异性分别为80.00%和86.66%;对于ADC值的阈值,敏感性和特异性分别为80.00%和75.00%。表3和表4分别为MK值和ADC值的诊断效能。图6为每个观测者的ROC曲线。
观测者内和观测者间可重复性,对于恶性和良性结节,MK值两次测量的观测者内一致性均较高(ICC分别为0.76和0.72);ADC值两次测量的观测者内一致性对于恶性结节较高(0.75),对于良性结节(0.81)非常高(表1)。对于恶性和良性结节,观测者间可重复性均非常高(ICC分别为0.87和0.86)。对于ADC,恶性结节的ICC值较高(0.79),而良性结节的ICC值非常高(0.85)(表2)。图7为观测者间和观测者内测量的Bland-Altman分析结果。
3 讨 论
本文的研究结果显示,肺部DKI可用于常规临床检查。在肺部DKI中恶性结节的MK值比良性结节显著升高,这说明非高斯扩散效应(即细胞复杂性较高)较为显著。此外,不同测量间的观测者内和观测者之间一致性比较高,但MK值(DKI成像)的诊断准确性与标准DWI成像的ADC值相比,并无显著性差异,与ADC值相比,MK值的曲线下面积并没有显著上升。虽然本文显示肺部DK的可行性,且MK值具有临床意义,但是仍需要大宗样本量研究,进一步证明肺部DKI临床应用的价值。
目前,动态对比增强MRI(DCE-MRI)是肺部结节较为常用的评估方法,但是对于强化明显的良性肿瘤与恶性肿瘤,单凭增强扫描和形态学特征很难区分[11]。扩散加权成像MRI-DWI可弥补DCE-MRI在这方面的缺点,且无需注射对比剂,因此更适合多重纵向随访研究,监测肿瘤生长及治疗效果。目前,仅有少数研究利用传统DWI对肺部肿瘤进行定量评估,且研究结果常常不一致[12-17]。大多数研究报道的诊断准确性较高,一般高于80%[14],但仍有少部分研究的诊断准确性低于80%[12-17],甚至有些研究无法有效鉴别肺部恶性和良性病变。在这些研究中,ADC值的阈值变化范围为0.834×10-3-1.4×10-3mm2/s。本文报道的诊断准确性与其他DWI研究一致(18-20),ADC值在其他研究报道的范围内。Ohba等[18]采用3.0T MRI,其报道的ADC值略高于本文中的ADC值。此外,Ohba等报道的3.0T DWI的ADC值高于1.5T DWI的ADC值。本文与Ohba等研究的差异可能来自纳入病变的病理学特征差异,以及DWI成像方法差异。例如,若b值低于600s/mm2,则可能受灌注效应的影响,若b值较高,则可能增加失真和磁敏感伪影的概率[19]。因此,本文将b值设置为800s/mm2。其他b值也许比该值更合适,有待进一步研究确定。ADC值不一致的另一个原因可能在于,磁敏感伪影使我们无法准确测量靠近包含气体的器官病变的ADC值。孤立性肺结节可能包含气体,从而影响了ADC的准确测量[20]。Bernardin等[21]研究显示,对于小于2.0cm的病变,ADC值的可重复性较低。以上原因均可能影响本文的研究结果。

表1 MK值和ADC值的观测者内可重复性(Obs. 1a: Obs. 1b)

表2 MK和ADC值的观测者间可重复性(Obs. 1a: Obs. 2)

表3 MK值鉴别恶性和良性肺结节的诊断效能
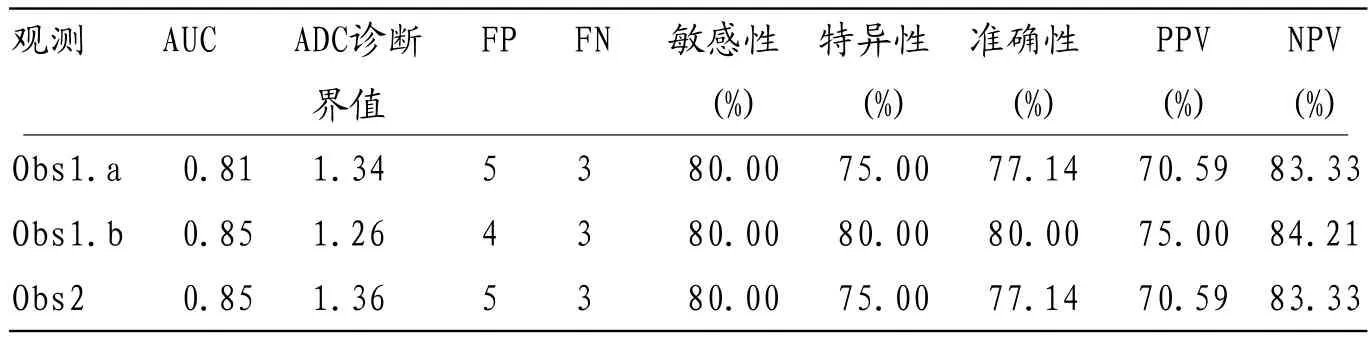
表4 ADC值鉴别恶性和良性肺结节的诊断效能

图1-4 一名61岁男性右下叶肺部鳞状细胞癌的图像,该患者的诊断为真阳性;图1 轴位脂肪抑制T2W PROPELLER图像显示右肺下叶有一个肿块;图2 DWI图像和图3 MK图来自患者该的轴位胸部DKI,图像显示ROI位于病变内;图4 CT引导下肺穿刺活检的病理照片,为肺内鳞状细胞癌。肿瘤细胞排列紧密,细胞质稀少。

图5 两名观测者平均峰度和ADC值的箱形图。良性结节和恶性结节的第一个观测者MK(a)和ADC(d)值的第一次观测结果和MK(b)和ADC(e)值的第二次观测结果,以及第二个观测者MK(c)和ADC(f)值的一次观测结果之间均存在显著性差异(P<0.05)。*=异常值。

图6 两名观测者平均峰度(a)和ADC值(b)鉴别恶性和良性肺部结节的ROC曲线。蓝线为观测者1第一次测量(Obs. 1a)的AUC,绿线为第二次测量(Obs.1b)的AUC;黄线为观测者2一次测量(Obs.2)的AUC。

图7 两名观测者重复观测差异的Bland–Altman分析。对于恶性结节的MK(a)和ADC值(c)以及良性结节的MK(b)和ADC值(f),观测者1的第一次测量vs.第二次测量;对于恶性结节的MK(c)和ADC值(g)以及良性结节的MK(d)和ADC值(h),观测者1的第一次测量和观测者2的一次测量对比。
目前,DKI较少用于肺结节的成像研究。本文中,虽然MK值的诊断准确性与ADC值相比并没有显著提高,但是用于肺结节的鉴别时,MK值比ADC值略高,说明DKI也许能更准确的评估肺部肿瘤,所以该结论有待进一步研究。
本文采用了呼吸门控方法进行扫描(而非屏气法),此方法与屏气式DW-MRI相比,呼吸触发扩散加权MRI(DW-MRI)不但能提高图像质量,而且能避免图像重合不良。
有些脑部DKI研究建议将最大b值设置为2000~2500s/mm2,由于信噪比和横向驰豫信号快速衰减的原因,该b值并不适用于其他器官(除头部外)。与头部线圈相比,柔性表面线圈的敏感性较低,造成组织的信噪比下降,而在这些组织中T2横向驰豫时间较短,导致横向驰豫的信号衰减较快[22]。也有一些研究者将DKI用于肾、前列腺和颈部区域的成像,发现b值为600~1500s/mm2时,即可满足DKI参数测量要求[23-26]。因此,本文将b值设置为1000s/mm2,便于在信噪比和DKI参数的准确定量之间达到平衡。我们还使用了以缩短回波时间(72.8ms),提高重复时间(8000ms),来提高信噪比。
本文存在以下局限性。①本文的研究结果仅为初步结果,还需要进行较大队列的多中心研究。②很难避免肺部结节DWI图像上磁敏感伪影的出现。虽然我们采用了呼吸门控的方法,但呼吸运动和心脏运动造成的伪影仍然无法避免。③病变中央坏死的边缘可能太薄,无法准确勾画ROI。为了提高信噪比,我们在DKI成像中使用了较高的层厚(6.0mm),也可能会影响测量结果。
综上所述,肺部DKI可以应用于常规临床检查。DKI成像与传统ADC值相比,能更好的提高恶性和良性肺结节鉴别诊断的可信度。但需要进一步的更多大样本研究,更全面的分析DKI成像研究,为临床应用提供非创伤性检查方法。
[1]Gould MK,Maclean CC,Kuschner WG,et al.Accuracy of positron emission tomography for diagnosis of pulmonary nodules and mass lesions:a meta-analysis[J].JAMA,2001,285(7):914-924.
[2]Cheran SK,Nielsen ND,Patz EF Jr.False-negative findings for primary lung tumors on FDG positron emission tomography:staging and prognostic implications[J].Am J Roentgenol,2004,182(5):1129-1132.
[3]Shim SS,Lee KS,Kim B,et al.Focal parenchymal lung lesions showing a potential of falsepositive and false negative interpretations on integrated PET/CT[J].Am J Roentgenol,2006,186(3):639-648.
[4]Schaefer JF,Vollmar J,Schick F,et al.Solitary pulmonary nodules: dynamic contrastenhanced MR imaging-perfusion differences in malignant and benign lesions[J].Radiology,2004,232(2):544-553.
[5]Takahara T,Imai Y,Yamashita T,et al.Diffusion weighted whole body imaging with background body signal suppression(DWIBS): technical improvement using free breathing,STIR and high resolution 3D display[J].Radiat Med,2004,22:275-282.
[6]Koyama H,Ohno Y,Seki S,et al.Value of diffusionweighted MR imaging using various parameters for assessment and characterization of solitary pulmonary nodules[J].Eur J Radiol,2015,84(3):509-515.
[7]Schwarcz A,Bogner P,Meric P,et al.The existence of biexponential signal decay in magnetic resonance diffusion- weighted imaging appears to be independent of compartmentalization[J].Magn Reson Med,2004,51(2):278-285.
[8]Jensen JH,Helpern JA.MRI quantification of non- Gaussian water diffusion by kurtosis analysis[J].NMR Biomed,2010,23(7):698Y710.
[9]Qayyum A.Diffusion-weighted imaging in the abdomen and pelvis:concepts and applications[J].Radiographics,2009,29(6):1797-1810.
[10]Atalay MK,Poncelet BP,Kantor HL,et al.Cardiac susceptibility artifacts arising from the heart-lung interface[J].Magn Reson Med,2001,45(2):341-345.
[11]Satoh S,Kitazume Y,Ohdama S,et al.Can malignant and benign pulmonary nodules be differentiated with diffusion- weighted MRI[J].Am J Roentgenol,2008,191(2):464-470.
[12]Uto T,Takehara Y,Nakamura Y, et al.Higher sensitivity and specificity for diffusion-weighted imaging of malignant lung lesions without apparent diffusion coefficient quantification[J].Radiology,2009,252(1):247-254.
[13]Tondo F,Saponaro A, Stecco A,et al.Role of diffusionweighted imaging in the differential diagnosis of benign and malignant lesions of the chest-mediastinum[J].Radiol Med,2011,116(5):720-733.
[14]Koyama H,Ohno Y,Aoyama N,et al.Comparison of STIR turbo SE imaging and diffusionweighted imaging of the lung:capability for detection and subtype classification of pulmonary adenocarcinomas[J].Eur Radiol,2010,20(4):790-800.
[15]Mori T,Nomori H,Ikeda K,et al.Diffusion-weighted magnetic resonance imaging for diagnosing malignant pulmonary nodules/masses: comparison with positron emission tomography[J].J Thorac Oncol,2008,3(4):358-364.
[16]Ohba Y,Nomori H,Mori T,et al.Is diffusion-weighted magnetic resonance imaging superior to positron emission tomography with fludeoxyglucose F 18 in imaging non-small cell lung cancer[J].J Thorac Cardiovasc Surg,2009,138:439-445.
[17]Usuda K,Sagawa M,Motono N,et al.Diagnostic Performance of diffusion weighted imaging of malignant and benign pulmonary nodules and masses:comparison with positron emission tomography[J].Asian Pac J Cancer Prev,2014,15(11):4629-4635.
[18]Ohba Y,Nomori H,Mori T,et al.Diffusion-weighted magnetic resonance for pulmonary nodules:1.5 vs.3 Tesla[J].Asian Cardiovasc Thorac Ann,2011,19(2):108-114.
[19]Jezzard P,Barnett AS,Pierpaoli C.Characterization of and correction for eddy current artifacts in echo planar diffusion imaging[J].Magn Reson Med,1998,39(5):801-812.
[20]Bernardin L,Douglas NH, Collins DJ,et al.Diffusionweighted magnetic resonance imaging for assessment of lung lesions:repeatability of the apparent diffusion coefficient measurement[J].Eur Radiol,2014,24(2):502-511.
[21]Nasu K,Kuroki Y,Sekiguchi R,et al.The effect of simultaneous use of respiratory triggering in diffusionweighted imaging of the liver[J].Magn Reson Med Sci,2006,5(3):129-136.
[22]Filli L,Wurnig M,Nanz D,et al.Whole-body diffusion kurtosis imaging: initial experience on non-Gaussian diffusion in various organs[J].Invest Radiol,2014,49(12):773-778.
[23]Pentang G,Lanzman RS,Heusch P,et al.Diffusion kurtosis imaging of the human kidney: a feasibility study[J].Magn Reson Imaging,2014,32(5):413-420.
[24]Quentin M,Pentang G,Schimmo¨ller L,et al.Feasibility of diffusional kurtosis tensor imaging in prostate MRI for the assessment of prostate cancer:preliminary results[J].Magn Reson Imaging,2014,32(7):880-885.
[25]Yuan J,Yeung DK,Mok GS,et al.Non-Gaussian analysis of diffusion weighted imaging in head and neck at 3T:a pilot study in patients with nasopharyngeal carcinoma[J].PLoS One,2014,9(1):e87024.
[26]Jensen JH,Helpern JA,Ramani A,et al.Diffusional kurtosis imaging: the quantification of non-Gaussian water diffusion by means of magnetic resonance imaging[J].Magn Reson Med,2005,53(6):1432-1440.
