MRI增强扫描与钼靶成像在鉴别乳腺导管原位癌中应用研究*
2018-03-07河南省新乡市中心医院放射科河南新乡453000
河南省新乡市中心医院放射科(河南 新乡 453000)
王春光 郝宗爱 闫少华孙长录
乳腺导管原位癌(DCIS)是乳腺癌的癌前病变,占新发乳腺癌的20%~30%[1]。提高对DCIS的检出率是临床早期诊断乳腺癌的关键。钼靶是临床诊断DCIS较为常用的影像学手段,具有操作简便、经济的特点,可清楚显示乳腺肿块的形态、边界及钙化情况,但对乳腺小肿瘤的诊出率较低。MRI具有良好的软组织分辨率,受乳腺致密度的影响较小,在乳腺癌诊断及鉴别诊断中优势明显[2]。对此,本研究回顾性分析了42例DCIS的钼靶和MRI影像学资料,分析两者影像学诊断,比较两者影像学单独及联合诊断DCIS的准确性,探讨两种影像学方式联合诊断本病的优势,现报道如下。
1 资料与方法
1.1 临床资料选取2014年2月~2016年2月我院经临床病理证实为DCIS患者42例作为研究对象,年龄29~72例,平均(53.26±4.09)岁;其中右乳23例,左乳19例。无主观症状者31例,其中依靠辅助检查发现14例,自查触及肿块就诊17例,其余存在主观症状(如:乳房疼痛、乳头溢液等)就诊11例。所有研究对象均完成钼靶、MRI扫描,术后均病理检查证实。
1.2 检查方法
1.2.1 钼靶检查:采用德国西门子MAMMOMAT300 NOVA数字钼靶机,检查期间取立位,充分暴露双乳,并将其置入摄片台与压迫器件间,常规行乳腺内外侧斜位(MLO位)、头足位(CC位)摄片,如显影不充分,可加行内外侧位(ML位)、内外侧斜位(LMO位)等。观察影像资料,了解病灶位置、形态、边缘、钙化情况等。
1.2.2 MRI检查:采用1.5 T超导型MR和专用乳腺线圈,取俯卧位,双侧乳腺自然悬垂于乳腺线圈凹形空洞内,横断位双乳同时扫描,矢状面左右分别扫描。SE序列横断位T1WI扫描,参数为TR/TE=565ms/20ms,层厚6mm,间隔1.2mm,脂肪抑制的短时反转恢复(STIR)序列T2WI扫描,参数为TR/TE=5000ms/60ms,层厚6mm,间隔1.2mm,脂肪抑制的矢状面T1WI扫描,参数为TR/TE=500ms/17ms,层厚5~6mm,间隔1.0~1.2mm。平扫结束后经肘静脉造影剂扎喷替酸葡甲胺(Gd-DTPA),立即行连续重复4次扫描,每次采集时间23s,间隔60s,再于注射后6、8、10min各重复扫描1次,分别进行双侧乳腺矢状位增强扫描,采用快速小角度激发动态增强扫描序列成像,TR/TE=5.0ms/17ms,层厚2.0~2.5mm,间隔1.0~1.2mm。取增强扫描序列第2或第3个序列和最后1个序列分别与平扫图像进行减影,在病变乳腺和正常乳腺组织个选1个兴趣区域绘制时间-信号强度曲线,了解病变范围、形态、边缘、血供情况、时间-信号强度曲线(TIC);TIC上信号呈持续渐进性强化为持续上升型(Ⅰ型)、强化初期迅速上升中后期呈平台状为平台型(Ⅱ型)、信号强度在中后期呈下降趋势为廓清型(Ⅲ型)。
1.3 BI-RADS分级标准采用评估参照美国放射学会(ACR)2013版乳腺影像报告和数据系统(BIRADS)分级[3]评估影像学检查结果,0级:需进一步进行影像学评估;1级:未见异常,常规筛查;2级:良性征象,常规筛查;3级:疑似良性征象,建议6个月随访或连续监察;4级:可疑异常,≥2个可疑征象,需活检确诊;5级:高度怀疑恶性,≥3个可疑征象,需活检确诊;6级:活检证实为恶性。
1.4 统计学方法采用统计学软件SPSS19.0处理数据,计数资料采用%表示,多组间比较采用秩和检验,组间两两比较采用χ2检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 钼靶和MRI影像学表现
2.1.1 钼靶影像学表现:42例行钼靶检查,BI-RADS分级:0级5例(图1-2),1~3级7例,4~5级30例。其中27例(64.29%)呈椭圆形或圆形分布,15例(35.71%)呈不规则形;25例(83.33%)特征性密集的钙化病灶,20例(47.62%)出现毛刺征或星芒征。
2.1.2 MRI影像学表现:42例行MRI平扫和增强扫,BI-RADS分级:0级7例,4~5级35例。T1WI为低信号,T2WI脂肪抑制序列呈等或高信号(图3),病灶内部信号欠均匀,31例(73.81%)肿块边缘略有分叶或长短不一毛刺征(图4-5);9例(21.43%)钙化病灶;24例(57.14%)增强扫描可见非肿块(区域性、段样)强化,TIC曲线:Ⅰ型5例,Ⅱ型20例,Ⅲ型10例(图6-7)。
2.2 钼靶和MRI单独及联合诊断DCIS符合率比较以临床病理检查为“金标准”,钼靶+MRI诊断DCIS的准确率为92.86%高于钼靶的71.43%差异有统计学意义(P<0.05),但钼靶与MRI、MRI与联合诊断组间比较,差异无统计学意义(P>0.05),见表1。

表1 两种影像学方式单独及联合诊断DCIS符合率比较
3 讨 论
乳腺癌是女性较为常见的恶性肿瘤之一,发生率呈逐年上升趋势,早期诊断,早期干预治疗,可提高疾病治愈率。DCIS是乳腺原位癌的常见类型,部分可发展浸润型乳腺癌,多数学者认为本病属于乳腺癌癌前病变,早期手术治疗预后良好,复发率较低[4]。DCIS患者发病期仅少部分伴随主观症状、触及肿块,大部分无明显症状。因此,提高乳腺癌中DCIS诊断准确率除乳腺筛查外,还可应用各种影像学手段进行疾病诊断。
钼靶是临床检测和筛查乳腺癌的首选影像学手段之一,具有经济、操作简便的特点,可清楚显示乳腺皮肤、乳腺内部管道结构及肿块位置、钙化情况等,其中钙化主要原因为恶性肿瘤快速生长,造成癌细胞大量坏死、钙盐沉积、癌细胞对矿物质亲和力较强。王舒等[5]研究发现,DCIS在钼靶上表现为钙化、非钙化肿块、结构紊乱。Barreau等[6]研究指出,DCIS患者病灶中90%左右伴随微钙化,钼靶X线诊断钙化病灶的敏感度高达85%,本研究结果为83.33%,与其基本一致。谢菲等[7]研究发现,钼靶在反映有无钙化方面独居优势,且优于MRI检查。然而,临床诊断期间仅根据病灶组织钙化情况判断肿瘤良恶性尚缺乏证据支持,临床仍需根据钙化组织周围腺体结构改变、走形紊乱等进行综合判断。钼靶在临床诊断DCIS中存在缺陷:密度分辨率较低,对致密性乳腺、小乳腺病灶的诊出率较低,本研究中发现,钼靶对DCIS的诊断准确性为;对缺乏典型钙化或肿块的病灶漏诊率较高,需结合其他影像学诊断率71.43%,需结合其他联合其他影像学方法提高诊断准确性;无法清楚显示近胸壁病变;无法清楚显示肿瘤血供情况。
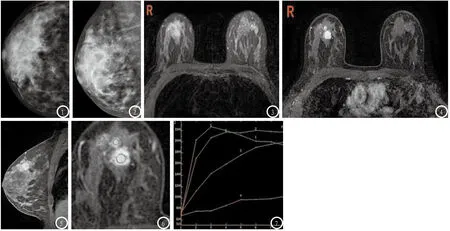
图1-7 为同一女性,36岁,右乳体查12点扪及肿物。图1 钼靶CC位右乳未见明确肿块影;图2 钼靶MLO位右乳未见明确肿块影;图3 T2WI压脂平扫可见12点钟局部腺体稍增多、信号稍增高,图4 MRI动态增强扫描可见右乳12点钟方向有两个强化结节,加大病灶可见浅分叶;图5 MRI增强扫描延迟期可见较大病灶边缘毛糙;图6-7 动态增强曲线显示较大病灶强化曲线为廓清型,其前方较小结节曲线为平台型,周边腺体为流入型。
MRI具有良好的软组织分辨率,可多方位成像,加之动态增强技术、脂肪抑制技术的应用,可准确显示病灶范围、边缘、周围组织受累状况、有无淋巴结转移、与周围组织的关系、病灶血流灌注,更好地进行肿瘤术前分期,对临床确定治疗方案有指导意义;对微小病灶的诊出率较高,可提高诊断准确性[8]。李岚等[9]指出,相比钼靶,MRI诊断DCIS的准确率更高。本文中MRI诊断率为83.33%高于钼靶的71.43%。多数研究支持,非肿块强化是DCIS在MRI上的特征性表现[10-11]。既往文献报道,DCIS患者MRI特征中65.8~85%表现为非肿块强化[12-13]。本研究中,24例DCIS患者表现为非肿块强化,占68.57%,与上述研究结果相符。MRI的图像后处理基础通过绘制TIC曲线了解血流灌注情况,有利于提高准确性。本研究中,DCIS患者TIC 显示为Ⅱ~Ⅲ型,占83.33%,略低于崔晓琳等[14]报道的87.5%,可能与研究病例数有关。本研究中,MRI诊断显示9例存在钙化,钼靶诊断显示25例存在钙化病灶,可见MRI增强对DCIS患者钙化病灶影响并不敏感,可能增加漏诊和误诊率。
本组研究中,钼靶联合MRI诊断DCIS的准确率高于单独检查,认为钼靶对钙化组织的诊断准确率较高,可弥补MRI对钙化病灶诊断缺陷;MRI除特征性表现外,对明确病灶血流灌注情况有独特优势,两者联合应用有利于提高诊断准确率。
综上所述,钼靶对微钙化的诊断准确率较高,MRI在显示病灶组织血流灌注情况上具有独特优势,临床可采用两种影像学方式联合诊断,提高DCIS早期诊断准确率,实现乳腺癌的早发现、早治疗。
[1]张荣菊,牛昀,高玉霞,等.乳腺导管原位癌浸润机制的研究进展[J].中华病理学杂志,2009,38(1):63-65.
[2]高红玲,王爱花.乳腺导管原位癌X线钼靶与磁共振检查的对比观察[J].临床误诊误治,2010,23(12):1171-1172.
[3]Jales R M,Sarian L O,Torresan R,et al.Simple rules for ultrasonographic subcategorization of BI-RADSUS 4 breast masses[J]. European Journal of Radiology,2013,82(8):1231-1235.
[4]梁晓燕,黄颖,许建林,等.乳腺导管原位癌与浸润性导管癌X 线征象对比分析[J].实用放射学杂志,2015,31(8):1266-1268,1277.
[5]王舒,倪青.钼靶、彩超及磁共振在乳腺导管原位癌中的诊断价值[J].肿瘤防治研究,2015,42(6):597-600.
[6]Barreau B,de Mascarel I,Feuga C,et al.Mammography of ductal carcinoma in situ of the breast: review of 909 cases with radiographic-pathologic correlations[J].Eur J Radiol,2005,54(1):55-61.
[7]谢菲,周波,杨德起,等.钼靶X线及超声在乳腺导管原位癌诊断中的价值[J].中国医学影像技术,2012,28(7):1314-1317.
[8]王丽君,汪登斌,李志,等.MRI非肿块样强化对乳腺导管原位癌与导管内乳头状瘤的鉴别诊断[J].实用放射学杂志,2013,29(2):215-219.
[9]李岚,梅昂,华佳,等.钼靶结合MRI对乳腺导管原位癌诊断价值的探讨[J].医学影像学杂志,2012,22(2):208-211.
[10]洪常华,韩德昌,杨新宇,等.乳腺MRI与乳腺X线诊断导管原位癌的临床效果[J].中国老年学杂志,2015,35(2):376-377.
[11]姜婷婷,顾雅佳,彭卫军,等.乳腺导管原位癌的MRI表现及与病理分级的关系[J].中国癌症杂志,2013,23(8):631-636.
[12]夏元福.磁共振、钼靶及高频彩超在乳腺导管原位癌中的诊断价值[J].中国医药导报,2016,13(13):113-116.
[13]王凡,陈家祥,赵伟志,等.乳腺导管原位癌的MRI特征性强化与病理分级对照[J].中国CT和MRI杂志,2014,12(3):45-48
[14]崔晓琳,周纯武,李静,等.MRI乳腺影像报告和数据系统在非肿块强化病变中的诊断价值研究[J].临床放射学杂志,2015,34(4):532-537.
