半胱氨酸与纳米银表面聚乙烯吡咯烷酮涂层的交互作用
2018-03-06姜鸿喆杨新瑶杨悦锁张博文
姜鸿喆, 杨新瑶, 杨悦锁, 张博文
(沈阳大学 区域污染环境生态修复教育部重点实验室, 辽宁 沈阳 110044)
当今社会,纳米银在工业和生活中的应用量日益增加,其主要用作抗菌剂(如化妆品、纺织物、医疗用品)[1].由于纳米银的大量使用,意味着越来越多的纳米银通过生产、使用过程进入环境中[2-3].当环境中纳米银浓度增加时,其可能会对人类和生态系统造成不利影响.许多学者在鱼类、无脊椎动物、藻类和微生物体内均发现有纳米银的存在[4-5].毒理学研究表明,纳米颗粒比由相同材料制成的大颗粒或聚集体更具反应性和毒性.纳米银进入地下水环境后,其归趋主要包括聚凝、溶解和天然有机物反应等.聚乙烯吡咯烷酮(PVP)是一种高分子有机聚合物,用PVP对纳米银表面进行修饰可以使纳米银保持稳定.其原理是PVP在纳米银表面可以提供空间位阻效应,使纳米银间相互排斥.
地下水中存在的有机物如半胱氨酸,是一种常见的天然有机聚合物,通常存在于细菌细胞膜蛋白或植物根系分泌物中.半胱氨酸表面的硫醇基具有很强的亲和能力,其与纳米银表面PVP的交互作用,可能影响纳米银的稳定性[6-7].此外,研究表明,pH、温度、有机物浓度和纳米颗粒浓度等因素,均会影响纳米颗粒在水环境中的行为与归趋[8-13].
但在自然环境中,纳米银由于PVP产生的稳定性会受多个因素的共同作用.目前尚缺少基于同一基准条件对一系列环境因素的影响效果的比较,环境中的主导因素尚未确定,且各因素共同作用时它们的相互作用关系尚不清楚.这些问题,使得对天然环境中多因素作用下纳米银的转化与归趋难以准确评价.针对这一现状,本研究采用统计与实验结合,系统定量地研究pH、温度、有机物质量浓度和纳米颗粒质量浓度等环境因素对地下水中Cys与PVP的交互作用的影响.
1 材料与方法
1.1 纳米银的合成与表征
实验中所用纳米银储备液(PVP-AgNP)采用多元醇的方法制备.将20 g PVP(55 kg·mol-1,山东西亚化学工业有限公司)充分溶解于50 mL乙二醇(HOCH2)2(分析纯,天津市化学试剂),然后转移到250 mL三角烧瓶中,向烧瓶中加入1.5 g AgNO3(优级纯,山东西亚化学工业有限公司),在室温下搅拌混合均匀,待到AgNO3充分溶解后,为三角烧瓶安装冷凝装置,并置于油浴锅(HH-S,金坛市城东新瑞仪器厂)中140 ℃恒温加热.24 h后,将三角瓶中的液体移出,并稀释于其10倍体积的高纯水中.稀释液使用离心机离心(Optima MAX-XP,Beckman,美国)1 h,去上清液,将沉淀重新分散于高纯水中,重复离心3次,以去除游离的PVP,得到质量浓度为1 500 mg·L-1的纳米银溶液,避光保存.
使用动态光散射(DLS)来表征颗粒大小,测量温度为25 ℃,散射角为173°.
1.2 实验设计
由于地下水存在于黑暗中,所以本实验不考虑有光照条件下纳米银的转化.地下水中影响纳米银转换的因素有很多种,实验从pH、温度、有机物质量浓度、 纳米银质量浓度等方面来研究在多种因素联合作用下纳米银的转化机制.真实地下水的pH值近中性,不同地区其地下水酸碱性也不同[14].所以我们选取地下水pH值分别为6.5和7.5条件下研究纳米银的转化机制.天然地下水温度在10 ℃左右,不同地区由于季节,地质条件的不同其温度也略有不同[15].选取温度为10 ℃和20 ℃这两个数值来模拟真实地下水温度对纳米银转化的影响.天然地下水中除了无机离子以外还存在着各种有机物.Cys是一种氨基酸,存在于细胞膜蛋白和植物根系分泌物中.Cys与纳米银的交互作用与其生态毒性效应关系密切,在本研究中将其作为典型有机物进行研究.
依据上述讨论选取了溶液中的4种影响因素作为实验因子,如表1所示.

表1 实验因子水平设计表Table 1 Design table of test factor level
用Minitab软件根据表1创建因子设计,设计类型为两水平因子,因子数为4,仿行数1,区组数1,中心点数为0,总实验数16.实验共计16组,每组中的影响因子有不同的实验水平,“-”代表低水平,“+”代表高水平,具体实验设计方案如表2所示.

表2 实验设计方案Table 2 Designing scheme of experiment
表2简称中,P表示pH,C表示Cys质量浓度,Ag表示纳米银质量浓度,T表示温度.如P6C1Ag2T1表示实验对应条件为pH=6.5,Cys质量浓度为1 mg·L-1,纳米银质量浓度为2 mg·L-1,温度为10 ℃.
1.3 批量实验
依据表2进行混合批实验,经前人[13]研究发现,在高离子强度下纳米银会发生聚凝,当纳米银发生聚凝时,我们无法从粒径的变化观察出Cys与纳米银表面PVP的交互作用,所以,我们选取硝酸钠配制离子强度为1 mmol·kg-1的背景溶液.
(1) 贮备液.配制离子强度1 mmol·kg-1的硝酸钠溶液(分析纯,天津恒兴试剂)作为实验的背景溶液,配制500 mL,1 000 mg·L-1的Cys(C3H7NO2S,121 g·mol-1,Sigma-Aldrich,USA)溶液并用氮气进行脱气处理,放入4 ℃的冰箱中备用.分别配制0.01 mol·L-1硝酸和氢氧化钠溶液(分析纯,天津恒兴试剂)用于调节溶液中的pH.
(2) pH的调节.溶液中的pH与溶液中的离子类型及电荷数目有关,由表2可知本实验共有16种组合方式,由于调节pH过程所需时间较长,在此期间若纳米银与水中有机物反应,向溶液中释放电荷不断改变溶液中的pH.所以我们仅考虑向1 mmol·kg-1硝酸钠背景溶液中加入一定量的Cys并保持温度恒定时的溶液进行pH调节.实验共有8种组合方式P6C1T1,P6C100T1,P6C1T2,P6C100T2,P7C1T1,P7C100T1,P7C1T2,P7C100T2.以P6C1T1为例,pH的调节方法如下:将500 mL硝酸钠溶液置于10 ℃恒温培养箱(ZXDR-2430,智诚)中,使溶液中的温度达到10 ℃并保持不变,加入0.5 mL 1 000 mg·L-1Cys溶液,搅拌均匀,用便携式哈希水质仪(HQ40D,哈希,美国)测量溶液初始pH,测试过程需不断搅拌,待读数稳定后记录溶液的初始pH为6.23,向溶液中滴加10 μL 0.01 mol·L-1氢氧化钠,搅拌均匀后测量pH值,如此反复多次,直到pH达到6.5,记录所加氢氧化钠体积.其余7种均按此方法调节pH.
(3) 纳米银转化实验.以P6C1Ag2T1为例,取500 mL离子强度1 mmol·L-1的硝酸钠溶液置于蓝盖瓶中,放入恒温培养箱中使溶液温度维持在10 ℃保持不变,加入0.5 mL 1 000 mg·L-1Cys贮备液,使溶液中Cys的质量浓度为1 mg·L-1,而后加入一定量0.01 mol·L-1氢氧化钠(pH调节过程所记录的体积)上下颠倒混匀溶液,最后加入0.667 mL质量浓度为1 500 mg·L-1的纳米银悬浮液,上下颠倒3次,放入10 ℃恒温培养箱中静置,实验全程用锡箔纸避光处理.取样时间为0、0.5、1、1.5、2、3 h,每次取样3 mL,用马尔文激光粒度仪(Nano ZS,Malvern,英国)测量粒径,初始粒径为0 h的实际测量值.
1.4 统计分析
将批量实验中得出的纳米银粒径变化速率代入1.2中Minitab生成的设计表中,选择实验设计中的分析因子设计进行实验因子分析,选择的响应为纳米银粒径变化速率,因子分析阶数为2阶,所有区间的置信水平为95%,得出标准正态效应图和Pareto图.
绘制实验因子图,分别得出影响纳米银粒径变化的主效应图和交互作用图,通过这两幅图可以对影响纳米银粒径变化的单因素主效应和双因素间交互作用进行分析.
2 结果与讨论
2.1 Cys对纳米银表面聚合物的置换机制
图1总结了批量实验结果.结果显示,在所有环境条件下,在Cys溶液中,纳米银粒径随时间延长而减小,由90~125 nm减小至75~94 nm,且粒径与时间呈非线性关系.
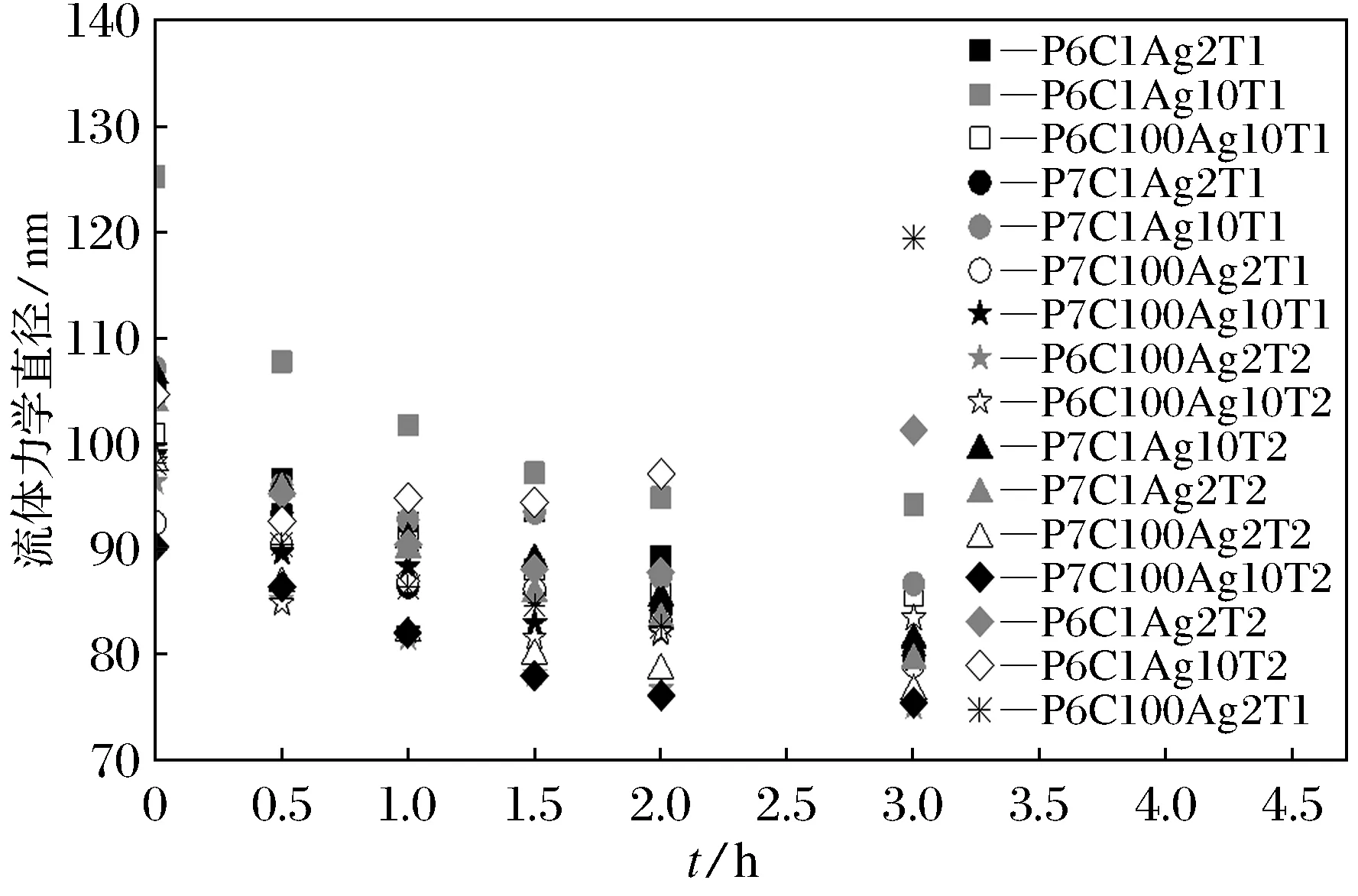
图1 硝酸钠溶液中纳米银粒径随随时间变化趋势图
根据前人研究, 出现纳米银粒径不断减小主要有以下四点原因[16]: ①加入电解质后, 由于离子强度增加,扩散层收缩,使纳米银粒径减小;②纳米银颗粒溶解,使粒径减小; ③由于银离子的溶解, 与氯离子生成小的氯化银纳米颗粒而导致粒度分布变化; ④纳米银表面涂层与有机物如Cys, EDTA等相互作用, 有机物能置换其表面涂层使粒径发生变化.由于实验离子强度较低, 扩散层的收缩不能引起粒度的显著降低, 而纳米银在3 h内不能快速地发生溶解. 研究表明纳米银溶解是一段相对较慢的过程, 如cit-AgNP在20 ℃,pH值为5.58的条件下,半衰期为1 d,升高pH会延长溶解时间, 溶解77%~78%的纳米银才能使粒径减小39%~45%[17]. 另一方面,Cys分子含有一个疏基官能团(-SH).根据前人的研究[18],有机硫和无机硫均能与银形成很强的化学键. 另一方面,PVP主要通过氧、氢或氢氧根与银结合,其化学键能比S-Ag键能弱.所以,粒径变小可能是因为小体积的Cys分子替换了大体积的PVP聚合物所致[19]. 而P6C1Ag2T2,P6C1Ag10T2,P6C100Ag2T1这3组实验在Cys与纳米银混合1.5~2 h后, 纳米银粒径突然开始增大. 这表明当纳米银表面PVP被Cys置换后, 纳米银失去了PVP提供的空间稳定性, 在某些环境条件下失稳发生聚凝.
2.2 量化多因素作用下Cys对纳米银表面PVP的置换速度
基于图1,通过回归分析得到纳米银粒径与时间的拟合方程,计算0点位置的导数值获得初始置换速度,见公式(1).
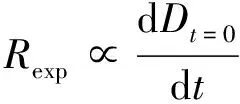
(1)
式中:Rexp为初始替换速度,nm·h-1;D为颗粒直径,nm.该公式计算当t=0时初始点的置换速度.各环境条件下Cys对PVP的初始置换速度计算结果如图2所示.
2.2.1 单因素对Cys置换速度的影响
如图2,以各溶液中因素均为低值的实验P6C1Ag2T1的结果(图2中a1)为基准,分别改变Cys质量浓度(图2中a2)、纳米银质量浓度(图2中a3)、温度(图2中a4)和pH(图2中b1),比较其余条件均为低值时单个因素的值变化对Cys置换速度的影响.
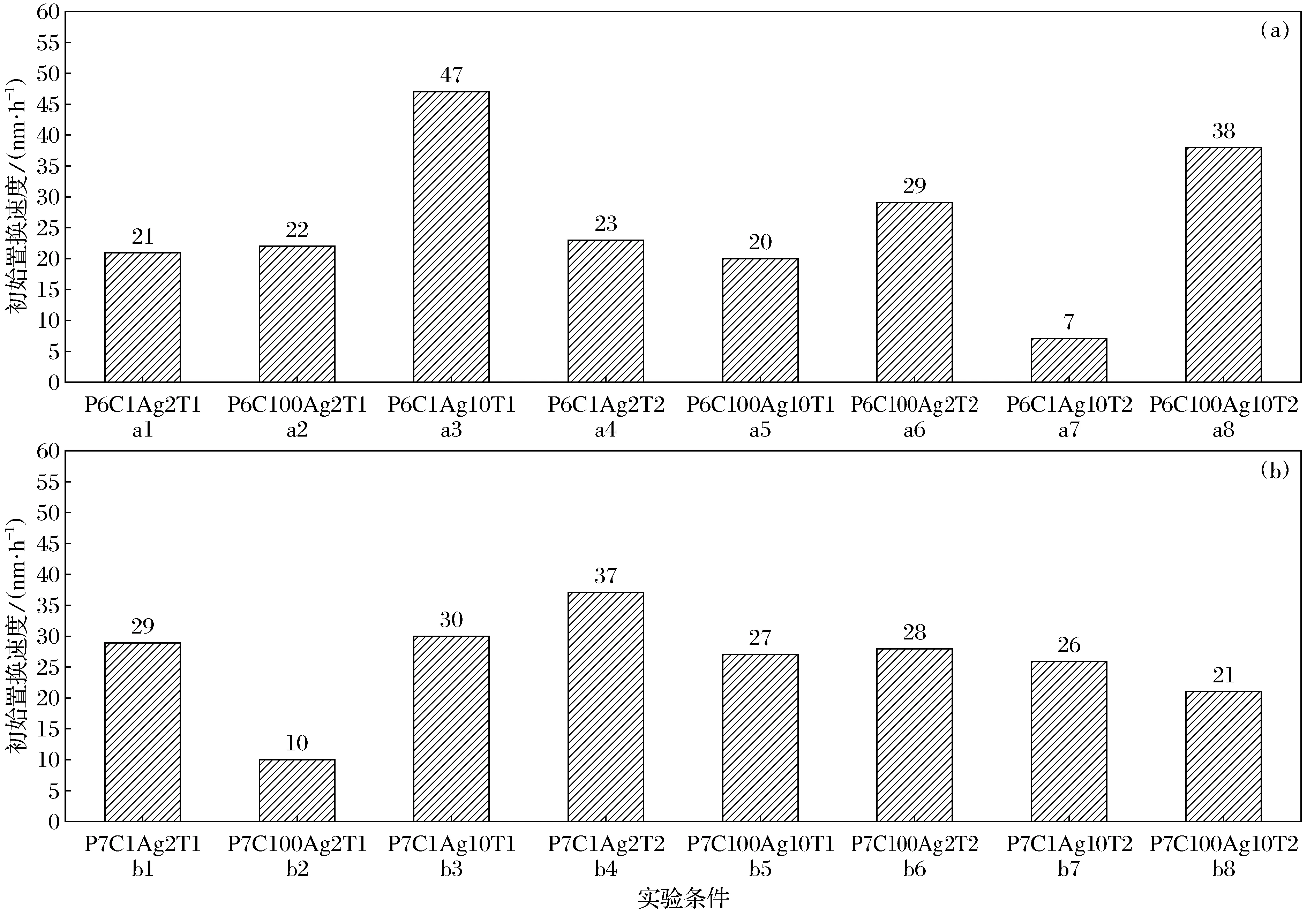
图2 Cys在不同pH下置换纳米银表面PVP的速度Fig.2 Thereplacement rate of PVP on Ag NP surface by Cys in the conditions of different pH(a)—低pH(pH=6.5); (b)—高pH(pH=7.5).
比较图2中a1与a2可知,增大Cys质量浓度,Cys置换速度从21 nm·h-1增加至22 nm·h-1.Cys质量浓度增加,单位时间内接触纳米银的机会增加,置换效率提高.比较图2中a1与a3可知,增加纳米银浓度,Cys置换速度从21 nm·h-1增加至47 nm·h-1.在当前离子强度下,纳米银质量浓度增加到10 mg·L-1,溶液中纳米银稳定不会发生聚凝,当纳米银质量浓度增高,纳米银悬浮液中PVP与纳米银之间较弱的化学键增多,可以被Cys置换的PVP也增多,使得平均粒径减小的更多,置换率增加.比较图2中a1与a4可知,增加反应体系温度,Cys置换速度从21 nm·h-1增加至23 nm·h-1.温度增高使得Cys与纳米银的分子热扩散速度增强而更容易发生接触,加之高温下纳米银与PVP之间的化学键更容易断裂[20].这些因素均能促进Cys的置换.比较图2中a1与b1可知提高溶液pH,Cys置换速度从21 nm·h-1增加至29 nm·h-1.综上所述,Cys质量浓度、纳米银质量浓度、温度和pH的值增加时,Cys的置换速度均增加.
2.2.2 双因素对Cys置换速度的影响
以图2中a1为基准同时改变两个因素,如Cys质量浓度与纳米银质量浓度(图2中a5)、Cys质量浓度与温度(图2中a6)、纳米银质量浓度与温度(图2中a7)、pH与Cys质量浓度(图2中b2)、pH与纳米银质量浓度(图2中b3)、pH与温度(图2中b4).
比较图2中a1与a5可知,同时增加溶液中Cys和纳米银质量浓度,Cys置换速度由21 nm·h-1减小至20 nm·h-1.由上节分析可知单独增加溶液中Cys质量浓度或纳米银质量浓度,Cys的置换速度均增加,但同时增加这两种因素,硝酸钠的置换速度减弱.因此,Cys质量浓度和纳米银质量浓度这两种因素互为拮抗作用.
比较图2中a1与a6可知,同时增加Cys质量浓度与温度,Cys置换速度从21 nm·h-1增加至29 nm·h-1.综合比较两种因素对Cys置换的影响发现,这两种因素交互作用对溶液中Cys置换起协同作用,温度的增高加快了PVP与纳米银之间化学键的断裂,使得置换速度增加.
同理,分别将图2中a1,a7,b2,b3,b4比较可知纳米银质量浓度与温度(图2中a7)、pH与Cys质量浓度(图2中b2)、pH与纳米银质量浓度(图2中b3)、pH与温度(图2中b4)4种双因素对Cys置换影响,除pH与温度(图2中b4)之间为协同作用外,其余3种均为拮抗作用.
2.3 置换作用下多因子的主从关系与交互作用统计分析
基于上述分析,找出了单个环境因素和双因素对Cys置换PVP的速度的影响规律.本节将基于统计分析,进一步建立主导因素.将置换速度值输入Minitab软件进行拟合分析,得出硝酸钠溶液中因子分析图,如图3所示.
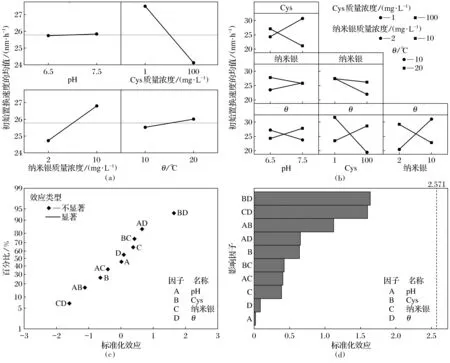
图3 硝酸钠溶液中Cys置换速率因子分析图Fig.3 The factor analysis of Cys replacement rate in NaNO3 solution(a)—主效应图; (b)—交互效应图; (c)—标准化效应正态分布图; (d)—标准化效应的Pareto图.
图3a为不考虑多因素交互作用下的单因素主效应图,各点纵坐标为在横坐标的条件下Cys置换速度的平均值,一般通过斜率的绝对值判断主导因素[21].从图中可知这4种因素中斜率绝对值最大的为Cys质量浓度,所以Cys质量浓度为这4种因素中的主效应,另外图中因素的斜率符号代表其效应的正负,当斜率为负值时,该因素起负效应,也就是增大该因素的值其所产生的效果是减弱的;若为正效应增大该因素,其所产生的效果是增强的.在Cys置换作用中Cys质量浓度起负效应,表明浓度增加置换效果减弱.这与2.2.1分析的结果相矛盾,其原因是因为在图3a中Cys的纵坐标为Cys质量浓度相同时纳米银初始粒径的平均值不考虑其余因素的大小,而2.2.2讨论的是pH,纳米银质量浓度、温度均为低值时的Cys质量浓度对置换速度的影响,所以结果会出现相反的情况.
同理,由图可知这4种因素起正效应的为pH、纳米银质量浓度、温度,起负效应的为Cys质量浓度.其中主效应为Cys质量浓度.
如图3b可知这5种影响因子的交互作用,若图中两水平线互相平行则说明这两种因素没有相互作用,反之,若两水平线不平行则说明两因素之间存在交互作用[21].从图中可知6组两因素之间水平线均不平行,说明这4种因素中两两均存在不同程度的交互作用.
图3c为Cys置换的标准化效应的正态概率分布图.根据正态概率分布的概念,因素与直线拟合不好,越偏离直线表明该因素对分析相的影响越显著,反之亦然[22].所以由图可知所选的4种因素均不显著,这4种因素中不存在显著影响Cys置换的效应.
图3d为Cys置换作用的标准化效应Pareto图,其中超过竖线右侧的因素为主要影响因素,可知这4种因素及他们之间的交互作用不存在主要影响因素,但通过此图可以比较出这几种因素影响Cys置换的强弱.由图3d可知,虽然无显著效应,但Cys质量浓度与温度的交互作用对Cys置换的效应大于其他因素的影响.
3 结 论
本文定量研究了溶液中pH、Cys质量浓度、纳米银质量浓度和温度4个环境因素交互作用下Cys与纳米银的交互作用.研究表明所有条件下,Cys均能置换纳米银表面的PVP涂层,导致纳米银粒径变小.提高单一因素pH、Cys质量浓度、AgNP质量浓度或温度的值时,Cys的置换速度均增加.同时改变两个因素时, 除Cys质量浓度和温度、pH和温度为协同作用外,其余4组两因素之间的相互作用均为拮抗作用.即Cys质量浓度与纳米银质量浓度、纳米银质量浓度与温度、pH与Cys质量浓度、pH与纳米银质量浓度之间均存在互相抑制效应.反之,同时提高Cys质量浓度和温度或者pH和温度,能增强Cys对纳米银的置换速度. 统计分析结果证实了实验所选4种因素间两两均存在交互作用.另一方面,所研究的4个因素以及两两交互均不是控制置换速度的主导因素.相比而言, Cys质量浓度与温度的交互作用对Cys置换速度的影响大于其他因素.由于细菌细胞膜蛋白中存在着Cys,研究表明当溶液温度升高时,细胞膜蛋白对吸附的纳米银的PVP洗脱效果会加强,由此引起的纳米银尺寸的改变,对于纳米银毒性的发挥,具有重要的影响.
[ 1 ] LOWRY G V,GREGORY K B,APTE S C,et al. Guestcomment: transformations of nanomaterials in the environment focus issue[J]. Environmental Science & Technology, 2012,46(13):6893-6899.
[ 2 ] 徐盛洪,程全国. 辽宁某地地下水中(重)金属污染评价[J]. 沈阳大学学报(自然科学版), 2016,28(6):467-473.
XU S H,CHENG Q G. Evaluation of (heavy) metals pollution of groundwater in some place in Liaoning Province of China[J]. Journal of Shenyang University(Natural Science), 2016,28(6):467-473.
[ 3 ] 金丹,郑冬梅,孙丽娜. 辽河铁岭段两岸河岸带土壤重金属分布及风险评价[J]. 沈阳大学学报(自然科学版), 2015,27(6):451-456.
JIN D,ZHENG D M,SUN L N. Heavy metal pollution and risk assessment of riparian soil along Liao River in Tieling region[J]. Journal of Shenyang University(Natural Science), 2015,27(6):451-456.
[ 4 ] YEO M K,YOON J W. Comparison of the effects of nano-silver antibacterial coatings and silver ions on zebrafish embryogenesis[J]. Molecular & Cellular Toxicology, 2009,5(1):23-31.
[ 5 ] YEO M K,PAK S W. Exposing zebrafish to silver nanoparticles during caudal fin regeneration disrupts caudal fin growth and p53 signaling[J]. Molecular & Cellular Toxicology, 2008,4(4):311-317.
[ 6 ] GONDIKAS A P,MORRIS A,REINSCH B C,et al. Cysteine-induced modifications of zero-valent silver nanomaterials: implications for particle surface chemistry, aggregation, dissolution, and silver speciation[J]. Environmental Science & Technology, 2012,46(13):7037-7405.
[ 7 ] YANG X,LIN S,WIESNER M R. Influence of natural organic matter on transport and retention of polymer coated silver nanoparticles in porous media[J]. Journal of Hazardous Materials, 2014,264(2):161-168.
[ 8 ] LI X,LENHART J J,WALKER H W. Aggregation kinetics and dissolution of coated silver nanoparticles[J]. Langmuir the Acs Journal of Surfaces & Colloids, 2012,28(2):1095-1104.
[ 9 ] BENN T M,WESTERHOFF P. Nanoparticle silver released into water from commercially available sock fabrics[J]. Environmental Science & Technology, 2008,42(11):4133-4139.
[10] KHAN S S,SRIVATSAN P,VAISHNAVI N,et al. Interaction of silver nanoparticles (SNPs) with bacterial extracellular proteins (ECPs) and its adsorption isotherms and kinetics[J]. Journal of Hazardous Materials, 2011,192(1):299-306.
[11] ELZEY S,GRASSIAN V H. Agglomeration, isolation and dissolution of commercially manufactured silver nanoparticles in aqueous environments[J]. Journal of Nanoparticle Research, 2010,12(5):1945-1958.
[12] HO C M,YAU S K,LOK C N,et al. Oxidative dissolution of silver nanoparticles by biologically relevant oxidants: a kinetic and mechanistic study[J]. Chemistry: An Asian Journal, 2010,5(2):285-293.
[13] PHILIPPE A,SCHAUMANN G E. Interactions of dissolved organic matter with natural and engineered inorganic colloids: a review[J]. Environmental Science & Technology, 2014,48(16):8946-8962.
[14] YANG X,FLYNN R,VON D K F,et al. Influence of ionic strength and pH on the limitation of latex microsphere deposition sites on iron-oxide coated sand byhumic acid[J]. Environmental Pollution, 2011,159(7):1896-1904.
[15] 张玉玺,孙继朝,陈玺,等. 珠江三角洲浅层地下水pH值的分布及成因浅析[J]. 水文地质工程地质, 2011,38(1):16-21.
ZHANG Y X,SUN J C,CHEN X,et al. Characteristics and preliminary analyses of the formation of pH in shallow groundwater in the Pearl River delta[J]. Hydrogeology & Engineering Geology, 2011,38(1):16-21.
[16] BAALOUSHA M,NUR Y,TEJAMAYA M,et al. Effect of monovalent and divalent cations, anions and fulvic acid on aggregation of citrate-coated silver nanoparticles[J]. Science of the Total Environment, 2013,454/455(5):119-131.
[17] LIU J,PENNELL K G,HURT R H. Kinetics and mechanisms of nanosilver oxysulfidation[J]. Environmental Science & Technology, 2011,45(17):7345-53.
[18] LEVARD C,HOTZE E M,LOWRY G V,et al. Environmental transformations of silver nanoparticles: impact on stability and toxicity[J]. Environmental Science & Technology, 2012,46(13):6900-6914.
[19] GONDIKAS A P,MORRIS A,REINSCH B C,et al. Cysteine-induced modifications of zero-valent silver nanomaterials: implications for particle surface chemistry, aggregation, dissolution, and silver speciation[J]. Environmental Science & Technology, 2012,46(13):7037-7045.
[20] SAIKAT M,ANAND G,NEETA L,et al. Studies on thereversible aggregation of cysteine-capped colloidal silver particles interconnected via hydrogen bonds[J]. Langmuir, 2001,17(20):6262-6268.
[21] 马明明,同帜,席小云,等. Minitab软件确定电镀镍钯金引线框架银胶扩散因素[J]. 电镀与涂饰, 2011,30(4):35-40.
MA M M,TONG Z,XI X Y,et al. Determination of factors on epoxy bleed out from nickel/palladium/gold plated lead frame by Minitab software[J]. Electroplating & Finishing, 2011,30(4):35-40.
[22] 付芝芳. 硬质合金刀具高速切削高强度钢切削力非线性规律研究[J]. 工具技术, 2011,45(3):32-35.
FU Z F. Study on non-linear characteristics of cutting forces in high speed machining of high strength steel with carbide tools[J]. Tool Engineering, 2011,45(3):32-35.
