镉胁迫对意大利苍耳(Xanthium italicum)生长、叶绿素及光合特性的影响
2018-03-06胡小英齐淑艳李瑞莉
胡小英, 齐淑艳,b, 李瑞莉
(沈阳大学 a. 生命科学与工程学院; b. 辽宁省城市有害生物治理与生态安全重点试验室, 辽宁 沈阳 11004)
重金属镉(Cd)是植物生长发育过程中非必需金属元素之一,毒性较强,具有可迁移的特点,易被植物吸收和积累,人们食用Cd污染的食品后易造成健康伤害[1].根据我国环保部和国土部的调查,Cd为我国众多重金属污染中的首要污染元素[2].随着我国工业、经济的快速发展,土壤重金属Cd污染问题越来越严重,对土壤重金属污染的修复迫在眉睫.植物修复技术具有成本低、对环境扰动小等特点,因而成为污染土壤修复研究的热点[3-4].目前已报道的Cd富集植物主要有龙葵(SolanumnigrumL.)、商陆(Phytolaccaacinosa)、三叶鬼针草(BidenspilosaL.)、宝山堇菜(Violabaoshanensis)等十几种[5].
意大利苍耳(Xanthiumitalicum)为菊科苍耳属1年生草本植物,原产于北美洲和欧洲.1991年在北京市昌平区首次被发现,由于其生长快速,适应性强,目前已经蔓延到广东、河北、新疆、辽宁、山东等地[6].由于意大利苍耳易于扩散,危害严重,它在2007年被列入《中华人民共和国进境植物检疫性有害生物名录》[7-8].当前对于意大利苍耳的研究报道主要集中在其生物学特性和防控[9-10],以及其对土壤生态的影响[11]的研究等方面,关于意大利苍耳对重金属胁迫响应机理及富集效果还未见报道.本研究主要通过不同质量分数Cd2+胁迫对意大利苍耳生长及光合特性的影响,探究意大利苍耳对重金属Cd2+胁迫的响应,以期为筛选超富集植物和对Cd污染土壤的生态修复与治理提供理论依据,为入侵植物的利用提供新思路.
1 材料与方法
1.1 试验材料与镉污染处理
意大利苍耳种子(瘦果)于2015年10月在沈阳浑河大堤南岸采集并保存.采用温室盆栽控制试验.基质为校园土与购买的腐殖土,按V(校园土)∶V(腐殖土)=2∶1均匀混合,2 mm孔径过筛,置于105 ℃烘箱中高温灭活8 h,放入直径20 cm、高15 cm的塑料花盆中备用,填土高度13 cm.试验以去离子水作对照组(CK),Cd2+质量分数分别为5×10-6、20×10-6、50×10-6、100×10-6和200×10-6,每个处理3个重复组,其中供试Cd2+来源于化学试剂CdCl2·2.5H2O(分析纯).每盆播种10粒,种子萌发后每盆定植3株,生长期间不定期浇水,控制土壤含水量保持在土壤田间持水量的80%左右.幼苗生长35 d后开始进行测量.
1.2 测定方法
1.2.1 叶绿素的提取与测定
采用乙醇提取法[12].称取每株距顶端第5片叶,鲜重0.25~0.50 g,并剪碎研磨,加入5 mL 95%乙醇溶液分批提取其叶绿素,以95%乙醇溶液为对照,用722s型可见光分光光度计在波长分别为665 nm、649 nm条件下测定提取液的吸光度.
叶绿素a和b及总叶绿素的质量浓度分别为:Ca、Cb和CT,单位mg/mL,可根据下式计算:
式中:A665、A649分别为提取液在波长665 nm、649 nm下的吸光度.
叶绿体色素的质量分数=(色素的质量浓度×提取液体积×稀释倍数)/样品鲜重.
1.2.2 光合生理指标及生物量的测定
选择天气晴朗的9∶00—15∶00,利用Li-6400便携式光合仪(美国Li-Cor公司)对不同处理组意大利苍耳的相同部位叶片进行净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2摩尔分数(Ci)光合指标的测定,水分利用率WUE=Pn/Tr,气孔限制值Ls=1-Ci/Ca.采用CI-203叶面仪(美国CID公司)测定其叶面积,重复3次.最后将意大利苍耳从盆中取出,清除泥土,依次测量其株高及根长度,并将植株的根、茎、叶分离,分别编号装入纸袋中,于鼓风干燥箱中120 ℃烘干至恒重,用电子天平(精确度为0.1 mg)称量干重.
1.2.3 Cd含量测定
将植物样品分为地上与地下两部分,烘干磨碎过筛,精确称取50 mg的植物样品加入坩埚中,加入10 mL混合酸(V(HNO3)∶V(HClO4)=5∶1),过夜进行预消解,然后置于电热板上进行加热消解直到溶液呈现透明,再用火焰原子吸收分光光谱法测定溶液中Cd的质量比[13].其中富集系数(BCF)和转移系数(TF)的计算公式[14]如下:
1.3 试验数据处理与计算
采用Excel对所统计数据进行整理、计算与绘图.采用DPS 3.01统计软件,利用Duncan新复极差法进行试验差异显著性检验分析.
2 结果与分析
2.1 不同质量分数Cd2+胁迫对意大利苍耳生长的影响
Cd2+胁迫对意大利苍耳生长的影响见表1.意大利苍耳的植株高度在Cd2+质量分数为5×10-6时,与CK相比略有增加,差异不显著(P>0.05);在Cd2+质量分数为20×10-6~200×10-6范围内,植株高度呈现逐渐降低的趋势,其中Cd2+质量分数为20×10-6~100×10-6时,与CK相比差异不显著(P>0.05),Cd2+质量分数为200×10-6时,与CK相比降低了37.87%,差异极显著(P<0.01).意大利苍耳的根长、叶片数和叶面积都随着Cd2+质量分数的增加均呈现不同程度的降低,但与CK相比,差异不显著(P>0.05).不同Cd2+胁迫对意大利苍耳比叶面积的影响不同,与CK相比,差异均不显著(P>0.05).意大利苍耳地上生物量和地下生物量随着Cd2+质量分数的增加而降低,当Cd2+质量分数为200×10-6时,地上生物量及地下生物量与CK相比分别降低了55.72%和61.33%,差异极显著(P<0.01),其他差异均不显著(P>0.05).虽然意大利苍耳的冠根比在不同质量分数的Cd2+胁迫下有所增加,但与CK相比差异并不显著(P>0.05).试验表明,高质量分数Cd2+(200×10-6)胁迫对意大利苍耳株高、生物量的抑制较为明显;而Cd2+质量分数在5×10-6~200×10-6范围时,对意大利苍耳的生长及生物量的胁迫没有明显的影响,说明意大利苍耳对Cd2+胁迫具有较强的耐受力.
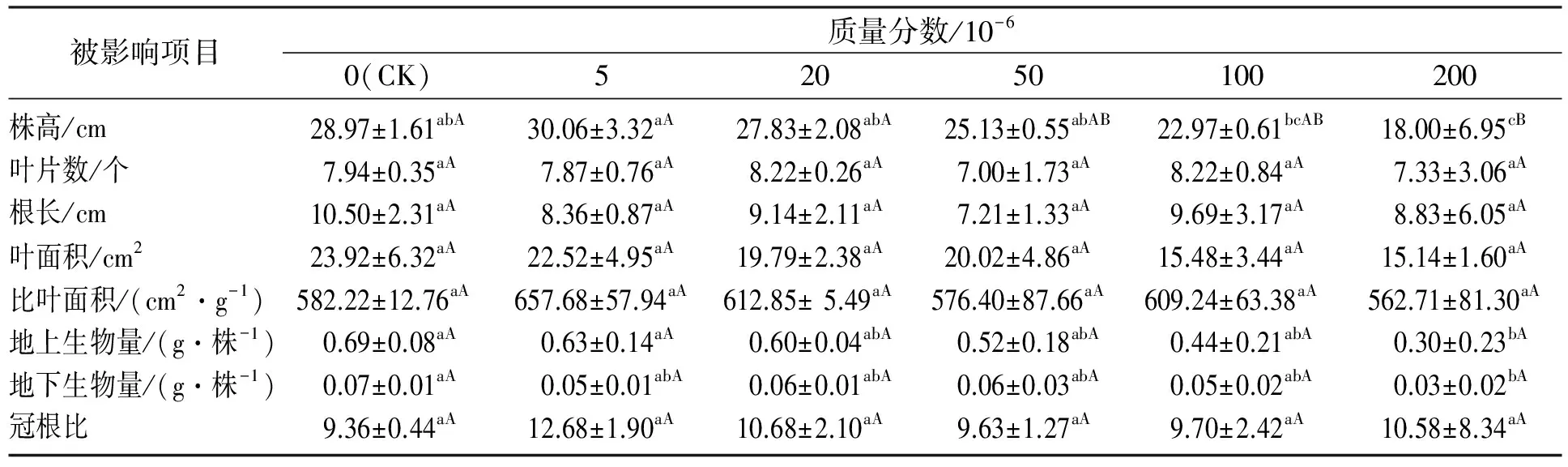
表1 不同质量分数Cd2+胁迫对意大利苍耳生长的影响Table 1 Effects of growth of X.italicum under different mass fraction of cadmium stress
注: 同行不同小写字母代表各指标差异显著(P<0.05),同行不同大写字母代表各指标差异极显著(P<0.01),下同.
2.2 不同质量分数Cd2+胁迫对意大利苍耳叶绿素质量分数的影响
意大利苍耳叶绿素a质量分数、叶绿素b质量分数和叶绿素总质量分数随着Cd2+质量分数的增加均呈现不同程度的下降趋势(表2).Cd2+质量分数为200×10-6时,与CK相比,叶绿素a质量分数、叶绿素b质量分数和叶绿素总质量分数分别显著下降了41.78%、41.62%和41.74%(P<0.05).其他差异均不显著(P>0.05);叶绿素a/b值在 Cd2+质量分数为100×10-6时达到了最高值,与CK相比,差异显著(P<0.05),这种现象可能是由于在此质量分数下,叶绿素a质量分数的降幅相对较小,而叶绿素b质量分数的降幅相对较大造成的.其他各处理的变化不一,但与CK相比,差异均不显著(P>0.05).试验表明Cd2+质量分数在5×10-6~100×10-6范围内时,对意大利苍耳叶绿素合成的抑制作用不明显,当Cd2+质量分数为200×10-6时,对意大利苍耳叶绿素合成的抑制作用明显.

表2 不同质量分数Cd2+胁迫意大利苍耳叶绿素质量分数的影响Table 2 Effects of chlorophyll content of X.italicum under different mass fraction of cadmium stress
2.3 不同质量分数Cd2+胁迫对意大利苍耳光合特征的影响
不同质量分数Cd2+胁迫对意大利苍耳光合特征的影响见图1.意大利苍耳Pn、Gs、Ci和Tr随着重金属Cd2+质量分数增加呈现先升后降的趋势,且不同质量分数Cd2+胁迫下意大利苍耳Pn、Gs、Ci和Tr均高于CK(图1a~图1d).Cd2+质量分数为20×10-6时,与CK相比,意大利苍耳Pn差异显著(P<0.05);Cd2+质量分数为50×10-6时,与CK相比,意大利苍耳Pn差异极显著(P<0.01),Gs和Tr差异显著(P<0.05);其他差异均不显著(P>0.05);试验表明Cd2+胁迫对意大利苍耳Pn、Gs、Ci和Tr有促进作用.
意大利苍耳WUE和Ls随着重金属Cd2+质量分数增加呈先降后升趋势,WUE和Ls值均低于CK,差异不显著(P>0.05)(图1e,图1f),表明Cd2+胁迫降低意大利苍耳WUE和Ls,但作用不明显.
2.4 意大利苍耳对Cd的吸收能力
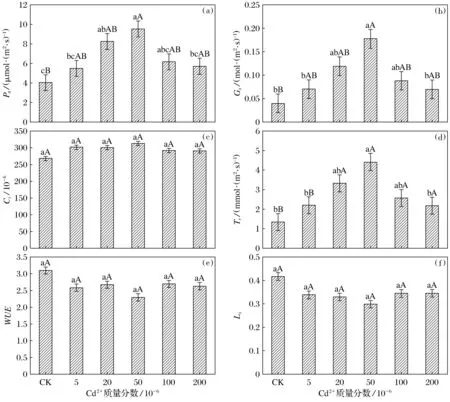
图1 不同质量分数Cd2+胁迫对意大利苍耳Pn、Ci、Gs、Tr、WUE和Ls的影响Fig.1 Effects of Pn、Ci、Gs、Tr、WUE and Ls of X.italicum under different mass fraction of cadmium stress
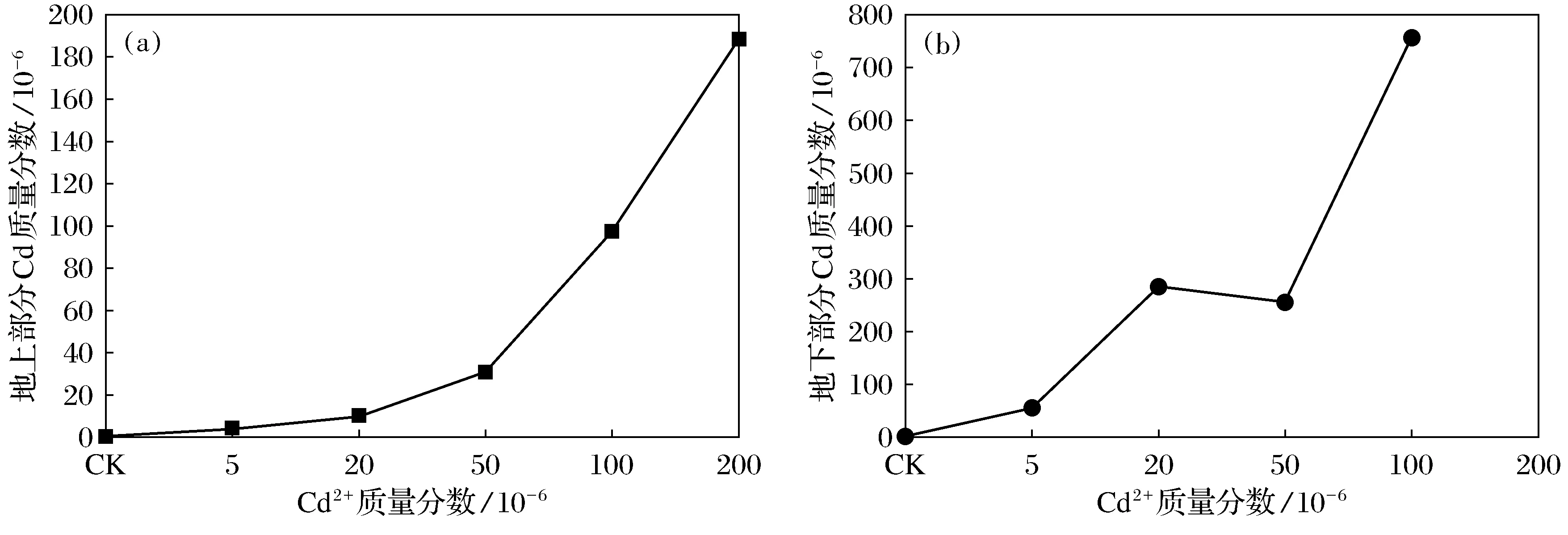
图2 不同质量分数Cd2+胁迫下意大利苍耳的Cd质量分数Fig.2 The cadmium content of X.italicum under different mass fraction of cadmium stress
随着Cd2+质量分数的增加,意大利苍耳地上及地下部分的Cd2+质量分数均呈现显著上升的趋势,地下部分Cd2+质量分数均高于地上部分Cd2+质量分数(图2).当Cd2+质量分数为100×10-6时地上部分Cd2+质量分数为97.23×10-6,Cd2+质量分数为200×10-6时地上Cd2+质量分数大于100×10-6(图2a);当Cd2+质量分数为20×10-6~100×10-6时地下Cd2+质量分数明显大于100×10-6(图2b),说明意大利苍耳根系对Cd的吸收能力较强.Cd2+质量分数为200×10-6时,意大利苍耳根系生长受到严重抑制,收获的地下部分生物量不够分析测定量,未进行测量.
从表3也能看出,Cd2+胁迫下意大利苍耳整个植株Cd2+富集系数均大于1,但地上部分富集系数均小于地下部分,转移系数均小于1,说明意大利苍耳对Cd有着较强的富集作用,但未能向地上部分大量转移.
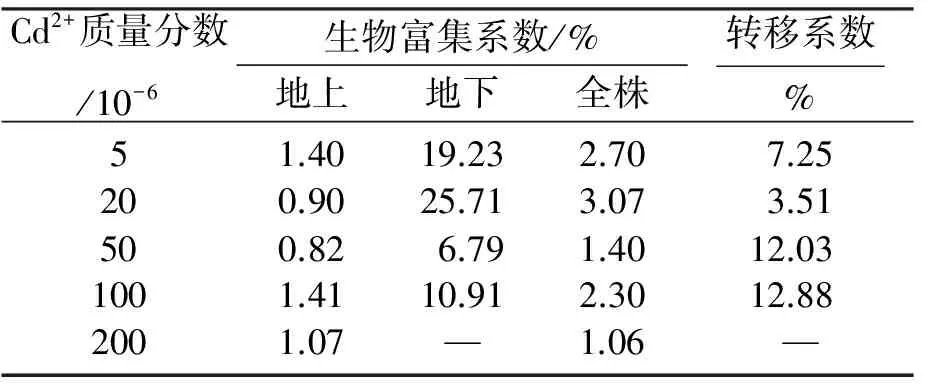
表3 不同质量分数Cd2+胁迫下意大利苍耳的富集系数与转移系数
注: “—”表示未测.
3 结果与讨论
Cd是植物生长发育中一种非必需的微量元素,它不仅能影响植物的生长,严重时能够造成植物死亡[15].且随着Cd2+质量分数的增加,其株高、叶面积和地上及地下生物量都呈下降趋势,高质量分数Cd2+胁迫显著抑制意大利苍耳的生长.王凯荣[16]等研究Cd2+对花生苗期的毒害效应及其品种间差异时,发现随着Cd2+质量分数的增加,不同品种花生苗的株高、基叶生物量、根系生物量都会显著下降,与本试验研究结果一致.植物的冠根比指的是植物地上部分与地下部分的干重的比值,它的大小反映了植物地下部分与地上部分的相关性.本研究中,意大利苍耳的冠根比随着Cd2+质量分数的增加均高于对照组,并且本研究还表明当意大利苍耳受到不同质量分数的Cd2+胁迫时,其地下部分对Cd富集的能力大于地上部分,说明Cd2+胁迫可能影响根系的生长及有机物在体内的分配.虽然Cd2+胁迫下意大利苍耳的生物量有所下降,但在高质量分数Cd2+胁迫(200×10-6)下仍能够存活,说明意大利苍耳对Cd具有较强的耐受力,这可能是意大利苍耳抵抗Cd胁迫的策略之一.
叶绿素作为植物光合作用的重要物质基础,各种环境胁迫均可导致叶绿素的破坏与降解.同时,叶绿素质量分数减少是衡量叶片衰老的重要生理指标[17],叶绿素a质量分数和叶绿素b质量分数的高低在一定程度上反映了植物光合作用的能力.随着Cd2+质量分数的增加,意大利苍耳叶绿素a质量分数、叶绿素b质量分数和叶绿素总质量分数与CK相比都呈下降趋势,当Cd2+质量分数为200×10-6时Cd2+胁迫有显著抑制作用.有研究发现,导致重金属Cd2+抑制叶绿素合成的原因可能是重金属Cd2+进入植物体内后与相关的酶发生作用从而抑制叶绿体的合成,也可能是细胞内的的活性氧增加,使更多的O2和H2O2等扩散到叶绿体内,从而参与了对叶绿素的降解作用[18],还有可能是Cd2+胁迫直接导致叶肉细胞排列紊乱,细胞内膜结构破坏,从而降低叶绿素的质量分数[19].苎麻(Boehmerianivea)[20]同本试验研究结果一致.植物叶绿素质量分数会伴随着植物叶片的衰老而逐渐降低,叶绿素a质量分数也会比叶绿素b质量分数下降得更快,叶绿素a/b值也可作为叶片衰老的指标[21].但本研究中Cd2+胁迫下意大利苍耳的叶绿素a/b值与对照组相比都有所上升,可能是由于其叶绿素b较叶绿素a的降幅变得更大所导致的,这也是意大利苍耳对Cd2+胁迫的一种响应.
净光合速率(Pn)直接反映了单位叶面积的光合同化能力[22],是反映植物对Cd2+胁迫的响应以及鉴定植物耐Cd能力的有效生理指标.本研究中,Cd2+胁迫下意大利苍耳的Pn均高于CK,说明意大利苍耳具有较强的光合同化能力.其中,在Cd2+质量分数50×10-6~200×10-6范围内,随着Pn和Gs下降,Ci也逐渐下降,说明引起光合作用下降的主要原因是气孔因素.气孔是植物光合作用和呼吸作用与外界气体进行气体交换的“大门”,也是蒸腾过程中水蒸气从体内排到体外的主要出口,其闭合程度直接影响光合作用和蒸腾作用[23].有研究表明,Tr除了对植物叶片的水分产生作用外,还对植物体内的水分运输起着关键作用,它不仅受植物本身结构与生理有关,还易受到外界环境影响,更有研究表明植物叶片Tr与Gs密切相关,二者成正比[24].本研究中意大利苍耳植株Gs增加的同时,Tr也增加;反之,Gs减小,Tr也相对减小.Ls则直接表明了植物叶片气孔限制的程度,是判断植物在逆境胁迫下气孔被限制程度的一项重要因素[25].本研究中Ls呈现低降高升的变化趋势,但均低于对照组且差异不显著,这可能也是意大利苍耳对Cd2+胁迫的一种防御策略.
目前关于Cd的超富集植物的界定标准主要看以下3方面:①植物叶或地上部分中Cd质量分数达到100×10-6[26-27];②对Cd的富集系数大于1[28];③植物中Cd的转移系数大于1[29],即能够实现将地下部分的Cd多数甚至全部转移到地上部分.本研究中,在Cd2+质量分数为200×10-6时意大利苍耳地上部分的Cd质量分数明显大于100×10-6,且Cd2+胁迫下意大利苍耳整个植株对Cd富集系数均大于1,满足了Cd超富集植物的前两点,但其转移系数小于1,说明意大利苍耳对Cd有着较强的富集能力,但是否能够成为超富集植物仍需探讨.
4 结 论
从株高、生物量、叶绿素含量以及光合指标综合来看,意大利苍耳对重金属Cd2+胁迫有着较强的耐受能力,而通过地上部分及地下部分的Cd2+质量分数及富集系数来看,意大利苍耳对Cd具有较强的富集作用,这表现出意大利苍耳对Cd污染土壤的修复与治理具有较大的应用潜力,但最终是否能作为重金属Cd的超富集植物还有待进一步研究.
[ 1 ] WAGNER G J. Accumulation of cadmium in crop plants and its consequences to human health[J]. Advances in Agronomy, 1993,51:173-212.
[ 2 ] 环境保护部,国土资源部. 全国土壤污染状况调查公报[J]. 中国环保产业, 2014,36(5):10-11.
Environmental Protection Department,Ministry of Land and Resources. Bulletin of the national survey of soil pollution status[J]. China Environmental Protection Industry, 2014:36(5):10-11.
[ 3 ] 韦朝阳,陈同斌. 重金属超富集植物及植物修复技术研究进展[J]. 生态学报, 2001,21(7):1196-1203.
WEI C Y,CHEN T B. Hyper-accumulator and phytoremediation of heavy metal contaminated soil: a review of studies in China and abroad[J]. Acta Ecologica Sinica, 2001,21(7):1196-1203.
[ 4 ] 李玉双,胡晓钧,侯永侠,等. 利用白菜修复污灌区重金属污染土壤的螯合诱导植物修复技术[J]. 沈阳大学学报(自然科学版), 2014,26(1):9-13.
LI Y S,HU X J,HOU Y X,et al. Chelate-induced phytoextraction of heavy metal contaminated soil of irrigation area by cabbage[J]. Journal of Shenyang University(Natural Science), 2014,26(1):9-13.
[ 5 ] 聂亚平,王晓维,万进荣,等. 几种重金属(Pb、Zn、Cd、Cu)的超富集植物种类及增强植物修复措施研究进展[J]. 生态科学, 2016,35(2):174-182.
NIE Y P,WANG X W,WAN J R,et al. Research progress on heavy metal (Pb, Zn, Cd, Cu) hyper-accumulating plants and strengthening measures of phytoremediation[J]. Ecological Science, 2016,35(2):174-182.
[ 6 ] 车晋滇,胡彬. 外来入侵杂草意大利苍耳[J]. 杂草学报, 2007(2):58-59.
CHE J D,HU B. An invasive exotic weed:XanthiumitalicumMoretti.[J]. Weed Science, 2007(2):57-59.
[ 7 ] 李楠,朱丽娜,翟强,等. 一种新入侵辽宁省的外来有害植物:意大利苍耳[J]. 植物检疫, 2010,24(5):49-52.
LI N,ZHU L N,ZHAI Q,et al. A new alien invasive plant:XanthiumitalicumMoretti. in Liaoning Province[J]. Plant Quarantine, 2010,24(5):49-52.
[ 8 ] 刘慧圆,明冠华. 外来入侵种意大利苍耳的分布现状及防控措施[J]. 生物学通报, 2008,43(5):15-16.
LIU H Y,MING G H. The distribution status and control measures of an alien invasive species:XanthiumitalicumMoretti.[J]. Bulletin of Biology, 2008,43(5):15-16.
[ 9 ] 迪利夏提·哈斯木,武红旗,买买提江·吐尔逊,等. 苍耳属两种植物种群构件生物量结构特征[J]. 新疆农业科学, 2014,51(4):708-713.
DILIXIATI H,WU H Q,MAIMAITIJIANG T,et al. Module biomass structure of twoXanthiumspeciesin different ecological environment habitats[J]. Xinjiang Agricultural Sciences, 2014,51(4):708-713.
[10] 郭婷婷,齐淑艳,董晶晶. 东北三省外来种子植物种类调查与分析[J]. 沈阳大学学报(自然科学版), 2014,26(5):349-353.
GUO T T,QI S Y,DONG J J. Investigation and analysis on species of exotic spermatophyte in three provinces in northeast China[J]. Journal of Shenyang University(Natural Science), 2014,26(5):349-353.
[11] 李乔,王月,张玉曼,等. 意大利苍耳入侵对土壤酶活与土壤肥力的影响[J]. 河北科技师范学院学报, 2013,27(3):6-9.
LI Q,WANG Y,ZHANG Y M,et al. Effects ofXanthiumitalicumMoretti. invasion on soil enzyme activity and fertility[J]. Journal of Hebei Normal University of Science & Technology, 2013,27(3):6-9.
[12] LICHTENTHALER H K. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes[J]. Methods in Enzymology, 1987,148C(1):350-382.
[13] 刘凤枝. 农业环境监测实用手册[M]. 北京:中国标准出版社, 2001.
LIU F J. Practical handbook of agricultural environmental monitoring[M]. Beijing: Standard Press of China, 2001.
[14] STOLTZ E,GREGER M. Accumulation properties of As, Cd, Cu, Pb and Zn by four wetland plant species growing on submerged mine tailings[J]. Environmental and Experimental Botany, 2002,47(3):271-280.
[15] 时萌,王芙蓉,王棚涛. 植物响应重金属镉胁迫的耐性机理研究进展[J]. 生命科学, 2016,28(4):504-512.
SHI M,WANG F R,WANG P T. Research advances in the tolerance mechanism of plant response to heavy metal cadmium stress[J]. Chinese Bulletin of Life Sciences, 2016,28(4):504-512.
[16] 王凯荣,曲伟,刘文龙,等. 镉对花生苗期的毒害效应及其品种间差异[J]. 生态环境学报, 2010,19(7):1653-1658.
WANG K R,QU W,LIU W L,et al. Toxic effect of Cd on peanut seedlings and the intra-specific variations[J]. Ecology and Environmental Sciences, 2010,19(7):1653-1658.
[17] 严重玲,李瑞智,钟章成. 模拟酸雨对绿豆、玉米生理生态特性的影响[J]. 应用生态学报, 1995(S1):124-131.
YAN Z L,LI R Z,ZHONG Z C. Effect of simulated acid rain on eophysiological characteristics of mung bean and maize[J]. Chinese Journal of Applied Ecology, 1995(S1):124-131.
[18] LIANG P,PARDEE A B. Differential display of eukaryotic messenger RNA by means of the polymerase chain reaction.[J]. Science, 1992,257(5072):967.
[19] 郭书奎,赵可夫. NaCl胁迫抑制玉米幼苗光合作用的可能机理[J]. 植物生理学报, 2001,27(6):461-466.
GUO S K,ZHAO K F. The possible mechanisms of NaCl inhibit photosythesis of maize seedlings[J]. Acta Phytophysiologica Sinica, 2001,27(6):461-466.
[20] 简敏菲,杨叶萍,余厚平,等. 不同质量分数Cd2+胁迫对苎麻叶绿素及其光合荧光特性的影响[J]. 植物生理学报, 2015(8):1331-1338.
JIAN M F,YANG Y P,YU H P,et al. Influences of different cadmium concentration stress on chlorophyll and its photosynthetic fluorescence characteristics of ramie (Boehmerianivea)[J]. Plant Physiology Journal, 2015(8):1331-1338.
[21] WOOLHOUSE N W. Longevity and senescence in plants[J]. Science Progress, 1974,61(241):123-147.
[22] 姜超强,李杰,刘兆普,等. 盐胁迫对转AtNHX1基因杨树光合特性与叶绿体超微结构的影响[J]. 西北植物学报, 2010,30(2):301-308.
JIANG C Q,LI J,LIU Z P,et al. Photosynthetic characteristics and chloroplast ultrastructure of transgenic poplar under NaCl stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2010,30(2):301-308.
[23] YAN X F,SUN G R,LI J L,et al. A comparative study on photosynthesis and transpiration diurnal variation ofAneurolepidiumchinenseandPuccinelliatenuiflora[J]. Bulletin of Botanical Research, 1994,14(3):287-291.
[24] 贺玉晓,赵丽,魏雅丽,等. 水分胁迫下柱花草叶水势、光合及叶绿素荧光特性的变化特征[J]. 农业环境科学学报, 2012,31(10):1897-1905.
HE Y X,CHAO L,WEI Y L,et al. Variation characteristics of leaf water potential, photosynthesis and chlorophyll fluorescence inStylosanthesGuianensisleaves under soil water stress[J]. Journal of Agro-Environment Science, 2012,31(10):1897-1905.
[25] WU F Z,BAO W K,LI F L,WU N. Effects of water stress and nitrogen supply on leaf gas exchange and fluorescence parameters ofSophoradavidiiseedings[J]. Photosynthetica, 2008,46(1):40-48.
[26] BAKER A J M,BROOKS R R,PEASE A J,et al. Studies on copper and cobalt tolerance in three closely related taxa within thegenusSilenceL.(Caryophyllaceae) from Zaïre[J]. Plant and Soil, 1983,73(3):377-385.
[27] MACNAIR M R. The hyperaccumulation of heavy metals by plants[J]. Advances in Botanical Research, 2003,40:63-105.
[28] 薛生国,陈英旭,林琦,等. 中国首次发现的锰超积累植物:商陆[J]. 生态学报, 2003,23(5):935-937.
XUE S G,CHEN Y X,LIN Q,et al.PhytolaccaacinosaRoxb.(Phytolaccaceae): a new manganese hyper-accumulator plant from Southern China[J]. Acta Ecologica Sinica, 2003,23(5):935-937.
[29] 汤叶涛,仇荣亮,曾晓雯,等. 一种新的多金属超富集植物:圆锥南芥(ArabispaniculataL.)[J]. 中山大学学报(自然科学版), 2005,44(4):135-136.
TANG Y T,QIU R L,ZENG X W,et al. A new found Pb/Zn/Cd hyperaccumulator:ArabispaniculataL.[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2005,44(4):135-136.
