硫化亚铁活化过硫酸钠降解酸性橙Ⅱ
2018-03-06马国峰鲁志颖贺春林
马国峰, 鲁志颖, 贺春林
(沈阳大学 辽宁省先进材料制备技术重点实验室, 辽宁 沈阳 110044)
随着人们生活品质的提高,印染与染料工业迅速发展,染料的数量和品种不断增多,其中偶氮染料是应用最为广泛的一类合成染料,约占有机染料品总量的80%[1-2].偶氮染料废水因色度深、有毒有机物含量高以及水质变化大等特点,成为难处理的工业废水之一[3].目前,国内外常用的偶氮染料废水处理的方法可以分为物理法、化学法和生物法.
硫化亚铁(FeS)是天然硫铁矿物中最丰富的矿物之一,而且无毒,广泛地分布于自然水体、沉积物、湖泊、以及地下水环境中[13-14].FeS具有二价铁离子和二价硫离子两种活性成分,所以FeS活化过硫酸盐降解废水中的有机污染物受到更多研究者的关注.例如,Fan[15]等人利用FeS活化过硫酸钠降解对氯苯胺,对氯苯胺去除率达到99%.虽然在含氯有机物的还原等方面表现出优异性能,但该体系处理偶氮染料废水的研究在国内外尚属空白,需要进行大量的基础性研究.
本研究采用FeS活化Na2S2O8的方法对酸性橙Ⅱ进行降解,考察各影响因素对活化反应的影响,分析反应过程中各物质变化规律;对比了不同条件下酸性橙Ⅱ去除率,以期为进一步探索处理偶氮颜料废水提供理论依据.
1 实验方法
FeS(天津市大茂化学试剂厂,分析纯);Na2S2O8(天津市大茂化学试剂厂,分析纯);HCl(天津市科密欧试剂有限公司,分析纯);750型紫外-可见分光光度计;PHS-25 pH计;恒温水浴锅;JJ-1电动搅拌器;带有X射线能量色散光谱(EDS)分析仪的日立S-4800扫描电子显微镜(SEM).
取100 mL配置好的酸性橙Ⅱ溶液(浓度100 mmol·L-1)置于烧杯中,于恒温水浴锅中预热至实验所需温度,粗调pH后,先加入FeS,再加入Na2S2O8,精调pH,在设定的时间点(0~90 min)取样,每隔一段时间取样,加入甲醇终止反应,用750型紫外-可见分光光度计进行吸光度和波长检测,同一组实验重复2次.
采用紫外-可见分光光度计于λ=483 nm处测定样品的吸光度.去除率计算如下:
X=(c0-ct)/c0×100%.
式中:X为酸性橙Ⅱ的去除率,%;t为反应时间,min;c0和ct分别为初始时刻和t时刻酸性橙Ⅱ的浓度,mmol·L-1.
2 结果与讨论
2.1 FeS的显微表征
图1是FeS的扫描电子显微形貌照片,从图中可以看出FeS凸凹不平,呈棒状结构,存在部分颗粒物.图2是FeS的X射线能量色散光谱分析图谱,EDS分析表明FeS表面元素主要为Fe、S和O.

图1 FeS的SEM照片
Fig.1 SEM photo of FeS
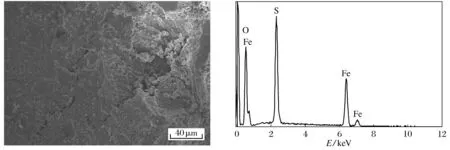
图2 FeS的X射线能量色散光谱分析图谱Fig.2 X-ray EDS analysis of FeS
2.2 初始pH对酸性橙Ⅱ去除率的影响
通常认为溶液初始pH值是降解偶氮颜料废水重要的影响因素.在30 ℃条件下FeS加入量为5.0 mmol·L-1、Na2S2O8初始浓度为2.0 mmol·L-1,研究了初始pH值分别为3.00、5.00、6.45(中性)、9.00和11.00对酸性橙Ⅱ降解的影响(见图3).从图3可以看出,降解效果受初始pH值影响十分显著,pH值对酸性橙Ⅱ的降解趋势由大到小为:6.45(中性)、5.00、3.00、9.00、11.00.
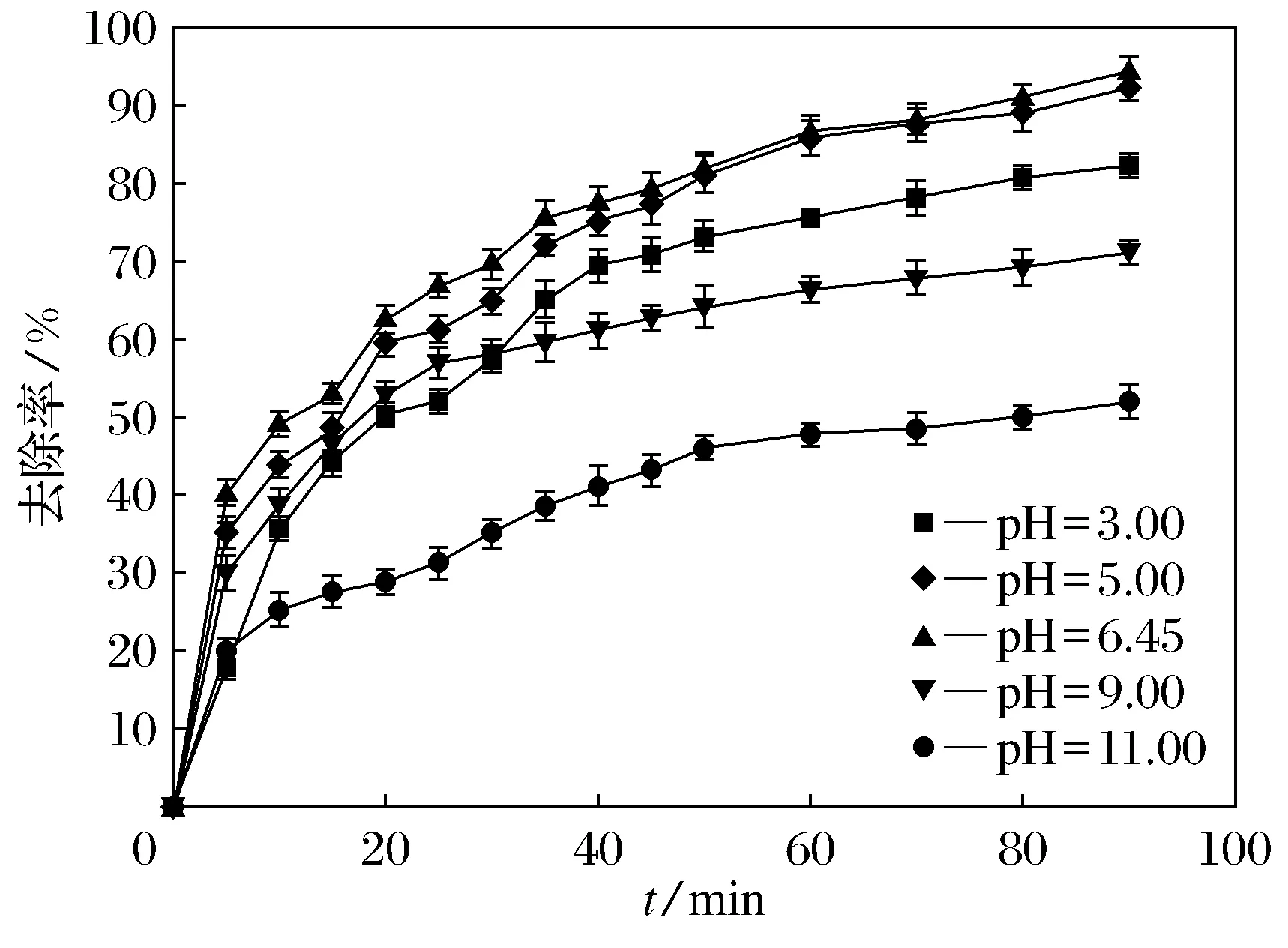
图3 初始pH值对降解酸性橙Ⅱ效果的影响
溶液初始pH值对废水的降解效果主要由以下几个反应机制决定:
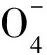
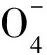
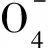
(3)

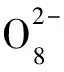
(6)
(5) FeS不溶于水,既可以在酸性条件下持续释放Fe2+(式(7))[20],同时其表面具有Fe2+,也可以活化过硫酸盐,反应如下:
根据上述分析,我们认为是这5个反应机制的相互作用使得溶液初始pH值在5.00到6.45时,酸性橙Ⅱ去除效果最优.
2.3 FeS加入量对酸性橙Ⅱ去除率的影响
在30 ℃条件下,溶液初始pH值为6.45(中性)、Na2S2O8初始浓度为2.0 mmol·L-1,研究了FeS加入量分别为1.0、3.0、5.0、7.0、9.0 mmol·L-1对酸性橙Ⅱ降解的影响,如图4所示.从图4可以看出,随着FeS加入量的增加,酸性橙Ⅱ的去除率逐渐提高,当FeS的投入量达到3.0 mmol·L-1后去除率变化不太明显;而随着FeS加入量的增加,酸性橙Ⅱ的去除效率越来越来越快.这些表明酸性橙Ⅱ的降解效果极大的依赖FeS和过硫酸钠的加入量.
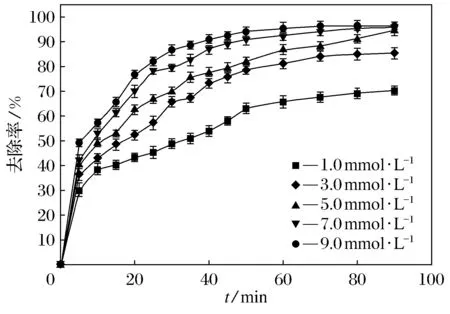
图4 FeS的加入量对降解酸性橙Ⅱ效果的影响
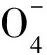
2.4 Na2S2O8初始浓度对酸性橙Ⅱ降解率的影响
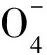
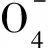
(8)
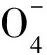

图5 Na2S2O8初始浓度对降解酸性橙Ⅱ效果的影响
2.5 温度对酸性橙Ⅱ去除率的影响
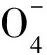
(9)
图6为温度对酸性橙Ⅱ的去除率的影响趋势图(溶液初始pH值为6.45、FeS加入量为5.0 mmol·L-1、Na2S2O8的加入量2.0 mmol·L-1).从图6可以看出,温度的升高能显著提高酸性橙Ⅱ的去除率.随温度的升高,酸性橙Ⅱ的去除率呈显著增长.而且温度的升高对反应速率也有提高,但反应后期去除率升高不明显,原因可能是温度的升高加快溶液中分子运动,从而提高反应物分子间的碰撞速率,加速反应进行,但随反应物的减少,温度的影响也随之下降了.
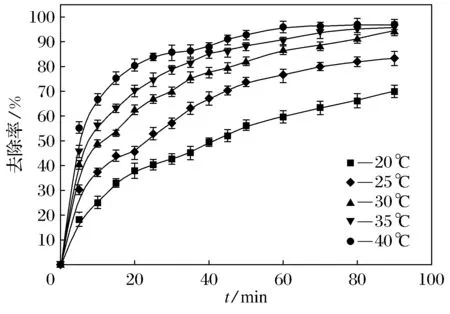
图6 温度对降解酸性橙Ⅱ效果的影响
通过对溶液初始pH值、FeS的加入量、Na2S2O8加入量和温度对酸性橙Ⅱ去除率的影响的分析讨论,降解酸性橙Ⅱ的最佳工艺条件为:酸性橙Ⅱ初始浓度为100 mmol·L-1、温度为30 ℃、溶液初始pH值为6.45(中性)、FeS加入量为5.0 mmol·L-1和Na2S2O8的加入量2.0 mmol·L-1.
2.6 紫外吸收光谱分析
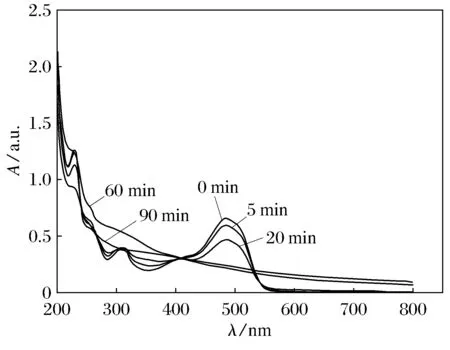
图7 酸性橙Ⅱ溶液随着降解的进行其紫外/可见光光谱随时间的变化曲线关系
3 结 论
(1) 通过扫描电子显微镜分析,FeS凸凹不平,呈棒状结构,存在部分颗粒物;表面主要元素为Fe、S和O三种.
(2) 通过单因素实验测定溶液初始pH值、FeS的加入量、Na2S2O8加入量和温度对酸性橙Ⅱ去除率的影响程度.FeS的加入量和Na2S2O8初始浓度是决定酸性橙Ⅱ去除效率的主要因素,随着两者加入量的增加,去除效率明显增加.降解酸性橙Ⅱ的最佳工艺条件为:酸性橙Ⅱ初始浓度为100 mmol·L-1、温度为30 ℃、溶液初始pH值为6.45(中性)、FeS加入量为5.0 mmol·L-1和Na2S2O8的加入量2.0 mmol·L-1.
(3)随着降解时间的延长,酸性橙Ⅱ在紫外-可见光区域的特征吸收峰的强度不断降低,最终消失,表明酸性橙Ⅱ的特征官能团被氧化破坏.
[ 1 ] SHEN J H,HORNG J J,WANG Y S,et al. The use of reactive index of hydroxyl radicals to investigate the degradation of acid orange 7 by Fenton process[J]. Chemosphere, 2017,182:364-372.
[ 2 ] 傅晨,黄进刚,成震,等. 偶氮染料废水处理方法的研究进展[J]. 山东化工, 2015,44(3):144-145.
FU C,HUANG J G,CHENG Z,et al. Progress in treatment technology of azo dye wastewater: a review[J]. Shandong Chemical Industry, 2015,44(3):144-145.
[ 3 ] 陈跃. 染料废水处理技术及研究趋势[J]. 湖北理工学院学报, 2011,27(1):8-14.
CHEN Y. Treatment technology of dyestuff wastewater and its research trend[J]. Journal of Huangshi Institute of Technology, 2011,27(1):8-14.
[ 4 ] 王继鹏,胡林潮,杨彦,等. Fe2+活化过硫酸钠降解1,2-二氯苯[J]. 环境工程学报, 2014,8(9):3767-3772.
WANG J P,HU L C,YANG Y,et al. Sodium per sulfate activation by Fe2+for degradation of 1,2-dichlorobenzene[J]. Chinese Journal of Environmental Engineering, 2014,8(9):3767-3772.
[ 5 ] 徐清艳. Fe2+活化过硫酸钠降解日落黄的研究[J]. 广州化学, 2015,40(4):7-12.
XU Q Y. Study on sodium persulfate activated by Fe2+for degradation of sunset yellow[J]. Guangzhou Chemistry, 2015,40(4):7-12.
[ 6 ] 马国峰,贺春林.Fe78Si13B9非晶合金对酸性橙Ⅱ的降解性能[J]. 沈阳大学学报(自然科学版), 2016,28(3):178-182.
MA G F,HE C L. Degradation property of Fe78Si13B9amorphous alloy for acid orange Ⅱ[J]. Journal of Shenyang University(Natural Science), 2016,28(3):178-182.
[ 7 ] ZHANG C Q,ZHU Z W,ZHANG H F,HU Z Q. Rapid decolorization of acid orange Ⅱ aqueous solution by amorphous zero-valent iron[J]. Journal of Environmental Sciences, 2012,24(6):1021-1026.
[ 8 ] WALDEMER R H,TRATNYEK P G,JOHNSON R L. Oxidation of chlorinated ethenes by heat-activated persulfate: kinetics and products[J]. Environmental Science &Technology, 2006,41(3):1010-1015.
[ 9 ] HOUSE D A. Kinetics and mechanism of oxidations by peroxydisulfate[J]. Chemical Reviews, 1962,62(3):185-203.
[10] HORI H,MURAYAMA M,INOUE N. Efficient mineralization of hydroperfluoro carboxylic acids with persulfate in hot water[J]. Catalysis Today, 2010,151(1/2):131-136.
[11] LAN T K,CHU W,GRAHAM N J D. The aqueous degradation of butylated hydroxyanisole by UV/S20: study of reaction mechanisms via dimerization and mineralization[J]. Environmental Science& Technology, 2006,41(2):613-619.
[12] SALARI D,NIAEI A,ABER S. The photo oxidative destruction of C.I. basic yellow 2 using UV/S20; process in a rectangular continuous photo reactor[J]. Journal of Hazardous Materials, 2009,66(1):61-66.
[13] WHARTON M J,ATKINS B,B J M C A,et al. An X-ray absorption spectroscopy study of the coprecipitation of Tc and Re with mackinawite (FeS)[J]. Applied Geochemistry, 2000,15(3):347-354.
[14] WOLTHERS M,GAAST S J V D,RICKARD D. The structure of disordered mackinawite[J]. American Mineralogist, 2015,88(11/12):2007-2015.
[15] YUAN Y,TAO H,FAN J,et al. Degradation of p-chloroaniline by persulfate activated with ferrous sulfide ore particles[J]. Chemical Engineering Journal, 2015,268:38-46.
[17] LIANG C,LEE I L,HSU I Y,et al. Persulfate oxidation of trichloroethylene with and without iron activation in porous media[J]. Chemosphere, 2008,70(3):426-35.
[18] HUSSAIN I,ZHANG Y,HUANG S,et al. Degradation of p-chloroaniline by persulfate activated with zero-valent iron[J]. Chemical Engineering Journal, 2012,203(5):269-276.
[19] ROMERO A,SANTOS A,VICENTE F,et al. Diuron abatement using activated persulphate: effect of pH, Fe(Ⅱ) and oxidant dosage[J]. Chemical Engineering Journal, 2010,162(1):257-265.
[20] LIU L,YIN J,ZHAO Y X,et al. Effects of ferrous ions on nitrobenzene reduction in zero-valent iron system[C]∥The International Conference on Bioinformatics and Biomedical Engineering. IEEE, 2008:3356-3359.
[21] LI B,LI L,LIN K,et al. Removal of 1,1,1-trichloroethane from aqueous solution by a sono-activated persulfate process[J]. Ultrasonics Sonochemistry, 2013,20(3):855-63.
