胎儿心脏横纹肌瘤的产前超声诊断与系统化评估
2018-03-06欧阳云淑张一休武玺宁姜玉新戚庆炜赵大春
欧阳云淑,张一休,孟 华,武玺宁,姜玉新,戴 晴,戚庆炜,赵大春
中国医学科学院 北京协和医学院 北京协和医院 1超声诊断科 2妇产科 3病理科,北京100730
胎儿心脏肿瘤非常罕见,在先天性心脏畸形中占2.8%,其中绝大多数为良性肿瘤,以横纹肌瘤最为常见,占胎儿心脏肿瘤的60%[1]。临床上50%~60%的心脏横纹肌瘤与结节性硬化症(tuberous sclerosis,TSC)相关,是一种常染色体显性遗传的神经皮肤综合征,可累及心脏、颅脑、肾脏、皮肤等多个器官系统。在胎儿和婴儿期心脏横纹肌瘤可能是TSC的唯一表现[2],因此,产前发现心脏横纹肌瘤后,除了考虑肿瘤本身的占位效应和血流动力学改变,还需要进一步评估胎儿罹患TSC的风险。目前国内关于心脏横纹肌瘤的产前诊断集中于心脏肿瘤的超声诊断和TSC的基因检测[3- 4],本研究结合超声、MRI、遗传学分析及病理检查,全面总结了该类病例的心脏及其他系统的影像学表现,探讨了发病机制和相关鉴别诊断方法,以达到对该畸形的系统认识,使其在临床工作中可以早期检出并给予合理的产前咨询。
资料和方法
资料来源2006年8月至2017年1月在北京协和医院经超声诊断的4例胎儿心脏横纹肌瘤,回顾性分析其临床及病理资料。本研究获得北京协和医院伦理委员会批准,所有病例均豁免知情同意。
胎儿系统超声检查及其他影像学检查采用GE Voluson E8和E10彩色多普勒超声诊断仪(General Electric Kretztechnik,Zipf,Austria),二维凸阵探头频率为2~5 MHz,三维探头频率为4~8.5 MHz(RAB 4- 8 L)。根据孕妇末次月经时间及超声径线确定胎儿孕周。按照世界妇产科超声协会指南及《中国胎儿产前超声检查规范》[5]进行胎儿心脏检查,发现心脏肿瘤后,详细记录其数目、位置、大小、回声、与周围组织的关系、心律及血流动力学变化。同时对胎儿颅脑、脊柱、胸部、腹部、四肢等结构进行详细的超声检查和记录。若发现可疑心外病变,则行3T MRI检查进一步明确病变数目、位置和性质。
胎儿病理及遗传学检查向孕妇及家属解释遗传学和病理检查的必要性并签署知情同意书。
遗传学检查:抽取羊水或脐带血进行核型分析、单核苷酸多态性比较基因组杂交(SNP-array)或外显子测序,发现异常片段后,若条件许可抽取父母外周血行相关遗传学检查。
病理检查:终止妊娠后,胎儿标本以甲醛固定,观察各器官大体形态,发现病变后常规石蜡制片、HE染色,光镜观察异常组织的形态学特征。
结 果
一般情况产前诊断胎儿横纹肌瘤共4例,孕妇中位年龄29岁(25~33岁),中位孕周26.1周(20.0~32.2周)。1例孕妇临床诊断为结节性硬化症,曾生育过2个异常胎儿,1例为无脑儿;1例出生后20 d死于肾功能衰竭,未获得明确诊断。1例孕妇前次妊娠因胎儿主动脉瓣狭窄而引产。2例孕妇无异常产史和家族史。2例胎儿行遗传学检查。经产前咨询后全部4例孕妇均选择终止妊娠,其中3例行病理学检查(表1)。
胎儿系统超声及MRI检查结果4例胎儿在产前超声检查时均发现心腔内单发或多发的强回声实性占位,边界清晰,附着于室壁或室间隔。1例因肿瘤占据大部分心室腔而影响心室充盈和输出(图1),其余3例胎儿的心律及血流动力学均无明显改变。在2例胎儿中发现其他系统病变:1例为直径0.4 cm的左肾表面囊肿,MRI无其他异常发现;1例为脑实质内3个强回声结节,MRI显示脑实质及室管膜下6个T1高信号T2低信号结节(图2)。
遗传学检查结果4例胎儿中2例进行了遗传学检查。1例行羊水穿刺,核型分析及比较基因组杂交未发现明显异常,外显子测序显示TSC2 基因c.4662+1G>A剪切位点变异,父母外周血外显子测序无异常发现。1例行脐带血穿刺,核型分析未见明显异常。
病理检查结果3例胎儿的引产后标本经甲醛固定,沿血流方向打开各心腔,心室腔内见单发或多发黄白色肿物,边界清晰,无包膜(图3A)。HE染色后镜下观察,心脏肿瘤组织均由形态不规则的、肿胀的“蜘蛛样”细胞构成(图3B)。1例可见左肾皮质囊肿,镜下双肾见多发来自肾小管的囊肿。1例可见心包结节(图4A)和多发皮肤结节(图4B)。颅脑组织因自溶而无法显示内部结构。
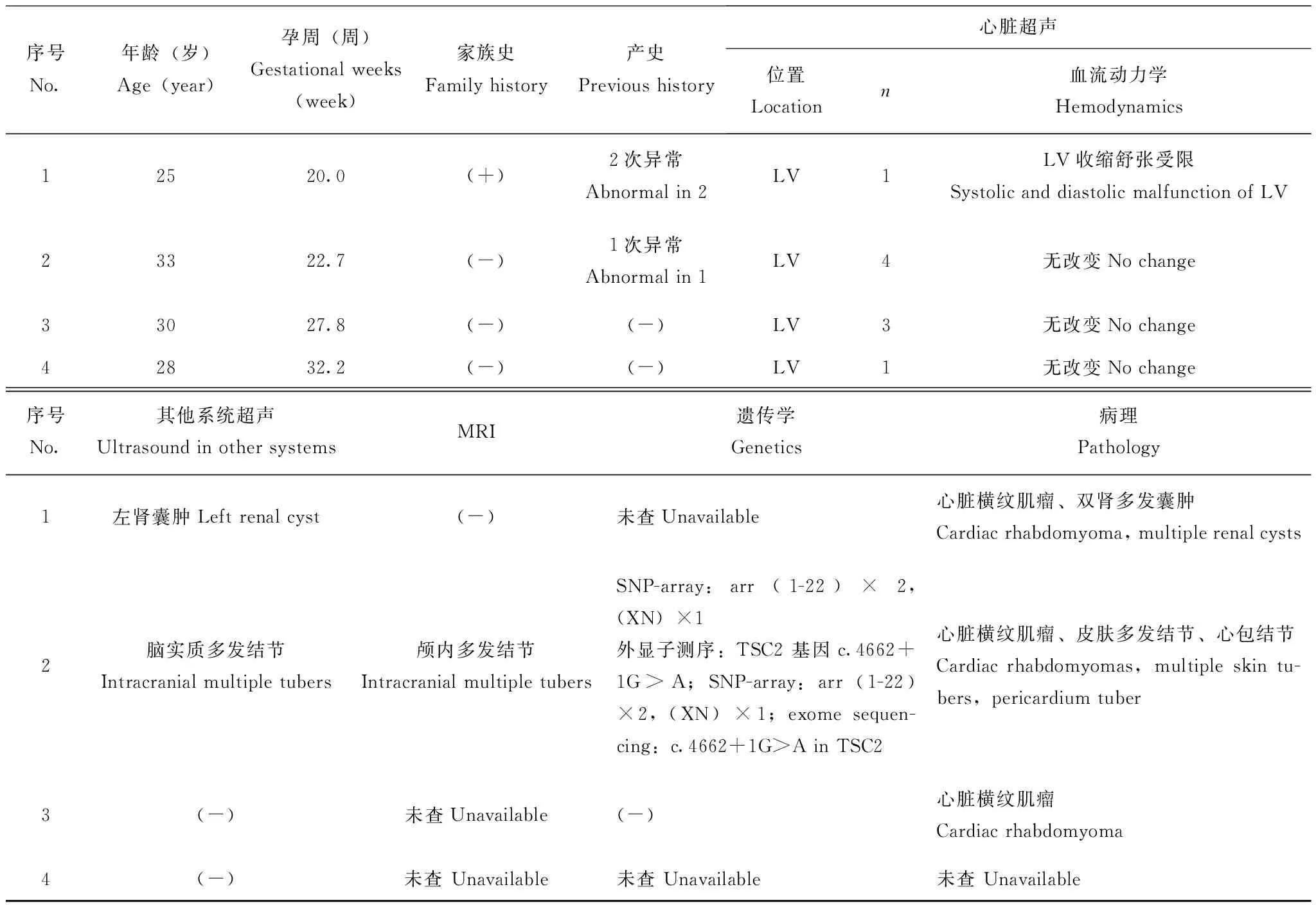
表 1 4例胎儿心脏横纹肌瘤的临床情况、影像学特征、遗传学及病理检查结果Table 1 Clinical presentations,imagings,genetics,and postmortem examinations of 4 cases of fetal rhabdomyoma
LV:左心室
LV:left ventricle

图1例1,左心室实性占位,附着于室间隔,大小2.77 cm×2.18 cm
Fig1Case 1,a solid echogenic mass of 2.77 cm×2.18 cm,which is situated in left ventricle and attached to the interventricular septum
讨 论
胎儿心脏横纹肌瘤具有特征性的超声表现,容易被产前超声检出。作为一种良性肿瘤,心脏横纹肌瘤在单独发生时预后相对良好。但是,由于该肿瘤与多器官系统受累的TSC密切相关,产前超声发现心脏横纹肌瘤的同时,必须对胎儿其他系统进行全面仔细地筛查,以准确评估胎儿罹患TSC的临床风险,在此基础上结合遗传学分析,尽可能实现TSC的早期诊断。
胎儿心脏横纹肌瘤通常在20周之后发现,超声上肿物呈边界清晰的高回声,位于心肌内或突向心腔生长,绝大多数位于心室腔内,少数位于心房、心外膜或瓣膜[6]。心脏横纹肌瘤可以单发或多发,多数没有明显占位效应,少数可导致心律失常、流入道或流出道梗阻、水肿、心力衰竭等,而在50%的病例中肿瘤也可自发消退[7]。因此,产前超声检出心脏横纹肌瘤后,需要仔细显示胎儿心脏各个切面,除了关注各个心腔是否有肿物外,还应特别注意心室壁与室间隔是否存在小的高回声占位,肿瘤体积较大或位于特殊部位如瓣膜时需要进一步评估胎儿心律和心功能。选择继续妊娠的应密切随诊观察肿瘤的数目和生长趋势,无明显症状者在出生后无需手术治疗。本研究中产前超声在全部4例胎儿的左心室内均发现占位,2例为单发,2例为多发。1例因肿瘤体积巨大影响左心室收缩舒张功能,其余无明显临床症状。病理检查除心室内肿瘤外,1例还发现了直径0.5 cm、厚0.1 cm的心包结节,超声上心包呈强回声,与横纹肌瘤回声接近,这可能是导致小的心包结节漏诊的主要原因。
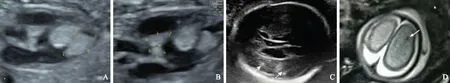
A. 左心室两个实性占位,分别附着于室间隔和游离壁;B. 左心室流出道两个实性占位;C. 脑实质多发强回声结节(箭头);D. MRI轴位T2加权成像显示顶叶T2低信号结节(箭头)
A. two solid masses in left ventricle,attached to the interventricular septum and the free wall respectively;B. two solid masses in the left outflow tract;C. multiple echogenic masses in the brain parenchyma(arrows);D. fetal MRI confirmed the presence of T2-hypointense lesions in the parietal lobe(arrow)
图2例2,超声发现心室内及颅内数个强回声占位,MRI显示脑实质多发结节
Fig2Case 2,ultrasound shows several intraventricular and intracranial echogenic masses,and the intracranial nodules are also detected by MRI
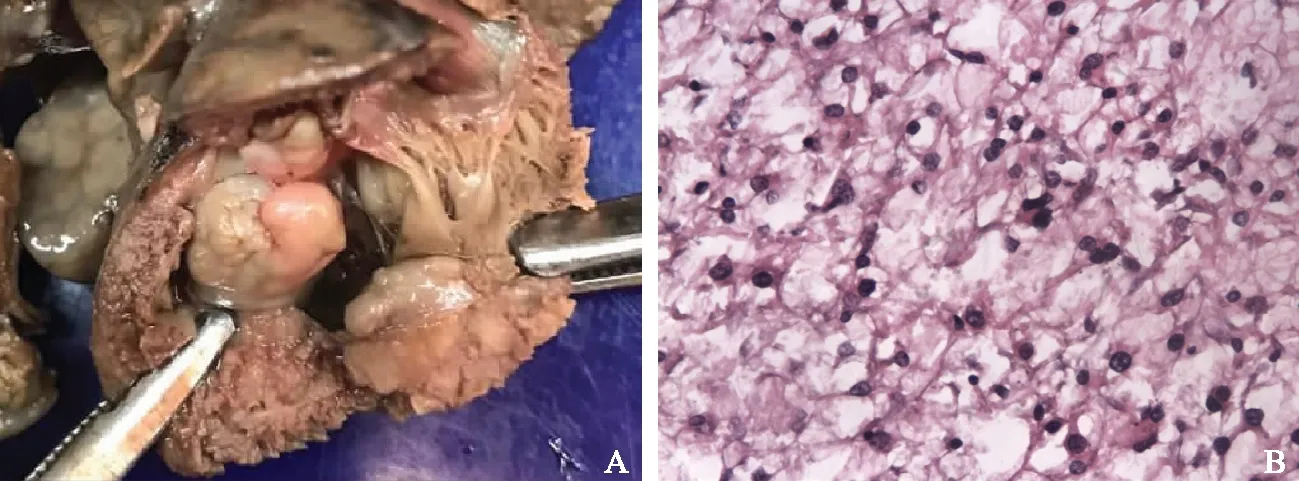
A.心室腔内黄白色肿物,边界清晰,无包膜;B.心脏肿瘤组织由形态不规则的、肿胀的“蜘蛛样”细胞构成(HE,×200)
A. postmortem examination showing multiple yellowish-white,circumscribed,and non-enveloped masses in the left ventricle;B. photomicrograph showing typical spider cells typical in the rhabdomyoma(HE,×200)
图3心脏横纹肌瘤病理表现
Fig3Pathology of cardiac rhabdomyomas
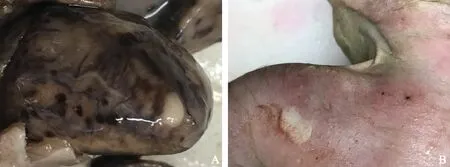
A.心包黄白色结节;B.肩部皮肤黄白色结节
A.a yellowish-white nodule in the pericardium;B.a yellowish-white nodule on the skin of left shoulder
图4尸检显示其他脏器受累的表现
Fig4Postmortem findings showing the involvement of other organs
心脏横纹肌瘤与TSC关系极为密切,60%~80%的TSC患者可合并心脏横纹肌瘤,而多发性心脏横纹肌瘤中50%~80%合并TSC[1],因此产前超声检查除关注心脏肿瘤外,还应进一步评估胎儿其他脏器是否存在TSC的表现。TSC是一种多器官系统受累的疾病,主要累及颅脑、皮肤、心脏、肾、肺、眼、面部和足趾。文献报道皮肤、肺、眼等病变多在儿童或青少年时期出现,而心脏、颅脑和肾脏病变在胎儿期即可出现,表现为心脏横纹肌瘤、室管膜下结节或巨细胞星形细胞瘤、肾脏错构瘤或囊肿[2,8- 9]。根据TSC的临床诊断标准[10],至少两个主要脏器受累即可诊断TSC,因此产前发现心脏横纹肌瘤后需要仔细扫查除外颅脑和肾脏受累。由于中晚孕期超声对于胎儿颅内近场结构的显示能力有限,我们建议在评估远场一侧脑实质后,等待胎儿体位改变使对侧脑实质位于远场,再仔细观察其内是否存在高回声结节。基于以上思路,我们在1例患儿体内发现了左肾直径0.4 cm的小囊肿,1例检出了脑实质多发结节,加上心脏横纹肌瘤,这两例早在20周和22周即作出TSC的临床诊断,国内文献尚无类似报道,充分表明产前超声系统筛查对于TSC具有重要价值。
绝大多数胎儿心脏横纹肌瘤合并TSC,其中30%~50%在胎儿期出现颅内表现。超声上TSC结节呈高回声,室管膜下结节难以和室管膜下出血相鉴别[11],小于5 mm的结节也很难与周围结构区分,位于近场时更容易漏诊。MRI上典型的TSC结节呈T1高信号T2低信号,容易与出血等病变鉴别,而且MRI扫查范围广泛,受胎儿体位影响较小,中晚孕期的快速扫查序列也容易为孕妇接受[12- 13]。多项研究还表明,胎儿期MRI与出生后MRI对于颅内病灶的检出能力相当,足以准确评估TSC胎儿的颅内情况[14]。我们对2例进行了胎儿MRI检查,1例无阳性发现,另1例中发现了6个颅内结节,而超声仅检出3个结节。因此,我们建议在发现心脏横纹肌瘤后,条件许可时应进行胎儿MRI检查,明确颅内病变的有无、大小、数目和位置,有助于发现超声不能检出的病灶,对于TSC的产前诊断具有重要价值。
TSC是一种常染色体显性遗传性疾病,相关基因为TSC1(9q34)和TSC2(16p13)。25%的TSC病例由TSC1突变引起,其中45%为新发突变;75%的TSC病例由TSC2突变引起,其中80%为新发突变。各种突变类型中,大片段缺失仅占10%,点突变占90%。由于TSC病例的新发突变率高,突变类型多样,多数病例的缺失片段较小,因此不能被传统的遗传学检查手段如核型分析检出。随着分子遗传学技术的进展,国内外已有多篇文献报道了TSC相关基因突变的产前诊断。刘晓伟等[3]应用目标区域捕获技术对TSC1/2基因外显子进行测序,在8例胎儿心脏横纹肌瘤中发现了1例TSC1基因突变和6例TSC2基因突变;Milunsky等[15]应用外显子测序和多种连接探针扩增技术,在18例胎儿心脏横纹肌瘤中检出1例TSC1基因突变和6例TSC2基因突变。本研究中1例应用核型分析及比较基因组杂交后没有检测到明显的片段异常,外显子测序显示TSC2基因的新发致病突变。1例虽未行遗传学检查,但孕妇有TSC的临床表现,胎儿除心脏横纹肌瘤外还有双肾多发囊肿,高度提示TSC2/PKD1邻近基因综合征[16]。常染色体显性遗传多囊肾的相关基因PKD1与TSC2在16号染色体上位置邻近,某些类型的突变如大片段缺失会同时累及两个基因,TSC2与PKD1的基因产物也具有功能上的联结,这是导致胎儿、儿童和成人TSC并发肾囊肿的可能原因[17- 19]。考虑到外显子测序价格昂贵且耗时耗力,国内临床尚未普遍应用,对于超声发现的胎儿心脏横纹肌瘤,目前主要依赖全面的家族史追查和系统的影像学检查以获得TSC的临床诊断。条件许可时也可行胎儿及其家系的基因芯片检查和外显子测序以深入了解遗传背景,对于临床不能诊断TSC的病例也可能获得更明确的产前基因诊断。
产前超声发现心脏横纹肌瘤后,首先需要对胎儿进行全面评估以明确TSC的相关风险,不仅应对胎儿其他系统进行仔细的超声检查,条件允许时还应通过MRI明确颅脑是否受累,在此基础上结合家族史追查和遗传学分析,尽可能实现TSC的临床诊断或基因诊断。对于产前不能诊断TSC的病例,需要向孕妇及家属说明横纹肌瘤与TSC的密切关系及目前产前诊断的局限性。若选择继续妊娠,应密切随诊观察肿瘤的数目和生长趋势,肿瘤体积较大或位于特殊部位时注意监测胎儿的心律和心功能,出生后也需要进行相关检查以除外TSC的诊断。单独发生的心脏横纹肌瘤预后良好,50%~60%的肿瘤在出生后逐渐缩小,18%的肿瘤可自行消失[6]。
综上,胎儿心脏横纹肌瘤具有特征性的超声表现,不合并其他异常时预后良好。系统的有针对性的产前超声检查结合MRI、家族史搜集和遗传学检查,有助于早期发现结节性硬化症的相关表现,对于产前诊断和预后评估具有重要价值。
[1] Isaacs H Jr. Fetal and neonatal cardiac tumors [J]. Pediatr Cardiol,2004,25(3):252- 273. DOI:10.1016/j.jpedsurg.2007.07.047.
[2] Smith HC,Watson GH,Patel RG,et al. Cardiac rhabdomyomata in tuberous sclerosis:their course and diagnostic value [J]. Arch Dis Child,1989,64(2):196- 200. DOI:10.1136/adc.64.2.196.
[3] 刘晓伟,谷孝艳,郝晓艳,等. 超声联合遗传学检查在胎儿心脏横纹肌瘤中的临床应用 [J]。中华妇产科杂志,2016,51(6):415- 419.DOI:10.3760/cma.j.issn.0529- 567x.2016.06.003.
[4] 谷孝艳,何怡华,韩玲,等. 胎儿心脏横纹肌瘤的超声诊断及基因学检测 [J]。中华围产医学杂志,2016,19(4):258- 262.DOI:10.3760/cma.j.issn.1007- 9408.2016.04.006.
[5] 欧阳云淑,李辉,孙锟. 胎儿心脏超声检查 [M]//姜玉新. 中国胎儿产前超声检查规范. 北京:人民卫生出版社. 2016:36- 53.
[6] Sciacca P,Giacchi V,Mattia C,et al. Rhabdomyomas and tuberous sclerosis complex:our experience in 33 cases[J]. BMC Cardiovasc Disord,2014,14:66- 76. DOI:10.1186/1471- 2261- 14- 66.
[7] Myers KA,Wong KK,Tipple M,et al. Benign cardiac tumours,malignant arrhythmias [J]. Can J Cardiol,2010,26(2):58- 61.DOI:10.1016/S0828- 282X(10)70009-X.
[8] Colosi E,Russo C,Macaluso G,et al. Sonographic diagnosis of fetal cardiac rhabdomyomas and cerebral tubers:a case report of prenatal tuberous sclerosis [J]. J Prenat Med,2013,7(4):51- 55.
[9] Tyagi V,Bornstein E,Schacht R,et al. Fetal and postnatal magnetic resonance imaging of unilateral cystic renal dysplasia in a neonate with tuberous sclerosis[J]. Pediatr Neonatol,2016,57(5):440- 443. DOI:10.1016/j.pedneo.2013.10.014.
[10] Roach ES,Gomez MR,Northrup H. Tuberous sclerosis complex consensus conference:revised clinical diagnostic criteria [J]. J Child Neurol,1998,13(12):624- 628. DOI:10.1177/088307389801301206.
[11] Levine D,Barnes P,Korf B,et al. Tuberous sclerosis in the fetus:Second-trimester diagnosis of subependymal tubers with ultrafast MR imaging [J]. AJR Am J Roentgenol,2000,175(4):1067- 1069. DOI:10.2214/ajr.175.4.1751067.
[12] Mailath-Pokorny M,Kasprian G,Mitter C,et al. Magnetic resonance methods in fetal neurology [J]. Semin Fetal Neonatal Med,2012,17(5):278- 284.DOI:10.1016/j.siny.2012.06.002.
[13] Chen CP,Liu YP,Huang JK,et al. Contribution of ultrafast magnetic resonance imaging in prenatal diagnosis of sonographically undetected cerebral tuberous sclerosis associated with cardiac rhabdomyomas [J]. Prenat Diagn,2005,25(6):523- 524. DOI:10.1002/pd.118.
[14] Goel R,Aggarwal N,Lemmon ME,et al. Fetal and maternal manifestations of tuberous sclerosis complex:Value of fetal MRI [J]. Neuroradiol J,2016,29(1):57- 60. DOI:10.1177/1971400915621323.
[15] Milunsky A,Ito M,Maher TA,et al. Prenatal molecular diagnosis of tuberous sclerosis complex [J]. Am J Obstet Gynecol,2009,200(3):321.e1-e6. DOI:10.1016/j.ajog.2008.11.004.
[16] Brook-Carter PT,Peral B,Ward CJ,et al. Deletion of the TSC2 and PKD1 genes associated with severe infantile polycystic kidney disease:a contiguous gene syndrome [J]. Nat Genet,1994,8(4):328- 332. DOI:10.1038/ng1294- 328.
[17] Longa L,Scolari F,Brusco A,et al. A large TSC2 and PKD1 gene deletion isassociated with renal and extrarenal signs of autosomaldominant polycystic kidney disease [J]. Nephrol Dial Transplant,1997,12(9):1900- 1907.
[18] Tyagi V,Bornstein E,Schacht R,et al. Fetal and postnatal magnetic resonance imaging of unilateral cystic renal dysplasia in a neonate with tuberous sclerosis [J]. 2016,57(5):440- 443. DOI:10.1016/j.pedneo.2013.10.014.
[19] Weber MA,Risdon RA,Malone M,et al. Isolated unilateral tuberous sclerosis-associated renal cystic disease in a neonate [J]. Fetal Pediatr Pathol,2005,24(4- 5):267- 275. DOI:10.1080/15227950500405700.
