犀角地黄汤对免疫性血小板减少症模型大鼠外周血CD4+CD25+调节性T细胞及Th17细胞的影响
2018-03-05江劲波陈新宇
王 跃,江劲波,聂 甜,付 玲,胡 辉,陈新宇
(湖南中医药大学第一附属医院,湖南 长沙 410007)
免疫性血小板减少症(ITP)是临床常见的获得性自身免疫性出血疾病,主要表现为血小板计数减少,并伴有皮肤黏膜出血、内脏出血、女性患者月经过多等,对患者生命质量造成严重影响。目前,临床常用于治疗ITP的西医类药物包括单克隆抗体、激素、免疫抑制剂、血小板生成刺激素等,但存在价格昂贵、不良反应多等缺点[1]。而中医辨证治疗ITP有一定优势,不但能够有效改善临床症状,且具有不良反应少、疗效稳定的特点,近年来日益受到重视[2]。犀角地黄汤出自《备急千金要方》,具有清心凉血、清热止血、增强免疫功能的功效[3],在临床上得到广泛应用。本研究观察了犀角地黄汤对ITP模型大鼠外周血中CD4+CD25+调节性T细胞(Treg)及Th17细胞的影响,旨在探讨犀角地黄汤治疗ITP的可能机制,为其临床应用提供一定依据。
1 实验资料
1.1实验动物 SD大鼠50只,SPF级,雄性,体质量(200±20)g,购自河南省动物实验中心,许可证号:SCXK(豫) 2013-0001,所有大鼠购回后均在清洁级动物饲养室IVC笼子中进行3 d适应性喂养,期间自由饮水摄食,室内温度20~25 ℃,湿度50%~60%。新西兰兔5只,购自南昌龙平兔业有限公司,许可证号:SCXK(赣)2013-001。
1.2实验药物 犀角地黄汤中的犀牛角用水牛角代替,水牛角45 g、丹皮9 g、生地黄30 g、白芍12 g。药材购自同仁堂大药店,所用药物先浸泡在冷水中30 min,其中水牛角需先煎煮30 min,再将其他几种药材放入,继续煎煮60 min,制成1 g/mL的浓缩水煎剂,放置于冰箱中。醋酸泼尼松片购自浙江仙居制药股份有限公司,国药准字H33021207,规格:5 mg/片。
1.3兔抗大鼠血小板血清制备 参照文献[4]中方法,采用戊巴比妥钠对SD大鼠进行麻醉,取大鼠腹主动脉血,放入EDTA抗凝管中,800 g离心15 min分离血浆,再将上清3 000 r/min 离心10 min沉淀血小板,用PBS缓冲液洗涤血小板3次后调整其浓度为1×109L-1,与等体积的完全弗氏佐剂充分混合制成佐剂抗原,并在新西兰兔的背部、后肢足垫处进行多点皮下注射,首次注射后于1,2,4周分别重复上述步骤,进行多次加强免疫,末次注射后3 d取新西兰兔的心脏血,37 ℃孵育箱中放置15 min,2 500 r/min离心10 min获取富含兔抗大鼠的血小板血清(APS),存放于-80 ℃冰箱中。
1.4动物分组、造模及干预 将48只SD大鼠随机分为正常组,模型组,泼尼松组,犀角地黄汤低、中、高剂量组,每组8只。除正常组外,其余组均进行造模:于实验第1,2,3天连续以1∶4稀释的APS(0.7 mL/200 g)进行腹腔注射,此后间隔1 d注射1次,共注射11次。APS每次从-80 ℃取出后需流水融化,56 ℃水浴30 min以灭活补体。正常组大鼠在同一时间点腹腔注射相同体积的生理盐水(0.7 mL/200 g)。于造模开始后第7天,正常组和模型组每天灌胃蒸馏水;醋酸泼尼松组每天灌胃醋酸泼尼松混悬液(先将片剂研磨碎后采用蒸馏水配制成混悬液,每次给药前充分混匀)5.4 mg/kg;犀角地黄汤各剂量组每天灌胃犀角地黄汤,给药剂量参照文献[4]按照体表面积公式与人的等效剂量进行换算(200 g大鼠的剂量=70 kg人的给药剂量×0.018),低、中、高剂量组给药剂量为0.012 5 g/kg、0.025 g/kg、0.05 g/kg,待给药时分别采用无菌蒸馏水稀释为1.25 mg/mL、2.5 mg/mL、5.0 mg/mL。各组灌胃剂量均为10 mL/kg,每天1次,连续14 d。
1.5观察指标 ①大鼠一般情况:观察实验过程中各组大鼠精神、活动状态及毛发、饮食等情况。②外周血血小板检测:分别于造模前、灌胃前、灌胃结束后尾静脉取血0.5 mL,采用日本东亚Sysmex公司生产的XT-1800i型全自动血细胞计数仪检测血小板计数。③Th17、Treg细胞检测:末次灌胃后采用10%水合氯醛(10 mL/kg)腹腔麻醉大鼠,采集腹主动脉血,加入EDTA抗凝管中,采用Ficoll分层法分离血中单核细胞,并调整细胞浓度为1×106mL-1,加入PMA、离子霉素、莫能霉素工作液(美国Biochemicals公司)吹打混匀后37 ℃孵育4 h,加入FITC标记的CD4抗体(美国BD Bioscience公司),于4 ℃避光放置,孵育30 min,采用4%多聚甲醛室温固定细胞15 min后,加入膜裂解剂室温孵育15 min,加入FITC标记的IL-17A(美国BD Bioscience公司)和PE标记的Foxp3(美国BD Bioscience公司),于4 ℃继续避光孵育30 min,采用美国Beckman公司生产的CytomicsTM FC500流式细胞仪对细胞信号进行采集,并通过配套软件CXP 2.2计算Th17/Treg的比率。④外周血单个核细胞中Foxp3mRNA测定:取大鼠末次灌胃后腹主动脉抗凝血1 mL与生理盐水1 mL及淋巴细胞分离液2 mL混合后400 g离心20 min,取第2层细胞即为淋巴细胞,采用Trizol法提取淋巴细胞中的总RNA,采用Reverse Transcription Kit(日本Takara公司)将RNA逆转录为cDNA,使用SYBR PrimeScript RT-PCR Kit(日本TaKaRa公司)进行实时荧光定量PCR(qRT-PCR)分析,反应体系:2×SYBRR Premix 12.5 μL,上下游引物各0.5 μL(10 μmol/L),cDNA模板2 μL,ddH2O 9.5 μL,采用7500系统(美国ABI公司)进行PCR扩增:95 ℃预变性30 s,95 ℃ 5 s、60 ℃ 30 s共40个循环,以β-action作为内参,采用2-ΔΔCT法计算Foxp3mRNA相对表达量。引物序列:Foxp3正向为5’-CTCGCCCAGATATACGAATGG-3’,反向为5’-GCCGAGCTGTTGCTGTCA-3’;β-action正向为5’-GTCAGGTCATCACTATCGGCA-3’,反向为5’-AGAGGTCTTTACGGATGTCAA-3’。⑤血清中IL-17、IL-35水平测定:取大鼠末次灌胃后腹主动脉血3 mL,800 g离心10 min,取上清,采用酶联免疫吸附实验(ELISA)检测血清IL-17、IL-35水平,检测试剂盒购自武汉博士德生物工程有限公司,全波长Multiskan FC型酶标仪购自美国Thermo Scientific公司,所有操作均按照说明书进行。
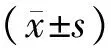
2 结 果
2.1各组大鼠一般状况 正常组大鼠饮食、活动、呼吸均正常,精神状态良好;其他组大鼠在连续3 d造模后活动力明显下降,呼吸加快,皮毛欠光泽,食欲下降,各给药组大鼠给药后整体状况均较模型组明显改善。
2.2各组大鼠血小板数目比较 造模前,各组大鼠血小板计数比较差异均无统计学意义(P均>0.05);灌胃前,各造模组大鼠血小板计数均明显低于正常组(P均<0.05);灌胃结束后,各给药组大鼠血小板计数均明显低于正常组但明显高于模型组(P均<0.05),但犀角地黄汤低、中剂量组明显低于犀角地黄汤高剂量组和醋酸泼尼松组(P均<0.05),犀角地黄汤高剂量组和醋酸泼尼松组比较差异无统计学意义(P>0.05)。见表1。
2.3各组大鼠外周血Th17、Treg细胞所占比例比较 模型组大鼠外周血中Th17细胞所占比例和Th17/Treg细胞比率明显高于正常组(P均<0.05),Treg细胞所占比例明显低于正常组(P<0.05);各给药组外周血中Th17细胞所占比例和Th17/Treg细胞比率均明显低于模型组(P均<0.05),Treg细胞所占比例明显高于模型组(P均<0.05);犀角地黄汤低、中剂量组外周血中Th17细胞所占比例和Th17/Treg细胞比率均明显高于犀角地黄汤高剂量组和醋酸泼尼松组(P均<0.05),Treg细胞所占比例明显低于犀角地黄汤高剂量组和醋酸泼尼松组(P均<0.05),犀角地黄汤高剂量组和醋酸泼尼松组各指标比较差异均无统计学意义(P均>0.05)。见表2及图1。

表1 各组大鼠血小板数目比较
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05;③与醋酸泼尼松组比较,P<0.05。
2.4各组大鼠外周血单个核细胞中Foxp3 mRNA表达水平比较 正常组、模型组、醋酸泼尼松组及犀角地黄汤低、中、高剂量组大鼠外周血单个核细胞中Foxp3 mRNA表达水平分别为0.85±0.05,0.23±0.01,0.58±0.03,0.50±0.02,0.56±0.02,0.69±0.03,模型组Foxp3 mRNA表达水平明显低于正常组(P<0.05),各给药组Foxp3 mRNA表达水平均明显高于模型组(P均<0.05),但犀角地黄汤低、中剂量组明显低于犀角地黄汤高剂量组和醋酸泼尼松组(P均<0.05),犀角地黄汤高剂量组和醋酸泼尼松组比较差异无统计学意义(P>0.05)。

表2 各组大鼠外周血Th17、Treg细胞比较
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05;③与醋酸泼尼松组比较,P<0.05。

图1 各组大鼠Th17/Treg细胞流式图
2.5各组大鼠血清IL-17、IL-35水平比较 模型组大鼠血清IL-17水平明显高于正常组(P<0.05),IL-35水平明显低于正常组(P<0.05);各给药组大鼠血清IL-17水平明显低于模型组(P均<0.05),IL-35水平明显高于模型组(P均<0.05);犀角地黄汤低、中剂量组血清IL-17水平均明显高于犀角地黄汤高剂量组和醋酸泼尼松组(P均<0.05),IL-35水平明显低于犀角地黄汤高剂量组和醋酸泼尼松组(P均<0.05),犀角地黄汤高剂量组和醋酸泼尼松组比较差异均无统计学意义(P均>0.05)。见表3。
3 讨 论
ITP约占出血性疾病的1/3,在各个年龄段均可发病,其中儿童的发病率相对较高[5]。近年来研究表明,T淋巴细胞亚群比例异常、功能紊乱及相关细胞因子分泌异常在ITP的发生发展中发挥着重要作用,但其具体致病机制并未阐明[6]。Treg细胞的表型为CD4+CD25+,是具有免疫抑制功能的T淋巴细胞;Foxp3是在Treg细胞核中特异性表达的细胞因子,主要发挥免疫抑制活性,其在多种免疫系统疾病中存在表达降低的现象;IL-35是目前发现的由Treg细胞分泌的唯一一个细胞因子,能够上调IFN-γ的表达,限制机体过度免疫应答[7-8]。Th17细胞是除Th1、Th2外的第三类效应T细胞,能够高水平分泌IL-17,活化NF-κB相关通路,激活下游因子,触发炎症反应,在风湿性关节炎、变态反应等多种炎性疾病中发挥重要作用[9]。相关研究表明Treg细胞和Th17细胞的比例失衡与哮喘、风湿性关节炎、系统性红斑狼疮等多种疾病的发生具有密切关联[10-11],但目前国内有关其与ITP相关性研究较少。本研究观察到,模型组大鼠淋巴细胞中Treg细胞所占比例明显下降,Th17细胞所占比例和Th17/Treg比率明显升高, Foxp3 mRNA表达显著降低,且相关细胞因子IL-17、IL-35水平均出现分泌异常,与高勇等[12]研究结果一致,证实Th17/Treg比例失衡可能是ITP的致病机制之一,调节Th17/Treg失衡可作为ITP治疗的新靶点。
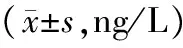
表3 各组大鼠血清细胞因子IL-17、IL-35水平比较
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05;③与醋酸泼尼松组比较,P<0.05。
目前西医采用的醋酸泼尼松片能够减少抗血小板抗体的分泌,减轻对血小板的破坏;单抗CD20能够清除产抗血小板抗体的B淋巴细胞;免疫抑制剂能够抵抗T细胞对血小板的破坏;但以上药物治疗均无法从根本上逆转免疫系统紊乱,病情易出现反复,目前尚无理想防治药物[5,13]。
祖国医学认为ITP属“紫斑”“血证”“衄血”等范畴,病机为阴虚火旺、血热妄行、气不摄血等[14],其中血热妄行是主要病机,治宜清热解毒、凉血止血。犀角地黄汤方中犀角清心解毒止血;地黄滋阴生津,可辅助犀角凉血止血;芍药、丹皮清热凉血、活血散瘀。既往临床研究报道显示,犀角地黄汤用于治疗小儿过敏性紫癜[15]、银屑病[16]、系统性红斑狼疮[17]等中医辨证为血热患者具有良好疗效。本研究结果显示,犀角地黄汤各组大鼠血小板数目较模型组明显升高,大鼠整体活力、毛皮光泽及摄食状况均好于模型组,且外周血淋巴细胞中Treg所占比例、Foxp3 mRNA相对表达量及IL-35水平均明显上升,而Th17细胞所占比例及IL-17水平均明显下降,并具有剂量依赖性。提示犀角地黄汤对ITP具有一定治疗作用,改善淋巴细胞中Th17/Treg的比例失衡可能是其作用靶点之一。
综上所述,犀角地黄汤可能通过上调ITP大鼠外周血中Treg细胞表达,下调Th17细胞表达,维持Treg/Th17平衡,进而调节相关细胞因子IL-17、IL-35的表达而减少血小板过度破坏,但其具体调控机制有待进一步深入研究。
[1] Abadi U,Yarchovskydolberg O,Ellis MH.Immune thrombocytopenia:recent progress in pathophysiology and treatment[J].Clin Appl Thromb Hemost,2015,21(5):397-404
[2] 王伟涛,吴深涛,刘宝山.免疫性血小板减少症的中医病因病机浅析[J].中医药学报,2016,44(2):8-9
[3] 栾大丽,马桐生.犀角地黄汤治疗小儿过敏性紫癜临床研究[J].河南中医,2016,36(4):653-655
[4] 夏乐敏, 崔乐乐, 姜一陵,等.犀角地黄汤通过线粒体途径抑制免疫性骨髓衰竭血小板凋亡的实验研究[J].江苏中医药,2017,49(4):74-77
[5] 吴冰,韦艳,张茜.免疫性血小板减少症治疗进展[J].中国实验血液学杂志,2015,23(4):1212-1215
[6] 翟菊萍,何杨,杨炳华.免疫失耐受在ITP自身抗体产生机制中的研究进展[J].中华微生物学和免疫学杂志,2016,36(10):790-794
[7] 孟亚红,孙丽华.CD4+CD25+调节性T细胞在ITP患者中的表达及与临床预后的相关性[J].浙江临床医学,2017,19(3):446-448
[8] 赵海丰,张翼鷟.CD4+CD25+调节性T细胞在免疫性血小板减少症发病中的研究进展[J].天津医药,2014,42(4):390-392
[9] Yu S,Liu C,Li L,et al.Inactivation of Notch signaling reverses the Th17/Treg imbalance in cells from patients with immune thrombocytopenia[J].Lab Invest,2015,95(2):157-167
[10] Talaat RM,Mohamed SF,Bassyouni IH,et al.Th1/Th2/Th17/Treg cytokine imbalance in systemic lupus erythematosus (SLE) patients: Correlation with disease activity[J].Cytokine,2015,72(2):146-153
[11] 贾瑞环,牛红青,李小峰.类风湿关节炎患者外周血及关节液中Treg细胞和Th17细胞水平的研究进展[J/CD].中华临床医师杂志:电子版,2016,10(24):3823-3826
[12] 高勇,宋月,韩姝坤,等.Th19、Th17、CD4+CD25+Foxp3+调节性T细胞亚群在成人原发免疫性血小板减少症发病中的意义[J].中华微生物学和免疫学杂志,2016,36(7):500-505
[13] Curtis BR.Recent progress in understanding the pathogenesis of fetal and neonatal alloimmune thrombocytopenia[J].Br J Haematol,2016,171(5):671-682
[14] 沈静涵,周韶虹.原发免疫性血小板减少症的中医药治疗进展[J].天津药学,2015,27(6):68-69
[15] 张晓蒙,李琳琳.犀角地黄汤联合匹多莫德治疗儿童过敏性紫癜效果及对免疫功能的影响[J].现代中西医结合杂志,2016,25(35):3906-3908
[16] 刘爱民,崔利莎,张步鑫,等.麻防犀角地黄汤与犀角地黄汤治疗冬季血热型银屑病的疗效观察[J].中国皮肤性病学杂志,2016,30(6):629-630
[17] 王洪彬,崔建美,赵舒,等.基于数据挖掘的中药防治系统性红斑狼疮组方规律研究[J].中国中医基础医学杂志,2016,22(7):970-972
