药物临床试验受试者知情同意的影响因素调查及分析*
2018-03-05陈晓云尤圣富
张 跃,陈晓云,尤圣富
(1上海中医药大学设备与房产管理处,上海 200032,zyuer0815@126.com;2上海中医药大学附属龙华医院伦理委员会,上海 200032)
1 研究背景
知情同意被定义为一个过程,个人通过这个过程在了解了决定参与试验所需的所有相关信息之后,自愿表达其参加该项实验的意愿。知情同意主要由书面的、签有姓名和日期的知情同意书进行证明。
受试者的知情同意是指在获取并记录知情同意时,研究者必须遵守相关法规的要求,按照GCP《药物临床试验管理规范》及运用《赫尔辛基宣言》的伦理原则去做。
我国知情同意在20世纪80年代中后期随着国外众多的医学人文理念一同被传入国内,当时国内的知情同意通常只是以理论的形式出现在一些译著、杂志或学术会议上。1999年,知情同意的理念被纳入《中华人民共和国执业医师法》;2002年,在国务院颁布的《医疗事故处理条例》及其配套法规中明确提出了“知情同意”。而由于国内外文化等各种因素的差异,如今国内医生以及研究者对于知情同意过程的认知以及真正实施存在很大的个体差异,在患者转变为受试者的过程中,有部分研究者会将受试者的权利一笔带过,不向受试者详细解释,这对受试者的利益有很大的损害,造成严重不良事件需要补偿和赔偿时难以有据可循。而在国外,已经有研究者发现了这样的问题,所以有许多与药物临床试验受试者的知情同意相关的调查研究报道[1-8]。而在国内,虽有研究者对于参加药物临床试验的受试者的知情同意权益发表过相关论述性文章[9-13],但很少有客观的大样本平行对照研究分析我国受试者的知情同意现状。本研究为医院伦理委员会年度质量改进项目中对研究项目进行的一次抽查调研工作总结,旨在对受试者的知情同意书内容的了解及自身权利的认知程度进行的调查,而问卷调查法特别适用于对目标人群的态度、习惯、观点和人口学信息进行调查。
1.1 研究对象
上海市某三甲医院2015年6月近一年内结题项目(受试者出组6~18个月的18~70岁、拥有自我判断能力的受试者), 分为慢性病组和急性病组。慢性病组(痛风非急性期药物Ⅲ期临床试验)总样本量为100例,急性病组(上呼吸道感染和下尿路感染急性期药物Ⅲ期临床试验)总样本量为178例。
1.2 调查方法
问卷调查采用电话访谈的形式。由于临床研究的受试者为特定人群,研究者限于外部条件因素(研究对象人群分布较广,且请受试者现场填写问卷会造成很大的不便,故不能由受试者亲自填写),选用电话访谈的形式进行调查,通过研究者(笔者做质量改进项目时均为医院伦理委员会工作人员,如委员或实习秘书,均在本中心签署过保密协议。)详细讲述调查目的,获得受试者的口头知情同意后,由特定的受过伦理培训的研究者代为填写问卷。
1.3 资料提取
参与的研究者签署保密协议后,通过医院档案室存档的受试者知情同意书及病例报告表统计参加药物临床试验的受试者的人口学资料(试用药物编号、姓名、性别、参加试验年龄、身高、体重、民族、住址所在区县、婚姻状况等),并剔除资料不完整或确认无法联系的不完整病例,获得所有符合纳入标准的原始资料后,对原始资料中受试者信息进行去标识化处理,保护受试者的隐私。
受试者的资料按录入顺序以“1~N”编号,然后按照年龄从小到大排序后进行系统抽样,依次以5人/间隔、3人/间隔、2人/间隔为标准抽样对受试者进行电话访谈,若受试者失联则以此抽样方式另外增加一例新样本。
完成访谈的问卷通过Excel表格录入为电子版,对所有完成电话回访的受试者按照录入数据再次进行编号,受试者接受知情同意的时间按照访谈结果分为三类(1为≤15分钟,2为≤2小时,3为>2小时),最终获得急性病组和慢性病组两组受试者知情同意调查表。另外,对问卷中涉及受试者对知情同意书的了解情况的问题按照知晓计1分,不知道计0分进行加权以做后续分析。
1.4 统计学分析
将匿名化处理后的问卷整理结果由专人进行统计分析,由于数据均为分类变量,不存在等级差别,采用卡方检验。年龄等计量资料采用t检验,受试者签署知情同意书的时间采用等级资料秩和检验。
2 问卷调查结果及比较
依照本项调查的资料提取方法抽取的所有受试者中存在失联率较高的情况发生。急性病组失访61例,拒绝访谈4例,完成问卷31例;慢性病组失访17例,拒绝访谈1例,完成问卷38例。
2.1 急性病组与慢性病组基本情况比较
2.1.1 受试者一般情况的比较。
急性病组试验受试者的基本情况为:男性72人,女性115人;年龄范围为19~69岁,平均年龄为41.86岁;所有受试者均为汉族。其中接受回访的受试者为31人,男性8人,女性23人;28人已婚,3人未婚。
慢性病组试验受试者的基本情况为:男性99人,女性1人;年龄范围为19~69岁,平均年龄为45.42岁;所有受试者均为汉族其中接受回访的受试者为38人,均为男性;33人已婚,5人未婚。
2.1.2 人群分布特征分析。
急慢性病组的受试者居住地在分布区县上存在明显统计学差异,从总的分布而言,急性病组的受试者的居住地所在区县与试验中心的距离相对慢性病组的受试者更近,甚至有较大比例的受试者就是居住在试验中心附近的。而慢性病组则相对来说有更大比例的受试者居住在郊县及外省市(崇明、浙江、江苏)的情况。见表1。

表1 两组受试者所在区县分布统计表
注:**表示P<0.05
2.1.3 试验信息的知晓程度比较。
急慢性组的受试者中,大多数的受试者在试验结束后一段时间会记得自己曾参加过药物临床试验,但是仍有一定比例的受试者在经过研究者的提醒之后,仍然表示已经完全忘记参与试验的情况,但听闻是医院电话访谈相关信息,配合了访谈,研究者将这部分受试者仍纳入人口学资料中。见表2。

表2 两组受试者对所参与试验的知晓比较[n(%)]
2.1.4 受试者对知情同意书的认知程度比较。
两组参加访谈的受试者对自身权利的了解情况不存在统计学差异,两组受试者对于参与试验所用药物为现今国内未上市的试验药物的知晓程度较高(89.7%);受试者大多认为自己服用的药物为治疗组,且有一定比例(36.2%)的受试者并不知道自己可能会服用对照组的药物或安慰剂;较大比例(41.4%)的受试者对于自己所服用的试验药物可能产生未知的副反应并不知情,但不排除医生为了避免不必要的纠缠而选择了不告知受试者;大多数的受试者(69.4%)知道自己有权利可以随时无理由退出药物临床试验。见表3。

表3 两组受试者对于知情同意书的了解情况[n(%)]
2.1.5 家属知晓受试者参与试验情况。
受试者在完成问卷的过程中有3例受试者存在对于问题“对于家属是否知晓自身参与药物临床试验”有抗拒情绪而拒绝回答,另有5例受试者则是由于对试验已完全遗忘故无法回答该问题。表4中急性病组缺失7例病例为两种情况均有存在,慢性病组缺失的1例为遗忘的缘故,故急慢性病组的家属知晓情况只有24例和37例。结果详见表4。
表4 家属知晓受试者参与药物临床试验的情况[n(%)]

组别知道不知道合计急性病组17(70.8%)7(29.2%)24(39.3%)慢性病组32(86.5%)5(13.5%)37(60.7%)合计491261
两组受试者家属是否知晓受试者参与试验的情况不存在统计学差异。大多数受试者会将自己参与药物临床试验的情况告知家属,但也有小部分受试者选择不向家属透露。
2.1.6 受试者的知情同意书从阅读到签署的时间比较。
有受试者中能够记得自己知情同意时间的仅54名,急性病组22例,慢性病组32例;其他受试者表示因试验完成时间较长,无法记起具体时间。
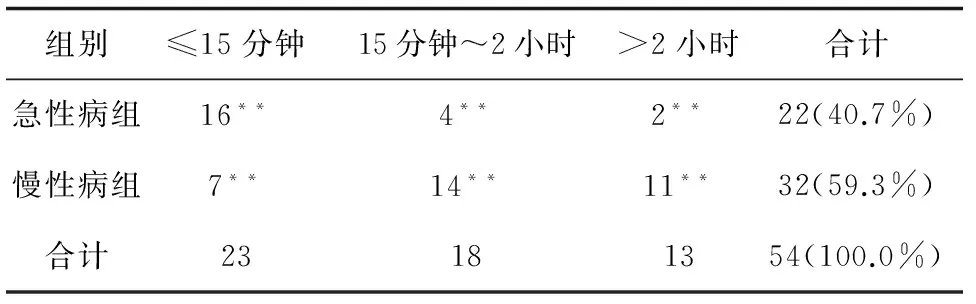
表5 从阅读到签署知情同意书的时间等级资料
注:**表示P<0.05
对表3各数据按知道为1分,不知道为0分,进行加权统计后,得下表:

表6 对表3各数据进行加权统计后的结果
两组受试者在从阅读知情同意书到签字同意参与研究的时间的等级分层上存在统计学差异,慢性病组的受试者平均完成知情同意过程的时间相比急性病组患者更长。即在完成临床试验后一段时间,慢性病组的研究者对于患者的知情同意告知更为充分,同时受试者也更容易记住自己参与的试验的相关资料,而急性病组的研究者则在此方面做的可能相对不够充分。按照受试者对于知情同意书了解情况的问题进行加权统计后发现,对于各组别时间段的受试者,知情同意过程时间的长短在各组别之前不存在统计学差异。也就是说,受试者对于自身参与的药物临床试验的了解程度及自身利益与知情同意过程时间的长短没有必然的关系。
2.2 国内外知情同意情况比较
在西方医学伦理学的发展史中,知情同意已列入医生的自我修养中,承载了医德的一部分,是医生对患者尊重的体现。真正意义上涉及知情同意的首次案例记载(1767年英国的Slater案)至今,国外对于知情同意的研究也在逐步深入,不同于我国短短十几年的知情同意的本土化融合和发展过程,他们在知情同意方面的研究远比我国更深入且更全面。因此,笔者整理了医学科研发达国家的知情同意研究现状,并结合本研究,在我国在急慢性疾病临床试验中知情同意的完成情况与受试者权利的知晓程度的研究基础上,借鉴比较国内外的利弊,做以下分析。
2.2.1 国外关于药物临床试验的受试者的知情同意的相关研究较为丰富。
经查相关文献得出:White CS[1]等人通过对50名接受肺皮活检的患者进行召回测试发现通过知情同意书告知受试者风险远比让医生和受试者背诵风险来的有效的多;Lynoe N[2]等通过对43位接受回访的受试者(共53位)进行知情同意情况的调查得知:尽管所有接受回访的受试者都知道自己参加了药物临床试验,但他们并不了解知情同意书中的许多信息,且经过分析受试者对于知情同意的认知缺陷可能是由于研究者的告知问题而非受试者本身理解能力等因素;Joffe S[3]等人对癌症药物临床试验的受试者进行的回访研究,发现受试者对癌症临床试验的误解之频繁,并得出了研究者之所以会造成一些误解的原因,由此可见即使在发达国家,受试者虽然签署了知情同意书,对于临床试验的认知也可能受到诸多因素的影响,受试者经常难以正确认识自己所参加的是临床试验,而非标准治疗;Molyneux CS[4]等人对低收入弱势群体的研究中,发现受试者法定监护人为了经济利益而忽视了受试者的权益,这对弱势受试者监护人的知情同意权提出了一个大大的问号;Andrea Akkad[5]等人对732名已在妇产科接受手术超过6个月的患者进行调查,关于其对手术知情同意书的地位、作用以及免除知情同意的理解,调查结果显示部分患者未认识到知情同意书的法律效应,许多患者甚至只是知晓需要签署知情同意但却不知为何签;Mary W. Stewart[6]等人对18对能够记得子女接受耳鼻咽喉科手术(鼓室管鼓膜切开术或扁桃体和增殖腺切除术)的父母对子女所存在的上述手术风险做了评估,然而结果是即使是在接受手术前额外提供了术前讲义并列出具体的手术风险的试验组的父母,在手术前和手术后一段时间进行了评估测试,发现虽然相对于对照组(未提供术前讲义并列出具体的手术风险的父母)评估结果较好,但对于手术风险的认知仍未达到所有风险全部答对的目标;Margo Hoover-Regan[8]等人对肿瘤药物临床试验的受试者进行了回顾性调查,研究参与的临床试验中的知情同意的管理标准、对研究设施、研究者及临床研究团队的满意度,结果发现大多数受试者(99%)签署了知情同意书,97%的受试者对研究设施满意,96%的受试者对研究人员满意,80%的受试者对研究目的、方法和风险的知识有较准确的认识,但是仍有20%的受试者对相关认识相对模糊。同时在研究中,无癌症的、≤60岁的受试者有较好的对于知情同意的回答,其对知情同意内容的认知亦更准确;Lindegger G[7]等人对在南非进行的HIV疫苗试验的受试者进行了药物的知情程度的调查,结果显示受试者对七个关键知情要素的了解存在显著的差异,得分最高的受试者知晓五个关键要素,包括相关的检查报告、所需的检查等,最低的受试者仅较为模糊的记忆了一些相关的片段等。
综上可知,国外对于该类知情同意的相关研究已处于一个较为成熟的状态,而对知情同意书的了解和受试者权利的认知同样是一个不尽如人意的状态。
2.2.2 对本项研究进行整理并得出相对比较数据。
本研究随机抽样电话访谈所得失联及拒绝的总体概率高于国外的研究,慢性病组为18/56(32.1%),急性病组为68/99(68.7%)。相对年轻的受试者,老年受试者(年龄大于60岁)的失联率普遍较高,两组受试者中约有1/4的失联人员为老年受试者。
慢性病组接受回访的受试者大多均知晓自身所参与的是医院的药物临床试验,但对于参加试验所用的药物为试验用药或对照药的了解程度存在较大的差异。完成知情同意较好的受试者能够基本完整的回忆完成知情同意过程中研究者对于其所讲述的各类信息;而完成知情同意较差的受试者则对存在对药物临床试验的理解出现严重偏差的情况,如认为参加试验所用药物与日常在医院所配的药物均为国内的上市药,对自己所拥有的权利和义务毫不在意等情况。
所有参加回访的受试者中,有三位慢性病组的受试者年龄超过了60岁,根据访谈内容可得知他们对于自身所参加的试验的了解情况较为完整,但认知情况略有偏差,如认为自己服用的肯定是试验药物、对于研究者曾告知的关于其随时无理由退出权等均有遗忘或未理解。这与Margo Hoover-Regan等的研究结果基本符合[8],由此得出结论未来应该关注老年受试者的知情同意,对他们的知情同意过程的操作应便于这一人群理解和记忆。而相对年轻的受试者,老年受试者的失联率普遍较高,两组受试者中约有1/4的失联人员为老年受试者,但不排除受试者更换联系电话及出现其他意外的情况。
3 调查结果分析
3.1 较高的失联率产生的原因
本次研究出现了较高的受试者失联率,慢性病组为18/56(32.1%),急性病组为61/99(61.6%)。失联主要的原因有联系电话长期无人接听、填写错误、空号、停机、关机等。考虑到产生该失联原因的主要可能为:距离试验结束已有较长的一段时间,受试者因各种可能出现的突发事件而更换联系方式;受试者屏蔽陌生电话;研究者在招募受试者时将受试者的联系方式填写错误以及其他未知的情况。
这些原因源于目前国内普遍对于电话推销、诈骗等不良电话的排斥和反感,这也增加了本次研究的难度。
3.2 部分受试者存在完成知情同意过程时间较短的原因
本次研究中,有一定比例的受试者存在知情同意过程较短的情况,考虑可能存在以下因素导致不充分知情同意的情况:研究者为了获得更高的完成试验率,未充分告知受试者其拥有的权利(如随时无理由退出权、知晓药物可能产生未知副反应的权利等);受试者对药物临床试验的知情同意的告知重视度不够,认为知情同意书完全是走一个形式而免去了研究者的告知过程;受试者对于参加试验研究所在的医院及医师的信任,不止一位受试者在电话访谈的过程中提及出于对医院的信任所以并未在意试验的知情同意,直接签署了知情同意书;受试者由于完成试验时间过长,遗忘完成知情同意过程的时间以及对研究医师比较尊重,碍于面子,不好意思多问医师或研究者具体情况。
3.3 受试者并未认识到伦理委员会的作用
研究中,受试者通常会忽视伦理委员会在药物临床试验中存在的作用,伦理委员会是在药物临床试验中保护受试者的权益的相关部门,同时监督临床试验安全、规范、顺利进行的部门。而本次研究发现通常受试者均不知道伦理委员会的存在。“有问题找介绍我入组的医生就好了”是较多受试者被问及应该在试验中有任何问题应当咨询谁时的回答。即使在研究过程中,受试者有相关的伦理问题或对研究者的不满,但因为相关宣传不够,受试者并不知道伦理委员是解答受试者疑问的部门,没有享受伦理委员会对其的进一步保护。
3.4 对受试者知情同意时间的长短与了解试验情况不成正比的分析
正常情况下,我们都会认为受试者知情同意时间越长,那么知情同意的效果就会越好,受试者对于自身参加的临床试验会更加了解。
在本次研究中却发现并非如此,对于三个时间段的受试者而言,他们的了解程度是相近的。经过分析,考虑到以下几点可能的因素:首先是经过6~18个月的时间,受试者绝大多数都容易对试验内容产生遗忘的情况,而根据艾宾浩斯遗忘曲线,无论是小于15分钟还是一周的知情同意时间对于不重复灌输知情同意信息的受试者而言并没有太大的区别,故出现了这个有异于正常设想的结果;另外,快速同意组的受试者中存在一部分为曾经参加过临床试验的受试者,本身对于临床试验就有所了解,故出现评分结果较高的情况。那么,根据这些推算,笔者认为该结果是合理的。
4 意见与建议
4.1 提高受试者参与药物临床试验的自主性
通常情况下,参加药物临床试验的受试者虽然签署了知情同意书但对其中自己所拥有的权利并未充分知晓。很多情况下,受试者会将知情同意书作为医生推卸责任的权宜之计,将选择权交给了受试者,而非一份注明了自身所拥有的权利的“自主性”文件。同时,在我国深厚的文化底蕴中,儒学思想中的一些传统的理念是与知情同意中要求受试者的自主性是相悖的[14],潜移默化中更增加了受试者自主的难度。在我国,药物临床试验的医生和受试者呈现的更像是一个家长与孩子的角色(研究者招募受试者,并对受试者试验中的所有流程进行规范),而非受试者有意识的希望参与药物临床试验,并能够对研究者告知的关于其的权利和义务充分履行。这点来说,强调个人主义的社会形态下,患者自主掌握受试者权利的状况仍未达到理想状态;而国内受试者对于自身自主性的理解还处于一个萌芽阶段,因为对自己的权利不知晓、把握不住,容易出现维权过度或被动弱势的情况,需要我们医学伦理工作者通过对作为研究者的医生们进行培训或对受试者告知相关措施加以完善。在此,笔者建议为了增强潜在受试者的自主意识,建议伦理工作者定期至附近社区进行相关的社区普及教育,同时,在医学院校对未来的医生们开设相关课程进行教育培训,相信能有更好的效果。4.2 采取有效措施,进一步提高知情同意质量以及提高受试者对药物临床试验的认知
本次研究发现,药物试验的受试者会在试验阶段保存知情同意书的情况并未如预期一般高比例,普遍的受试者并未认识到知情同意书的法律作用,通常情况来看,仅作为一份纸质版的资料,考虑各方面因素来说,若非主观意识保存,通常易出现破损和遗失的情况发生。而在调查中发现有一部分保留了知情同意书的受试者在回答关于受试者的权利和义务等知情同意方面问题的时候质量普遍较高。同时,在招募受试者之时对受试者进行较为充分的知情同意过程是有必要加以重视的问题,从入组前阅读、谈话、理解、同意、到签署知情同意时间≤15分钟的受试者占了总人数的较高比例(42.6%),在仓促情况下决定参与研究的受试者往往对研究了解不够,且未能充分体现其自主性。因此伦理委员会在对研究者和受试者进行培训时,应进一步强调知情同意书在受试者权益保护中的重要性。
同时,在药物临床试验中应当提高伦理委员会在受试者中的关注度,不仅仅是在知情同意书末尾处添置一句类似“研究中如有任何问题欢迎询问伦理委员会,电话××××××××”这类模版用语,更应在招募病人入组时由招募的研究者告知受试者伦理委员会在试验中的作用,以引起受试者的重视,进一步提高知情同意的质量。
另外,根据受试者对于不同时间段的知情同意过程比较的考虑,可以适当地对受试者进行重复较快速的知情同意再告知过程,这样能更有效的帮助受试者记忆自身在参加临床试验的过程中的权利和义务。
4.3 建立研究者与受试者之间的信任,有助于药物临床试验的顺利进行
在电话访谈的过程中,急慢性病组受试者对于医院、医生、研究者的信任程度略有些不同,在慢性病组受试者中存在较高比例的受试者陈述“相信医院,所以当医生(即研究者)提及试验,基本没怎么考虑就同意参加了”的情况发生,而急性病组的受试者则对医院和医师的情感因素相对较少,仅有一个急性病组受试者因为在医院治疗过哮喘所以对医院有良好的印象,所以当听说参加一项其他科室的药物临床试验的时候并未拒绝。急性病组的受试者与研究者之间的关系较为生疏,不容易出现因研究者与受试者之间关系良好而招募病人的情况。而虽然同是广泛招募,慢性病组的研究者通常会较熟悉受试者病情并且有可能推荐适合研究药物的就诊病人参与药物临床试验。因此,在研究中研究者与受试者在试验过程中培养良好的交流关系将有利于药物临床试验较顺利的进行且提高受试者参加试验的依从性。
正如,1986年,美国学者Richard[15]撰文表述“无论是非自愿的参与还是误解的参与,对于受试者个人而言是没有道德含义的。在大多数情况中,自由地同意参与人体试验的满足,是唯一的能与实验过程中的风险与不适保持平衡。这一道德含义不能通过事后的解释来补足。”德国的学者汉斯认为[16]对试验角色的单纯形式上的“同意”还没有使这种物化真正伦理化。只有真正的、有充分理由的和认识的自愿才能纠正“物性”这一压制主体的状况。知情同意的过程对于药物临床试验的受试者的重要性毋庸置疑。希望今后通过进一步知情同意的质量改进计划,使我们的研究者能够担当起受试者权益的主要维护者的角色;同时提高受试者的自主权利维护能力,这样才可“标本同治”,真正提高我国受试者知情同意的质量。
[1] White CS, Mason AC, Feehan M, et al.Informed consent for percutaneous lung biopsy:comparison of two consent protocols based on patient recall after the procedure[J].AJR,1995,165:1139-1142.
[2] Lynoe N, Sandlund M, Dahlqvist G, et al.Informed consent: A study of quality of information given to participants in a clinical trial[J].Br Med J,1991,303(6803): 610-613.
[3] Joffe S, Cook EF, Cleary PD, et al.Quality of informed consent in cancer clinical trials: across-sectional survey[J]. Lancet,2001, 358(9295): 1772-1777.
[4] Molyneux CS, Peshu N, Marsh K. Understanding of informed consent in a low income setting: three case studies from the Kenyan coast[J]. Social Science and Medicine,2004, 59(12): 2547-2559.
[5] Andrea Akkad,Clare Jackson,Sara Kenyon,et al.患者对书面知情同意的理解:问卷研究[J].英国医学杂志(中文版),2007,10(2):81-84.
[6] Stewart MW. Research News: Parental Understandingof Informed Consent[J].Perian esth Nurs,2010,25(5):325-326.
[7] Lindegger G, Milford C,Slack C,et al Beyond the checklist: assessing understanding for HIV vaccine trial participation in South Africa[J].J Acquir Immune DeficSyndr,2006,43(15):560-566.
[8] Hoover-Regan M. Informed consent and research subject understanding of clinical trials[J]. Wisconsin medical journal,2013,112(1):18-23.
[9] 欧阳樱君.药物临床试验受试者知情同意的现状及改进措施[J].现代医院,2008,8(6):116-117.
[10] 赵璐萍,武志昂.我国临床研究受试者知情同意现状及改善措施[J].中国药房,2014(41):3844-3846.
[11] 邓蕊.受试者知情同意决策与家庭的相关度研究[J].医学与哲学(A),2013,34(17):39-41,48.
[12] 张晓荣,李小龙,方相锋,等.反安慰剂效应对新药临床试验疗效评估的影响与应对建议[J].中华中医药杂志,2015(2):405-408.
[13] 徐喜荣.论人体试验中受试者的知情同意权——从“黄金大米”事件切入[J].河北法学,2013(11):111-120.
[14] 李亚明.从医患关系模式的角度分析中国医疗领域中的“自主性原则”[J].中国医学伦理学,2014,27(4):537-539.
[15] Richard Delgado,Helen Leskovac. Informed Consent in Human Experimentation: Bridging the Gap between Ethical Thought and Current Practice[J].UCLA L Rev,1986,34(1):67-130.
[16] 汉斯·约纳斯.技术、医学与伦理学:责任原理的实践[M].张荣,译.上海:上海译文出版社,2008:82, 84.
