应用高效体积排阻色谱法测定市场抽检口蹄疫灭活疫苗中的抗原(146S)含量
2018-03-05徐嫄邹兴启刘晓东李翠朱元源李阳万建青何天慈徐璐张乾义王琴郑金来赵启祖
徐嫄,邹兴启,刘晓东,李翠,朱元源,李阳,万建青,何天慈,徐璐,张乾义,王琴,郑金来,赵启祖*
(1.中国兽医药品监察所, 北京100081; 2.北京市动物疫病预防控制中心, 北京 102629; 3. 北京标驰泽惠生物科技有限公司, 北京 102600)
口蹄疫(foot-and-mouth disease,FMD)是传染性最强的家畜疫病之一,我国目前对口蹄疫采取以灭活疫苗免疫为主的防控策略[1-2]。疫苗对动物的保护效果主要取决于疫苗毒株与流行毒株的匹配度和疫苗中的抗原含量[3]。目前国内口蹄疫灭活疫苗生产企业多以O/MYA98谱系毒株、O/GX/09-7株、OHM/02株、O/HB/HK/99株、AF/72株、AKT-Ⅲ株和Asia1/HN/2006株等毒株生产单价或多价灭活疫苗。《中国兽药典》[4]规定口蹄疫灭活疫苗效力评估标准是本动物免疫攻毒试验,必须使用抗体阴性的本动物,存在试验成本高、生物安全风险、实验动物福利及环保问题[5]。疫苗中的有效抗原,即完整病毒颗粒(146S)的含量,是口蹄疫灭活疫苗质量的关键,是关乎疫苗效力的重要因素。因此,口蹄疫灭活疫苗146S含量检测技术的研究成为近几年关注的重点。目前,大型疫苗生产厂家和国际口蹄疫疫苗储备库通用的测定146S含量的方法是利用蔗糖或氯化铯密度梯度分析方法,通过测定各个级份的OD259 nm值,计算出146S浓度,该方法的弊端在于操作较复杂,耗时长,每次检测样品数量有限,结果重复性受较多因素影响,因此尚未标准化[6-7]。酶联免疫吸附试验(ELISA)因灵敏度高、特异性强等优点,被广泛关注,但因其在口蹄疫抗原检测中的通用性不理想而受到局限[7-9]。高效体积排阻色谱技术(High Performance Size Exclusion Chromatography,HPSEC),是一种以凝胶色谱柱的分子筛机制,根据待测组分的分子大小进行分离的一种液相色谱技术,样品进入色谱柱后,各组分从大到小一次被洗脱,该技术常用于生物大分子的分离纯化[10-11]。Marcelo[12]和杨延丽[13]等,均对该方法应用于测定146S含量检测进行研究,认为该技术在疫苗生产工艺研究和质量控制中均具有应用前景。Vajda[14]等应用该技术分离三株流感病毒,并通过红细胞凝聚活性测定进行验证。王宁[15]等成功利用该法对病毒细胞培养液中的戊型肝炎类病毒颗粒进行实时定量。本试验应用HPSEC,以外标法对市场抽检的5批口蹄疫灭活疫苗中的146S含量进行测定,并结合口蹄疫抗原测试卡对抗原类型进行鉴别。
1 材料与方法
1.1 仪器 L-2000型高效液相色谱仪配紫外检测器(HITACHI),L203型电子天平(梅特勒-托利多),himac CF16RX型离心机(HITACHI),纯水机(MiliQ),生物安全柜(NUAIRE),PHSJ-4F型pH计(雷磁),RH basic KT/C型磁力搅拌器,单道移液器(eppendorf),高压灭菌锅。
1.2 试剂与材料 无水硫酸钠、磷酸二氢钠、磷酸氢二钠、正戊醇、氯化钠(国药集团 分析纯),50mM磷酸盐缓冲液(pH8.0含0.15M NaCl)(PBS),聚乙二醇(PEG)6000(国药集团 优级纯),206油佐剂,口蹄疫抗原测试卡(北京三联百晗生物技术有限公司)。
146S(O型)标准品由中国科学院过程工程研究所生化工程国家重点实验室提供。5批疫苗信息见表1。
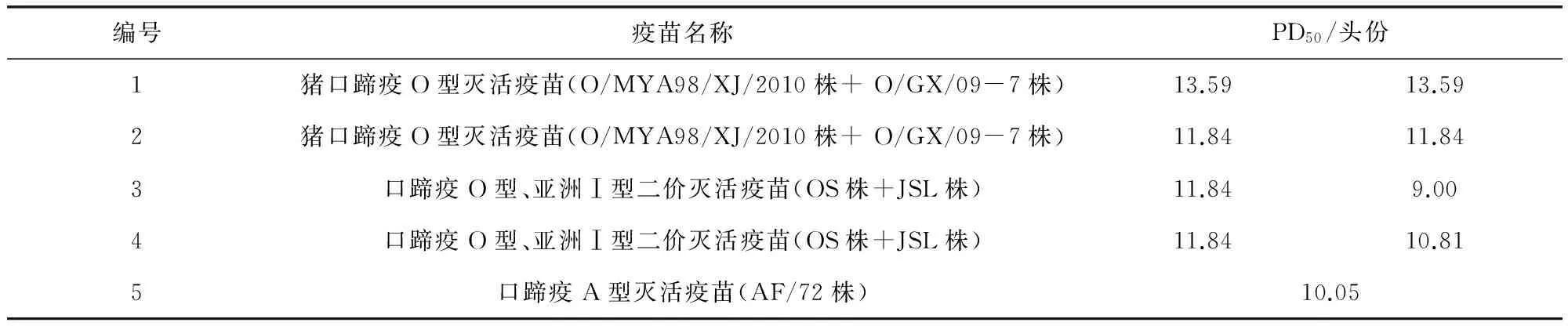
表1 口蹄疫灭活疫苗信息Tab 1 Information on FMD inactivated vaccine
1.3 色谱条件 色谱柱:TSKgel G4000SWXL(7.8 mm×30 cm)色谱柱(TOSOH)、TSKgel guardcolumn SWXL(6.0 mm×4 cm)色谱柱保护柱(TOSOH);流动相:pH7.2的50 mmol/L磷酸缓冲液,含0.1 mol/L Na2SO4;紫外检测器检测波长:259 nm;流速:0.6 mL/min;进样量:100 μL。
1.4 线性回归方程 用50 mM PBS将浓度为47.4 μg/mL146S标准品进行1.5倍系列稀释,共配制7个稀释梯度。HPSEC进样检测,以146S浓度为横坐标,以相应峰面积为纵坐标,绘制标准曲线并进行线性回归。
1.5 疫苗破乳 使用正戊醇作为破乳试剂,按疫苗体积与破乳试剂体积比9:1充分振摇混合,4 ℃静置分层后,3000 rpm,4 ℃,离心5 min,小心吸取底层水相用于检测。
2 结 果
2.1 线性回归方程 146S标准品溶液线性回归方程Y=65907X-203584,R2=0.9937,表明146S在4.2~47.4 μg/mL浓度范围内,与峰面积线性关系良好,见图1,色谱图见图2。
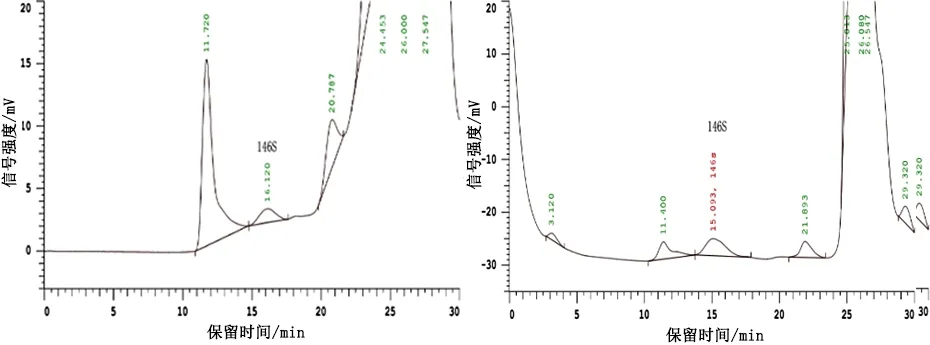
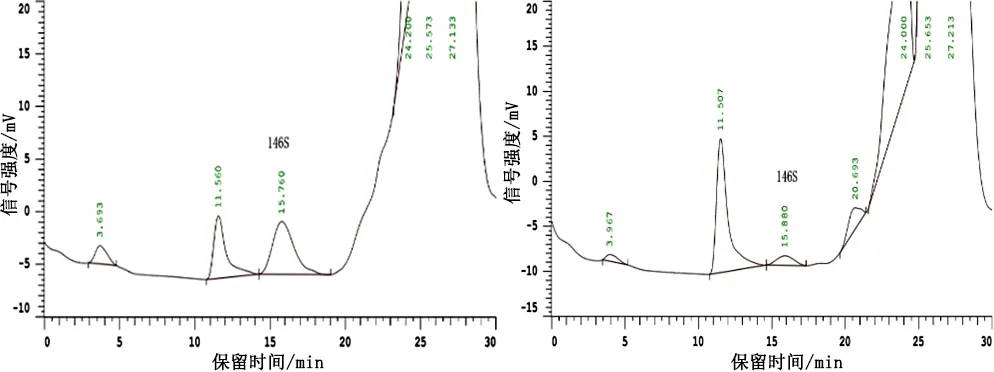
2.2 疫苗146S含量 将疫苗破乳水相检测结果积分得到的146S峰面积代入标准曲线,即得146S在破乳水相中的浓度。疫苗生产一般以206油佐剂与水相质量1∶1配苗,水相密度约为1.0 kg/L,佐剂密度约为0.85 kg/L,则灭活疫苗中水相体积分率理论值为0.46,故根据破乳后水相146S浓度计算灭活疫苗中146S浓度时,乘以体积系数0.46进行计算,即得灭活疫苗中146S浓度,结果见表2,色谱图见图3。

图1 146S标准曲线Fig 1 Standard curve of 146S
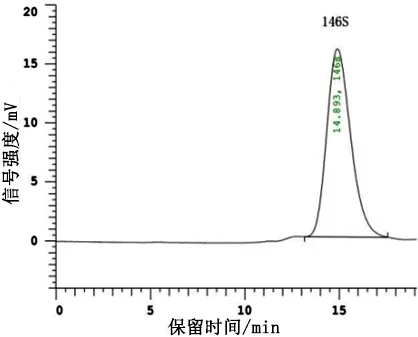
图2 146S标准品色谱图Fig 2 Chromatogram of 146S standard

编号破乳水相146S浓度/(μg·mL-1)灭活疫苗146S浓度/(μg·mL-1)14.462.0528.113.7334.412.03410.594.8757.413.41
1号疫苗; 2号疫苗Vaccine 1; Vaccine 2
3号疫苗; 4号疫苗Vaccine 3; Vaccine 4

5号疫苗Vaccine 5图3 疫苗HPSEC色谱图Fig 3 Chromatograms of FMD inactivated vaccine
2.3 抗原测试 使用口蹄疫O型、A型和亚洲1型抗原测试卡对5批疫苗抗原进行鉴定,将90 μL破乳水相滴加在样品孔内,20 min后观察,结果显示所有测试卡均出现C线,检测有效,且T区显示的结果均与疫苗中抗原血清型相对应。

图4 抗原测试卡检测结果Fig 4 Antigen test results of FMD inactivated vaccine
3 讨 论
应用HPSEC测定口蹄疫灭活疫苗产品146S含量,有时会遇到分离度不理想或吸收峰不明显的情况,而在方法学研究中,通过在实验室PEG沉淀处理浓缩灭活抗原液,配制疫苗,破乳后HPSEC测定水相,可以得到分离度理想的146S的特征吸收峰。分析认为,除了与疫苗中146S的浓度较低有关外,疫苗产品的生产工艺、保存运输条件对146S有重要的影响。不同工艺生产的疫苗中杂蛋白的含量不同,导致疫苗纯度不同,并且146S自身的二十面体结构非常不稳定,在温度高于56 ℃或pH低于6的条件下很快发生裂解[16-17],因此,疫苗中可能存在146S的聚集体或降解产物。以上因素给146S含量测定带来难度。针对目前出现的问题,将结合抗原测试卡、SDS-PAGE、电镜等技术对影响色谱结果的杂质峰进行深入分析,以优化疫苗的前处理方法。对因146S含量较低检测色谱峰面积不明显或色谱峰受杂质干扰严重的疫苗,尝试对破乳水相进行PEG沉淀,浓缩后再次检测,发现可有效提高146S峰面积,但由于该操作会造成146S的损失,需要计算损失率进行定量。目前,口蹄疫商品苗多为多价疫苗,该方法测定疫苗中146S总量,无法对抗原血清型加以区分,因此本实验结合口蹄疫抗原测试卡进行鉴定。目前已有口蹄疫O型抗原不同谱系毒株的抗原测试卡,可进一步对疫苗中使用的抗原毒株进行鉴定。应用体积排阻色谱技术测定口蹄疫抗原含量相比蔗糖密度梯度分析等方法更加快捷、高效、准确[13]。随着检测方法的优化以及口蹄疫灭活疫苗生产工艺水平的不断提高,使抗原的纯度和稳定性进一步提升,该技术将有望成为口蹄疫灭活疫苗生产过程中质量控制和疫苗终产品质量评价的重要技术方法。
[1] 崔辰, 黄立纲, 李晶,等. 猪O型口蹄疫病毒抗体化学发光酶联免疫检测方法的建立[J]. 生物工程学报, 2016, 32(11):1519-1530.
Cui C, Huang L G, Li J,etal. Establishment of chemiluminescent enzyme immunoassay for detecting antibodies against foot-and-mouth disease virus serotype O in swine[J]. Chin J Biotech, 2016, 32(11): 1519-1530.
[2] 张元沛,李彦芹,王玲玲,等. 口蹄疫疫苗研究进展[J]. 中国畜牧兽医,2013,40(7):171-173.
Zang Y P, Li Y Q, Wang L L,etal. Research Progress on foot-and-mouth disease vaccine [J]. Chin Anim Husb Vet Med, 2013, 40(7):171-173.
[3] Rweyemamu M M, Unehara O, Giorgi W,etal. Effect of formaldehyde and binary ethyleneimine (BEI) on the integrity of foot and mouth disease virus capsid[J]. Revue Scientifique Et Technique, 1989, 8(3):747-764.
[4] 中国兽药典委员会. 中华人民共和国兽药典2015年版[S].
Chinese Veterinary Pharmacopeia Commission. Veterinary pharmacopoeia of the People's Republic of China,2015 edition[S].
[5] 赵启祖, 谢庆阁. 家畜口蹄疫疫苗简介[J]. 中国兽医科学, 2000, 30(6):43-44.
Zhao Q Z, Xie Q G. Introduction of foot-and-mouth disease vaccine[J]. Chinese Journal of Veterinary and Technology, 2000, 6(30): 43-44.
[6] Chinsangaram J, Grubman M J, Koster M,etal. Foot-and-mouth disease virus vaccine: EP, EP 1389043 B1[P]. 2009.
[7] 董金杰,王凡,陈苗苗,等. 口蹄疫灭活疫苗146S含量检测方法概述[J].山东畜牧兽医,2017,10(38):78-79.
Dong J J,Wang F,Chen M M,etal. Overview of detection methods of 146S content in foot-and-mouth disease inactivated vaccine[J]. Shangdong Journal of Animal Science and Veterinary ,2017,10(38):78-79.
[8] Le C T, Grambsch P M, Giebink G S. Quality control and the identification of vaccine responders using ELISA-derived antibody data[J]. Stat Med, 2003, 22: 2935-2942.
[9] 李乐, 苗海生, 信爱国, 等. ELISA用于口蹄疫病毒146S抗原快速定量的研究. 中国预防兽医学报, 2008, 4(30): 314-317.
Li L, Miao H S, Xin A G,etal. Rapid quantification of FMDV 146S antigen by ELISA method[J]. Chin J Pre Vet Med, 2008, 4(30): 314-317.
[10]于世林. 高效液相色谱方法及应用[M]. 化学工业出版社, 2005.
Yu S L. High performance liquid chromatography method and its application[M]. Chemical Industry Press, 2005
[11]张祥民. 色谱-质谱技术在生物分析研究中的最新进展[J]. 色谱, 2017, 35(1):138-140.
Zhang X M. Recent advances in the application of chromatography mass spectrometry in biological analysis[J]. Chin J Chrom,2017, 35(1)138-140.
[12]Spitteler M A, Fernández I, Schabes E,etal. Foot and mouth disease (FMD) virus: quantification of whole virus particles during the vaccine manufacturing process by size exclusion chromatography.[J]. Vaccine, 2011, 29(41): 7182.
[13]Yang Y, Li H, Li Z,etal. Size-exclusion HPLC provides a simple, rapid, and versatile alternative method for quality control of vaccines by characterizing the assembly of antigens[J]. Vaccine, 2015, 33(9):1143-50.
[14]Vajda J, Weber D, Brekel D,etal. Size distribution analysis of influenza virus particles using size exclusion chromatography.[J]. Journal of Chromatography A, 2016, 1465:117-25.
[15]王宁, 王青波, 李静,等. 分子尺寸排阻高效液相色谱法检测戊型肝炎类病毒颗粒[J]. 中国生物制品学杂志, 2011, 24(10):1220-1223.
Wang N,Wang Q B,Li J,etal.Test for Hepatitis E Virus-like Particles by Size-exclusion High Performance Liquid Chromatography [J]. Chin J Biologicals, 2011, 24(10):1220-1223.
[16]Doel T R, Baccarini P J. Thermal stability of foot-and-mouth disease virus[J]. Archives of Virology, 1981, 70(1):21-32.
[17]Doel T R, Chong W K T. Comparative immunogenicity of 146S, 75S and 12S particles of foot-and-mouth disease virus[J]. Archives of Virology, 1982, 73(2):185-191.
