香蒲水浸提液对铜绿微囊藻及水华鱼腥藻的化感作用
2018-03-05夏侯佐英金桂宏何云核
冯 彬,郭 明,赵 爽,夏侯佐英,金桂宏,何云核
(1.浙江农林大学风景园林与建筑学院,浙江临安 311300;2.浙江农林大学理学院,浙江临安 311300)
近年来,随着水体富营养化程度加剧,引起藻类水华频繁暴发,不仅导致水生态系统的失衡,破坏水域生态景观,同时造成水质恶化,水产养殖业蒙受巨大的经济损失,甚至威胁人类健康[1-2],藻类水华问题是当前许多水体面临的重大环境问题,因此改善水体富营养化、防止水华发生,已是环境领域迫切须要研究解决的问题。传统的控藻技术有许多的缺点,水生植物化感抑藻现象的发现为这一问题的解决提供了一种新的方法和思路。水生植物广泛存在于水体,容易栽植,并且分泌的化感物质大多为次生代谢物质,能在自然条件下降解,生态安全性好,水生植物抑藻是一种颇有前景的控藻方式[3-4],利用水生植物化感抑藻研究是国内外环境领域研究的热点和前沿。目前,已报道的具有化感抑藻效应的高等水生植物有几十种[5],但多局限于对单一藻种的的研究,同时对化感作用的生理机制研究较少,这在一定程度上限制了水生植物在富营养化水体修复和防治藻类水华中的应用,深入开展水生植物对不同藻类的化感抑制作用是否具有选择性和化感作用的机制研究是极有必要的。
香蒲(Typhaorientalis)属于香蒲科香蒲属,多年生水生或沼生草本植物,是优良的水生观赏植物,具有吸收与分解污染物的作用,能够有效去除水体中的氮和磷,明显改善水质[6],因此香蒲在富营养化水体修复和防治水华发生方面具有广阔的应用前景。铜绿微囊藻(Microcystisaeruginosa)、水华鱼腥藻(Anabaenaflos-aquae)是2种常见的蓝藻水华藻类,在适宜条件下,极易形成水华,铜绿微囊藻能合成和分泌细胞毒素,使水环境质量恶化,水华鱼腥藻在夏季极易引起水华,其适应性强,发生水华的频率快、范围广[7-8]。因此,本试验通过研究不同质量浓度香蒲水浸提液对铜绿微囊藻、水华鱼腥藻的细胞密度、叶绿素a含量、MDA含量及超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性变化,从生理机制方面研究不同质量浓度的香蒲水浸提液对铜绿微囊藻、水华鱼腥藻的化感效应,分析香蒲对不同藻类的化感作用是否具有选择性,为香蒲应用于富营养化水体水华防治提供理论依据。
1 材料与方法
1.1 材料
试验用香蒲(Typhaorientalis)材料采自浙江农林大学校园植物园湿地公园,2015年8月从浙江农林大学官塘湿地公园随机挖取生长健壮、株高1.5~1.8 m香蒲植株,将采集的香蒲叶片用自来水反复冲洗干净,再用蒸馏水清洗3次,然后自然阴干,用于试验。铜绿微囊藻(编号 FACHB-905)、水华鱼腥藻(编号 FACHB-245)均购自中国科学院水生生物研究所淡水藻种库,用经灭菌的BG11培养基于型号PGX-3503智能光照培养箱中进行扩大培养,培养温度25 ℃,光照度 2 400 lx,光暗比12 h ∶12 h,每天定时摇晃,培养至对数生长期用于试验。
1.2 方法
1.2.1 香蒲水浸提液的制备 参照王志强等的制备方法[9],将阴干后的香蒲叶片剪碎,经植物粉碎机粉碎后,精确称量香蒲叶片粉末150.00 g 于3 000 mL烧杯中,加入 1 500 mL 蒸馏水浸提48 h,每隔6 h搅拌5 min,粗提液经2层纱布过滤3次,再用定性滤纸过滤,得到的滤液试验前经0.22 m微孔滤膜减压抽滤,以消除其他微生物的影响,用植物质量变化表示化感物质的相当量(g/L),则最后得到质量浓度为100 g/L的香蒲叶浸提液,4 ℃储存备用。
1.2.2 香蒲叶浸提液对2种藻类的化感作用 分别将0.0、12.5 、25.0、62.5、125.0 mL的香蒲叶浸提液置于500 mL的三角烧瓶中,分别接种处于对数生长期的铜绿微囊藻40 mL和水华鱼腥藻30 mL,再依次加入灭菌的BG11培养基使培养液总体积为250 mL,相应的质量浓度梯度为0(对照组)、5、10、25、50 g/L,以未加浸提液的处理组为对照,每组设置3次重复。2种藻类的初始密度为1×106个/mL。三角烧瓶置于型号PGX-3503智能光照培养箱中培养,每天定时摇晃3次,并随机放置三角烧瓶。每3 d取样1次,测定铜绿微囊藻、水华鱼腥藻的密度、叶绿素a含量、SOD活性、POD活性、CAT活性、MDA含量。
1.3 测定方法
铜绿微囊藻、水华鱼腥藻的藻细胞数量采用血球计数板法[10];叶绿素a含量采用热乙醇法测定[11]。
1.3.1 酶液的制备 取50 mL藻液4 000 r/min 离心15 min 收集藻细胞。加入5 mL预冷后的0.05 mol/L pH值=7.2磷酸缓冲液(内含1% PVP),在冰浴条件下,用超声波细胞破碎机破碎,超声5 s,间隔5 s,功率300 W,总时间12 min,4 ℃下 4 000 r/min 离心15 min,所得的上清液即为酶液,用于测定。可溶性蛋白含量的测定采用考马斯亮蓝法;丙二醛(MDA)含量的测定采用硫代巴比妥酸(TBA)法;超氧化物歧化酶(SOD)活性的测定采用羟胺法;过氧化氢酶(CAT)活性的测定采用可见光法;过氧化物酶(POD)活性的测定采用愈创木酚氧化法。测定时均采用南京建成生物工程研究所相应的测定试剂盒进行。
1.3.2 藻类抑制率的计算IR=(N0-NS)/N0×100%。式中:IR为抑制率,N0为对照组藻细胞密度,NS为处理组藻细胞密度[12]。
1.4 数据处理与统计
运用SPSS 16.0 软件及Origin 8.0软件对数据进行统计分析和计算。
2 结果与分析
2.1 不同质量浓度香蒲水浸提液对铜绿微囊藻、水华鱼腥藻生长的影响
不同质量浓度香蒲水浸提液对铜绿微囊藻、水华鱼腥藻的生长影响见图1、图2。从图1、图2可以看出,对照组铜绿微囊藻在试验期间生长良好,质量浓度为5 g/L时,对铜绿微囊藻的生长具有一定促进作用,但表现出“低促”的现象。质量浓度为10 g/L时,铜绿微囊藻细胞密度在培养后3 d略高于对照,随后生长减缓,表现为较强的抑制作用;在培养后 12 d 时的抑制率为76.61%。在高浓度浸提液(≥25 g/L)作用下,铜绿微囊藻的生长受到强烈的抑制作用,藻细胞密度逐渐降低,在培养后12 d达到最大抑制率,质量浓度为25、50 g/L 时的抑制率分别为89.48%、91.37%,此时藻液变清,表明藻细胞大量死亡。浸提液质量浓度为5 g/L时,对水华鱼腥藻的生长也具有一定的促进作用,试验结束时,藻细胞密度略高于对照组,质量浓度 10 g/L时,随着培养时间的增加藻细胞生物量逐渐增加,但低于对照,生长受到抑制,培养后12 d时的抑制率为25.41%,浸提液浓度25 g/L时,前6 d水华鱼腥藻的生物量逐渐增加,但小于对照,随后生长减缓,培养后9 d生物量下降,培养后12 d达到最大抑制率,抑制率为58.96%,质量浓度50 g/L,试验前6 d生物量逐渐增加,随后生物量开始下降,培养后12 d到达最大抑制率,抑制率为65.64%。
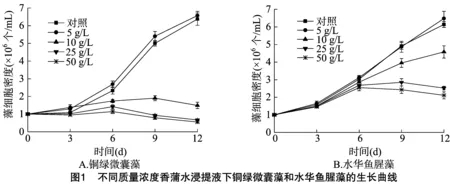
本研究结果表明,香蒲对铜绿微囊藻、水华鱼腥藻的化感作用表现出“低促高抑”现象,其原因可能为低浓度的浸提液使细胞酶活性升高,能改变藻细胞膜的通透性,使藻细胞更易吸收溶液中营养成分,同时浸提液中本身也可能含有一些营养成分,从而对藻类生长起到促进作用。浸提液浓度大于 10 g/L 时,对2种藻类都具有化感抑制作用,随着浸提液浓度的增加,抑藻能力增强,且对铜绿微囊藻的生长抑制作用明显大于水华鱼腥藻,表明香蒲对藻类的生长抑制具有一定的选择性,今后应注意其在防治藻类水华中的选择应用。已有研究表明,水生植物对藻类化感作用与植物的种类和生物量有关,表现出“低促高抑”的现象[13],宰学明等研究表明,当水芹浸提液浓度为10 g/L时对斜生栅藻的增加具有明显的促进作用,在高浓度浸提液(≥20 g/L)下,具有显著的抑制效应[14]。王志强等研究不同质量浓度的芦苇浸提液对水华微囊藻的化感作用,研究结果表明,低浓度的芦苇浸提液对水华微囊藻生长具有促进作用,高浓度具有强烈的抑制作用,浓度为30、40 g/L 时,培养后4 d藻细胞全部解体死亡[9],本研究结果与之相符。
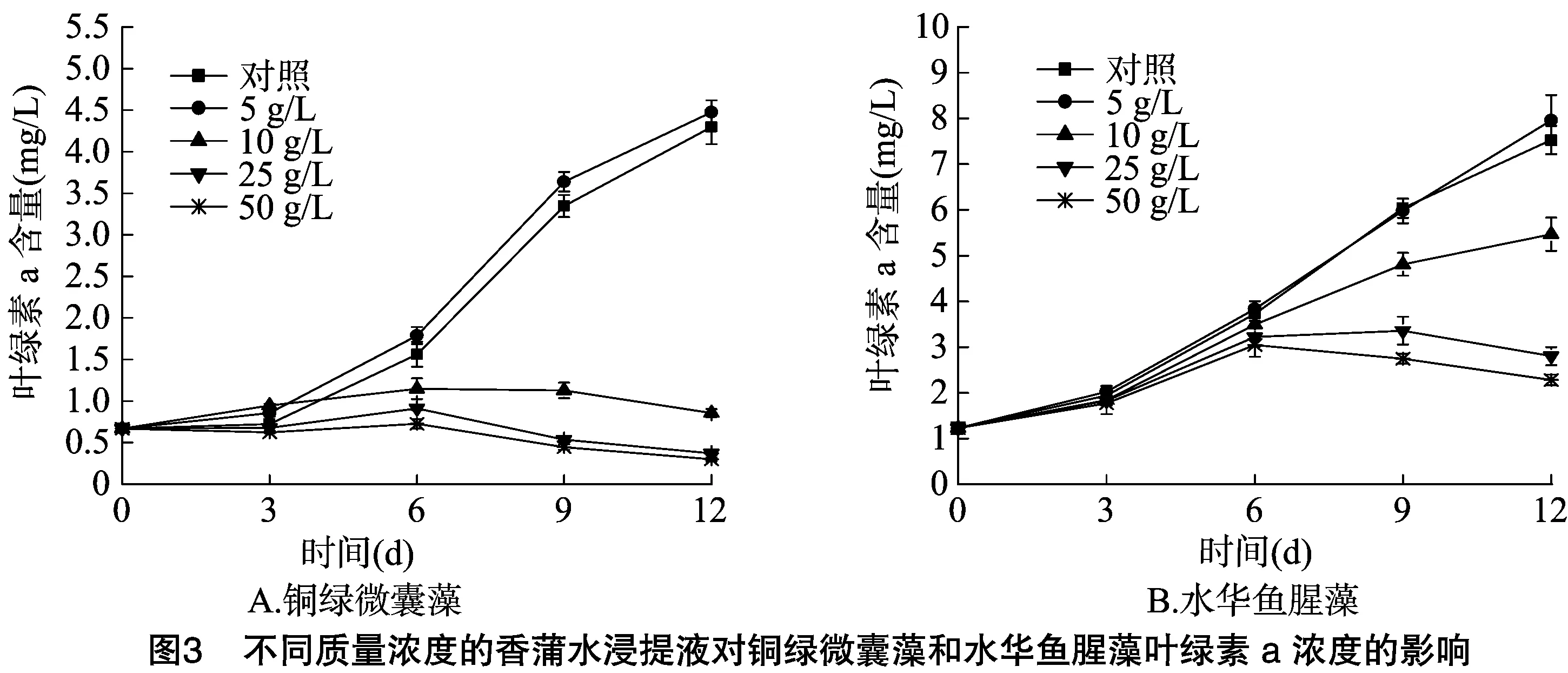
2.2 不同质量浓度的香蒲水浸提液对铜绿微囊藻和水华鱼腥藻叶绿素a含量的影响
藻类和浮游植物是依靠光合作用进行生长,而叶绿素a是蓝藻主要的光捕色素[15],可以作为反映光合作用的重要指标,通过测定其叶绿素a含量,可以从生理角度检验植物浸提液对藻类的化感效应程度。从图3可以看出,在质量浓度为5 g/L作用下铜绿微囊藻叶绿素a 总量较对照略高,试验结束时叶绿素a总含量为4.475 6 mg/L,对照为4.296 6 mg/L,质量浓度为10 g/L时,铜绿微囊藻叶绿素a总量前9 d缓慢增加,几乎持平,培养后9 d开始下降,培养后12 d降至 0.858 0 mg/L,在浸提液浓度大于25 g/L作用下,铜绿微囊藻叶绿素a含量,试验前6 d小幅度增加,随后下降,质量浓度25、50 g/L时,培养后12 d叶绿素a总量分别为0.370 6、0.299 9 mg/L,此时藻液变清。浸提液浓度为5 g/L时,水华鱼腥藻的叶绿素a总量比对照也略有增加,在质量浓度 10 g/L 作用下,水华鱼腥藻叶绿素a含量逐渐上升,但培养后6 d后上升速率明显小于对照,试验结束时,叶绿素a含量为5.467 4 mg/L,在质量浓度大于25 g/L作用下,水华鱼腥藻叶绿素a总量前6 d为上升阶段,质量浓度25 g/L时,叶绿素a含量培养后9 d开始下降,培养后12 d下降为2.803 4 mg/L,当质量浓度为50 g/L时,叶绿素a总量培养后6 d开始降低,试验结束时叶绿素a含量降至2.281 1 mg/L。

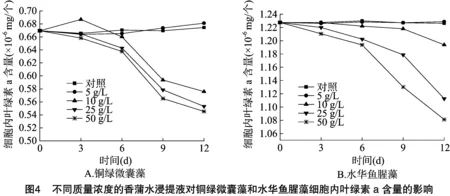
藻细胞密度与藻类叶绿素a总量呈线性关系,可以作为表征藻细胞密度的指标[16],这与本研究结果相符。2种藻类的生长曲线与叶绿素a含量变化曲线相一致,从图3、图4可以看出,在浸提液浓度大于10 g/L时,2种藻类的叶绿素a总量均低于对照,一方面是由于在浸提液的作用下,藻类的生长受到抑制甚至死亡,另一方面是由于在浓度大于10 g/L时,2种藻类细胞内的叶绿素a含量逐渐下降,且浓度越高,下降程度越高,表明香蒲浸提液可能抑制藻类叶绿素a的合成,或促进叶绿素a的降解,从而影响2种藻类正常的光合作用,这可能是香蒲对2种藻类具有化感抑制作用的原因之一。研究结果表明,植物的化感物质对藻细胞的光系统Ⅱ产生影响,低浓度下可能有利于叶绿素的合成,从而促进光合作用和藻类的生长,高浓度作用下可能通过破坏藻类的叶绿素,减少同化产物,从而抑制藻类的生长[17-18],其他水生植物对藻类叶绿素a的影响也屡见报道,周庆等研究凤眼莲对铜绿微囊藻生长影响时,发现在凤眼莲影响下,藻细胞叶绿素a 总含量迅速下降,与铜绿微囊藻的细胞密度呈极显著正相关,藻细胞中的叶绿素a含量到第8天时显著低于的对照[19]。袁亚光等研究发现,40 g/L水芹浸提液作用下,小球藻细胞壁断裂消失,叶绿体片层肿胀甚至解体[20]。朱俊英等发现,在共培条件下,铜绿微囊藻叶绿素含量和叶绿素荧光参数都受到显著的抑制[21],表明穗花狐尾藻通过破环正常的光合作用抑制铜绿微囊藻的生长。
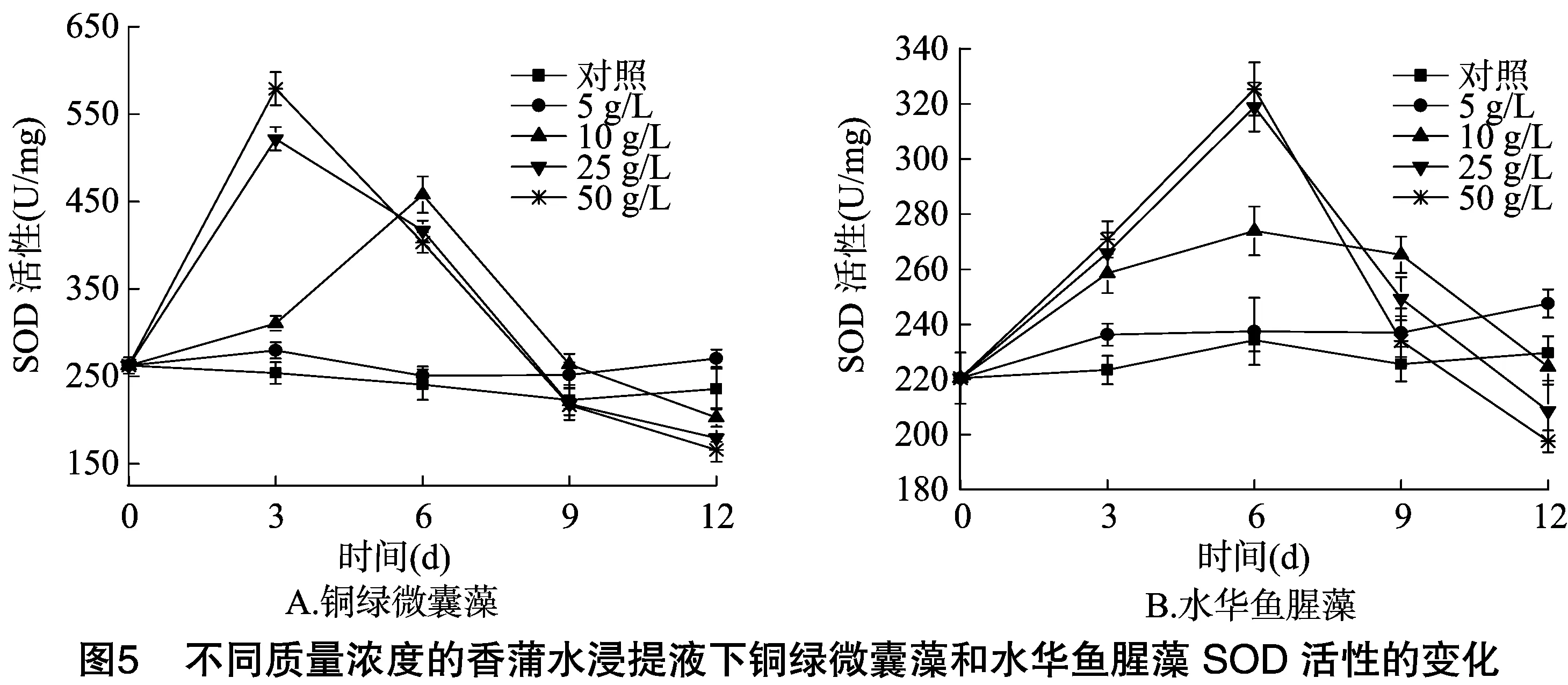
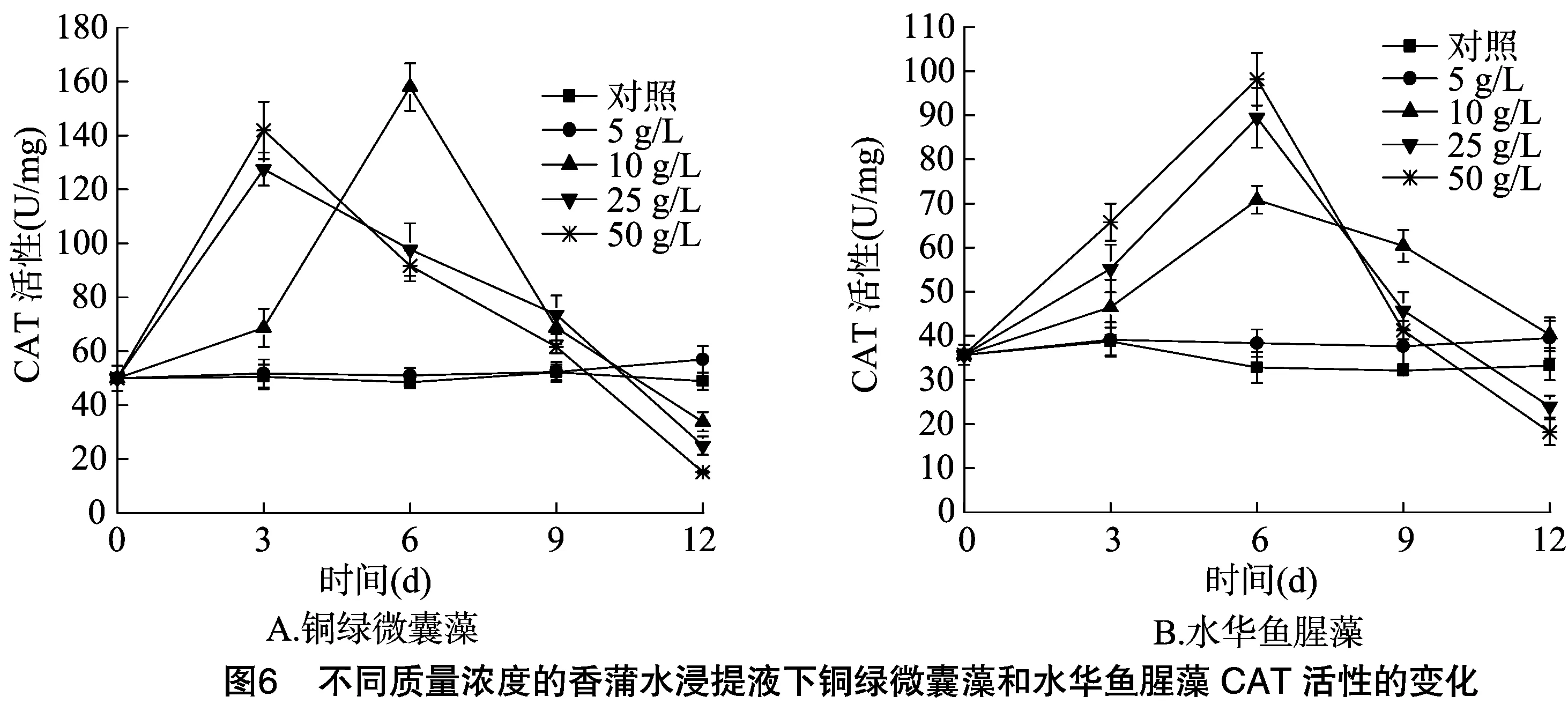
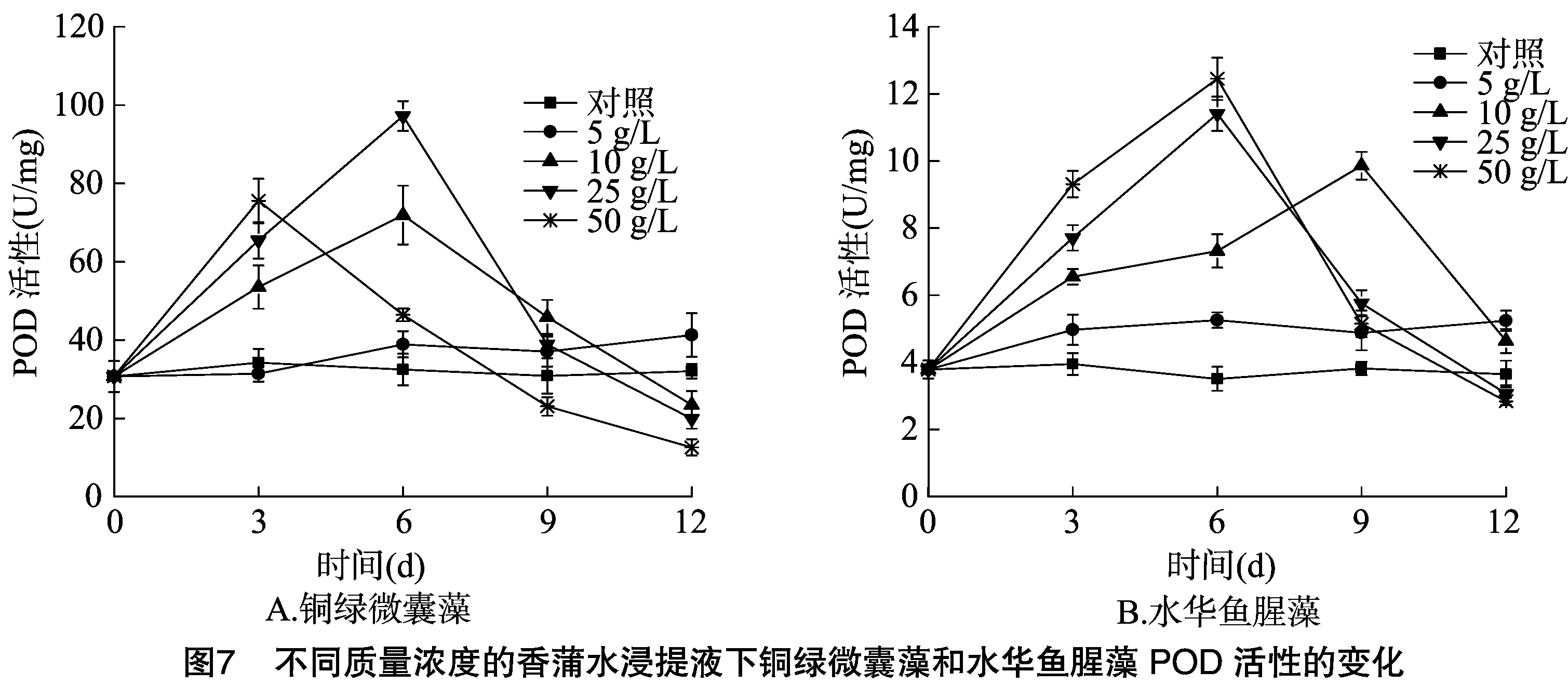
2.3 不同质量浓度的香蒲水浸提液对铜绿微囊藻、水华鱼腥藻SOD、POD、CAT活性的影响
植物在正常的生长情况下,ROS的产生与清除处于动态平衡,在逆境条件下,这种平衡被打破,从而造成ROS的大量积累,同时ROS具有超强的反应活性,阻碍叶绿素的合成,引发并加剧脂质过氧化作用,导致细胞质膜系统受损,影响细胞内多种反应的进行,干扰植物的代谢过程,严重时导致细胞死亡[22-24]。而植物自身具有清除ROS产生的抗氧化酶系统,SOD、POD、CAT是抗氧化酶系统中重要的清除酶,能够清除多余的ROS,从而起到保护细胞的作用。藻细胞受到严重胁迫时,体内ROS的增加超过了正常的歧化能力,导致大量的ROS积累,过量的ROS会抑制SOD、POD和CAT活性[25-26]。从图5、图6、图7可知,对照SOD、POD、CAT活性在试验过程中相对平稳,表明对照藻细胞生长良好,在低浓度5 g/L条件下,2种藻类的SOD、POD、CAT活性均有不同程度的升高,在质量浓度大于10 g/L作用下,SOD、POD、CAT活性均出现先升高后下降的现象,但不同质量浓度下铜绿微囊藻、水华鱼腥藻SOD、POD、CAT活性变化规律有差异。质量浓度为 10 g/L 时,铜绿微囊藻的SOD、POD、CAT活性在培养后6 d时达到最大值,随后急剧下降;水华鱼腥藻的SOD、CAT活性,在培养后6 d达到最大值,随后显著下降;POD活性在培养后9 d后也开始下降;质量浓度为25 g/L时,铜绿微囊藻的SOD、CAT活性在培养后3 d后显著减少;POD活性在培养后6 d后也急剧下降;质量浓度为50 g/L时,铜绿微囊藻SOD、POD、CAT活性均在培养后3 d达到最大值后显著减少;质量浓度大于25 g/L时,水华鱼腥藻SOD、POD、CAT活性试验前6 d逐渐上升,达到最大值,随后急剧下降。
本研究结果表明,在质量浓度大于≥10 g/L作用下,2种藻类的SOD、POD、CAT活性均先有不同程度的升高,说明香蒲浸提液对铜绿微囊藻、水华鱼腥藻具有胁迫效应,导致藻细胞内的ROS产生增加,从而促进2种藻类的SOD、POD、CAT活性的升高,随着培养时间的延长,2种藻类的SOD、POD、CAT活性出现急剧下降的现象,表明随着胁迫时间的延长及ROS的大量增加,香蒲水浸提液对2种藻类细胞产生了严重的胁迫效应,当ROS的大量积累超过了一定范围,不能被及时清除,藻细胞抗氧化酶系统遭到破坏,失去平衡,进而抑制SOD、POD、CAT活性,同时造成细胞膜脂过氧化加剧,细胞质膜的严重受损,藻细胞开始死亡。在质量浓度5 g/L时,2种藻类的SOD、POD、CAT活性均比对照略有上升,藻细胞也逐渐上升,表明低浓度的浸提液对2种藻类的细胞也具有一定的胁迫,导致ROS水平的上升,但多余ROS可以由POD、POD、CAT清除掉,从而避免藻细胞受到损害。
已有研究表明,水生植物可引起藻细胞的抗氧化酶系统损伤,吴晓辉等研究发现,在马来眼子菜和斜生栅藻共生培养条件下,处理组的POD酶带总数保持稳定,酶谱组成发生变化,SOD酶带数量减少、CAT酶带数量增多,推断藻体通过改变酶活性、调整同工酶的组成来抵御活性氧的伤害[27]。张维昊等研究结果显示,菖蒲对铜绿微囊藻具有化感作用,菖蒲会引起铜绿微囊藻SOD、CAT等抗氧化系统酶的活性增强,推测化感物质造成活性氧的增加是藻体死亡的原因之一[28]。傅海燕等研究发现,在浓度大于20 g/L水网藻种植水作用下,铜绿微囊藻的SOD、POD、CAT活性在第2天达到极限,均呈现先上升后下降的趋势[23],本研究结果与之相一致。
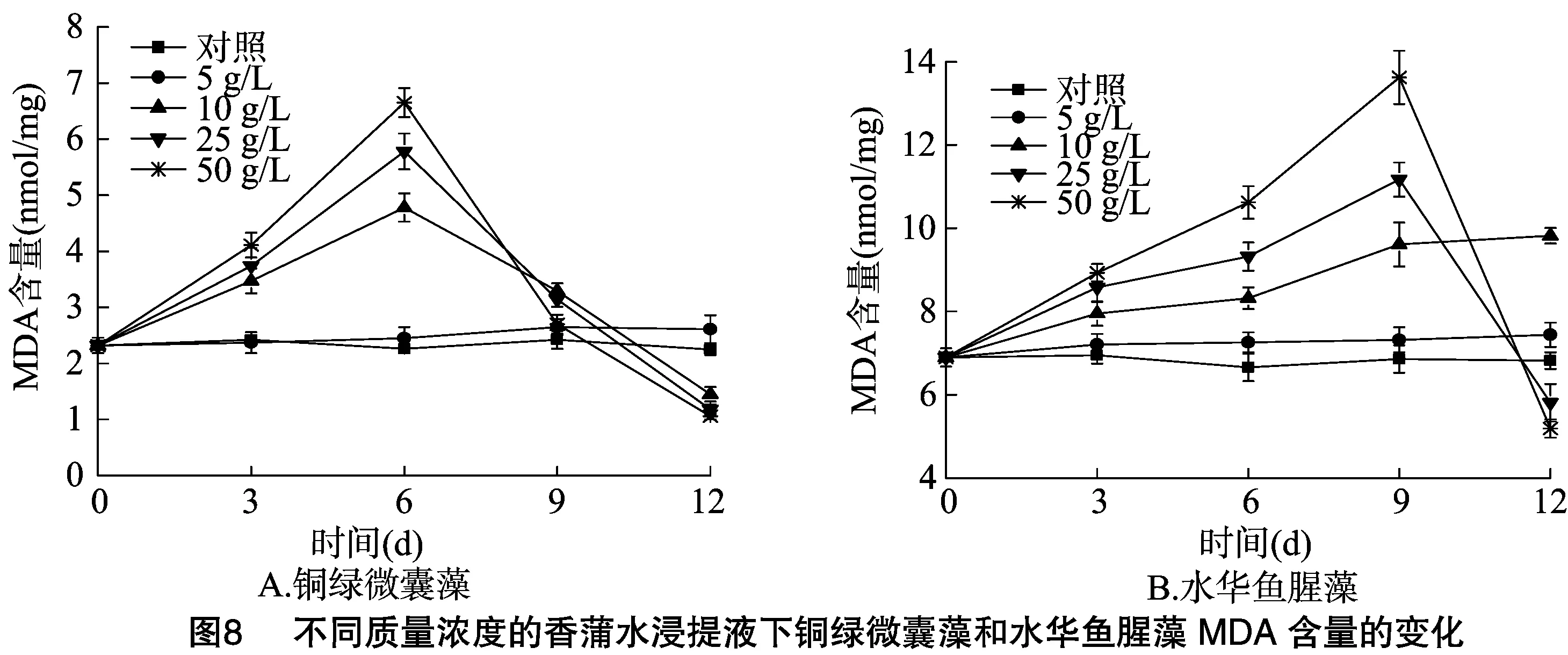
2.4 不同质量浓度的香蒲水浸提液对铜绿微囊藻、水华鱼腥藻MDA含量的影响
MDA是细胞膜脂过氧化作用的产物之一,MDA的含量可指示细胞内反映氧簇的数量和细胞膜脂过氧化的程度,其形成和积累量可作为细胞膜结构损伤,藻体受胁迫程度的一种标志[29-32]。从图8可以看出,对照组铜绿微囊藻、水华鱼腥藻MDA含量在试验期间相对稳定,在质量浓度为5 g/L时,2种藻类的MDA含量较对照均略有上升,在质量浓度为10 g/L时,铜绿微囊藻MDA含量在培养后6 d达到最大值,随后急剧下降,水华鱼腥藻MDA含量在试验期间则一直呈上升趋势,在质量浓度大于25 g/L时,2种藻类MDA含量均表现为先上升后下降的趋势,铜绿微囊藻MDA含量在培养后6 d后急剧下降,水华鱼腥藻MDA含量的培养后9 d后也急剧下降。已有研究表明,在苦草、菹草、红掌[33-35]胁迫下会引起铜绿微囊藻的MDA积累,藻细胞的膜脂过氧化加剧。张庭坚研究发现,酚酸类物质阿魏酸和对羟基苯甲酸会使水华鱼腥藻和小球藻MDA含量呈先上升后下降的趋势变化[36],推测酚酸类物质对藻类的化感抑制作用可能与自由基的产生和膜脂过氧化有关。在试验过程中,在质量浓度大于10 g/L时,2种藻类的MDA含量均有1个上升阶段,是由于藻细胞膜脂过氧化加剧,藻细胞膜受到损伤,引起MDA含量的积累,随后急剧下降,表明此时藻细胞质膜损伤严重,藻细胞已经开始裂解。
3 结论
香蒲浸提液对铜绿微囊藻和水华鱼腥藻的化感作用表现为“低促高抑”的现象,在浸提液质量浓度大于10 g/L时,对2种藻类具有抑制作用,随着浸提液浓度的增加,抑藻能力增强,且香蒲对2种藻类的生长具有一定的选择性,对铜绿微囊藻的抑制作用明显大于水华鱼腥藻,今后应在防治藻类水华中选择应用时重视香蒲对铜绿微囊藻的化感抑制作用。
在试验过程中,当浸提液质量浓度大于10 g/L时,降低铜绿微囊藻、水华鱼腥藻的叶绿素a总量,表明香蒲通过促进叶绿素a的分解或阻碍叶绿素a的合成,从而影响藻细胞的光合作用。
在浸提液质量浓度大于10 g/L作用下,铜绿微囊藻、水华鱼腥藻受到胁迫,细胞内ROS含量增加,促进SOD、CAT、POD活性的升高,MDA含量的增加,ROS的大量积累,超过一定范围,多余的ROS不能及时被抗氧化酶系统清除,则会抑制SOD、CAT、POD活性,导致细胞膜脂过氧化加剧,细胞结构严重破坏,藻细胞的生长受到抑制,细胞开始大量死亡。
[1]Ni L,Acharya K,Hao X,et al.Isolation and identification of an anti-algal compound fromArtemisiaannuaand mechanisms of inhibitory effect on algae[J].Chemosphere,2012,88(9):1051-1057.
[2]Sun X X,Choi J K,Kim E K.A preliminary study on the mechanism of harmful algal bloom mitigation by use of sophorolipid treatment[J].Journal of Experimental Marine Biology and Ecology,2004,304(1):35-49.
[3]胡洪营,门玉洁,李锋民.植物化感作用抑制藻类生长的研究进展[J].生态环境,2006,15(1):153-157.
[4]郭亚丽,傅海燕,黄国和,等.阿魏酸和香豆素对铜绿微囊藻的化感作用[J].环境科学,2013,34(4):1492-1497.
[5]Hilt S,Gross E M.Can allelopathically active submerged macrophytes stabilise clear-water states in shallow lakes?[J].Basic & Applied Ecology,2008,9(4):422-432.
[6]付春平,唐运平,陈锡剑,等.香蒲湿地对泰达高盐再生水景观河道水质净化效果的研究[J].农业环境科学学报,2006,25(增刊1):186-190.
[7]陈国元,李青松,黄晓鸣,等.不同质量浓度苦草对铜绿微囊藻生长及抗氧化酶系统的影响[J].环境工程学报,2012,6(11):4107-4112.
[8]吕 赟,王应军,冷 雪,等.稀土铈对水华鱼腥藻生理特性及藻毒素释放的影响[J].农业环境科学学报,2012,31(9):1677-1683.
[9]王志强,王 捷,班剑娇,等.芦苇水浸提液对水华微囊藻的化感作用研究[J].安全与环境学报,2014,14(4):302-306.
[10]刘晓宇,傅海燕,黄国和,等.美人蕉有机酸组分对铜绿微囊藻的化感作用[J].环境工程学报,2015,9(12):5769-5774.
[11]杨小杰,韩士群,唐婉莹,等.凤眼莲对铜绿微囊藻生理、细胞结构及藻毒素释放与削减的影响[J].江苏农业学报,2016,32(2):376-382.
[12]浦寅芳,孙颖颖,阎斌伦,等.3种沉水植物对水华藻类生长的影响[J].水生态学杂志,2009,2(6):46-50.
[13]Nakai S,Inoue Y,Hosomi M,et al.Growth inhibition of blue-green algae by allelopathic effects of macrophytes[J].Water Science & Technology,1999,39(8):47-53.
[14]宰学明,朱士农,钦 佩,等.水芹水浸提液对斜生栅藻的化感效应研究[J].植物研究,2011,31(6):735-738,757.
[15]李 磊,侯文华.荷花和睡莲种植水对铜绿微囊藻生长的抑制作用研究[J].环境科学,2007,28(10):2180-2186.
[16]于海燕,周 斌,胡尊英,等.生物监测中叶绿素a浓度与藻类密度的关联性研究[J].中国环境监测,2009,25(6):40-43.
[17]Wu Z B,Deng P,Wu X H,et al.Allelopathic effects of the submerged macrophytePotamogetonmalaianusonScenedesmusobliquus[J].Hydrobiologia,2007,592(1):465-474.
[18]Hong Y,Hu H Y,Li F M.Physiological and biochemical effects of allelochemical ethyl 2-methyl acetoacetate (EMA) on cyanobacteriumMicrocystisaeruginosa[J].Ecotoxicology and Environmental Safety,2008,71(2):527-534.
[19]周 庆,韩士群,严少华,等.凤眼莲对铜绿微囊藻生长及藻毒素与营养盐释放的影响[J].环境科学,2014,35(2):597-604.
[20]袁亚光,李思宇,宰学明,等.水芹(Oenanthejavaica)浸出液对小球藻(Chlorellavulgaris)生长及超微结构的影响[J].生态与农村环境学报,2012,28(3):266-270.
[21]朱俊英,刘碧云,王 静,等.穗花狐尾藻化感作用对铜绿微囊藻光合效率的影响[J].环境科学,2011,32(10):2904-2908.
[22]张志良.植物生理学实验指导[M].北京:高等教育出版社,2003.
[23]傅海燕,柴 天,赵 坤,等.水网藻种植水对铜绿微囊藻生长的抑制作用研究[J].环境科学,2012,33(5):1564-1569.
[24]鲁志营,高云霓,刘碧云,等.水生植物化感抑藻作用机制研究进展[J].环境科学与技术,2013,36(7):64-69,75.
[25]Oncel I,Yurdakulol E,Keles Y,et al.Role of antioxidant defense system and bio-chemical adaptation on stress tolerance of high mountain and steppe plants[J].Acta Oecologica-International Journal of Ecology,2004,26(3):211-218.
[26]Hejl A M,Koster K L.Juglone disrupts root plasma membrane H+-ATPase activity and impairs water uptake,root respiration,and growth in soybean (Glycinemax) and corn (Zeamays)[J].Journal of Chemical Ecology,2004,30(2):453-471.
[27]吴晓辉,张兵之,邓 平,等.马来眼子菜化感作用对斜生栅藻同工酶的影响[J].武汉植物学研究,2007,25(5):479-483.
[28]张维昊,周连凤,吴小刚,等.菖蒲对铜绿微囊藻的化感作用[J].中国环境科学,2006,26(3):355-358.
[29]Zhang S,Zhang B,Dai W,et al.Oxidative damage and antioxidant responses inMicrocystisaeruginosaexposed to the allelochemical berberine isolated from golden thread[J].Journal of Plant Physiology,2011,168(7):639-643.
[30]唐 萍,吴国荣,陆长梅,等.凤眼莲根系分泌物对栅藻结构及代谢的影响[J].环境科学学报,2000,20(3):354-359.
[31]徐 华,刘婉华,姚萍萍,等.柑橘潜叶蛾危害对脐橙叶片几种生理指标的影响[J].江苏农业科学,2016,44(4):221-223.
[32]刘海波,魏玉清,周维松,等.NaCl胁迫对萌发期甜高粱和春小麦生理生化特性的影响[J].江苏农业科学,2016,44(8):106-111.
[33]陈卫民,张清敏,戴树桂.苦草与铜绿微囊藻的相互化感作用[J].中国环境科学,2009,29(2):147-151.
[34]李 源,闫 浩,施 媚,等.菹草与铜绿微囊藻化感互作及其对藻抗氧化能力的影响[J].安徽师范大学学报(自然科学版),2015,38(6):572-575,602.
[35]朱嘉成,周 利,朱 佳,等.水生观赏植物红掌对铜绿微囊藻的化感作用[J].环境科学研究,2015,28(10):1638-1644.
[36]张庭廷,吴安平,何 梅,等.酚酸类物质对水华藻类的化感作用及其机理[J].中国环境科学,2007,27(4):472-476.
