小儿重症病毒性脑炎临床特点、预后及其相关因素分析
2018-03-05胡文静杨理明廖红梅唐静文方红军
胡文静,杨理明,廖红梅,唐静文,杨 赛,王 平,方红军
(湖南省儿童医院,湖南 长沙 410007)
病毒性脑炎(viral encephalitis,VE)是一组由各种病毒侵入颅内,导致颅内病毒感染而引起的脑实质急性弥漫性炎症,有时可累及脑膜,是小儿神经系统常见的感染性疾病之一[1]。近年来,小儿病毒性脑炎发病率有逐渐升高趋势,由0.035‰升至0.160‰,给患儿成长发育和生命安全带来严重影响。重症病毒性脑炎(severe viral encephalitis,SVE )具有发展迅速、病情严重、致残率极高的特点,并易留下后遗症。SVE患儿中80%~95%可存活,文献[2]报道,SVE后遗症发生率为50%,甚至达70%,部分病例死亡。目前,国内对小儿SVE的预后及相关因素研究较少,本研究对102例SVE患儿的临床资料及相关资料进行回顾性分析,分析相关因素与预后之间的关系,为临床识别SVE的患儿,指导临床治疗及预防提供理论依据。
1 对象与方法
1.1 研究对象 2014年1月—2016年1月湖南省儿童医院神经内科及儿科重症监护病房(PICU)收治的SVE患儿102例,常规完善儿童格拉斯哥预后量表(CGOS)、脑电图、头磁共振(MRI)、病毒病原体检测等,并随访6个月。根据预后结果将患儿分为预后良好组和预后不良组。
1.2 诊断标准
1.2.1 病毒性脑炎纳入标准[3]需具备有以下二项:(1) 脑实质损害的症状和/或体征。①意识障碍; ②精神障碍如胡言乱语、行为异常; ③癫痫样发作; ④神经系统缺损体征如瘫痪、失语、共济失调等。(2)至少满足以下条件中的 1项。①前驱感染的证据:上呼吸道或消化道感染症状,如发热、头痛、恶心、呕吐等; ②头颅影像学检查证实脑实质受损: MRI 示颅内单发或多发异常信号影; ③异常脑电图(EEG)改变: 与脑炎病变相一致的EEG表现,如局灶性或弥漫性非特异性高波幅慢波,或高波幅慢波背景上的局灶性棘慢综合波等; ④脑脊液(CSF)检查异常:细胞数增多(白细胞数>10×106/L) ,和/或蛋白含量增高>0.45 g/L,和/或颅内压增高>180 mmH2O,和/或CSF病原学检查找到相关病毒抗体。
1.2.2 病例排除标准 排除化脓性脑膜炎、隐球菌脑膜炎、结核性脑膜炎、自身免疫性脑炎等其他中枢神经系统感染疾病。
1.2.3 SVE诊断标准[4]达到病毒性脑炎纳入标准下具备以下条件之一时诊断为SVE:(1)频繁抽搐24 h内≥3次或惊厥持续状态;(2)意识障碍,如嗜睡、昏睡、昏迷等;(3)大脑皮质受损表现,如肢体瘫痪;(4)皮质下或脑干颅神经损害;(5)严重或持续颅内压增高、脑疝形成;(6)多器官功能受损甚至衰竭。
1.3 方法
1.3.1 儿童格拉斯哥预后量表 (CGOS)[5]采用CGOS评定患儿预后。1级:死亡;2级:植物人生存状态,仅有最小反应(如随着睡眠、清醒周期眼睛能睁开);3级:日常生活无法自理,严重残疾,24 h 需照料;4级:日常生活及社会活动尚可独立,轻度残疾;5级:恢复良好,日常生活可自理,可正常活动。根据预后结果将患儿分为预后良好组(CGOS 评级4~5级)和预后不良组( CGOS 评级1~3级)。
1.3.2 EEG分级 EEG异常分为轻度、中度、重度异常。轻度异常:背景节律变慢;中度异常:弥漫性高波幅慢波阵发性出现或局灶性癫痫样放电;重度异常:出现较多弥漫性高波幅慢波或无枕区优势或出现爆发抑制或低电压等现象。
1.3.3 MRI分级 本研究根据头部MRI病灶累及范围进行分级。1级:正常;2级:单侧幕上单一斑片状病灶;3级:双侧幕上对称性或非对称性斑片状病灶;4级:颅内3处以上多发病灶,累及2个以上脑叶,或脑叶病灶伴有基底核区,或脑干、或幕上幕下同时受累。
1.4 统计学处理 应用SPSS 14.0软件进行处理,两研究组计量资料比较采用t检验,计数资料比较采用χ2检验,多因素预后分析采用非条件logistic回归分析,P≤0.05为差异有统计学意义。
2 结果
2.1 临床特征 102例SVE中男性60例,女性42例,年龄5个月~14岁(平均6.2岁);住院时间9~100 d(平均35 d)。预后良好组24例(23.5%),预后不良组78例(76.5%)。预后良好组患儿发热持续时间、住院时间均短于预后不良组,差异具有统计学意义(均P<0.05)。预后良好组和预后不良组CSF白细胞计数及CSF蛋白比较,差异均无统计学意义(P>0.05)。见表1。头颅MRI 1级(正常)7例,2级15例,3级35例,4级45例,头颅MRI异常率为93.1%。头颅MRI病灶累及单侧岛叶、脑干各6例,小脑8例,枕叶、基底核-丘脑区各13例,双侧额叶各14例,顶叶7例,颞叶8例,脑实质广泛大面积受累4例。所有患儿均在入院1周内行EEG检查,正常12例(11.8%),轻度异常12例(11.8%),中度异常26例(25.5%),重度异常52例( 50.9%)。入院后3 d之内完善腰穿检查,颅内压力升高96例(94.1%),CSF白细胞数增高94例(92.2%),CSF蛋白增高90例(88.2%)。见表1。
表1预后良好组和预后不良组SVE患儿计量资料比较
Table1Comparison of the measurement data of SVE children in good prognosis group and poor prognosis group
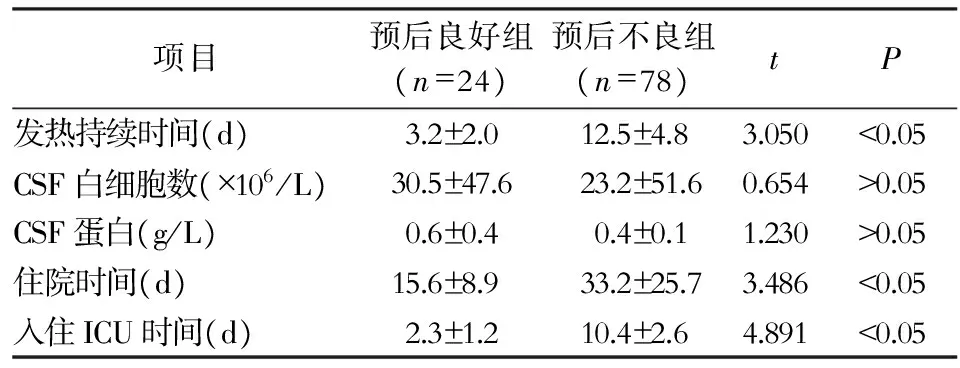
项目预后良好组(n=24)预后不良组(n=78)tP发热持续时间(d)3.2±2.012.5±4.83.050<0.05CSF白细胞数(×106/L)30.5±47.623.2±51.60.654>0.05CSF蛋白(g/L)0.6±0.40.4±0.11.230>0.05住院时间(d)15.6±8.933.2±25.73.486<0.05入住ICU时间(d)2.3±1.210.4±2.64.891<0.05
2.2 SVE 患儿预后情况 102例患儿中,住院期间死亡10例(9.8%),CGOS评级均为1级,其中 6例死于脑干脑炎,4例死于脑疝。对92例患儿出院后6个月进行随访,出院后随访死亡4例(3.9%),88例接受CGOS评估,评估患儿出院4~12个月的情况,结果预后良好 24例和预后不良 64例。预后良好患儿中,9例有轻度后遗症,轻微功能或行为改变,生活可以自理(CGOS评级分级为4级);15例已完全康复(CGOS评级为5级)。预后不良患儿中25例留有严重后遗症(CGOS评级为2级),日常生活不能自理;39例有中度后遗症(CGOS评级为3级),但可生活自理。有严重后遗症患儿生活不能自理,表现为智力运动低下、症状性癫痫、大小便失禁、瘫痪、失明失语等,其中4例处于植物人状态。
2.3 SVE 患儿预后的单因素和多因素分析
2.3.1 单因素分析 低钠血症(血清钠<135 mmol/L)患儿48例(47.1%),低钾血症(血清钾<3.5 mmol/L)患儿 36例(35.3%),应激性高血糖(血糖>6.67 mmol/L)患儿42例(41.2%)。单因素分析结果显示,不同年龄、性别,是否低钠血症、低钾血症、偏瘫等因素SVE患儿预后比较,差异均无统计学意义(均P>0.05);EEG异常、意识障碍、惊厥持续状态、呼吸衰竭、头颅MRI累及病灶超过2处或累及幕下、合并脏器损伤、 应激性高血糖、是否发热,以及入住ICU情况对SVE预后均有影响(均P<0.05)。见表2。
表2SVE 患儿预后单因素分析结果
Table2Univariate analysis result of prognosis of children with SVE
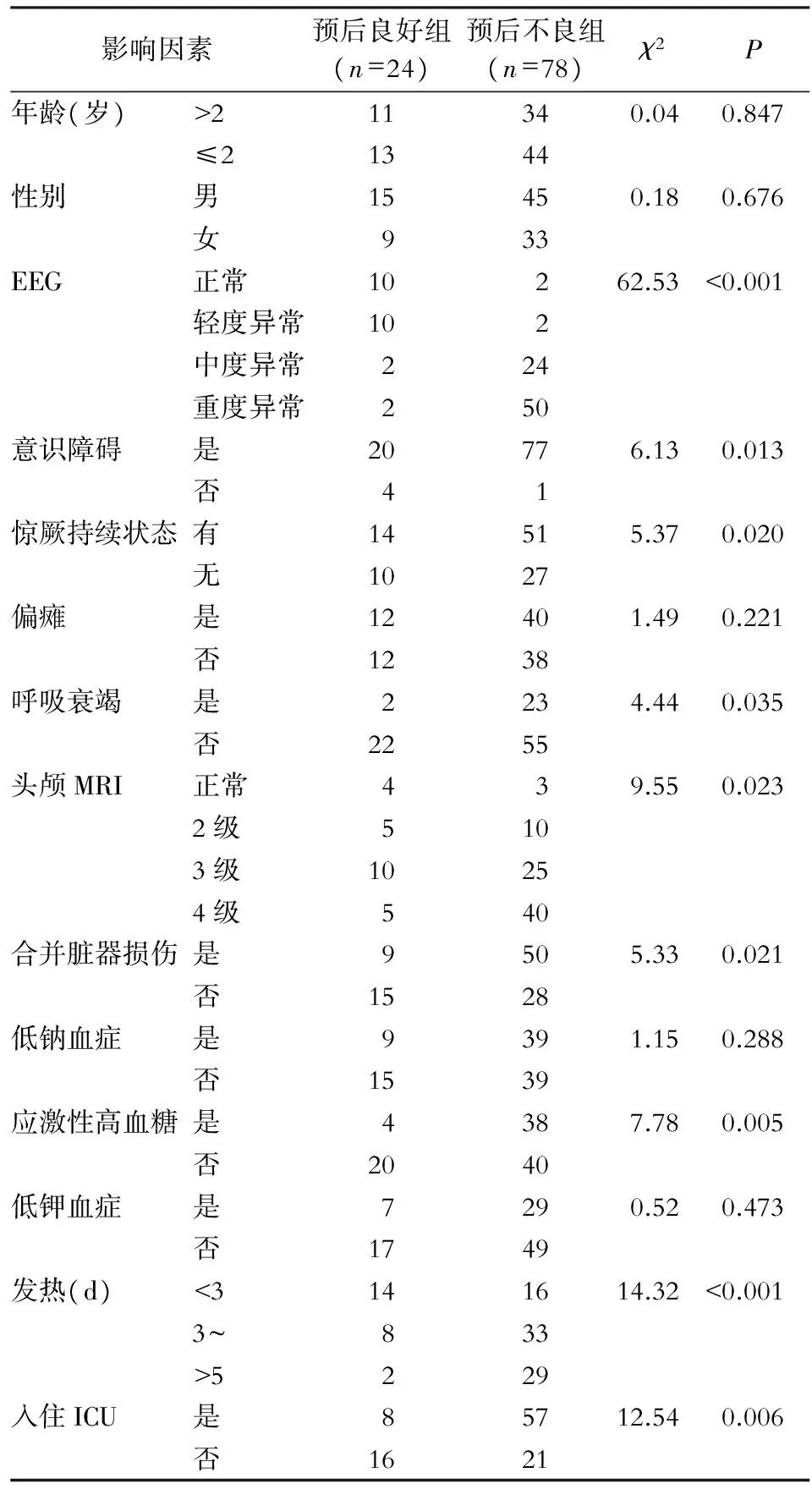
影响因素预后良好组(n=24)预后不良组(n=78)χ2P年龄(岁)>211340.040.847≤21344性别男15450.180.676女933EEG正常10262.53<0.001轻度异常102中度异常224重度异常250意识障碍是20776.130.013否41惊厥持续状态有14515.370.020无1027偏瘫是12401.490.221否1238呼吸衰竭是2234.440.035否2255头颅MRI正常439.550.0232级5103级10254级540合并脏器损伤是9505.330.021否1528低钠血症是9391.150.288否1539应激性高血糖是4387.780.005否2040低钾血症是7290.520.473否1749发热(d)<3141614.32<0.0013~833>5229入住ICU是85712.540.006否1621
2.3.2 多因素分析 将单因素分析中有统计学意义的因素,如EEG严重程度、意识障碍、惊厥持续状态、呼吸衰竭、头颅MRI、合并脏器损伤、应激性高血糖、入住ICU、发热持续时间等因素纳入非条件logistic回归分析,结果显示惊厥持续状态、呼吸衰竭、发热持续时间长(>5 d)、脑电图重度异常、头颅MRI累及病变超过2处或累及幕下,以及合并应激性高血糖为SVE预后不良的危险因素,差异具有统计学意义(均P<0.05)。见表3~4。
表3SVE 患儿预后多因素分析赋值表
Table3Assignment table of multivariate analysis of prognosis in children with SVE

因素赋值EEG正常=0,轻度异常=1,中度异常=2,重度异常=3意识障碍否=0,是=1惊厥持续状态无=0,有=1呼吸衰竭否=0,是=1头颅MRI正常=0,2级=1,3级=2,4级=3合并脏器损伤否=0,是=1应激性高血糖否=0,是=1发热时间(d)<3=0,3~=1,>5=2入住ICU否=0,是=1
表4SVE 患儿预后多因素分析
Table4Multivariate analysis of prognosis in children with SVE

影响因素POR95%可信区间EEG正常---轻度异常0.4360.6030.434-1.318中度异常0.1282.4560.643-8.589重度异常<0.00110.1963.680-19.879惊厥持续状态0.00313.4688.310-21.346呼吸衰竭0.0144.5802.705-14.208头颅MRI正常---2级0.8022.1060.468-6.9703级0.0023.0122.034-10.5394级0.0015.8933.460-11.659应激性高血糖0.0306.3161.246-14.479发热时间(d)<3---3~0.0631.5160.972-2.105>5<0.0012.3781.544-3.662
2.4 病原学检查结果 患儿均行血清及CSF特异性病毒IgM抗体检查(包含单纯疱疹病毒、EV71病毒、柯萨奇病毒,夏秋季患者送检乙型脑炎病毒),以酶联免疫吸附法测定血清病毒IgM抗体为实验室诊断证据。病原学检查证实感染单纯疱疹病毒8例(7.8%),肠道病毒EV-71 6例(5.9%),乙型脑炎病毒21例(20.6%),柯萨奇病毒4例(3.9%)。
3 讨论
SVE的主要临床表现为发热、头痛、精神行为异常、意识障碍、抽搐、瘫痪、颅神经麻痹等,临床辅助检查包括头颅MRI、EEG、腰穿CSF相关检查,以及CSF、血清病原体特异性抗体检测等。诊断主要依据患者临床表现、CSF检查及病原学分析。一般临床上通过血清学或CSF明确病原体,通过EEG、头颅MRI明确病灶位置。SVE治疗手段包括药物抗病毒药物(阿昔洛韦、更昔洛韦),脱水降颅压(甘露醇、甘油氯化钠等),糖皮质激素及免疫球蛋白;抗癫痫、护脑及改善脑组织代谢,压低温[6]等治疗降低脑代谢,保护神经元细胞功能,康复治疗促进功能恢复等。亦有文献[7]报道,可采用机械通气、血浆置换等方法治疗SVE。SVE可遗留神经系统后遗症,常见如智力、运动、语言发育落后,症状性癫痫,视力听力受损等。
3.1 临床表现与预后的关系 Rudolph等[8]通过回顾性研究发现,SVE患儿入院时已有3 d抽搐发作史和(或)存在意识障碍,格拉斯昏迷(GCS)≤10分,高度提示预后不良。本组资料结果显示,与SVE预后密切相关的因素为惊厥持续状态及发热持续时间、呼吸衰竭等。若炎症损伤丘脑下部,可出现超高热等体温调节障碍,因退热药物的应用,本研究对热峰尚不能明确。动物研究[9]证实,惊厥持续状态可导致以海马区神经元死亡为主的选择性脑损伤,惊厥发作持续时间越长,次数发作频繁,不良预后发生率越高。本研究表明,发热持续时间长、伴有惊厥持续状态、呼吸衰竭等是影响儿童SVE预后的危险因素。需尽早控制患儿惊厥, 纠正呼吸衰竭有利于患儿预后及控制后遗症的发生。
3.2 患儿入住ICU时间的长短与预后的关系 SVE患儿大多存在严重颅内压增高或惊厥持续状态,故多数患儿可能首先收住ICU,若伴有呼吸障碍则需机械通气,则可能发生呼吸机相关肺炎或医院感染。本组10例住院期间死亡患儿首诊收入科室均为PICU,且在PICU死亡。出院后随访死亡的4例患儿均曾长时间入住PICU。研究发现,患儿在ICU住院的时间越长,则预后越差,原因可能如下:(1)患者病情本身就重,故在ICU 需稳定病情的时间越长;(2)患者在ICU时发生了医院感染,尤其是耐药菌的感染,可能导致患儿病情进展甚至死亡;(3)患者在ICU的时间越长,缺少监护人的陪护及精心照料时间越长,遗留严重后遗症及肢体瘫痪或变形的可能性大。
3.3 EEG与预后的关系 EEG能较早、较敏感地动态反映脑功能改变。EEG改变的范围和严重程度可反映中枢病变的范围和脑功能损伤的程度[10]。在脑炎急性期EEG均有不同程度的异常:多位弥漫性高波幅慢波,节律或非节律性δ波。当白质受累时慢波活动更突出,常出现高波幅无节律的多形性δ波。慢波活动的加重常伴有意识障碍,表明损伤严重[11]。部分患者有局灶性/多灶性癫痫样放电,并可合并癫痫发作。病毒性脑炎EEG异常有以下特点[12]:(1)起病早期EEG检查可能正常,起病5 d后EEG异常率高;(2)异常持续时间长,当临床症状基本好转后,EEG大多仍为异常慢波或无枕区优势;(3)EEG异常程度与病情轻重有一定相关性,EEG有重度异常表现者病情较轻度异常者严重,治愈时间也延长。本研究中EEG异常率为88.2%(90/102),主要表现为弥慢性高波幅慢波,局灶性癫痫样放电,前者提示病毒性脑炎大脑功能紊乱,后者与定位体征相符合。
3.4 头颅MRI与预后的关系 头颅MRI病变累及2处或累及幕下是影响儿童SVE预后的危险因素。SVE MRI表现特点[13]: (1)病灶非常广泛, 双侧多发;(2)可累及额、顶、颞、枕叶、基底节、丘脑、脑干各部位, 皮层及白质均可受累; 以双侧颞、额、顶叶受累最为多见;(3) 皮质病灶表现为大片状,白质病变为脱髓鞘性改变; (4)弥漫性脑组织肿胀;(5)而单纯疱疹病毒性脑炎MRI表现更具特异性,多累及颞叶,病灶内可伴有出血。本组资料表明,患者临床意识障碍越重,MRI表现病灶弥漫性脑肿胀越严重,累及范围越广泛,预后越差。应尽快采取各种有效手段进行综合治疗, 减轻脑水肿。经治疗好转后复查 MRI常表现脑萎缩脑软化灶,导致智力低下;颞、额叶受累者易继发癫痫;基底节受累易表现锥体外系症状、瘫痪等后遗症;脑干受累,易抑制呼吸及吞咽,临床表现凶险,预后不良;枕叶受累者可出现皮质盲视力受损[14]。本组资料显示,患儿顶叶及白质脱髓鞘病变预后相对较好,虽然早期意识障碍较重, 但予以静脉丙种球蛋白及糖皮质激素治疗后临床症状可以完全消失。复查MRI示病灶缩小,对患儿学习、记忆功能影响不大。
3.5 血糖与预后的关系 本研究中,预后良好组发生应激性高血糖的比例低于预后不良组,提示血糖高可影响预后。研究[15]表明,脑炎患儿血糖水平与病情轻重有关,其原因可能为应急状态下胰岛素抵抗机制及严重感染时机体过度应激反应等。SVE患儿发生高血糖时低钠血症、低钙血症发生率增高,提示高血糖可加重机体内环境紊乱,使病情恶化。SVE患儿血糖虽高,但不能被外周组织吸收充分利用,造成细胞外高糖和细胞内能量缺乏,甚至发生高渗血症,易导致患者中枢性高热、意识障碍、抽搐等。治疗SVE患儿,需积极控制高血糖。
3.6 病原体与预后关系 已有文献[16-17]报道,单纯疱疹性脑炎、乙型脑炎、EV-71所致脑干脑炎等是引起SVE的常见病原体。本组患儿均行血清及CSF特异性病毒IgM抗体检查,以测定血清病毒IgM抗体为实验室诊断证据,结果显示感染单纯疱疹病毒8例(7.8%),肠道病毒EV-71 6例(5.9%),乙型脑炎病毒21例(20.6%),柯萨奇病毒4例(3.9%)。由于实验条件有限,大多数病毒性脑炎无法明确病原体,故无法进行病原体与预后关系的研究。本研究中,EV-71肠道病毒所致SVE为脑干脑炎,预后较差。单纯疱疹病毒脑炎、乙型脑炎患儿的症状均较重,乙型脑炎病SVE患儿中未按计划接种乙脑疫苗者病情更危重。已有动物实验以及人体临床实验证明,接种疫苗或应用抗病毒抗体可能有助于预防某些病毒性脑炎的发生[18],且有时计划免疫是控制某些病毒性脑炎的最佳方案。
SVE严重威胁儿童的生存质量,伴有发热病程长、惊厥持续状态、呼吸衰竭、入住ICU时间长、重度异常、头颅MRI累及病变超过2处或累及幕下,合并应激性高血糖等是影响儿童SVE预后的危险因素。尽早确诊,早期、积极治疗,控制惊厥稳定病情后尽早从ICU转至普通病房,能够改善患儿的预后,提高患儿生活质量。
[1] Venkatesan A, Tunkel AR, Bloch KC, et al. Case definitions, diagnostic algorithms, and priorities in encephalitis; consensus statement of the international encephalitis consortium[J]. Clin Infect Dis, 2013, 57(8): 1114-1128.
[2] Ai J, Xie Z, Liu G, et al. Etiology and prognosis of acute viral encephalitis and meningitis in Chinese children:a multicenter prospective study[J]. BMC Infect Dis, 2017, 17(1): 494.
[3] 胡亚美,江载芳.诸福棠实用儿科学[M].8版.北京:人民卫生出版社,2015.
[4] Lin JJ, Lin KL, Hsia SH, et al. VGKC complex antibodies in pediatric severe acute encephalitis: a study and literature review[J]. Brain Dev, 2013, 35(7): 630-635.
[5] Lax Pericall MT, Taylor E. Family function and its relationship to injury severity and psychiatric outcome in children with acquired brain injury: a systematized review [J]. Dev Med Child Neurol, 2014, 56(1): 19-30.
[6] Ahmed AI,Bullock MR,Dietrich WD,et al. Hypothermia in traumatic brain injury[J]. Neurosurg Clin N Am, 2016, 27(4): 489-497.
[7] Bookstaver PB, Mohorn PL, Shah A, et al. Management of viral central nervous system infections: a primer for clinicians[J]. J Cent Nerv Syst Dis, 2017, 9: 1179573517703342.
[8] Rudolph H, Schroten H, Tenenbaum T, et al. Enterovirus infections of the central nervous system in children: an update[J]. Pediatr Infect Dis J, 2016, 35(5): 567-569.
[9] Sankar R, Shin DH, Liu H, et al. Patterns of status epileptic-induced neuronal injury during development and long-term consequences[J]. J Neurosci, 2008, 18(20): 8382-8393.
[10] 黄亮,俞丹,罗蓉,等.儿童病毒性脑炎急性期临床病理特征对继发性癫痫的影响[J].四川大学学报(医学版),2017,48(2):257-262.
[11] Milshtein NY, Paret G, Reif S, et al. Acute childhood encephalitis at 2 tertiary care children hospitals in Israel:etiology and clinical characteristics[J]. Pediatr Emerg Care, 2016, 32(2): 82-86.
[12] Kneen R, Michael BD, Menson E, et al. Management of suspected viral encephalitis in children-Association of British Neurologists and British Paediatric Allergy, Immunology and Infection Group national guidelines[J]. J Infect, 2012, 64(5): 449-447.
[13] 刘彦荣,苏雪娟.小儿病毒性脑炎MRI影像诊断及鉴别诊断[J].中国CT和MRI杂志,2015,13(5):14-15,28.
[14] 余婕,郭虎,郑帼,等.病毒性脑炎患儿的管理[J].中华实用儿科临床杂志,2015,30(23):96-98.
[15] Aiyathuri EJ,Candlish JK. Factors in serum and cerebrospinal fluid from children with viral encephalopathies impair glucose transport[J]. Acta Paediatr Jpn, 1990, 32(4): 417-425.
[16] Britton PN, Eastwood K, Paterson B, et al. Consensus guidelines for the investigation and management of encephalitis in adults and children in Australia and New Zealand[J]. Intern Med J, 2015, 45(5): 563-576.
[17] Huang SW, Huang YH, Tasi HP, et al. A selective bottleneck shapes the evolutionary mutant spectra of enterovirus A71 during viral dissemination in humans[J]. J Virol, 2017, 91(23), pii: e01062-17.
[18] Ginsburg AS, Meghani A, Halstead SB, et al. Use of live attenuated Japanese encephalitis vaccine SA 14-14-2 in children: A review of safety and tolerability studies[J]. Hum Vaccin Immunother, 2017, 13(10): 2222-2231.
