铜绿假单胞菌临床分布及耐药性的不均一性
2018-03-05王淑玲徐兰兰
颜 令,王淑玲,徐兰兰,张 震,廖 璞
(重庆市人民医院,重庆 400014)
目前细菌耐药性已成为全球性问题,抗菌药物的使用会导致细菌耐药性的增加,抗菌药物滥用被公认为是导致目前细菌耐药性增加的最主要原因。抗菌药物是治疗细菌感染最有效的方法,及时的抗菌药物治疗是提高细菌感染患者生存率和生存质量的最主要方式,而目前细菌药敏报告时间相对滞后,根据药敏报告治疗可能会延误最佳治疗时机,所以详细合理的耐药分析对临床抗菌药物经验用药的指导非常重要。铜绿假单胞菌为革兰阴性菌,是临床分离率最高的非发酵菌,也是耐药性较严重的菌株之一,其多重耐药问题的严重性仅次于鲍曼不动杆菌,所以有必要对临床铜绿假单胞菌耐药性分布特征进行分析,以利于临床抗菌药物经验性用药的选择,减少抗菌药物滥用。本研究回顾性分析2012—2016年住院患者检出的铜绿假单胞菌,分析其耐药性在临床分布中是否存在不均一性,现将结果报告如下。
1 资料与方法
1.1 菌株来源 回顾性分析某院LIS电子病历系统导出的2012年1月1日—2016年12月31日住院患者检出的铜绿假单胞菌,同一患者、同一住院周期、同一标本类型相同耐药表型的菌株只统计一次。
1.2 研究方法 标本采集、运送及细菌分离培养按照相应采集运送指南及《全国临床检验操作规程》最新版进行。药敏试验结果判读按照上一年美国临床实验室标准化协会(CLSI)版本执行。细菌鉴定及药敏试验采用法国生物梅里埃公司VITEK 2 Compact 60自动分析仪与配套相应鉴定卡。必要时结合手工生化反应如氧化酶、触酶等补充试验,及K-B和E-text药物敏感性试验进行确认。质控菌株:霍氏肠杆菌ATCC 700323、嗜麦芽窄食单胞菌ATCC 17666、大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853、肺炎克雷伯菌ATCC 700603,所有质控菌株均购自美国ATCC。
1.3 统计分析 应用Excel 2010软件进行数据录入,SPSS 13.0软件进行统计学分析。采用卡方检验进行统计学比较,P≤0.05为差异具有统计学意义。
2 结果
2.1 铜绿假单胞菌临床分布特征 2012年1月1日—2016年12月31日共分离铜绿假单胞菌2 432株。菌株主要来源于重症监护病房(ICU),727株(29.89%);主要标本来源为痰,2 064株(84.87%)。见表1。
表12 432株铜绿假单胞菌临床分布特征
Table1Clinical distribution characteristics of 2 432P.aeruginosastrains

项目菌株数构成比(%)来源科室 ICU72729.89 老年医学科56823.36 神经科37315.34 呼吸科2108.63 其他内科31612.99 外科23899.79来源标本 痰206484.87 尿1295.30 脓液682.80 其他标本1717.03
2.2 不同年份分离铜绿假单胞菌对常用抗菌药物耐药情况 2012—2016年各年份铜绿假单胞菌对除哌拉西林/他唑巴坦外的其他检测抗菌药物的耐药率比较,差异均有统计学意义(均P<0.05)。对哌拉西林、头孢他啶、头孢吡肟、亚胺培南、美罗培南、左氧氟沙星、环丙沙星的耐药率在2014年达高峰后有下降趋势;对阿米卡星、庆大霉素、妥布霉素的耐药率较低,且呈逐年下降趋势(均P<0.05)。见表2。

表2 2012—2016年铜绿假单胞菌对常见抗菌药物的耐药率(%)
2.3 不同标本类型分离铜绿假单胞菌对常用抗菌药物的耐药情况 除头孢吡肟和妥布霉素外,来源于痰标本的铜绿假单胞菌对抗菌药物的耐药率均高于其他标本(均P<0.05);但是来源外科痰标本的铜绿假单胞菌对常见抗菌药物的耐药率为1.25%~18.75%。见表3。
2.4 不同标本类型中不同年龄组患者分离铜绿假单胞菌对常用抗菌药物的耐药情况 痰标本分离的铜绿假单胞菌中,≥65岁患者分离的菌株对头孢他啶、美罗培南、阿米卡星的耐药率高于<65岁患者分离菌株(均P<0.05);≥65岁患者分离菌株对妥布霉素的耐药率低于<65岁患者(P<0.001)。其他标本分离的铜绿假单胞菌中,≥65岁患者分离的菌株对哌拉西林、哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、亚胺培南、美罗培南、左氧氟沙星、环丙沙星的耐药率均低于<65岁患者分离菌株(均P<0.05)。见表4。
表3不同标本来源铜绿假单胞菌对常用抗菌药物的耐药率(%)
Table3Resistance rates ofP.aeruginosafrom different specimens to commonly used antimicrobial agents(%)

抗菌药物痰(外科痰)其他标本χ2P哌拉西林24.82(16.88)11.0130.321<0.001哌拉西林/他唑巴坦17.00(12.50)8.5916.380<0.001头孢他啶28.96(18.75)13.5737.193<0.001头孢吡肟16.81(10.00)8.5915.8000.084亚胺培南46.74(17.50)23.8265.727<0.001美罗培南34.85(6.58)19.5729.733<0.001阿米卡星5.52(1.25)2.227.0180.008庆大霉素12.25(10.00)7.227.6110.020妥布霉素8.84(8.87)6.372.4170.287左氧氟沙星25.85(10.00)18.848.0960.004环丙沙星27.02(15.00)19.399.3210.001
表4不同标本类型中不同年龄组患者分离铜绿假单胞菌对常用抗菌药物的耐药率(%)
Table4Resistance rates ofP.aeruginosafrom different specimens to antimicrobial agents commonly used in different age groups of patients(%)
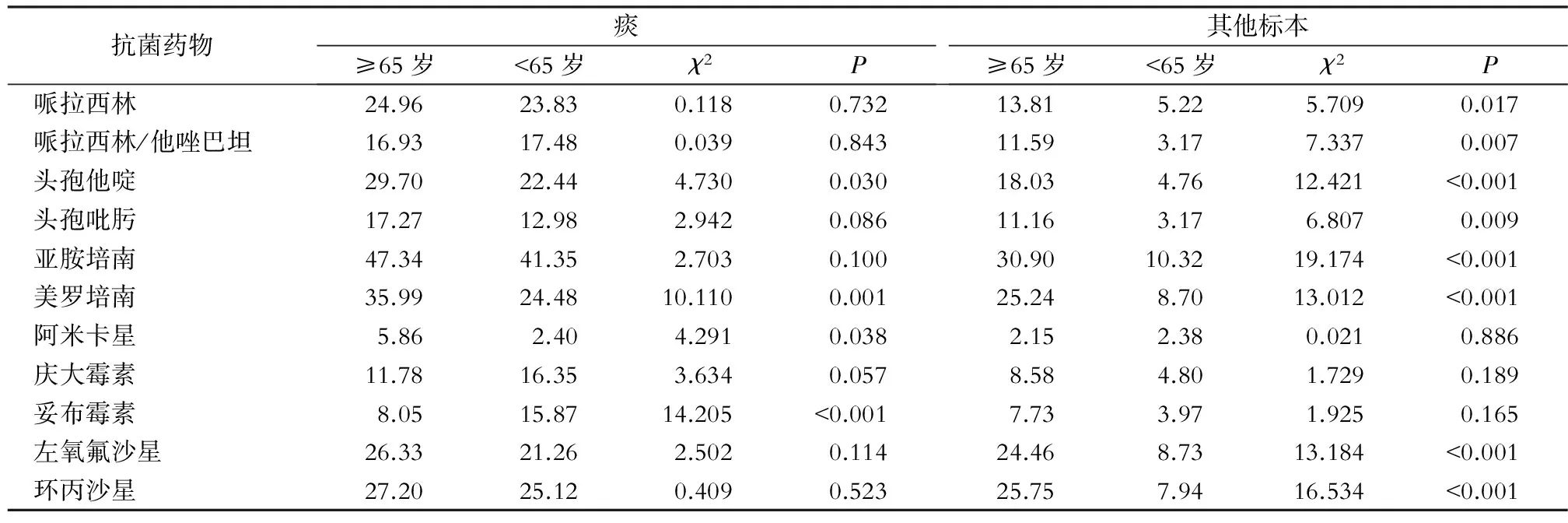
抗菌药物痰≥65岁<65岁χ2P其他标本≥65岁<65岁χ2P哌拉西林24.9623.830.1180.73213.815.225.7090.017哌拉西林/他唑巴坦16.9317.480.0390.84311.593.177.3370.007头孢他啶29.7022.444.7300.03018.034.7612.421<0.001头孢吡肟17.2712.982.9420.08611.163.176.8070.009亚胺培南47.3441.352.7030.10030.9010.3219.174<0.001美罗培南35.9924.4810.1100.00125.248.7013.012<0.001阿米卡星5.862.404.2910.0382.152.380.0210.886庆大霉素11.7816.353.6340.0578.584.801.7290.189妥布霉素8.0515.8714.205<0.0017.733.971.9250.165左氧氟沙星26.3321.262.5020.11424.468.7313.184<0.001环丙沙星27.2025.120.4090.52325.757.9416.534<0.001
2.5 不同科室分离铜绿假单胞菌对常用抗菌药物的耐药情况 不同科室分离铜绿假单胞菌对常用抗菌药物的耐药率比较,差异均有统计学意义(均P≤0.001)。除庆大霉素、妥布霉素外,ICU分离的铜绿假单胞菌对抗菌药物的耐药率均高于其他科室,为7.71%~66.02%。外科分离的铜绿假单胞菌对常用抗菌药物的耐药率相对较低,为1.69%~11.86%。见表5。

表5 不同科室分离铜绿假单胞菌对常用抗菌药物的耐药率(%)
3 讨论
铜绿假单胞菌是医院感染最常见的致病菌之一[1],其主要分离自ICU和内科病房,在住院患者中老年患者分离率高于年轻患者,其分离率可能与患者病情、机体免疫功能、住院周期和广谱抗菌药物的使用有关。痰标本是其主要来源,虽然很难明确痰标本分离的铜绿假单胞菌是定植菌还是致病菌。但有研究[2]显示痰分离铜绿假单胞菌与患者的远期病死率关系密切;而且铜绿假单胞菌主要引起肺部感染,其血培养阳性较少,判断感染与否主要依据呼吸道标本培养结果[1]。最近研究[3]证实合格痰标本与支气管肺泡灌洗液培养结果符合率达96.5%,此外,其也可能是潜在的医院感染源,所以即使来源于痰培养也应引起重视。
铜绿假单胞菌耐药性强[1,4],耐药机制复杂,且相对大肠埃希菌和肺炎克雷伯菌,铜绿假单胞菌具有更强的耐药性,其对多种抗菌药物天然耐药,且容易获得新的耐药性[5]。本研究对近5年共2 432株铜绿假单胞菌的耐药性分析发现,近5年其耐药性变化相对较小,在2014年达高峰后有所回落,可能与近5年抗菌药物使用的控制有关,因抗菌药物使用是公认的导致细菌耐药性增加的最主要原因[6],且其对所有氨基糖苷类抗生素的耐药率在近5年呈下降趋势,可能与该院近几年氨基糖苷类抗生素使用率较低有关,有研究发现敏感菌株在无抗菌药物压力存在时可能战胜耐药菌株重新成为优势菌株[7]。
进一步分析发现,不同来源的铜绿假单胞菌对抗菌药物的耐药性差异较大,与病区、标本和年龄有一定相关性。来源于痰标本的铜绿假单胞菌耐药性最强,对亚胺培南的耐药率达46.74%;而非痰标本对所有检测抗菌药物的耐药率均<30%,对亚胺培南的耐药率也仅23.82%。≥65岁患者分离铜绿假单胞菌耐药率高于<65岁患者。ICU分离铜绿假单胞菌的耐药率均较高,对亚胺培南的耐药率达66.02%,可能与其患者病情重、住院周期长等因素有关;铜绿假单胞菌在除ICU、神经科和呼吸科以外的内科病区耐药率相对较低;外科病房分离的铜绿假单胞菌对亚胺培南的耐药率最高,也仅为11.86%。研究[8]表明,抗菌药物使用量与细菌耐药率呈正相关,因此,我们分析认为铜绿假单胞菌耐药性在医院内的不均一性与抗菌药物的使用有关,且长时间体内抗菌药物亚治疗量是导致细菌耐药性增加的重要原因之一[9],老年患者及重症患者由于免疫能力较差,导致清除抗菌药物的能力降低,以至于抗菌药物半衰期延长,使机体较长暴露于亚治疗浓度,此外,老年和ICU患者口腔和机械通气管道上铜绿假单胞菌定植,及生物被膜形成,都可能使细菌处于亚治疗浓度。此外,有研究[10]发现>65岁是感染耐碳青霉烯类铜绿假单胞菌的独立危险因素。
抗菌药物是治疗细菌感染最有效的方法,及时有效的抗菌药物治疗不仅可以缩短患者住院周期[11],减少患者经济负担,还是提高患者生存质量和生存率的关键因素[12-13]。但是,抗菌药物使用也是导致细菌耐药性增加的关键因素[14],尤其是不合理的使用不仅会导致细菌耐药性增强还会导致治疗失败[15]。近年来超级细菌的不断出现被认为可能与抗菌药物滥用有关,而我国更是抗菌药物滥用的重灾区[16]。铜绿假单胞菌推荐选择对其具有抗菌活性的抗菌药物联合治疗,非多重耐药菌株感染患者症状较轻者也可选择单一抗菌药物治疗[2],然而细菌药敏结果报告通常需要较长时间,可能会延误治疗时机,所以依据细菌耐药谱制定合理的经验用药方案显得尤其重要[15]。铜绿假单胞菌是重要的医院感染致病菌,社区获得性感染少见,且定植率较高,所以及时隔离、阻断传播途径(如手卫生)、清除定植菌等措施,可能比抗菌药物使用更重要。
本研究结果表明,铜绿假单胞菌的耐药特征具有明显的不均一性,对同一种抗菌药物耐药率差异最高达3倍以上。因此,对铜绿假单胞菌的经验用药方案应参考不同病区、不同感染部位甚至不同年龄段耐药监测数据进行制定,获药敏报告以后应根据药敏结果进行个性化治疗。医院感染监控时也应考虑其耐药性的不均一性,以制定相应的医院感染控制策略。但本研究数据有限且数据仅来源于一所医院,各个医院情况(如疾病、年龄分布、抗菌药物使用情况等)可能有差异,所以仍需更多的数据支持。
[1] 中华医学会呼吸病学分会感染学组. 铜绿假单胞菌下呼吸道感染诊治专家共识[J].中华结核和呼吸杂志, 2014, 37(1):9-15.
[2] Dubourg G, Abat C, Rolain JM, et al. Correlation between sputum and bronchoalveolar lavage fluid cultures[J]. J Clin Microbiol, 53(3): 994-996.
[3] Almagro P, Salvadó M, Garcia-Vidal C, et al.Pseudomonasaeruginosaand mortality after hospital admission for chronic obstructive pulmonary disease[J]. Respiration, 2012, 84(1): 36-43.
[4] Azizov IS, Lavrinenko AV, Belyaev IA, et al. Sensitivity to antimicrobial drugs ofPseudomonasaeruginosaextreme-resis-tant strains isolated in the major hospitals of Central Kazakhstan[J]. Open Access Maced J Med Sci, 2017, 5(1): 6-8.
[5] Alikhani MY, Karimi Tabar Z, Mihani F, et al. Antimicrobial resistance patterns and prevalence of blaPER-1and blaVEB-1genes among ESBL-producingPseudomonasaeruginosaisolates in west of Iran[J]. Jundishapur J Microbiol, 2014, 7(1): e8888.
[6] Barbosa TM, Levy SB. The impact of antibiotic use on resis-tance development and persistence[J]. Drug Resist Updat, 2000, 3(5): 303-311.
[7] Kuster SP, Rudnick W, Shigayeva A, et al. Previous antibio-tic exposure and antimicrobial resistance in invasive pneumococcal disease: results from prospective surveillance[J]. Clin Infect Dis, 2014, 59(7): 944-952.
[9] Matzneller P, Krasniqi S, Kinzel M, et al. Blood, tissue, and intracellular concentrations of azithromycin during and after end of therapy[J]. Antimicrob Agents Chemother, 2013, 57(4): 1736-1742.
[11] Zhang D, Micek ST, Kollef MH. Time to appropriate anti-biotic therapy is an independent determinant of postinfection ICU and hospital lengths of stay in patients with sepsis[J]. Crit Care Med, 2015, 43(10): 2133-2140.
[12] Micek ST, Welch EC, Khan J, et al. Empiric combination antibiotic therapy is associated with improved outcome against sepsis due to Gram-negative bacteria: a retrospective analysis[J]. Antimicrob Agents Chemother, 2010, 54(5): 1742-1748.
[13] Kollef MH, Micek ST. Rational use of antibiotics in the ICU: balancing stewardship and clinical outcomes [J]. JAMA, 2014, 312(14): 1403-1404.
[14] Gaynes R, Monnet D. The contribution of antibiotic use on the frequency of antibiotic resistance in hospitals[J]. Ciba Found Symp, 1997, 207: 47-56.
[15] Blasi F, Concia E, Del Prato B, et al. The most appropriate therapeutic strategy for acute lower respiratory tract infections: a Delphi-based approach[J]. J Chemother, 2017, 29(5): 274-286.
[16] Tang Q, Song P, Li J, et al. Control of antibiotic resistance in China must not be delayed: The current state of resistance and policy suggestions for the government, medical facilities, and patients[J]. Biosci Trends, 2016, 10(1): 1-6.
