利用人工ta-siRNA策略培育抗PVY烟草
2018-03-04吴斌姜珊珊张眉徐德坤辛志梅王升吉
吴斌 姜珊珊 张眉 徐德坤 辛志梅 王升吉


摘要:人工ta-siRNA基因沉默技术具有同时表达多个ta-siRNA和产生ta-siRNA位置固定等特点,在精确性和高效性等方面有明显优势。本研究以马铃薯Y病毒(potato virus Y,PVY)外壳蛋白(coat protein,CP)为靶基因,选取不同位置的3个siRNA为靶序列,烟草TAS3a作为ta-siRNA表达的骨架,分别构建植物表达载体PVY-CP5′、PVY-CPM和PVY-CP3′,并利用叶盘法转化烟草NC89。瞬时表达检测结果显示,3个syn-tasiRNA植物表达载体均能在植物体内成功表达siRNA;抗病性鉴定发现,转PVY-CP5′、PVY-CPM和PVY-CP3′的转基因株系中抗病株系的比率分别为45.08%、27.21%、61.90%;Northern杂交分析显示,目的片段转录产物(总RNA)的积累量与植株的抗病性呈负相关,转基因植株中均有siRNA存在,表明植株的病毒抗性是由RNA介导的。
关键词:人工ta-siRNA;马铃薯Y病毒(PVY);RNA介导的病毒抗性;转基因烟草
中图分类号:S572.034文献标识号:A文章编号:1001-4942(2018)12-0086-05
RNA沉默是植物调控内源基因表达和防御外源核酸入侵的重要机制,其根本就是产生小RNA整合到RNA沉默复合体中介导靶RNA的降解或抑制其翻译[1]。其中Trans-acting siRNAs作为植物中起反式调控作用的一类siRNA[2],在植物生长发育过程中具有重要的表达调控功能。目前为止,在拟南芥中共发现4个编码ta-siRNA的TAS基因家族[3],其中TAS1和TAS2依赖于miR173的剪切作用,TAS3依赖于miR390的剪切作用,TAS4依赖于miR828的剪切作用。研究发现,TAS3基因中同时存在2个miRNA靶位点,对ta-siRNA的正确形成是必需的[4, 5],同时,TAS3基因中miR390靶位点及两个相连的ta-siRNA产生位点高度保守,目前在番茄、烟草、水稻、草莓等植物中均发现了TAS3的同源基因[6, 7]。
在此基础上一种新的植物基因沉默技术——人工trans-acting siRNA(synthetic trans-siRNA, syn-tasiRNA)建立起来,通过替换ta-siRNA序列进而干涉其他靶基因[8],其在精确性和高效性等方面有了新突破[9, 10]。de la Luz Gutiérrez-Nava等在拟南芥中用靶向FAD2的人工ta-siRNA序列替换内源ta-siRNA,有效抑制了FAD2基因的表达,达到基因沉默的效果[11];Montgomery等借助人工ta-siRNA成功抑制了拟南芥PDS基因的表达,发现替换TAS1c的miR173靶位点3′端的序列后能够产生次级siRNA,为单个syn-tasiRNA抑制多基因表达提供理论依据[12];Carbonell等针对拟南芥TAS1c建立了更为有效、更易于操作的沉默体系[13]。syn-tasiRNA的应用多见于拟南芥中TAS1的应用,Montgomery等利用拟南芥TAS3a成功抑制了拟南芥PDS基因的表达,证明TAS3用于人工ta-siRNA技术的可行性[14]。
本研究以马铃薯Y病毒为研究材料,利用烟草TAS3基因改造人工ta-siRNA表达体系,同时构建靶向PVY的人工ta-siRNA表达载体,对获得的转基因植物进行抗性等方面的分析,明确人工ta-siRNA技术在介导植物抗病毒中的可行性和有效性,为利用该策略培育高抗、多抗和高安全性的抗病毒作物提供理论依据。
1 材料与方法
1.1 材料与试剂
马铃薯Y病毒坏死株系(PVYN)繁殖并保存于烟草NC89,由作物生物学国家重点实验室植物抗病基因工程研究室馈赠;大肠杆菌DH5α、农杆菌EHA105、农杆菌LBA4404、改造后含有烟草TAS3基因的表达载体pROKⅡ-TAS3均由本实验室保存;植物转化受体烟草品种为NC89。
主要试剂:Easy Taq (5 U/μL )、10 × Easy Taq Buffer、dNTPs均购自康为世纪有限公司,T4 DNA连接酶、DNA Marker、各种限制性内切酶购于大连TaKaRa,DIG Northern Starter Kit试剂盒购于Roche公司,DNA产物纯化试剂盒、琼脂糖凝胶回收试剂盒、质粒提取试剂盒购自美国Omga公司,Trizol和反转录试剂盒购于Invitrogen公司,Hybond-N+尼龙膜购于Amersham公司,其余试剂均为国产分析纯。试验所用引物由生工生物工程(上海)股份有限公司合成。
1.2 试验方法
1.2.1 植物表达载体构建
在网络软件(http://www.ambion.com/techlib/misc/siRNA_finder.html)中分别输入PVY CP核苷酸序列,寻找潜在的可能形成siRNA的序列。将这些序列分别在烟草mRNA数据库(http://bioinfo3.noble.org/miRNA/miRU.htm)中筛选,以连续互补序列不超过5个碱基为原则,去掉可能以烟草内源mRNA为靶序列的siRNA。
针对筛选出的靶序列设计引物合成带有BspHⅠ酶切位点的靶序列,插入同樣经过酶切的植物表达载体pROK Ⅱ-TAS3中,构建植物表达载体PVY-CP5′、PVY-CPM和PVY-CP3′(表1)。
1.2.2 瞬时侵染检测植物表达载体的有效性
将构建成功的重组载体PVY-CP5′、PVY-CPM、PVY-CP3′和空载体pROKⅡ-TAS3利用冻融法导入农杆菌EHA105。用渗透培养液冲悬YEP培养的农杆菌细胞,调节浓度到OD600为0.5~1.0,室温下培养3 h,选择4 ~ 5叶期本氏烟进行注射。3 d后,提取接种叶片的siRNA,以PVY-CP为探针进行Northern blot检测,分析siRNA的表达情况。
1.2.3 转基因植株的获得及检测
利用冻融法将构建成功的植物表达载体直接导入农杆菌LBA4404,同时以pROKⅡ-TAS3的空质粒作为对照,利用叶盘法转化烟草NC89,获得转基因植株,并进行PCR鉴定。
1.2.4 [JP3]转基因植株的抗病性分析
待烟草长至4~5片叶时,选取感染PVYN的烟草叶片,按1∶10(w/v)比例用磷酸缓冲液(PB,pH 7.4)研磨,汁液摩擦接种,同时以非转基因的野生型烟草NC89及转pROKⅡ-TAS3的转基因烟草为对照,在接种后45 d内每天观察记录症状。
1.2.5 转基因植株的Northern blot分析
随机选取部分抗病和感病的转基因植株及对照植株,进行Northern blot分析。Trizol法提取植株基因组总RNA,电泳和分光光度计确定RNA浓度后,每个样品约取20 μg,进行甲醛变性凝胶电泳分离,借助核酸印记仪转移至HybondTM-N+尼龙膜上,80℃固定2 h。杂交RNA探针设计合成及Northern blot杂交分析按说明书的方法进行。
借助Pure LinkTM miRNA Isolation Kit(Invitrogen)提取转基因植株的siRNA,经15%聚丙烯酰胺凝胶电泳分离后,电转仪20 V转移1 h至HybondTM-N+尼龙膜上,6 000 mJ强度下UV光线交联1 min固定,杂交方法与总RNA Northern blot分析方法相同。
2 结果与分析
2.1 syn-tasiRNA结构植物表达载体的构建
将构建完成的重组表达载体利用热激法转化大肠杆菌DH5α。随机选取抗性菌落,以pROKⅡ-3′引物作为上游引物,以插入片段自身的5′端引物作为下游引物进行PCR检测,以空质粒pROKⅡ-TAS3为阴性对照。结果显示:各抗性菌落均扩增到170 bp左右的片段,表明各片段已成功连入pROKⅡ-TAS3载体中。
2.2 瞬时表达后siRNA的检测
为了检测构建植物表达载体的有效性,将3个表达载体转化农杆菌EHA105后瞬时侵染本氏烟。利用空载体pROKⅡ-TAS3处理的烟草上没有检测到病毒CP基因特异siRNA的积累,而利用各重组载体处理的烟草叶片上均能检测到siRNA积累,表明构建的syn-tasiRNA载体能成功诱导植物体自身的RNA沉默系统,识别dsRNA,产生siRNA。
2.3 转基因烟草的获得
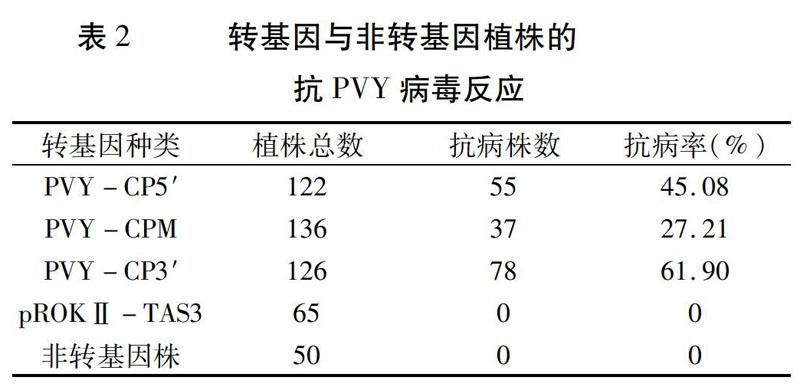
将构建的植物表达载体通过冻融法转化农杆菌LBA4404,并利用叶盘法转化烟草NC89。植株经PCR检测后,共获得转PVY-CP5′载体的植株122株,转PVY-CPM载体的植株136株,转PVY-CP3′载体的植株126株,转pROK Ⅱ-TAS3的植株65株。转基因植株在生长发育和形态性状等方面与非转基因植株无明显差异。
2.4 转基因烟草的抗病性分析
在烟草摩擦接种PVYN10天左右,所有转pROKⅡ-TAS3和非转基因植株均表现出花叶和脉坏死症状,而其余三种转基因植株均表现出抗病或者感病两种类型,且感病植株症状与非转基因植株相同,抗病植株全生育期无病毒感染症状产生,与健康对照无明显差异。抗性检测结果(表2)表明,不同的转基因植株对PVY的抗性存在明显差异。
2.5 转基因烟草的Northern blot分析
随机选取转化各载体中部分抗病和感病的转基因烟草进行Northern杂交分析。结果显示,转PVY-CP5′、PVY-CPM和PVY-CP3′的植株均检测到特异的杂交信号,表明外源基因在转录水平上均得到正常表达,且抗病植株中RNA的积累量明显低于同类型的感病植株,即目的片段转录产物的积累量与病毒抗性呈负相关;而转pROKⅡ-TAS3烟草中没有检测到任何杂交信号。Northern blot分析结果表明转基因植株对PVY的抗性是由RNA介导的。
2.6 转基因烟草植株中siRNA的杂交分析
为进一步探讨抗病植株的抗性是否由RNA介导及抗性与siRNA积累量之间的关系,随机选取转化各载体中部分抗病和感病的转基因烟草进行siRNA的Northern杂交分析。结果显示,抗病和感病的转基因烟草中均能检测到siRNA特异条带,且抗病植株中siRNA的积累量明显高于同类型的感病植株,即目的片段转录产物的积累量与病毒抗性呈正相关。结果进一步表明植株对PVY的抗性是由RNA介导的。
3 讨论与结论
RNA介导病毒抗性具有特异性强、抗性持久、抗病程度高等特点[15],已广泛应用于植物基因功能研究和作物抗病育种等领域。相比其他RNA介导病毒抗性方法,syn-tasiRNA有多方面优势,在基因沉默的准确性和高效性方面有新的突破。首先,ta-siRNA是由植物内源基因编码,不易与内源基因发生同源重组,具有更高的生物安全性;其次,能产生可控的21碱基的siRNA,较为有效地避免潜在的脱靶现象;最后,可以同时表达多个ta-siRNA并且产生ta-siRNA位置固定,更易于将多个siRNA序列构建到同一个载体中,进而借用一个表达载体沉默多个基因[16]。本研究利用syn-tasiRNA策略构建了靶向PVY CP syn-tasiRNA重组载体,获得抗PVY的烟草植株,Northern blot分析表明该抗性是由RNA介导产生的,证明了syn-tasiRNA在抗病毒作物培育上的可行性和高效性,同时为进一步利用该策略培育高抗、多抗和高安全性的抗病毒作物提供理论依据。
前期的研究表明,RNA沉默的效率多与靶序列的结构密切相关,复杂的靶序列结构导致siRNA难以结合,进而降低沉默效率。局部最小自由能ΔGloc往往用于體现靶序列二级结构的复杂程度,靶序列的内部结构越稳定表现为ΔGloc越低,越不利于siRISC复合物的亲近[17]。本试验中,靶向PVY CP基因不同区段syn-tasiRNA的转基因植株对PVY的抗性存在明显差异,分析可能与靶序列的二级结构有关。借助Mfold(http://www.bioinfo.rpi.edu/applications/mfold)预测PVY CP基因序列的二级结构,并统计各靶序列的ΔGloc,结果(表3)发现,具有较低抗病性载体靶向的区段具有较低的ΔGloc,与ΔGloc所代表的结构稳定性规律相符合,表明syn-tasiRNA培育抗病毒植株策略中靶序列的二级结构和抗病效率之间存在相关性。
参 考 文 献:
[1] Fire A,Xu S, Montgomery M K, et al. Potent and specific genetic interference by double- stranded RNA in Caenorhabditis elegans[J]. Nature, 1998, 391(6669): 806-811.
[2] 謝兆辉. 小RNAs作用机制的研究进展[J]. 遗传, 2009, 31(12): 1205-1203.
[3] Rajauopalan R, Vaucheret H, Trejo J, et al. A diverse and evolutionarily fluid set of microRNAs in Arabidopsis thaliana[J]. Genes Development, 2006, 20(24): 3407-3425.
[4] Axtell M J, Jan C, Rajagopalan R, et al. A two-hit trigger for siRNA biogenesis in plants[J]. Cell, 2006, 127: 565-577.
[5] Zhang C, Ng D W, Lu J, et al. Roles of target site location and sequence complementarity in trans-acting siRNA formation in Arabidopsis[J]. The Plant Journal, 2012, 69(2): 217-226.
[6] Krasnikova M S, Milyutina A I, Bobrova V K, et al. Novel miR390-dependent transacting siRNA precursors in plants revealed by a PCR-based experimental approach and database analysis[J]. Journal of Biomedicine and Biotechnology, 2009, 2009: 952304.
[7] 李贺, 毛健鑫, 戚华彩, 等. 草莓miR390靶基因TAS3的克隆及表达分析[J]. 西北植物学报, 2013, 33(11): 2153-2158.
[8] 张晓辉, 邹哲, 张余洋, 等. 从反义RNA到人工miRNA的植物基因沉默技术革新[J]. 自然科学进展, 2009, 19(10): 1029-1037.
[9] Pandey P, Senthil-Kumar M, Mysore K S. Advances in plant gene silencing methods[C]//Mysore K, Senthil-Kumar M(eds). Plant Gene Silencing:Methods in Molecular Biology, Humana: New York, 2015, 1287: 3-23.
[10]deAlba A E M, Parent J, Vaucheret H. Small RNA-mediated control of development in plants[J]. Epigenetic Memory and Control in Plants, 2016, 2: 177-199.
[11]de la Luz Gutiérrez-Nava M, Aukerman M J, Sakai H, et al. Artificial trans-acting siRNAs confer consistent and effective gene silencing[J]. Plant Physiol., 2008, 147(2): 543-551.
[12]Montgomery T A, Yoo S J, Fahlgrena N, et al. AGO1-miR173 complex initiates phased siRNA formation in plants[J]. Proc. Natl. Acad. Sci. USA, 2008, 105(51): 20055-20062.
[13]Carbonell A, Takeda A, Fahlgren N, et al. New generation of artificial microRNA and synthetic trans-acting small interfering RNA vectors for efficient gene silencing in Arabidopsis[J]. Plant Physiology, 2014, 165(1): 15-29.
[14]Montgomery T A,Howell M D, Cuperus J T, et al. Specificity of ARGONAUTE7-miR390 interaction and dual functionality in TAS3 trans-acting siRNA formation[J]. Cell, 2008, 133(1): 128-141.
[15]Matzke M, Matzke A J M, Kooter J M. RNA: guiding gene silencing[J]. Science, 2001, 293(5532): 1080-1083.
[16]Baykal U, Zhang Z. Small RNA-mediated gene silencing for plant biotechnology[M]. Gene Silencing: Theory, Techniques and Application, 2010.
[17]Schubert S,Grunweller A, Erdmann V A, et al. Local RNA target structure influences siRNA efficacy: systematic analysis of intentionally designed binding regions[J]. Journal of Molecular Biology, 2005, 348(4): 883-893.
