2012年夏季水团输送对挪威-格陵兰海营养盐及浮游植物群落结构的影响
2018-03-03辜帆金海燕庄燕培张扬卢勇王斌陈建芳
辜帆 金海燕 庄燕培 张扬 卢勇 王斌 陈建芳
(国家海洋局海洋生态系统和生物地球化学重点实验室,国家海洋局第二海洋研究所,浙江 杭州 310012)
0 引言
营养盐作为海洋生物生长不可缺少的微量元素,是海洋初级生产力和食物链的物质基础,其分布受海流搬运及一系列海洋生物地球化学过程的影响。营养盐的含量与海洋生物的活动有非常密切的联系,Redfield提出生物在吸收这些元素时是按比例进行的(N∶P∶Si=16∶1∶16)[1],浮游植物生长所需无机氮、磷酸盐、硅酸盐的最低阈值为1.0 μmol·L–1、0.1 μmol·L–1、2.0 μmol·L–1[2]。通常对光辐射和营养盐的竞争是浮游植物演替的主要驱动力[3]。营养盐要素对浮游植物的群落组成结构具有明显的影响作用。上升流富营养区域主要由粒径较大的小型浮游植物(如硅藻)占据着,而微微型浮游植物则是寡营养海区主要的群落组成[4]。
格陵兰海和挪威海位于北大西洋高纬区域,是北冰洋与大西洋的主要物质和能量交换通道,同时也是大西洋深层水形成的源头[5-6]。气候变暖加速了格陵兰冰盖融化,加大了对大西洋的淡水注入[7-8],深层海水呈现淡化的趋势,有可能影响大洋传送带,对全球气候变化产生影响[8]。同时北欧海特殊的冷暖流交汇的海洋环境也造成了北欧海区域的营养盐分布的差异,原先在不同水体中的浮游生物及鱼类也会在锋面聚集,甚至对渔业资源造成影响[9]。浮游植物通过光合作用,将无机碳转化为有机碳,并通过食物网向更高营养级传递。当因环境变化引起的浮游植物初级生产力增加时,也会引起鱼类生产力的增加,其表现为更高的丰度和更快的生长速率[9]。所以了解这一海区的营养盐及浮游植物的分布具有重要的意义。
挪威-格陵兰海区域主要受两大流系的影响,一是温暖高盐的大西洋入流,二是低温低盐的极地水[10-11],其营养盐的分布在各个不同的水团中具有明显的差异,同时各个季节混合层深度的变化与浮游植物的分布和生产力的变化有密切的联系[11-15]。因此,不同水团对浮游植物群落的分布有不同的影响,研究水团输送对营养盐及浮游植物群落结构的影响具有重要的意义。浮游植物细胞内具有不同的光合色素种类,含量也不相同。一些浮游植物由于具有其特征色素,可以利用其特征色素的标志性来研究和表征浮游植物群落结构[16],利用浮游植物特征色素表征浮游植物群落结构的研究在北极及亚北极区域也开展了一些工作[17-18],王肖颖等[19]对挪威-格陵兰海域浮游植物特征色素进行了研究,并通过CHEMTAX分析了该海域表层和次表层浮游植物群落组成,但没有就水团输送对营养盐及浮游植物群落结构影响进行展开分析。本文以挪威-格陵兰海200 m以浅为研究区域,使用浮游植物光合色素来指征高纬度海域浮游植物群落组成及空间分布,并分析了区域营养盐要素的分布特征,探讨水团输送对营养盐分布及浮游植物群落结构的影响。
1 材料与方法
1.1 调查区域及样品采集
依托“雪龙”号科考船,于中国第五次北极科学考察(2012年的6月27日-9月27日)期间,首次在北大西洋挪威海和格陵兰海区域进行了多学科综合调查,在AT断面和BB断面共16个站位进行了营养盐的分析,其中选择 BB01、BB03、AT07、AT09、AT10五个站位进行了光合色素样品的采集和分析工作,具体站位如图1所示。
本次调查海水中所有水样均用 Sea-Bird SBE9配有的10 L Niskin 采水器采集,通过一根乳胶管用少量水样冲洗水样瓶2—3次,采集水样约500 mL,水样采集后上层海水立即经0.45 μm醋酸纤维膜过滤,分装。过滤的水样在0.4℃下冷藏保存,在短时间内(< 48 h)使用Skalar营养盐自动分析仪测定。叶绿素样品的采集使用ROSETTE采水器,采集按标准层或根据海区的真光层深度、跃层分布特点确定采样深度。色素样品采集4 L的上层海水,在低照度低压条件下(< 0.5 atm)使用 Whatman GF/F 膜(φ47 mm,0.7 μm)过滤,滤膜置入冻存管保存于−80℃冰箱。温度和盐度数据由“雪龙”号科考船的船载CTD得到。

图1 挪威海和格陵兰海区域营养盐及光合色素采样站位及上层流场示意图.绿点表示光合色素采样站,红线表示大西洋入流,蓝线表示北冰洋出流Fig.1.Sampling sites of nutrients and pigments and upper layer circulation in Norwegian Sea and Greenland Sea
1.2 样品分析
1.2.1 营养盐分析
海水中磷酸盐、硝酸盐和硅酸盐测定采用营养盐自动分析仪现场测定,其方法分别为磷钼蓝法、铜镉柱还原法和硅钼蓝法。详见 1999年Grasshoff 等[20]出版的《海水分析方法》(Methods of seawater analysis)及我国《海洋调查规范》[21]。本次考察现场测定及试剂配制所用水均为Millipore超纯水(18.2 MΩ)。
1.2.2 色素分析
色素分析,将冷冻滤膜以 3 mL 100%甲醇(HPLC级)于−20 ℃冷藏萃取,1 h后超声30 s(冰浴)并接着萃取 1 h。萃取液滤过 0.2 μm 滤膜保存于CNW棕色瓶,并与四丁基醋酸铵(TBAA,28 mM)1︰1混合进样。色谱系统为Waters 600色谱工作站,色谱柱为 Eclipse XDB C8 柱(150×4.6 mm,3.5 μm),检测器为Waters 2998多极管阵列检测器。色素分析参考 Zhuang等[18]的方法,使用梯度淋洗程序为:(0 min,90%A,10%B),(36 min,5%A,95%B),(41 min,5%A,95%B),(42 min,90%A,10%B),(56 min,90%A,10%B),流速 1 mL·min–1,柱温 45°C。流动相 A 液为 TBAA(28 mmol·L–1)︰甲醇=30︰70,B液为100%甲醇,检测波长为450 nm。通过对照色素标准色谱峰保留时间与光谱特性,分别对叶绿素(Chlorophylls)和类萝卜素(Carotenoids)进行定性。使用外标法定量,色素标准为已知浓度的液体标样,购自丹麦14C检测中心(International Agency for14C determination,Danmark)。
1.3 数据分析
采用CANOCO 4.5软件对各站位各层浮游植物特征色素和环境因子进行梯度分析,首先将特征色素数据进行去趋势对应分析(DCA),并根据DCA分析结果中各排序轴长度决定排序的模型(如排序轴长度>4,选择单峰模型; 反之,则选择线性模型),结果显示,排序轴最大梯度长度为 0.983,因此选用冗余分析(RDA)线性模型进行分析。
2 结果
2.1 挪威-格陵兰海温盐及营养盐分布特征
如图2所示,AT断面 200 m以浅温度为3.07—11.64℃,盐度为34.94—36.26。AT断面上层海流主要受大西洋入流的影响,随纬度升高,表层次表层温度降低,盐度升高。以AT08站为界100 m以深存在比较明显的温盐差异,大西洋水从 AT08站开始出现有一个显著的下沉现象,温盐等值线加深。
如图3所示,BB断面 200 m以浅温度为−0.43—9.14℃,盐度为 34.85—35.18。BB 断面上层冷暖水团的交汇非常明显,在BB04和BB05之间形成了明显的温度、盐度锋面。大西洋的水通过莫恩海脊(Mohn Ridge)向南,与相对低温的北冰洋冷水相遇,使莫恩海脊两端温盐差异明显。在位于挪威海的BB01—04站,盐度值为35.00—35.20,表层温度>10℃,随深度的加深温度下降;位于格陵兰的 BB05—09站,盐度值为 34.70—35.00,表层温度由于太阳辐射的影响,在4—6℃,50 m 以下基本< 0℃,是典型的受北冰洋水影响明显的水体。
如图2所示,AT断面200 m以浅硝酸盐浓度为2.0—16.1 μmol·L–1,平均浓度为 9.0(±5.0) μmol·L–1,其中AT10、AT09、AT08站次表层30 m以浅相对其他站位浓度较低,硝酸盐消耗较多。50 m层营养盐分布比较均匀; 50 m以深,浓度等值线随着纬度升高而加深。在 AT10、AT09、AT08站100 m以深硝酸盐浓度有一个抬升,最高浓度分别为15.0 μmol·L–1、14.8 μmol·L–1、13.8 μmol·L–1。磷酸盐浓度为 0.21—0.98 μmol·L–1,平均浓度为 0.65(±0.29)μmol·L–1,与硝酸盐类似,浓度值在表层和次表层值达到最低,纬度较低的 AT10、AT09、AT08站 30 m以浅的浓度值相对较低,但 100—200 m浓度值相对其他站位要高。50 m以深,浓度等值线随着纬度升高加深。硅酸盐浓度为 0—4.3 μmol·L–1,平均浓度为 1.8(±1.6)μmol·L–1。可以看出,对于硝酸盐、磷酸盐来说,在上层浓度就已接近最低值,在下层海水中浓度增加的速度相对缓慢。硅酸盐的含量随深度的增加而均匀增加,50 m以浅硅酸盐浓度分布均匀,表层硅酸盐几乎被消耗殆尽,50 m以深,同样浓度等值线也随着纬度升高加深。在AT10、AT09、AT08站100 m以深硅酸盐浓度与硝酸盐、磷酸盐一样存在相对高值,最高值分别为4.3、3.9 和 3.4 μmol·L–1。
如图3所示,BB断面200 m以浅,温度和盐度的变化非常明显,BB04、BB05断面之间可以明显地看出上层的两个冷暖水团交汇特征。200 m以浅硝酸盐浓度为 2.5—14.1 μmol·L–1,平均浓度为 8.9(±3.8)μmol·L–1,BB03、BB04 站硝酸盐浓度等值线有一个明显的上升,在莫恩海脊以南上层硝酸盐浓度要高于以北。200 m以浅磷酸盐浓度为0.32—0.97 μmol·L–1,平均浓度为 0.71(±0.22)μmol·L–1; 在表层,BB04、BB07站的磷酸盐浓度仍然具有相对的一个高值,但50 m以深,在BB05、BB06、BB07站即莫恩海脊以北具有相对高的浓度。200 m以浅硅酸盐浓度为 0—4.6 μmol·L–1,平均浓度为1.8(±1.6)μmol·L–1,硅酸盐在表层除了 BB04 站,基本都处于几乎耗尽的状态,100 m以上,随着纬度的升高,浓度等值线下降; 但在 150 m左右的BB05、BB06、BB07、BB08、BB09 站(莫恩海脊以北)有一个明显的相对高值的分布。
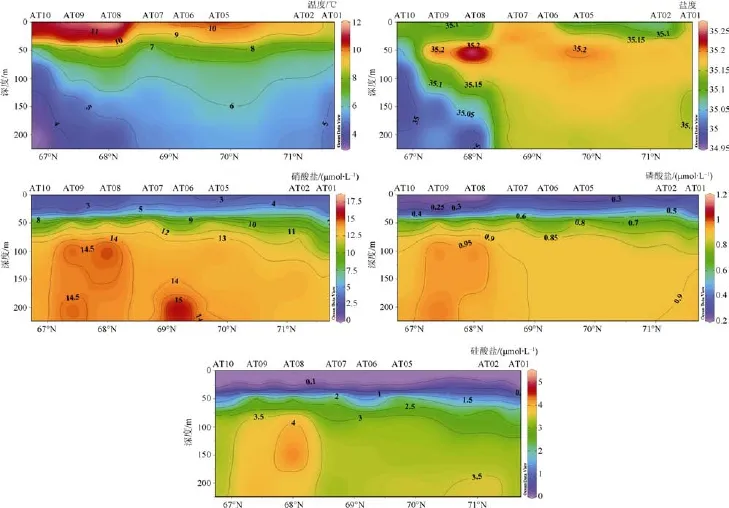
图2 AT断面表层200 m温、盐、营养盐分布Fig.2.Distribution of temperature,salinity and nutrients above 200 m at section AT
从表层看,AT断面的营养盐浓度相对于BB断面来说较低,磷酸盐和硝酸盐浓度随纬度增加先升高后降低,在AT07有一个高值,而硅酸盐没什么变化。BB断面表层的营养盐浓度随纬度的增高先升高再降低,在 BB04站出现营养盐的高值。从底层看,AT断面的营养盐浓度相对于BB断面来说较高,底层营养盐在AT08存在高值,在BB08站存在低值。
2.2 挪威-格陵兰海色素分布
光合色素的高效液相色谱分析的结果表明:BB01、BB03、AT07、AT09、AT10五个站位主要的色素类群有叶绿素 a(Chl a)、岩藻黄素(Fucoxanthin)、19-已酰氧基岩藻黄素(19’-hex-fucoxanthin)、硅甲藻黄素(Diadinoxanthin)、19-丁酰氧基岩藻黄素(19’-but- fucoxanthin)和青绿黄素(Prasinoxanthin)。其中叶绿素在大部分藻类中都含有,岩藻黄素和硅甲藻黄素为硅藻的特征色素,19-已酰氧基岩藻黄素为定鞭藻的特征色素,19-丁酰氧基岩藻黄素为金藻的特征色素,青绿黄素为青绿藻的特征色素。各站位主要特征色素分布情况如图4所示。通过对色素的检测发现Chl a和Fuco均在 BB03站位 30 m 处达到最大值 0.81 μg·L–1和 0.67 μg·L–1; But-fuco 和 Hex-fuco 在 BB03 站位20 m 处达到最大值 0.069 μg·L–1和 0.24 μg·L–1;Diadino的最高值出现在AT09站位的表层,浓度为 0.11 μg·L–1; Prasino的最高值出现在BB01站位的 30 m 层,浓度为 0.017 μg·L–1。从图4 中可以看出,各站位叶绿素a、岩藻黄素和青绿黄素变化趋势大致相同,呈现表层较低,随深度增加在次表层达到最高,然后降低的变化趋势。19-已酰氧基岩藻黄素,在各站位变化趋势虽然与叶绿素a相似,但其最大值出现在水更浅处。除 BB03站位外,硅甲藻黄素均呈现随水深增加而浓度降低的分布情况。
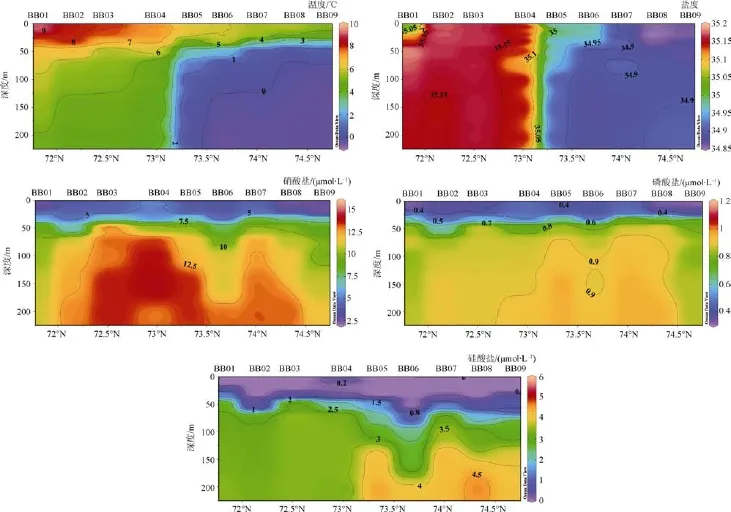
图3 BB断面200m温、盐、营养盐分布Fig.3.Distribution of temperature,salinity and nutrients above 200 m at section BB
3 讨论
3.1 水团对营养盐的输送
由图5a可以看出,BB断面不同盐度的营养盐浓度具有明显的差异(以硝酸盐为例),可以将其分成两部分,看不同水团影响下营养盐的结构。挪威海和格陵兰海区上层主要受到大西洋入流和北冰洋出流的影响,温暖高盐的大西洋暖流主要通过冰岛-法罗海脊(Iceland-Scotland Ridge)进入 GIN海域(格陵兰海、冰岛海和挪威海的统称),主要分为两个分支: 挪威-大西洋流(Norwegian Atlantic Current)和挪威-大西洋梯度流(Norwegian Atlantic Slope Current)[6,22]。从图5b中可以看出,当盐度低于35时(椭圆区域),其N/Si偏低表现为N的相对不足; 当盐度高于35时(矩形区域),其N/Si较高表现为N的相对充足,反映出不同水团具有不同的营养盐结构。相关文献表明: 大西洋水的温度为 7.0—8.5℃,盐度为 35.1—35.3,大西洋水团表层温度夏季可以达到 12℃[4]; 而北冰洋水温度全年一直比较低,表层在 3.3℃左右,夏季受表层太阳辐射的影响,温度会相对较高。通过弗拉姆海峡往南的北冰洋水团的温度一般<0℃,盐度值在35以下[11]。大西洋在全球海洋中具有最强的固氮作用[23],而硅酸盐浓度在大洋中的分布与水体的形成时间有关,在大洋环流中,大西洋是最年轻的大洋,同时具有最低的硅酸盐浓度。Rey[24]发现挪威海域硅藻的生长受到硅的限制,而磷的限制作用最低。北冰洋上层是大洋中氮限制最显著的水体,其上层营养盐与大西洋入流存在明显的营养盐结构差异[17]。
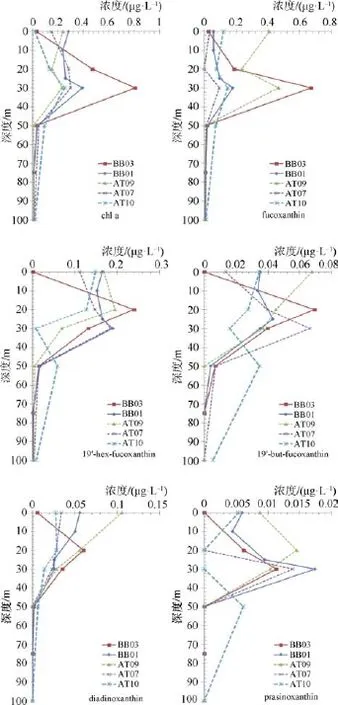
图4 BB01、BB03、AT07、AT09、AT10站位主要色素结果Fig.4.Results of major phytoplankton pigments of the sites BB01,BB03,AT07,AT09 and AT10
由图6表明,在挪威海海域和格陵兰海域200 m水层以浅,营养盐之间存在很高的相关关系,表明两海域营养盐具有相同的来源或者相同的生物地球化学过程。从回归结果来看,AT断面和BB01—04站ΔN/ΔP比值分别为17.09和17.48,高于 Redfield比值 16[25]。与北冰洋 N限制水体的混合造成BB05—09站ΔN/ΔP比值相对较低为16.0,但总的来说,无机氮和磷酸盐相对丰富,并且自上而下升高,基本能满足浮游植物的生存需要,且大西洋上层水体对格陵兰海具有明显的硝酸盐输运作用。从回归结果来看,ΔN/ΔSi比值在AT断面、BB01—04站和BB05—09站分别为3.01、2.49和1.88,与Redfield比值偏离较大,表明水体中硅酸盐相对于硝酸盐远远不足,且 SiO32–< 2 μmol·L–1表现为显著的硅限制,但随着纬度的升高,这种硅限制程度降低,说明北冰洋水存在相对含量高的硅酸盐的输送(按照Redfield比值1∶1[25])。
3.2 浮游植物分布的主要影响因素
混合层对海洋生物生产力有非常重要的影响[11-12,26]。大西洋水和北冰洋水的混合层变化机制非常相似,冬季混合层深度受上层温暖的大西洋水控制,而夏季混合层深度主要受表层太阳辐射的影响[26],Mueter等[27]发现在挪威海海域,夏季海表温度和生物生产力有显著的关系,也认为在亚北极地区水体的混合是决定浮游植物对光和营养盐的利用的重要因素,受到大尺度的气象过程影响。夏季大西洋水和北冰洋水的混合层深度都非常浅,约在20 m左右,冬季混合层深度大约可以达到300 m左右[12]。
浮游植物的群落结构会受环境因子的影响,同时浮游植物的旺发及群落组成结构会对营养盐分布产生影响,由于温盐跃层以及低营养盐水的输入限制了水体的垂直混合,表层水的营养盐随着生物的利用往往表现为贫营养[28]。通过 RDA分析到的结果(图7)显示,温度及各项营养盐对浮游植物群落结构影响较大,盐度与浮游植物群落结构影响较小。其中,温度与各项色素间表现为正相关关系,各营养盐与各色素间表现为负相关关系,因此可以表明,浮游植物的利用对营养盐在海水中的浓度存在着一定的影响。根据图7,硅甲藻黄素与温度的相关性最高,因为硅甲藻黄素作为光保护色素在光强较高的区域的浮游植物体内大量存在,而表层海水因受光照最强温度也最高; 从图4中也可以看出硅甲藻黄素在垂直分布上呈现从表层到次表层的递减,与温度的变化情况相同,因此呈现出很高的相关性。同样,岩藻黄素与Si的负相关性最显著,表明硅藻与硅酸盐间的负相关关系,因硅藻黄素是硅藻的特征色素,硅藻在旺发过程中消耗水体中 Si,且基本耗尽,呈现出其特征色素与硅酸盐浓度的显著负相关性,进一步表明浮游植物利用对营养盐在海水中浓度的影响。
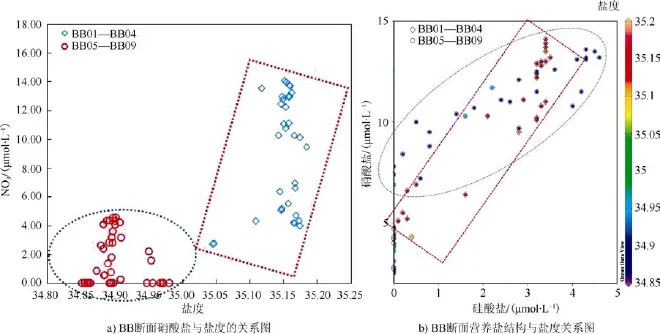
图5 BB断面营养盐浓度及N/P结构与盐度分布Fig.5.Relationship between nutrients,N/P and salinity on section BB.a) relationship between nitrate and salinity,b) relationship between the structure of nutrients and salinity
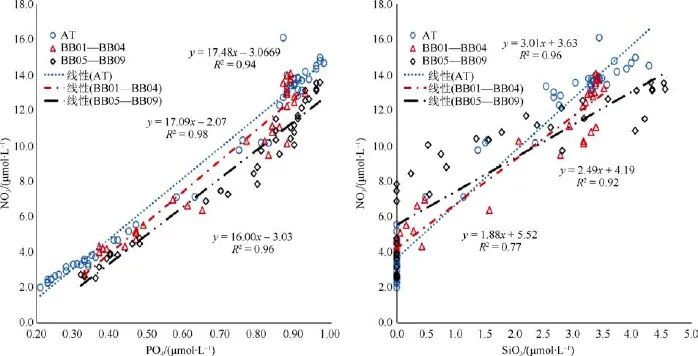
图6 AT断面、BB01—BB04站、BB05—BB09站营养盐浓度相互关系图Fig.6.Relationship between nutrients on section AT,sites BB01—BB04 and sites BB05—BB09
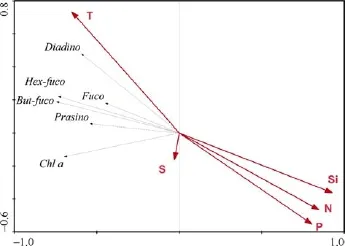
图7 浮游植物色素与环境因子的RDA排序图(累计解释率为41.3 %)Fig.7.RDA ordination plot of pigments and environmental variables(Cumulative percentage variance of species data=41.3%)
在挪威海海域,浮游植物生产力和生物量随季节的变化非常明显,冬季和春季初,浮游植物生产力和生物量比较低,从4—6月因上层水体的增温会出现浮游植物的旺发; 7—8月为浮游植物的旺发后期,表现为生物量的下降; 9—10月出现一个小型而短暂持续的秋季旺发,而后浮游植物生物量降低[15]。营养盐浓度在将近40 m以浅的深度很低,硅酸盐呈现耗尽的一个状态,叶绿素浓度主要在50 m以浅有较高的浓度。说明在混合层以下,仍然存在浮游植物消耗营养盐。通过色素结果可以发现,Fuco的浓度在次表层最高,But-fuco和Hex-fuco在表层最高,次表层较低,这表明,硅藻更易聚集于温跃层上方,而定鞭金藻、金藻更偏向于表层水体。Zhuang等[18]在对夏季北白令海的浮游植物群落结构研究中认为硅藻更易于聚集在跃层的下方是由于主动运动的能力较弱,而鞭毛藻与硅藻相比在低营养条件下更具有竞争力,且因为具有鞭毛的缘故具有主动活动性,故容易聚集于混合层。与次表层的高值不同的是,BB03站位表层各项色素浓度都非常的低。Colebrook[29]认为在北大西洋浮游植物不是由营养盐限制的而是被浮游动物摄食所控制。因此BB03站位表层色素浓度低的可能原因是浮游动物摄食对浮游植物的生物量造成了影响。在AT09表层、次表层,叶绿素浓度具有相对高值分布,但具有明显的温盐和营养盐特征。AT09站位表层温度具有高温高盐的特征,与AT10站位有明显差异。50 m以浅营养盐浓度相对较低,但在50 m以深有一个明显的营养盐的上涌现象。说明大约在AT09的位置,大西洋入流分支挪威-大西洋流流经区域,输入了营养盐,浮游植物向温度更高、营养盐更充分的区域聚集,消耗营养盐,造成了 AT09表层、次表层的叶绿素高值和营养盐低值。一般,Fuco的浓度较But-fuco和Hex-fuco高,但在部分站位表层Hex-fuco高于Fuco,由此可见挪威-格陵兰海区夏季浮游植物以次表层硅藻为主,在表层部分站位表现为以硅藻及定鞭金藻为主的情况。春季随着光限制的减少,层化加强[11],同时营养盐相对较充分,产生硅藻的旺发,成为优势种。Dale等[15]在1999年的研究发现,在春季旺发过后,夏季因营养盐的限制,生产力降低,硅藻的数量有所减少,部分被鞭毛藻类、颗石藻类所替代。王肖颖等[19]利用Chemtax对2012年挪威-格陵兰海域分级色素进行分析后得出小型浮游植物中硅藻对叶绿素 a的贡献最大,表明硅藻在浮游植物中占优势地位,在微型和微微型中以硅藻和定鞭藻占优势。
4 结论
1.AT断面上层主要受大西洋入流影响; 在BB断面莫恩海脊处(BB04和BB05站位之间)大西洋水和北冰洋水相遇形成明显的温度、盐度锋面。挪威海和格陵兰海域200 m以浅水层营养盐具有相同的来源或相似的地球化学过程,但由于北冰洋N限制水体的输入,莫恩海脊以北ΔN/ΔP相对较低; 大西洋上层水体则对格陵兰海具有明显的硝酸盐输运。挪威海和格陵兰海域上层水体中硅酸盐相对于硝酸盐远远不足,且呈显著硅限制,随纬度升高硅限制降低,表现为北冰洋入流水的硅酸盐输送。
2.挪威-格陵兰海区夏季浮游植物在表层以硅藻或硅藻和定鞭金藻为主,在次表层以硅藻为主。色素与温度表现为正相关关系,色素与营养盐间表现为负相关关系,表明浮游植物的利用对营养盐在海水中的浓度存在着一定的影响。由于大西洋入流分支挪威-大西洋流流经区域的影响,输入了营养盐,浮游植物向温度更高、营养盐更充分的区域聚集,造成了水体表层、次表层叶绿素高值而营养盐低值的出现。Fuco、But-fuco和Hex-fuco分布情况的不同表明硅藻更易聚集于混合层下方温跃层上方,定鞭金藻更偏向于表层水体且在低营养盐条件下更具竞争力。
致谢感谢中国第五次北极科学考察期间全体“雪龙”号船员和科考队员的无私帮助; 同时感谢国家海洋局极地考察办公室对现场考察及研究项目的资助。
1 Redfield A C.The influence of organisms on the composition of sea-water[J].Mat Zametki,1963,40(6): 640—644.
2 Justić D,Rabalais N N,Turner R E,et al.Changes in nutrient structure of river-dominated coastal waters: stoichiometric nutrient balance and its consequences[J].Estuarine,Coastal and Shelf Science,1995,40(3): 339—356.
3 Chisholm S W.Phytoplankton size[M]//Falkowski G P.Primary Productivity and Biogeochemical Cycles in the Sea.Woodhead AD:Plenum Press,1992: 213—237.
4 Falkowski P G,Katz M E,Knoll A H,et al.The evolution of modern eukaryotic phytoplankton[J].Science,2004,306(5705): 354—360.
5 Dickson R R,Brown J.The production of North Atlantic deep water: sources,rates,and pathways[J].Journal of Geophysical Research:Oceans,1994,99(C6): 12319—12341.
6 Hansen B,Østerhus S.North Atlantic–Nordic Seas exchanges[J].Progress in Oceanography,2000,45(2): 109—208.
7 Aagaard K,Carmack E C.The role of sea ice and other fresh water in the Arctic circulation[J].Journal of Geophysical Research,1989,94(C10): 14485—14498.
8 Schlosser P,Bönisch G,Rhein M,et al.Reduction of deepwater formation in the Greenland Sea during the 1980s: evidence from tracer data[J].Science,1991,251(4997): 1054—1056.
9 Loeng H,Drinkwater K.An overview of the ecosystems of the Barents and Norwegian Seas and their response to climate variability[J].Deep Sea Research Part II: Topical Studies in Oceanography,2007,54(23—26): 2478—2500.
10 Aksenov Y,Bacon S,Coward A C,et al.The North Atlantic inflow to the Arctic Ocean: high-resolution model study[J].Journal of Marine Systems,2010,79(1—2): 1—22.
11 Bagøien E,Melle W,Kaartvedt S.Seasonal development of mixed layer depths,nutrients,chlorophyll andCalanus finmarchicusin the Norwegian Sea–a basin-scale habitat comparison[J].Progress in Oceanography,2012,103: 58—79.
12 Findlay H S,Tyrrell T,Bellerby R G J,et al.Carbon and nutrient mixed layer dynamics in the Norwegian Sea[J].Biogeosciences,2008,5(9): 1395—1410.
13 Harrison W G,Børsheim K Y,Li W K W,et al.Phytoplankton production and growth regulation in the Subarctic North Atlantic: a comparative study of the Labrador Sea-Labrador/Newfoundland shelves and Barents/Norwegian/Greenland seas and shelves[J].Progress in Oceanography,2013,114: 26—45.
14 Rey F,Noji T T,Miller L A.Seasonal phytoplankton development and new production in the central Greenland Sea[J].Sarsia,2000,85(4): 329—344.
15 Dale T,Rey F,Heimdal B R.Seasonal development of phytoplankton at a high latitude oceanic site[J].Sarsia,1999,84(5—6):419—435.
16 Jeffrey S W,Mantoura R F C,Wright S W.Phytoplankton Pigments in Oceanography[M].Paris: UNESCO Publishing,1997: 34.
17 庄燕培,金海燕,陈建芳,等.北冰洋中心区表层海水营养盐及浮游植物群落对快速融冰的响应[J].极地研究,2012,24(2):151—158.
18 Zhuang Y P,Jin H Y,Li H L,et al.Phytoplankton composition and its ecological effect in subsurface cold pool of the northern Bering Sea in summer as revealed by HPLC derived pigment signatures[J].Acta Oceanologica Sinica,2014,33(6): 103—111.
19 王肖颖,张芳,李娟英,等.2012年夏季挪威海和格陵兰海浮游植物群落结构的色素表征[J].生态学报,2014,34(8): 2076—2084.
20 Grasshoff K,Kremling K,Ehrhardt M.Methods of Seawater Analysis[M].New York: John Wiley & Sons,2009.
21 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 12763.4-2007 海洋调查规范 第4部分: 海水化学要素调查[S].北京: 中国标准出版社,2008.
22 Orvik K A,Niiler P.Major pathways of Atlantic water in the northern North Atlantic and Nordic Seas toward Arctic[J].Geophysical Research Letters,2002,29(19): 1896.
23 Deutsch C,Weber T.Nutrient ratios as a tracer and driver of ocean biogeochemistry[J].Annual Review of Marine Science,2012,4(4):113—141.
24 Rey F.Phytoplankton: the grass of the sea[M]//Skjoldal H R.The Norwegian Sea Ecosystem.Trondheim,Norway: Tapir Academic Press,2004: 97—136.
25 Redfield A C.The biological control of chemical factors in the environment[J].American Scientist,1958,46(3): 205—221.
26 Nilsen J E Ø,Falck E.Variations of mixed layer properties in the Norwegian Sea for the period 1948—1999[J].Progress in Oceanography,2006,70(1): 58—90.
27 Mueter F J,Broms C,Drinkwater K F,et al.Ecosystem responses to recent oceanographic variability in high-latitude Northern Hemisphere ecosystems[J].Progress in Oceanography,2009,81(1—4): 93—110.
28 高生泉,陈建芳,李宏亮,等.2008年夏季白令海营养盐的分布及其结构状况[J].海洋学报,2011,33(2): 157—165.
29 Colebrook J M.Continuous plankton records: seasonal variations in the distribution and abundance of plankton in the North Atlantic Ocean and the North Sea[J].Journal of Plankton Research,1982,4(3): 435—462.
