食品中PCDD/Fs和dl-PCBs的 检测方法研究进展
2018-03-02叶海云俞国珍张蓓蕾
叶海云,俞国珍,张蓓蕾
(三门县食品药品检测中心,浙江台州 317199)
多氯代二苯并-对-二恶英(Polychlorinated dibenzo-p-dioxins,PCDDs)、多氯代二苯并呋喃(polychlorinated dibenzo-furans,PCDFs)和二恶英样多氯联苯(dioxin-like polychlorinated biphenyls,dl-PCBs)统称为二恶英类化合物[1]。2001年5月,包括中国在内的150多个国家联合签署了《关于持久性有机污染物的斯德哥尔摩公约》(简称《POPs公约》),PCDD/Fs和dl-PCBs成为首批列入受控名单的持久性有机污染物[2-4]。PCDD/Fs和dl-PCBs结构稳定、亲油性强、难以降解,一旦它们进入水生环境,极易结合沉积物,由各种途径进入食物链并会在生物体内富积[1,5-6]。二十世纪五十年代,二恶英首次被报道为食物链的重要污染物,PCDD/Fs和dl-PCBs进入人体的途径主要有皮肤接触、空气吸入和食物摄入,其中,膳食摄入是最主要的进入途径,占90%以上[7-9]。本文综合了二恶英类化合物的致毒机理和几种用于分析检测二恶英类化合物方法的基本原理和优缺点,较系统地总结了国内外分析检测的最新研究进展,并对我国开展二恶英类化合物的分析监测提出了建议和展望。
1 PCDD/Fs和dl-PCBs的分类、结构和来源
PCDDs包含75个同系物,PCDFs包含135个同系物,均为氯化合物[10],结构式如图1所示。其中,在2、3、7和8位具有0~3个氯原子的PCDD/Fs同系物无明显毒性,而含有4~8个氯原子的PCDD/Fs具有显著的毒性[11]。210个PCDD/Fs中同系物中具有毒性的同系物只有17种(PCDDs占7种,PCDFs占10 种)[12]。毒性PCDD/Fs通过机体循环进入人们体内,常聚集在皮下、呼吸道和肝脏中,对机体的代谢产生巨大的影响,其中毒性最大为2,3,7,8-四氯二苯并-对-二恶英(TCDD)[10]。理论上多氯联苯(PCBs)具有209个同系物,但只有12个PCBS在持久性和效果方面具有与PCDD/Fs相似的性质,称之为二恶英样多氯联苯(dl-PCBs),其他PCBs被称为非二恶英类多氯联苯(ndl-PCBs),dl-PCBs具有至少4个氯原子,结构中两个苯环可以采取共平面的位置,但被氯原子取代的临位应为非氯原子取代基(如图1)[4]。PCDD/Fs主要来源于含氯化学品制造、市政垃圾焚烧、三废排放以及废旧电子垃圾拆解焚烧等过程;dl-PCBs主要来源于商业多氯联苯混合物的生产和使用,以及工业液体的泄漏及运输过程中造成的渗漏,多氯联苯混合物已经在20世纪70年代被禁止生产[9]。
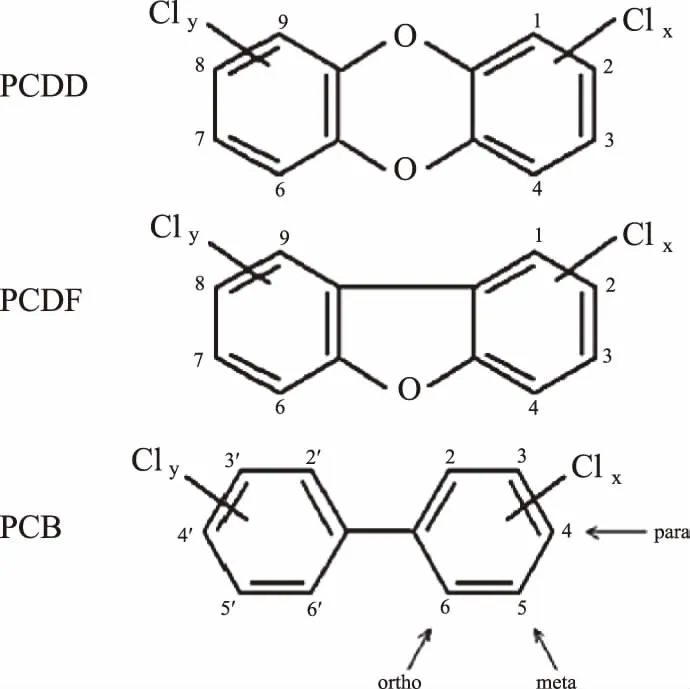
图1 二恶英(PCDDs和PCDFs)和PCBs的结构式Fig.1 Structural formulas of PCDD/Fs and PCBs
2 PCDD/Fs和dl-PCBs的致毒机理及限量标准
PCDD/Fs和dl-PCBs的毒性大,其在低浓度下也易对机体的健康产生巨大的影响,引发人类严重的生殖,免疫和神经系统问题,具有强致癌性、生殖毒性、内分泌干扰毒性、生物蓄积性和胚胎毒性[13]。多年的研究发现PCDD/Fs和dl-PCBs的致毒机制既不是对细胞产生直接损伤,也不是与蛋白质和核酸形成加合物,更不是对细胞核中的DNA产生直接损害,而是通过激活细胞中的芳香烃受体(AhR)和下游一系列的信号通路从而对人体产生毒害作用[14-16]。AhR本质是一种高分子量的蛋白质,生物体中一种配基依赖的转录因子,与二恶英类化合物具有极强的亲和力,进入细胞质中的二恶英类化合物可以与细胞质内静息态的AhR蛋白复合体相结合,被激活的复合体进入细胞核与AhR核转运蛋白形成二聚体(AhR-Arnt),AhR-Arnt二聚体随后与特异基因上的增强子结合,从而控制下游调控基因的转录和翻译(如细胞色素CYP1A1、环氧酶-2等),最终导致广泛的毒理和健康效应(神经毒性、致癌毒性、生殖毒性、内分泌干扰等)[14-15,17]。
通常情况下,PCDD/Fs和dl-PCBs以混合物的形式存在于自然环境、食物链和人体组织中。因此,为对二恶英类化合物的毒性效应做出合适的评价,世界卫生组织(WHO)提出采用毒性当量因子(TEF)来对PCDD/Fs和dl-PCBs的生物毒性做出估算、衡量和评价。WHO以毒性最大的TCDD的TEF值为基准1,其它二恶英类化合物以此标准折算以确定有毒同族体的毒性当量因子,研究对象总体的的毒性当量(toxic equivalencies,TEQ)即为所测样品中各有毒同系物浓度与其毒性当量因子乘积的加和[1]。PCDD/Fs和dl-PCBs具有极强的亲脂性和稳定性,一旦进入人体便很难被代谢排除,因此美国环保局(USEPA)认为不存在人类可以接触二恶英的“安全水平”,任何接触都可导致严重危害。WHO为确保人类健康安全对现有数据及调查报告进行重新评估,将人体二恶英的日允许摄取量(tolerable daily intake,TDI)从1998年的0.014-0.037 pg/g体重修改为0. 001-0. 004 pg/g 体重[18]。
3 PCDD/Fs和dl-PCBs的检测方法
PCDD/Fs和dl-PCBs的定量检测属于多组分超痕量分析,是有机超痕量分析领域的一个难点:大多数情况下,PCDD/Fs和dl-PCBs以极微量形式存在于环境及生物体内,且其大量的同系物、异构体使得PCDD/Fs和dl-PCBs的分离较为困难,同时由于水产样品中基质的干扰和分析时组分色谱峰交叉严重,使得二恶英化合物的分析过程极其复杂,对其检测系统的特异性、选择性和灵敏度要求极高[19]。目前,PCDD/Fs和dl-PCBs的主要分析方法有化学分析法(色谱分析法)和生物学分析技术(免疫学分析法和生物检测法)。
3.1 化学分析法-色谱分析法
3.1.1 色谱分析法的基本原理及前处理技术 目前,色谱分析法是国际公认的分析检测PCDD/Fs和dl-PCBs的标准方法。色谱法的原理是不同物质在不同相态具有不同的选择性分配,由于物质在不同相中具有不同分配系数,因此,可通过流动相对固定相中的混合物进行分离洗脱,混合物中不同PCDD/Fs和dl-PCBs以不同的速度沿固定相移动,最终达到分离的效果。色谱法分析PCDD/Fs和dl-PCBs主要分为两个阶段:样品前处理阶段和色谱分析阶段。通常情况下生物样品中二恶英的含量均很低,实际样品中复杂的基质及其他干扰物质量浓度明显高于目标化合物,色谱分析法中各仪器精密性较高,因此对于样品前处理的要求相对较高,样品前处理的结果对检测结果的准确性影响较大。PCDD/Fs和dl-PCBs测定样品前处理主要分为4个步骤:样品的采集、化合物提取、净化及富集。样品的提取和分离纯化为最耗时也最为重要的两个步骤。用于PCDD/Fs和dl-PCBs的提取的方法较多,主要有以下几种:索氏提取、固相萃取、微波辅助萃取、加速溶剂提取、加压流体萃取、超临界流体萃取等[20-22],其中索氏提取是最为常用且提取率最高的方法,也是我国食品安全国家标准食品中二恶英及其类似物毒性当量的测定中首推提取PCDD/Fs和dl-PCBs的方法[23]。抽提后,样品中的绝大部分PCDD/Fs和dl-PCBs进入提取液,同时生物样品原有的多环芳烃、有机农药、脂肪大分子等众多干扰物质也跟随PCDD/Fs和dl-PCBs混入了提取液,为确保PCDD/Fs和dl-PCBs检测的准确性,需要通过一定的方法对提取液进行净化,去除提取液中的干扰物质。目前常用的提取液净化方法有:碱解、液-液分配、柱层析、浓硫酸磺化和氧化等[24]。经索氏提取并净化后的提取液再采用多个不同色谱柱的方法进行相应的纯化,得到的洗脱液用于进一步的色谱分离分析使用。
3.1.2 色谱分析
3.1.2.1 同位素稀释-高分辨气相色谱/高分辨质谱法(HRGC/HRMS) 同位素稀释-高分辨气相色谱/高分辨质谱法(Isotopedilution-HRGC/HRMS)是测定PCDD/Fs和dl-PCBs分析的“黄金标准法”[4,25],广泛应用于环境样品、生物样品和食品中二恶英类化合物的检测[26],是目前唯一具有法律效益的二恶英类化合物检测方法,也是对痕量及超痕量浓度水平样品中PCDD/Fs和dl-PCBs定性定量的最佳检测方法。典型的国际和国家相关组织确定的二恶英标准分析方法[27]有:USEPA的EPA-8290、EPA-8280 和EPA-1613二恶英标准分析方法、日本的JISK-0311法以及我国环保部的HJ/T 77、HJ 650-2013二恶英标准分析方法。同位素稀释EPA-1613法已经成为各实验室的检测基础,同位素稀释定量法是保证二恶英类分析数据准确性的关键。在样品提取前定量加入13C 标记2,3,7,8-取代的二恶英毒性同类物,由于13C 标记物的化学性质与被分析组分的化学性质完全一致,因此样品提取和净化过程中的损失相同,样品中二恶英含量根据13C内标物定量可以保证分析结果的准确性。Wang等[28]利用不分流注入模式和多离子监测(MID)方法,通过配备有DB-5MS毛细管柱(60 m×0.25 mm×0.25 μm)的HRGC/HRMS法分析了我国东南部舟山渔业中32种鱼类中的十七种PCDD/Fs和十二个同位素dl-PCBs中毒性较大的同系物含量,发现不同鱼类中PCDD/Fs和dl-PCBs的水平差异显着在0.002~0.078 pg WHO-TEQ/g鲜重之间,分别为0.002~0.553 pg WHO-TEQ/g鲜重和0.003~2.059 pg WHO-TEQ/g鲜重。Squadrone等[12]利用HRGC/HRMS分析了来自意大利北部瓦雷泽湖鲶鱼鱼肌样品中PCDD/Fs和dl-PCB含量,研究发现鲶鱼样品中总PCDD/Fs含量范围为0.001~1.310 pg/g(w/w),总dl-PCBs含量范围为0.031~21.000 pg/g(w/w)。HRGC/HRMS的优点是它可以对PCDD/Fs和dl-PCBs分别进行分离,分离效率高;并能够对分离出的每种成分进行准确的定量,灵敏度高、分析速度快;且相对来说样品用量较少,因而具有极其广泛的应用范围。但HRGC/HRMS法对仪器的精密性要求较高,因此样品的前处理过程极为繁琐,检测时间较长,并且需要提供较为良好的实验环境及专业人员进行相应的检测工作,检测成本较高。
3.1.2.2 气相色谱-三重四级串联质谱法(GC-MS/MS) 气相色谱-三重四级串联质谱法(GC-MS/MS)相对HRGC/HRMS法而言,对样品前处理的要求较低,为简化检测步骤GC-MS/MS法也被广泛的应用于对样品PCDD/Fs和dl-PCBs的检测[29]。GC-MS/MS法由于其相对简单的样品前处理过程,更好的选择性和一定的灵敏度,目前已经得到了欧盟官方的认同[4]。代澎等[30]建立了可用于生活饮用水中20种PCBs的测定的GC-MS/MS测定方法,采用液液微萃取富集,离心分离,13C内标法定量,检出限为0. 35~6.60 ng/L,定量限为1.04~19.7 ng/L,该方法优势在于样品处理简单、快速、可靠,应用7种13C同位素内标物对样品进行标记能够降低基质的干扰,使目标物得到较好的分离,并且用GC-MS/MS检测特征离子的二级离子,提高了灵敏度,增强了定性、定量的准确度。实际检测过程中食品样品基质对GC-MS/MS检测限的干扰较大导致GC-MS/MS法灵敏度低于HRGC/HRMS法,所以GC-MS/MS法测定的PCDD/Fs和dl-PCBs的检测限一般高于HRGC/HRMS法[31],。虽然GC-MS/MS法灵敏度略低于HRGC/HRMS法,但其选择性优于HRGC/HRMS法,因此GC-MS/MS法比较适用于二恶英含量较高的样品[32]。
3.1.2.3 正交分离系统全二维气相色谱法(GC×GC) PCDD/Fs单体众多,且dl-PCBs与PCDD/Fs物理化学性质极为相近,因此很难在一根色谱柱上实现所有单体的分离,单根色谱柱分离PCDD/Fs和dl-PCBs极容易出现各化合物共流出的现象。高灵敏度的正交分离系统全二维气相色谱技术(GC×GC)方法分离检测PCDD/Fs和dl-PCBs能够在显著提高柱效的同时防止化合物共流出现象的发生,它具有不同分离机制、不同极性且互相独立的2支色谱柱,以串连的方式结合成二维气相色谱。经第1支色谱柱分离后的每个馏分,再经调制器聚焦后以脉冲方式进入第2支色谱柱中进一步分离,通过温度和极性的改变,实现气相色谱分离特性的正交化。GC×GC方法利用多种色谱柱交叉使用的方法避免了传统多维GC系统中复杂的色谱柱更换、重复进样操作等操作带来的不便,且可以连续出峰并确保彼此之间无重叠,减少分析化合物的时间,是一种快速分离技术[33]。De Boer等人利用GC×GC联用电子俘获检测器系统地对美国儿童膳食中多种二恶英类化合物(90种PCBs和17种PCDD/Fs)进行检测,发现可以从所得谱图上鉴定出这些化合物中的所有同系物[34]。目前应用较多的组合为正交分离系统全二维气相-飞行时间质谱联用系统(GC×GC-TOF/MS),Hoh等通过GC×GC-TOF/MS检测系统对鱼油中二恶英类物质进行了相关检测分析[35],通过检测发现其分辨率稳定性低于HRGC/HRMS法,但该方法在进行全扫描检测同时可启动选择离子扫描检测,因此应用前景仍然比较乐观。
3.1.3 色谱分析检测法优缺点 色谱分析法仪器精密性较高,可分离样品中二恶英类物质的每种成分,并准确定量痕量毒物,是对痕量及超痕量浓度水平样品中PCDD/Fs和dl-PCBs定性定量的最佳检测方法。但由于PCDD/Fs和dl-PCBs的同源物和异构体作为复杂混合物存在生物样品中,化学分析法只能识别和量化可分离并且已知的标准化合物[36],由于检测过程中需要相对应的标准品来对样品中的二恶英类化学物质进行定性,而目前仍有部分化合物不具备相对应的标准品,因此色谱法只能对己知的二恶英类物质进行定性定量测定,无法确定样品中PCDD/Fs和dl-PCBs真实总量,而且化学分析法分析过程中不能确定复杂混合物中化学物质之间的相互作用以及PCDD/Fs和dl-PCBs的生物效应[25]。

表1 色谱分析检测法优缺点Table 1 The advantages and disadvantages of chromatographic analysis
3.2 生物学检测法
3.2.1 生物学检测法基本原理及分类 生物学检测方法是依据PCDD/Fs和dl-PCBs单体进入生物细胞内与AhR结合的致毒机理而开发的灵敏度和检出下限可达到或接近HRGC/HRMS水平的新方法,其原理是借助与二恶英具有特异性结合位点的抗体、受体、酶的识别机制,通过测定生物分子活化程度间接确定二恶英类化合物毒性当量。生物学检测方法可分为免疫法(酶免疫分析法-EIA和荧光免疫分析法-DELFIA)和生物法(酶活力诱导法-EROD和荧光素酶报告基因法-CALUX)两大类[37]。
3.2.2 免疫分析法
3.2.2.1 酶免疫分析法 酶免疫分析法是以抗原和抗体的特异性反应为基础的分析方法,但免疫法中使用的抗体较难获取且该法不能检测所有的同系物。酶免疫分析法(EIA)是根据鼠单克隆抗体(DD3)与二恶英结合的特点而建立的竞争抑制酶免疫方法,检测的基础是结合在固相载体表面且具有免疫学活性的抗原、抗体以及既具有免疫学活性又具有酶活性的酶标记抗体。在测定过程中,以不同浓度二恶英为标准物质作出标准样品的剂量-效应曲线,最终通过测定抗体与竞争酶的荧光强度反向获取二恶英的TEQ,荧光强度与TEQ为反比关系[38-39]。EIA法具有操作简便,一次可平行测定多个样品的特点,而且开发出的价格低廉商品化的试剂盒可在采集样品现场直接完成相关测定[40]。Tsutsumi等[41]利用酶免疫试剂盒与HRGC/HRMS测定鱼类样品中dl-PCB的TEQ浓度,发现酶免疫试剂盒可以识别鱼类样品中dl-PCBs的浓度临界值为50pg TEQ/g,两种方法所测结果相关性良好(r=0.92,n=26),因此酶免疫试剂盒有助于在HRGC/HRMS分析之前对大量的鱼类样品进行初步的筛选。但EIA法无法确定PCDD/Fs和dl-PCBs的生物效应且前期开发较为繁琐,费用昂贵,测定PCDD/Fs和dl-PCBs时也需采取不同的EIA方法。与其他生物分析技术相比,EIA法表现出更大的分析特异性和对来自其他污染物的干扰的相对不敏感性[42-43]。Samara等[43]利用EIA法和HRGC/HRMS法对来自工业设施现场样品中PCDDs/Fs及多溴二苯并对二恶英/呋喃(PBDDs/Fs)进行比较,发现基于EIA法样品中测定的PCDDs/Fs的毒性当量高于HRGC/HRMS法0~4个数量级,而PBDDs/Fs的毒性当量高于HRGC/HRMS法0~1数量级,且在EIA和HRGC/HRMS数据之间没有发现相关性,这可能归因于同源物特异性交叉反应、样品基质类型的差异以及在免疫测定中竞争抗体结合的其他化合物的存在的影响。
3.2.2.2 荧光免疫分析法 荧光免疫分析法(DELFIA)利用生物基因技术选择出与样品中PCDD/Fs和dl-PCBs相互竞争的单克隆抗体的抗原键合铕离子,反应完全后加入荧光增强液解离抗原中的铕离子至增强液中,增强液中形成的胶束铕离子能够高效地发出荧光。用时间分辨荧光法技术排除非特异性荧光干扰后对鳌合物加以分析,获取样品中PCDD/Fs和dl-PCBs荧光值,其荧光强度与样品中PCDD/Fs和dl-PCBs的TEQ成反比[44]。EIA法与DELFIA法相比并不需要细胞内诱导活化过程,从而大大提高了样品中PCDD/Fs和dl-PCBs的检测效率,并且检测所得的TEQ值比较一致,但EIA法灵敏度相对DELFIA法较低。DELFIA法采用时间分辨荧光技术,可以消除非特异性荧光干扰,灵敏度大大提高。由于灵敏度提高,检测所需试样量少,因此大大降低了二恶英类物质检测成本。Tatsuro Endo等[45]建立了酶放大微流控荧光免疫传感器来检测共平面PCBs(Co-PCBs),可以在30秒内确定样品中Co-PCBs衍生物的浓度,Co-PCBs检测的线性范围从0.1 pg/mL至1.0 μg/mL(回归分析提供了相关性系数r=0.982~0.964),重现性好、精度高。
3.2.3 生物分析法 生物分析法是依据二恶英的致毒机理,根据机体细胞对二恶英专一性反应或是生物分子对PCDD/Fs和dl-PCBs结构独特的识别能力来对其进行相关测定。
3.2.3.1 酶活力诱导法 7-乙氧基-异吩恶哇酮-脱乙基酶(EROD)与PCDD/Fs和dl-PCBs的结合具有良好的时间-效应关系。PCDD/Fs和dl-PCBs与AhR结合活化后,AhR核转位因子进入到细胞核内与AhR核转位子蛋白再度结合并识别特定DNA片段,启动发挥毒性的靶基因转录,激活EROD酶。通过测定EROD酶的活性,间接反映PCDD/Fs和dl-PCBs与AhR的结合能力,一定范围内,EROD酶活与二恶英浓度呈线性关系[46]。相对来说,EROD法有利于筛选目的物质,得到更多关于激动剂和拮抗剂的信息支持,从而揭示未知的活性化合物[42]。冯忠孚[47]在检测垃圾焚烧二恶英类化合物的检测过程中,结合新型前处理柱对比EROD生物测试法和HRGC-HRMS法发现两者检测结果具有强相关性(R2=0.95),从而说明结合新型前处理柱的EROD生物测试法能够得到与高分辨气质仪器分析方法具有相近TEQ值的检测结果,具有高灵敏度和高通量的特点,能够以较低的成本快速筛查大量样品,是一种极具发展潜力的二恶英类化合物检测方法。

表2 生物学分析检测法优缺点Table 2 The advantages and disadvantages of biological detection
3.2.3.2 荧光素酶报告基因法 荧光素酶报告基因法(CALUX)也称为受体报告基因法,能够特异性测定样品中所有具有AhR 受体的化合物,AhR受体是TEQ的生物学基础,因而CALUX灵敏度更高,检测的线性范围更宽,检测时间更短,因此CALUX法更适用于健康评价[48]。Samara等[38]使用化学活化的荧光素酶基因表达细胞生物测定系统(CALUX)和基于抗体的方法酶免疫测定(EIA)来检测几种多溴、多氯、多溴/氯化二苯并对二恶英/呋喃的二恶英样反应(PBDDs/Fs,PCDDs/Fs和PBCDDs/Fs),测试结果显示溴化合物和混合的溴/氯化合物的生物活性类似于它们的氯化类似物。目前CALUX法较适合大量样本灵敏的快速筛选,比传统的HRGC/HRMS的成本低40%~70%,已被广泛用于对多种环境介质、生物样品和食品中二恶英的检测[49-52],USEPA在2008年2月将CALUX生物测定法批准为二恶英检测的替代方法[52-55]。由于CALUX法测定的是所有具有AhR受体的二恶英类物质,因此一般情况下CALUX法样品测定结果高于化学分析法样品测定的结果[53]。Vromman等[54]通过CALUX和GC-HRMS(比利时境内标准检测法)两种方法测定比利时境内食品基质(乳制品、鸡蛋、鱼、动物脂肪和植物油)中二恶英和二恶英样多氯联苯的污染数据,观察到两种方法之间的测定结果存在显著差异,CALUX方法测得食物基质中的二恶英的中位数浓度约为GC-HRMS法二恶英的中位浓度的两倍。由此可见,在比利时官方控制计划框架内CALUX方法获得的数据不能用于风险评估,特别是不能准确估计二恶英和二恶英样多氯联苯的膳食摄入量。这可以解释为:一方面不属于17种二恶英/呋喃的大量不同形状的化合物和12种二恶英样多氯联苯同系物也与芳基烃受体(AhR)相结合。另一方面,该测定法被用于合规监测的筛选,其中需要通过最大水平强调方法性能,从而导致监测浓度的准确度不足。因此,实际应用时,可先用CALUX筛选检测,再将筛选出的阳性样品用化学分析法作进一步定性定量检测。籍龙杰等[55]利用HRGC/HRMS和CALUX对42个垃圾焚烧飞灰样品进行二恶英类化合物的分析,发现CALUX结果与HRGC/HRMS结果具有很好的线性相关性(R=0.96),并计算两者的换算系数为0.332,最终可以利用快速检测的结果和换算系数来推算出HRGC/HRMS的结果。
3.2.4 生物学检测法优缺点 生物学检测法是以现代分子生物学的研究成果为基础,针对传统仪器分析方法的缺点而发展起来的二恶英类化合物检测技术。生物学检测法因其操作简便、灵敏度高、特异性强、设备简单、成本低(分析成本降低50%以上)、测试周期短、可平行测试大量样品等优点成为研究热点[56]。美国、欧盟、日本等纷纷将生物学检测方法推荐为二恶英类化合物检测的指导方法及筛选方法[46]。尽管生物学检测法测试周期短,适于快速、大规模样品的筛选,但其无法鉴定生物样品中二恶英化合物的种类,只能测定出混合物的总毒性当量。
4 展望
二恶英类化合物进入到机体后,可以随着食物链逐步富积,对我国的食品安全及人们健康产生不利影响,因此,检测食物中的二恶英类化合物尤为重要,常用的检测方法有化学分析法和生物法,这两种方法各有优缺点,并相互补充。化学分析法具有准确可靠,可分离测定出二恶英化合物中物质单体,并准确定量痕量毒物单体TEQ数据等特点,但前处理过程复杂、消耗大量化学试剂和耗材,分析成本高、周期长、无法同时处理大量样品,对仪器设备、实验环境及人员配备要求较高,不能确定复杂混合物中化学物质之间的相互作用以及PCDD/Fs和dl-PCBs的生物效应。生物学检测法一般用于大量样品的筛选或含量较高样品的测定以及无需对单体进行定量,检测结果只能体现出总TEQ 数据,属于半定量方法。生物学检测法具有检测周期短、操作简单、低成本、高通量、能反映有毒物质对机体造成的生物影响的特点,但不能了解样品中二恶英类化合物具体组成及单体TEQ数据,因此在处理具有争议的结果时,仍须化学分析法进行确证。综上所述,为加快推进PCDD/Fs和dl-PCBs监测防控进程,可通过以下几个方面进行切入:
为确保我国食品安全及更精确快速的检测出食品中二恶英类化合物含量,我国应尽快构建快速、灵敏、经济的二恶英毒性检测方法和制定食品中允许限量标准,并同步建立食品行业体系中独立的二恶英类污染物检测实验室。
由于食品样品基质较为复杂,应根据检测样品及检测目的的不同,充分利用化学、生物学检测法各自的优势,构建适合于我国食品行业的二恶英污染物检测评价体系。例如,低成本和高通量的生物检测法可作为农畜及水产品中二恶英类化合物的检测工具,精确的化学分析法则可用于对准确定量痕量二恶英类污染物的认证分析。
PCDD/Fs和dl-PCBs类物质的异构体和同类物种类繁多,检测时结构性质相近使得部分色谱峰出现不可避免的重叠现象,尽管高分辨质谱可以很好的识别不同质量分数的PCDD/Fs和dl-PCBs化合物,但对相同质量分数的异构体和化合物并不能进行很好的区分,因此想要更精确的测定食品中PCDD/Fs和dl-PCBs类化合物的含量,需要提升色谱分析技术或加快构建合理的多维色谱及高分辨率质谱仪联用体系。
生物学检测方法(特别是CALUX)虽然不能代替化学分析法,但因为其快速、简单、低成本以及在研究化学物质的生物及毒性效应方面的巨大优势,使得其能作为化学分析的补充,广泛用于PCDD/Fs和dl-PCBs类物质的初步筛选性分析检测。因此,应该对生物学检测法进行明确的定义,从而使其真正意义上应用于食品中二恶英类化合物的快速筛选,并制定出适合我国国情的可接受的操作标准;同时需要提升检测人员对生物方法筛选策略的理解和知识的丰富度,并根据不同生物检测法的局限性对其实验结果进行分别分析,更合理的评估食品样品中二恶英化合物的影响;注重开发成本相对低廉但具有高分辨质谱相似灵敏度与分辨率的仪器,以促进食品中二恶英污染物的快速检测的进程。
[1]Yudkovski Y,Herut B,Shefer E,et al. Dioxin-like biological activity of organic extracts from sediments and fish livers sampled along the Israeli Mediterranean and Red Sea coasts[J]. Marine Pollution Bulletin,2015,98(1-2):295-300.
[2]Wang L,Ding G,Zhou Z,et al. Patterns and dietary intake of polychlorinated dibenzo-p-dioxins and polychlorinated dibenzofurans in food products in China[J]. Journal of Environmental Sciences,2017,51(1):165-172.
[3]Olanca B,Cakirogullari G C,Ucar Y,et al. Polychlorinated dioxins,furans(PCDD/Fs),dioxin-like polychlorinated biphenyls(dl-PCBs)and indicator PCBs(ind-PCBs)in egg and egg products in Turkey[J]. Chemosphere,2014,94(1):13-19.
[4]Ron H,Wim T,Alwyn F,et al. European developments following incidents with dioxins and PCBs in the food and feed chain[J].Food Control,2015,50:670-683
[5]Shin E,Kim J,Choi S,et al. Estimated dietary intake and risk assessment of polychlorinated dibenzo-p-dioxins and dibenzofurans and dioxin-like polychlorinated biphenyls from fish consumption in the Korean general population[J]. Chemosphere,2016,146:419-425.
[6]Perelló G,Díaz-Ferrero J,Llobet J M,et al. Human exposure to PCDD/Fs and PCBs through consumption of fish and seafood in Catalonia(Spain):Temporal trend[J]. Food and Chemical Toxicology,2015,81:28-33.
[7]Lorenzi V,Ghidini S,Angelone B,et al. Three years of monitoring of PCDD/F,DL-PCB and NDL-PCB residues in bovine milk from Lombardy and Emilia Romagna regions(Italy):Contamination levels and human exposure assessment[J]. Food Control,2016,68:45-54.
[8]Son M,Kim J,Park H,et al. Assessment of the daily intake of 62 polychlorinated biphenyls from dietary exposure in South Korea[J]. Chemosphere,2012,89(8):957-963.
[9]Manning T M,Roach A C,Edge K J,et al. Levels of PCDD/Fs and dioxin-like PCBs in seafood from Sydney Harbour,Australia[J]. Environmental Pollution,2017,224:590-596.
[10]Karima G,Lucie C,Sabrine M,et al.Treatment technologies used for the removal of As,Cr,Cu,PCP and/or PCDD/F from contaminated soil:A review[J].Journal of Hazardous Materials,2017,333:194-214
[11]Shen H,Starr J,Han J,et al. The bioaccessibility of polychlorinated biphenyls(PCBs)and polychlorinated dibenzo-p-dioxins/furans(PCDD/Fs)in cooked plant and animal origin foods[J]. Environment International,2016,94:33-42.
[12]Squadrone S,Prearo M,Nespoli R,et al. PCDD/Fs,DL-PCBs and NDL-PCBs in European catfish from a northern Italian lake:the contribution of an alien species to human exposure[J]. Ecotoxicology and Environmental Safety,2016,125:170-175.
[13]Oh JR,Ikonomou MG,Fernandez MP,et al. PCB and PCDD/F totals,TEQs,and congener patterns in Korean coastal marine environments,1987,1988,1990,and 1996-1999.[J]. Archives of Environmental Contamination and Toxicology,2003,44(2):224-236.
[14]Linda S. B. Dioxin and the AH receptor:Synergy of discovery[J].Current Opinion in Toxicology,2017,2:120-123
[15]Fracchiolla N S,Annaloro C,Guidotti F,et al. 2,3,7,8-Tetrachlorodibenzo-p-dioxin(TCDD)role in hematopoiesis and in hematologic diseases:A critical review[J]. Toxicology,2016,374:60-68.
[16]Okey A B. An Aryl Hydrocarbon Receptor Odyssey to the Shores of Toxicology:The Deichmann Lecture,International Congress of Toxicology-XI[J]. Toxicological Sciences,2007,98(1):5-38.
[17]Puga A,Ma C,Marlowe JL. The aryl hydrocarbon receptor cross-talks with multiple signal transduction pathways[J]. Biochemical Pharmacology,2009,77(4):713-722.
[18]Van Leeuwen FX,Feeley M,Schrenk D,et al. Dioxins:WHO’s tolerable daily intake(TDI)revisited.[J]. Chemosphere,2000,40:1095-1101.
[19]Guo rui Liu,Ming hui Zheng,Zongwei Cai,et al. Dioxin analysis in China[J].Trends in Analytical Chemistry,2013,46:178-188.
[20]Brocca D,Lasagni M,Collina E,et al. Supercritical fluid extraction:An innovative tool for a fly ash-like model support[J].Environmental Science and Technology,2002,36(4):790-796.
[21]Kitamura K K K N,Takazawa Y,Hashimoto S,et al. Effective extraction method for dioxin analysis from lipid-rich biological matrices using a combination of pressurized liquid extraction and dimethyl sulfoxide/acetonitrile/hexane partitioning[J]. Analytica Chimica Acta,2004,512(1):27-37.
[22]van Beuzekom A C,Hijman W C,Berkhoff C J,et al. Fast sample preparation involving MASE and coupled column normal phase liquid chromatography for the rapid trace analysis of dioxins in air-dust samples from fire catastrophe emissions[J]. Talanta,2004,63(5):1183-1192.
[23]中华人民共和国国家卫生和计划生育委员会.GB 5009.205-2013食品安全国家标准食品中二噁英及其类似物毒性当量的测定[S].北京:中国标准出版社,2013.
[24]Focant J J F U,Pirard C,De Pauw E. Automated sample preparation-fractionation for the measurement of dioxins and related compounds in biological matrices:A review[J]. Talanta,2004,63(5):1101-1113.
[25]Vanderperren H N V I,Van Wouwe N,Behets S,et al. TEQ-value determinations of animal feed;emphasis on the CALUX bioassay validation[J]. Talanta,2004,63(5):1277.
[26]Hernández F,Sancho J V,Ibáez M,et al. Current use of high-resolution mass spectrometry in the environmental sciences[J]. Analytical and Bioanalytical Chemistry,2012,403(5):1251-1264.
[27]程劼,苏晓鸥. 饲料中二恶英类化合物检测方法研究进展[J].饲料研究,2010(2):44-47.
[28]Wang X,Zhang H,Zhang L,et al. Assessment on dioxin-like compounds intake from various marine fish from Zhoushan Fishery,China[J]. Chemosphere,2015,118:163-169.
[29]Cunliffe A M,Williams P T P T. Isomeric analysis of PCDD/PCDF in waste incinerator flyash by GC-MS/MS[J]. Chemosphere,2006,62(11):1846-1855.
[30]代澎,张晓妍,马金波.液液微萃取-气相色谱-三重四级杆测定生活饮用水中的20种多氯联苯[J].中国卫生检验杂志,2016,26(14):2006-2012.
[31]Myers A L,Mabury S A,Reiner E J. Analysis of mixed halogenated dibenzo-p-dioxins and dibenzofurans(PXDD/PXDFs)in soil by gas chromatography tandem mass spectrometry(GC-MS/MS)[J]. Chemosphere,2012,87(9):1063-1069.
[32]Eppe G,Focant J,Pirard C,et al. PTV-LV-GC/MS/MS as screening and complementary method to HRMS for the monitoring of dioxin levels in food and feed[J]. Talanta,2004,63(5):1135-1146.
[33]Eljarrat E,Barcelo D. Congener-specific determination of dioxins and related compounds by gas chromatography coupled to LRMS,HRMS,MS/MS and TOFMS.[J]. Journal of Mass Spectvometry,2002,37(11):135-141.
[34]Dougherty CP,Henricks Holtz S,Reinert JC,et al. Dietary exposures to food contaminants across the United States[J]. Environmental Research,2000,84(2):170-185.
[35]Hoh E,Lehotay S. J,Mastovska K,et al. Evaluation of automated direct sample introduction with comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry for the screening analysis of dioxins in fish oil.[J]. Journal of Chromatography A,2008,1201(1):69-77.
[36]Garrison P.M,Tullis K,Aarts J.M.M.J.G,et al. Species-Specific Recombinant Cell Lines as Bioassay Systems for the Detection of 2,3,7,8-Tetrachlorodibenzo-p-dioxin-like Chemicals[J]. Fundamental and Applied Toxicology,1996,30(2):194-203.
[37]Behnisch P A. Combinatorial Bio/Chemical Analysis of Dioxin and Dioxin-like Compounds in Waste Recycling,Feed/Food,Humans/Wildlife and the Environment[J]. Environmental International,2003,29:861-877.
[38]Samara F,Gullett BK,Harrison RO,et al. Determination of relative assay response factors for toxic chlorinated and brominated dioxins/furans using an enzyme immunoassay(EIA)and a chemically-activated luciferase gene expression cell bioassay(CALUX)[J]. Environment International,2009,35(3):588-593.
[39]Harrison RO,Eduljee GH. Immunochemical analysis for dioxins-progress and prospects[J]. The Science of the Total Environment,1999,239(1/3):1-18.
[40]Focant J.-F,Eppe G,De Pauw E. Optimisation and use of tandem-in-time mass spectrometry in comparison with immunoassay and HRGC/HRMS for PCDD/F screening[J]. Chemosphere,2001,46(4):417-424.
[41]Tsutsumi T,Amakura Y,Okuyama A,et al. Application of an ELISA for PCB 118 to the screening of dioxin-like PCBs in retail fish[J].Chemosphere,2006,65(3):467-473.
[42]Levy W,Brena B M,Henkelmann B,et al. Screening of dioxin-like compounds by complementary evaluation strategy utilising ELISA,micro-EROD,and HRGC-HRMS in soil and sediments from Montevideo,Uruguay[J]. ToxicologyinVitro,2014,28(5):1036-1045.
[43]Samara F,Wyrzykowska B,Tabor D,et al. Toxicity comparison of chlorinated and brominated dibenzo-p-dioxins and dibenzofurans in industrial source samples by HRGC/HRMS and enzyme immunoassay[J]. Environment International,2010,36(3):247-253.
[44]孙晞,欧仕益,彭喜春. 二恶英类化学物质生物检测方法研究进展[J]. 环境与职业医学,2007,24(2):218-221.
[45]Endo T,Okuyama A,Matsubara Y,et al. Fluorescence-based assay with enzyme amplification on a micro-flow immunosensor chip for monitoring coplanar polychlorinated biphenyls[J]. Analytica Chimica Acta,2005,531(1):7-13.
[46]李晓敏,张庆华,王璞.饲料中二恶英检测方法研究进展[J].中国饲料,2014,(15):23-27.
[47]冯忠孚,王宛,杨炳建.利用EROD生物测试法快速筛选焚烧废气中二恶英类化合物[J].山东化工,2014,43,(7):
67-69.
[48]Hilscherova K,Machala M,Kannan K,et al. Cell bioassays for detection of aryl hydrocarbon(AhR)and estrogen receptor(ER)mediated activity in environmental samples[J]. Environmental Science and Pollution Research,2000(3):159-171.
[49]Chan J K Y,Man Y B,Xing G H,et al. Dietary exposure to polychlorinated dibenzo-p-dioxins and dibenzofurans via fish consumption and dioxin-like activity in fish determined by H4IIE-luc bioassay[J]. Science of The Total Environment,2013,463-464(5):1192-1200.
[50]Khim J S,Villeneuve D L,Kannan K K,et al. Instrumental and bioanalytical measures of persistent organochlorines in blue mussel(Mytilus edulis)from Korean coastal waters[J]. Archives of Environmental Contamination and Toxicology,2000(3):360-368.
[51]Nelson E A S,Hui L L,Wong T W,et al. Demographic and lifestyle factors associated with dioxin-like activity(CALUX-TEQ)in human breast milk in Hong Kong[J]. Environmental Science and Technology,2006(5):1432-1438.
[52]Song Y,Wu N,Han J,et al. Levels of PCDD/Fs and DL-PCBs in selected foods and estimated dietary intake for the local residents of Luqiao and Yuhang in Zhejiang,China[J]. Chemosphere,2011(3):329-334.
[53]Windal I I W I,Denison M S,Birnbaum L S,et al. Chemically activated luciferase gene expression(CALUX)cell bioassay analysis for the estimation of dioxin-like activity:critical parameters of the CALUX procedure that impact assay results[J]. Environmental Science and Technology,2005(19):7357-7364.
[54]Vromman V R,Baert K,Vanderperren H,et al. Evaluation of the use of CALUX results for dioxins and dioxin-like PCBs analysis for quantitative human exposure assessments[J]. Food Control,2012,27(2):314-321.
[55]籍龙杰,陆胜勇,杜颖哲,等. 荧光素酶报告基因法测定飞灰中二噁英类物质[J]. 环境污染与防治,2016(9):19-24.
[56]Reiner E J,Clement R E,Okey A B,et al. Advances in analytical techniques for polychlorinated dibenzo-p-dioxins,polychlorinated dibenzofurans and dioxin-like PCBs[J]. Analytical and Bioanalytical Chemistry,2006(4):791-806.
