超声剪切波弹力成像联合超声甲状腺影像报告与数据系统对甲状腺微小癌的诊断价值研究
2018-03-02郭丽盛张素燕赵斗贵
商 宁 郭丽盛 杜 辉 李 军 史 娜 张素燕 赵斗贵
甲状腺癌是发生在甲状腺最常见的恶性肿瘤,全球每年有超过62 000新发甲状腺癌,且该数值在过去的数十年中持续升高[1-2]。绝大部分甲状腺癌为滤泡上皮癌,少部分为甲状腺髓样癌。目前,关于早期对甲状腺癌的监测和治疗尚存争议,针吸活检术和影像学技术的发展提高了甲状腺癌的诊断率,但是同时美国甲状腺癌协会也提出其中存在过度诊断和过度治疗的问题,治疗相关的医源性死亡也不容小觑,手术治疗获益有时并不大[3-5]。
超声是检测甲状腺结节较为敏感和方便的方法,也可在一定程度上协助鉴别甲状腺结节的性质。超声剪切波弹力成像(shear wave elastography,SWE)是一项较新的超声技术,其无需人工施压,成像深度、重复性和应用性均较好,可为甲状腺结节的硬度客观定量,在临床操作中的灵敏度及特异度均较高[6-7]。甲状腺影像报告与数据系统(thyroid imaging reporting and data system,TI-RADS)是由Kwak[8]提出的甲状腺结节分级标准,该分级标准基于彩超,以细胞学检出为证据,根据分级的不同采取不同的治疗方案[9]。该标准权衡了结节的极低回声、微小钙化、边界不清、异常淋巴结和纵横比征象,共分为5级,级数越高,恶性的可能性越大。
本研究采用超声SWE联合TI-RADS分级对甲状腺微小癌的诊断进行评价,旨在探讨超声SWE联合TI-RADS对甲状腺微小癌的诊断价值。
1 资料与方法
1.1 一般资料
选取2015年1月至2017年1月就诊于邯郸市传染病医院的62例甲状腺微小结节患者,其中男性16例,年龄20~64岁,平均年龄(45.3±11.2)岁;女性46例,年龄23~67岁,平均年龄(44.9±13.2)岁。在62例患者中有60例患者在超声检查下发现单个微小结节,2例患者在超声检查下发现2个微小结节,共计64个;在16例男性中共发现超声下微小结节17个,在46例女性中共发现超声下微小结节47个。对患者在术前行超声SWE检查,同时行常规超声进行TI-RADS分级。完善检查后所有患者行相应的手术治疗,以术后病理为最终诊断结果。本研究经医院伦理委员会批准并备案。
1.2 纳入与排除标准
(1)纳入标准:①由超声确诊甲状腺微小结节,微小结节定义为超声下病灶最大直径<1 cm;②患者均行甲状腺全部或次全切除术,术后切除的甲状腺组织送病理检查;③患者不合并其他肿瘤和其他系统的严重疾病;④患者或其授权委托人了解本研究,并签署知情同意书。
(2)排除标准:①超声检查下甲状腺结节>1 cm;②患者不同意进行手术,无病理学结果最终确诊;③患者合并其他肿瘤和其他系统的严重疾病,或合并心脏、肾脏、肝功能不全;④患者不能配合完成本研究。
1.3 仪器设备
采用HDI 5000型彩色多普勒超声扫描仪(荷兰飞利浦公司);EUB 315型B超仪(日本日立公司);Supersonic Air Plorer实时定量超声剪切波弹力成像超声诊断仪(法国Supersonic Imagine公司)。
1.4 检查方法
(1)甲状腺超声检查方法。所有患者均在手术前再次行甲状腺超声检查,取平卧位,采用B超仪器对所有患者行二维超声检查,观察甲状腺的整体形态和血供,确定甲状腺病灶在甲状腺中的位置、形态、大小、数目、与周围组织关系、硬度、钙化情况、囊变情况、回声强度和均匀速度;采用彩色多普勒超声扫描仪,确定甲状腺的血流情况及病灶的血流情况,观察血流平均收缩期流速和阻力指数。
(2)超声SWE检查方法。所有患者均在手术前行常规甲状腺超声检查后再行超声SWE检查。采用实时定量SWE超声诊断仪。以4~15 MHz、L4~L15线阵探头检查。患者取仰卧位,先按上述行常规甲状腺超声检查。启动仪器的剪切波弹力成像模式,将探头轻触于患者甲状腺上,避免探头压迫甲状腺,发现靶区后,使患者屏住呼吸3~5 s,完成采集图像过程。
1.5 观察与评价指标
(1)按照Kwak等[8]的TI-RADS分级将患者甲状腺超声的情况分为5级:①甲状腺腺体大小、回声均正常,未发现结节,无囊肿和钙化为1级;②超声检查确认结节为良性为2级;③可能为良性为3级;④具有1~4项的恶性超声征象为4级,即低度可疑恶性,具有1项恶性超声征象为4级a,中度可疑恶性,具有2项恶性超声征象为4级b,非典型恶性征象,具有3项或4项恶性超声征象为4级c,⑤典型恶性征象,具有5项恶性超声征象为5级,其中5项超声恶性征象包括极低回声、微小钙化、边界不清、异常淋巴结和>1的纵横比。在本研究中将4级b、4级c、5级定义为恶性,其余为良性。
(2)设置感兴趣区,包括病灶和甲状腺组织,获取图像,将定量取样框设置在弹性成像区域内,根据病灶形态使取样框覆盖病灶,避开钙化灶,以降低钙化灶对病灶硬度的计算干扰。若病灶硬度分布均匀,难以确定最大硬度处,则降低量程以确定最大硬度,而后将测量框放置在最大硬度处;若病灶硬度分布不均匀,则直接确定最大硬度处,确定平均杨氏模量值。对每个病灶测量3次取其平均值后记录(如图1所示)。

图1 超声剪切波弹力成像图
(3)确定数据值,对数据进行分析并绘制受试者操作特征(receiver operating characteristic,ROC)曲线,确定截断值,截断值以上为恶性,截断值以下为良性。以ROC曲线确定截断值,计算敏感度、特异度、阳性预测值以及阴性预测值,根据ROC曲线下面积(area under curve,AUC)评估诊断价值,曲线下面积越大,诊断准确性越高。
(4)良性与恶性记录,将TI-RADS分级中4级b、4级c及5级联合超声SWE检查确定的性质定义良性和恶性结节。
1.6 统计学方法
所有数据采用SPSS 12.0统计软件分析。计量资料以平均值标准差(x-±s)表示,组间比较采用t检验;计数资料以数量和百分比(%)表示,采用卡方检验比较;以P<0.05为差异有统计学意义。
2 结果
2.1 病理结果
在62例患者的病理结果中共发现超声下甲状腺微小结节64个,其中最终病理结果提示恶性结节35个(占54.7%),为乳头状微小癌;良性结节29个(占45.3%);其中包括结节性甲状腺肿20个(占31.3%),桥本氏甲状腺炎14个(占21.9%),亚急性甲状腺炎1个(占1.6%)。按TI-RADS分级标准,4级a以下有28个结节,其中最终病理结果确认良性23个,恶性5个;4级b以上共36个结节,其中30个恶性,6个良性(见表1)。
2.2 超声SWE检查结果
(1)最终病理结果确诊为甲状腺微小癌的结节中,超声SWE杨氏模量弹性平均值的均值为(40.97±22.60)kPa;最大值的均值为(57.74±29.97)kPa。
(2)最终病理结果确诊为良性的结节中,超声SWE杨氏模量弹性平均值的均值为(16.62±11.94)kPa;最大值的均值为(26.79±13.32)kPa。
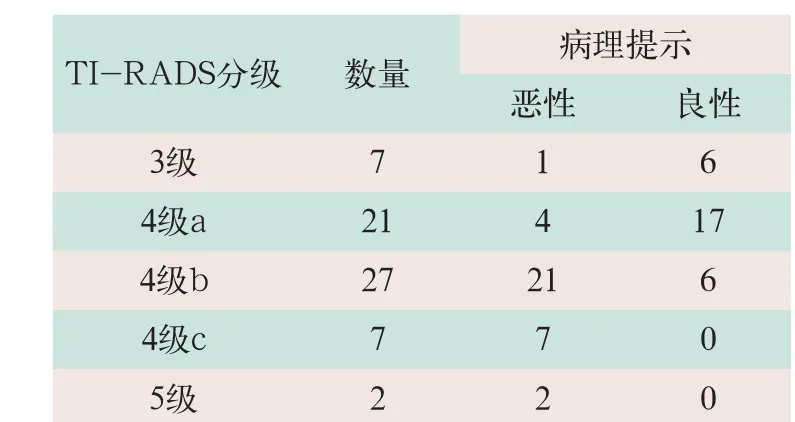
表1 62例TI-RADS分级结果与最终病理结果对照(个)
(3)病理确诊为甲状腺微小癌和病理确诊为良性的结节相比,二者超声SWE杨氏模量弹性平均值差异有统计学意义(t=3.944,P<0.05);二者超声SWE杨氏模量弹性最大值差异显著(t=5.613,P<0.05)。以病理诊断为最终诊断结果,超声SWE杨氏模量弹性最大值和平均值诊断甲状腺良、恶性结节的ROC曲线下面积为0.839和0.804,超声SWE杨氏模量弹性最大值的效能最好,其界值为40 kPa。具体病理结果见表2。
2.3 联合诊断甲状腺微小结节的良恶性
(1)SWE联合TI-RADS分级诊断与单独超声SWE和TI-RADS相比较,联合诊断出64个甲状腺微小结节的准确性最高(见表3)。
(2)以术中病理为最终结果,分别计算三者的灵敏度、特异度、阳性预测值以及阴性预测值,绘制ROC曲线后得出AUC,TI-RADS分级、超声SWE及二者联合诊断的AUC分别为0.819、0.839及0.897,如图2所示。
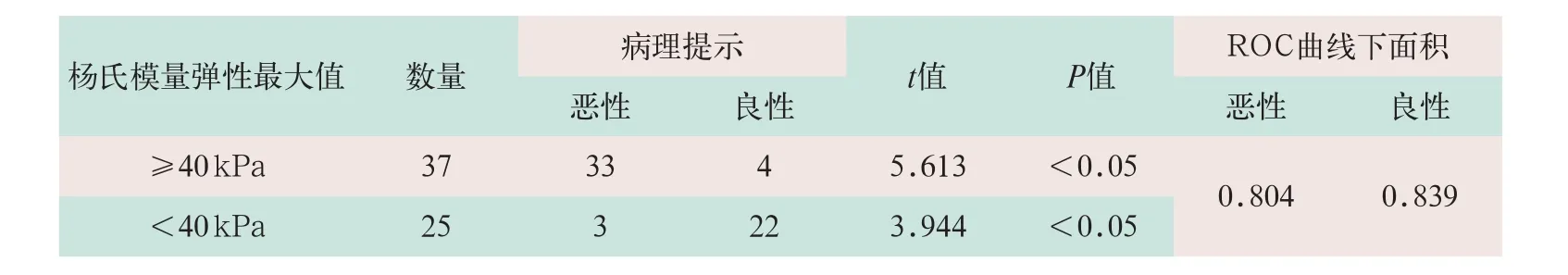
表2 62例甲状腺患者超声SWE杨氏模量弹性最大值结果与最终病理结果对照(个)
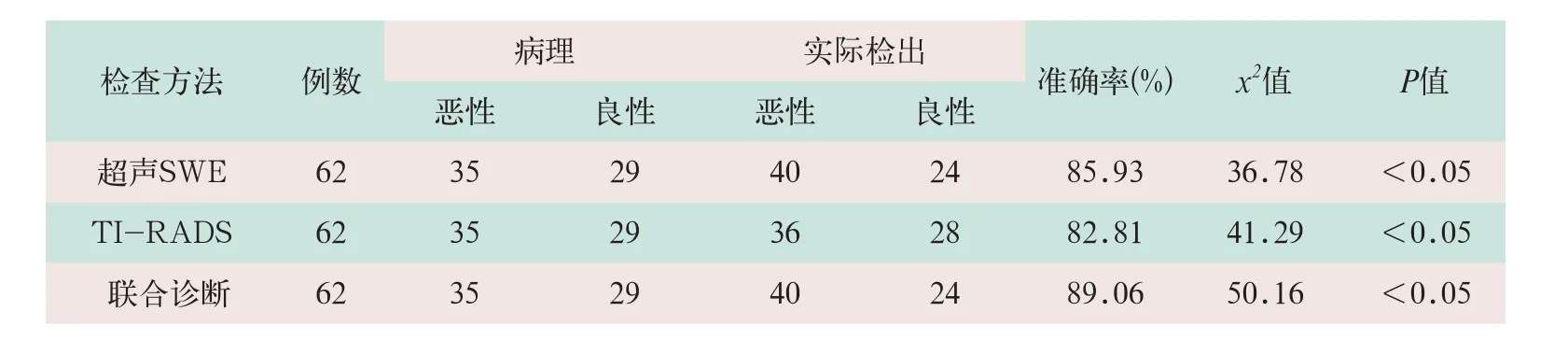
表3 62例甲状腺患者(64个结节)超声SWE、TI-RADS及二者联合诊断甲状腺微小癌的比较(个)
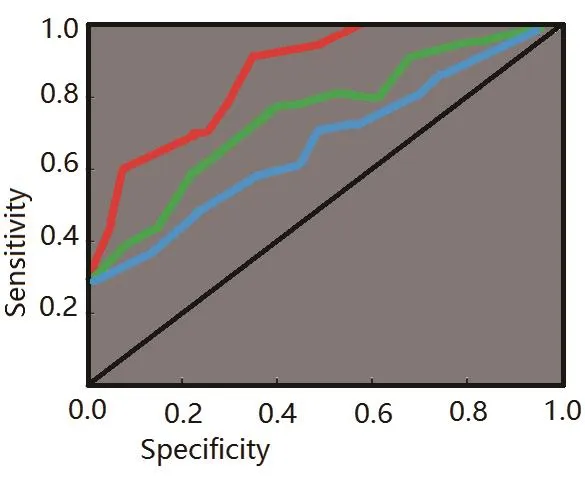
图2 超声SWE、TI-RADS及二者联合诊断甲状腺微小癌的ROC曲线图
3 讨论
甲状腺癌的危险因素包括辐射、过量的碘摄入、激素分泌紊乱、遗传和肥胖等[10-13]。1988年,世界卫生组织将最大直径<1 cm的甲状腺癌定义为甲状腺微小癌,且不论有无淋巴结转移[13]。甲状腺微小癌起病隐匿,术前很难确诊,多由术中冰冻病理标本确诊,其癌灶微小,若出现早期转移则预后差,在临床上应予以甲状腺微小癌重视。
甲状腺微小癌的发病率较高,且不易被发现,在临床检查中极易被漏检。有研究指出,甲状腺微小癌在尸检中的发现率高达30%以上[14]。因此,如何通过日益更新发展的检测手段在早期发现甲状腺微小癌至关重要。利用超声检测甲状腺结节有很多优点,如超声无辐射、费用低及操作简便。其他如CT、核磁共振等在对甲状腺的检测上反而不如超声。一项分析结果表明,常规超声在对恶性结节检出的比例为11.14(95%CI为6.6~18.9)[15]。但是超声对于甲状腺微小癌的检出率差强人意。
目前,临床上多用Kwak等[8]于2011年提出的TIRADS分级标准来对甲状腺结节进行规范化的诊断和分级,然而由于甲状腺结节的成分多样,在临床操作中,不同分级之间往往难以准确区分[13]。因此,如何进一步提高对甲状腺结节良恶性的鉴别,是临床研究中一个新的热门话题。
本研究使用超声SWE技术对结节进行量化,利用其可重复、可量化以及可操作性的特点,进一步对甲状腺微小癌的检出进行优化[16-19]。在本研究中的62例患者中,共对检测出的64个甲状腺微小结节进行常规超声和超声SWE术前检测,以术中病理学为最终诊断依据,分别评价超声SWE、TI-RADS及二者联合对甲状腺微小癌的诊断,显示联合超声SWE和TIRADS评价结果,能更好地对甲状腺微小癌进行检测和诊断。
在本研究中,结节的位置、与周围组织的关系可能会影响超声SWE杨氏模量弹性值,这也是目前关于超声SWE研究的共同弱点[20]。当结节的横断面积较小时,在测量过程中也不易勾画感兴趣区域,容易受周围组织的影响[10,16]。本研究结果提示,联合超声SWE和TI-RADS能更好地对甲状腺微小癌进行检测和诊断,二者联合使用比单独使用的诊断效能要高。但值得一提的是,超声SWE和TI-RADS联合诊断也存在误诊风险,最终的确诊仍需以术中或活检病理学结果为准。
本研究结果提示,超声SWE可以量化地对甲状腺微小癌的诊断提供帮助,超声SWE和TI-RADS联合诊断有助于对微小结节的良恶性进行鉴别,为后续的甲状腺微小癌早期发现和检测方法提供了新的思路和客观证据。
[1]Carling T,Udelsman R.Thyroid cancer[J].Annu Rev Med,2014,65(1):125-137.
[2]Cabanillas ME,Mcfadden DG,Durante C.Thyroid cancer[J].Lancet,2016,388(10061):2783-2795.
[3]Tufano RP,Noureldine SI,Angelos P.Incidental thyroid nodules and thyroid cancer: considerations before determining management[J].JAMA Otolaryngol Head Neck Surg,2015,141(6):566-572.
[4]Kitahara CM,Sosa JA.The changing incidence of thyroid cancer[J].Nat Rev Endocrinol,2016,12(11):646-653.
[5]Vollmer RT.Revisiting overdiagnosis and fatality in thyroid cancer[J].Am J Clin Pathol,2014,141(1):128-132.
[6]Azizi G,Keller JM,Mayo ML,et al.Thyroid Nodules and Shear Wave Elastography:A New Tool in Thyroid Cancer Detection[J].Ultrasound Med Biol,2015,41(11):2855-2865.
[7]Stoian D,Timar B,Derban M,et al.Thyroid Imaging Reporting and Data System (TIRADS):the impact of Quantitative Strain Elastography for better stratification of cancer risks[J].Med Ultrason,2015,17(3):327-332.
[8]Kwak JY,Han KH,Yoon JH,et al.Thyroid imaging reporting and data system for US features of nodules:a step in establishing better stratification of cancer risk[J].Radiology,2011,260(3):892-899.
[9]Wei X,Li Y,Zhang S,et al.Thyroid imaging reporting and data system(TI-RADS)in the diagnostic value of thyroid nodules:a systematic review[J].Tumour Biol,2014,35(7):6769-6776.
[10]Stansifer KJ,Guynan JF,Wachal BM,et al.Modifiable Risk Factors and Thyroid Cancer[J].Otolaryngol Head Neck Surg,2015,152(3):432-437.
[11]翟建敏,原韶玲.甲状腺癌危险因素研究进展[J].中华肿瘤防治杂志,2012,19(10):791-795.
[12]陈志丹,陈德杰,程瑾,等.甲状腺癌相关危险因素分析[J].中国肿瘤,2016,25(6):433-437.
[13]Wu LS,Milan SA.Management of microcarcinomas(papillary and medullary)of the thyroid[J].Curr Opin Oncol,2013,25(1):27-32.
[14]Kakkos SK,Scopa CD,Chalmoukis AK,et al.Relative risk of cancer in sonographically detected thyroid nodules with calcifications[J].J Clin Ultrasound,2000,28(7):347-352.
[15]Brito JP,Gionfriddo MR,Al Nofal A,et al.The accuracy of thyroid nodule ultrasound to predict thyroid cancer:systematic review and meta-analysis[J].J Clin Endocrinol Metab,2014,99(4):1253-1263.
[16]Park AY,Son EJ,Han K,et al.Shear wave elastography of thyroid nodules for the prediction of malignancy in a large scale study[J].Eur J Radiol,2014,84(3):407-412.
[17]Carneiro-Pla D.Ultrasound elastography in the evaluation of thyroid nodules for thyroid cancer[J].Curr Opin Oncol,2013,25(1):1-5.
[18]支欣,钱林学,耿慧英,等.剪切波弹性成像技术临床应用进展[J].中国医学装备,2016,13(12):66-70.
[19]朱炳刚,彭柳清,樊启佑.超声组织弹性成像技术对甲状腺微小癌的诊疗有效性及可行性探究[J].中国当代医药,2015,22(7):99-101.
[20]Shapiro RS.Management of thyroid nodules detected at sonography:Society of Radiologists in Ultrasound Consensus Conference Statement[J].Thyroid,2006,16(3):209-210.
