霞晖6号桃离体快繁及叶片愈伤诱导技术
2018-03-02许建兰马瑞娟俞明亮
许建兰,马瑞娟,俞明亮,周 懋
桃属于蔷薇科(Rosacease)李属,原产于我国,树体适应性强,结果早,见效快,栽培十分普遍[1]。我国是世界桃生产大国之一,资源丰富,分布广泛。目前桃栽培品种繁殖主要通过嫁接技术,而病毒也主要靠嫁接(芽接、切接)传染,据报道,病毒对桃树的危害已经相当严重。目前已发现的核果类果树病毒病共161种,我国鉴定明确的核果类果树病毒及其类似病害有15种,其中桃3种[2]。由于桃树体高大,田间保存占用大量人力、物力、财力,有限的土地资源难以满足人们的需求,加之,近些年气候复杂变化,给资源保存也带来一定困难。而组织培养技术可以在不受任何外界条件限制下进行种质保存,还可研究被培养植物的生长和分化的规律,并且可以利用各种培养条件影响它们的生长和分化。离体保存占用空间小、繁殖速度快、管理方便,且有利于获得脱除病毒的整齐一致的苗木。
国内外学者对桃的离体分化培养和基因转化作了不少研究,但较多是关于组织快繁技术[3-6],而桃遗传转化研究的工作进展缓慢。转基因是目前改良植物遗传特性,创造新品种的一项新技术。建立一个高频率的离体再生体系是基因转化的重要途径。而再生植株的获得需经过愈伤分化,为获得高频再生体系,首先需诱导出大量愈伤进而分化出芽。由于桃再生困难,再生方面的研究报道较少且主要是关于砧木品种,以转基因为目的的高效再生体系目前尚未建立。
栽培品种与砧木品种相比无论在树体性状还是再生能力方面均存在较大差异。桃属于无性繁殖难生根树种,在组织培养和扦插过程中均存在生根率低的问题[7]。霞晖6号是江苏省农业科学院育成的中熟桃新品种,近年来在江苏、山东、浙江等省推广应用。本试验以霞晖6号为研究对象,开展桃快繁体系的建立和愈伤诱导技术研究,为栽培品种的遗传转化提供参考。
1 材料与方法
1.1 试验材料
供试材料霞晖6号来自江苏省农业科学院果树研究所试验园,取一年生枝条(芽未萌动前),带回实验室用流水冲洗,后置组培室24℃水培催芽,隔天换一次水,每次剪去基部2~3 mm,直至枝条抽出叶芽。
1.2 试验方法
1.2.1 无菌苗的获得 外植体茎尖消毒参考许建兰等[5]的方法进行,将准备好的茎尖在实验室流水冲洗2 h,然后用75%乙醇处理1 min,无菌水清洗5次,再用0.1%HgCl2消毒12 min,无菌水冲洗6次,将消毒好的茎尖接种到 MS+6-BA 0.5 mg/L+IBA 0.3 mg/L+GA30.2 mg/L+2.0%蔗糖+5.0 g/L Agar培养基上进行初代培养。
1.2.2 基本培养基的筛选 选择MS、WPM作为基础培养基,添加相同浓度和配比的6-BA 0.5 mg/L和IBA 0.3 mg/L,每种培养基接种30个外植体,30 d后观察比较。
1.2.3 增殖培养条件的筛选 根据1.2.2试验结果,选择MS为基础培养基,添加不同种类、浓度的外源激素 6-BA(0.5、1.0、2.0、4.0 mg/L)、IBA(0.5、1.0 mg/L)进行配比,每个处理接种10瓶,每瓶接种3个外植体,重复3次,30 d后比较增殖生长情况。
1.2.4 MS及改良MS对生根的影响 MS(大量元素减半)、MS(所有元素减半)与MS为基本培养基,分别加入相同种类、浓度的生长素进行生根培养基的筛选。
1.2.5 不同激素种类对生根的影响 根据1.2.4试验结果,加入不同种类生长素NAA、IBA、IAA,浓度均设定为2.0 mg/L,进行生根比较。
1.2.6 不同蔗糖浓度对生根的影响 根据1.2.5试验结果,分别加入不同浓度蔗糖(1%、2%、4%、8%),比较根系生长及玻璃化情况。
1.2.7 不同暗培养时间对生根的影响 根据1.2.6试验结果,将接种生根苗直接光照培养、常温暗培养1周、常温暗培养2周、常温暗培养3周后再进行光照培养,比较生根效果。
1.2.8 不同活性炭浓度对生根的影响 以MS+IAA 2.0 mg/L为基本培养基,加入不同浓度活性炭(0、0.05%、0.1%、0.5%),比较其生根效果。
1.2.9 愈伤的诱导 以MS为基本培养基,将不同浓度的 TDZ(1.0、3.0、5.0 mg/L)、IBA(0.2、0.5 mg/L)、2,4-D(1.0、2.0 mg/L)进行配比,共设 10 个不同处理。取植株顶部3~4片叶,在叶面划伤口,然后进行接种培养,以叶片背面接触培养基,先在4℃低温下暗培养4周,后放入培养温度为(23±1)℃、光周期为12 h/d的条件下进行培养。
1.2.10 褐化的防治 共设3个处理,不加任何抗氧化剂、加入 PVP(2.0 g/L)、加入 AgNO3(2.0 g/L)进行比较试验。
1.3 数据分析
采用DPS方差分析软件进行数据分析。
以上处理除特殊说明外,则处理的蔗糖浓度为2.0%、琼脂为 4.5 g/L、pH 值为 5.8、温度 23 ℃、光照强度为3000 lx。
2 结果与分析
2.1 基本培养基的筛选
将消毒过的芽接种到WPM与MS两种不同的基本培养基中,比较发现,接种初期两者没有太大的差别,但生长一个月后,可明显看出MS培养基中生长的植株叶色较绿,而WPM培养基中生长势较弱,叶色呈现淡黄色,说明MS培养基更适合其生长。
2.2 增殖培养基的筛选
从表1可以看出,随着6-BA浓度的逐渐升高,增殖倍数呈显著的上升趋势。当6-BA浓度为4.0 mg/L、IBA 浓度分别为0.5 mg/L 和1.0 mg/L 时,试管苗的增殖倍数分别为7.2和6.8,与其它处理达显著差异水平,但增殖芽多呈丛生状态,芽瘦小,生长较弱,且较高浓度细胞分裂素会加重玻璃化;当6-BA浓度为0.5 mg/L时,试管苗叶色绿,叶片大而舒展,植株生长健壮,但增殖倍数低,不利于继代扩繁;当6-BA 浓度为 2.0 mg/L、IBA 浓度为 0.5 mg/L 时,试管苗既能保持较佳的生长状态,又能维持较高的增殖倍数5.2,此组合适于试管苗的增殖培养。
2.3 MS及改良MS对生根的影响
以MS(大量元素减半)、MS(所有元素减半)与MS为基本培养基,分别加入NAA 2.0 mg/L进行生根培养基的筛选。表2结果显示,MS(大量元素减半)的生根率最高,达18.3%,平均生根数最多,为1.68,高于MS(所有元素减半)培养基的生根率13.3%、平均生根数1.47和MS的生根率11.7%、平均生根数1.33;MS(大量元素减半)平均生根数与其它处理达显著差异水平;所有处理均出现玻璃化现象,但根部都产生了愈伤。

表1 不同激素的配比对增殖生长的影响
2.4 不同激素种类的浓度对生根的影响
以MS(大量元素减半)为基本培养基,加入不同种类、浓度的生长素NAA、IBA、IAA进行配比生根。从表3中看出,加入2.0 mg/L NAA的处理生根率及平均生根数最低,分别为18.3%与1.7;加入IAA处理的生根率和平均生根数相对较高。随着IAA浓度的升高,生根率有所下降,当IAA浓度为1.0 mg/L时生根率最高,为70.0%,但玻璃化率高达16.7%;当IAA浓度提高到4.0 mg/L时生根率为50%;当IAA浓度为2.0 mg/L时,生根率为53.3%,平均生根数为2.1,且根部无愈伤产生。比较发现,加入NAA、IBA在诱导生根时,切口基部都有愈伤产生,而加入IAA的处理在生根时基部无愈伤产生,有利于移栽。综合比较,说明IAA是生根首选激素,浓度控制在2.0 mg/L较适合。

表2 不同基本培养基对生根的影响
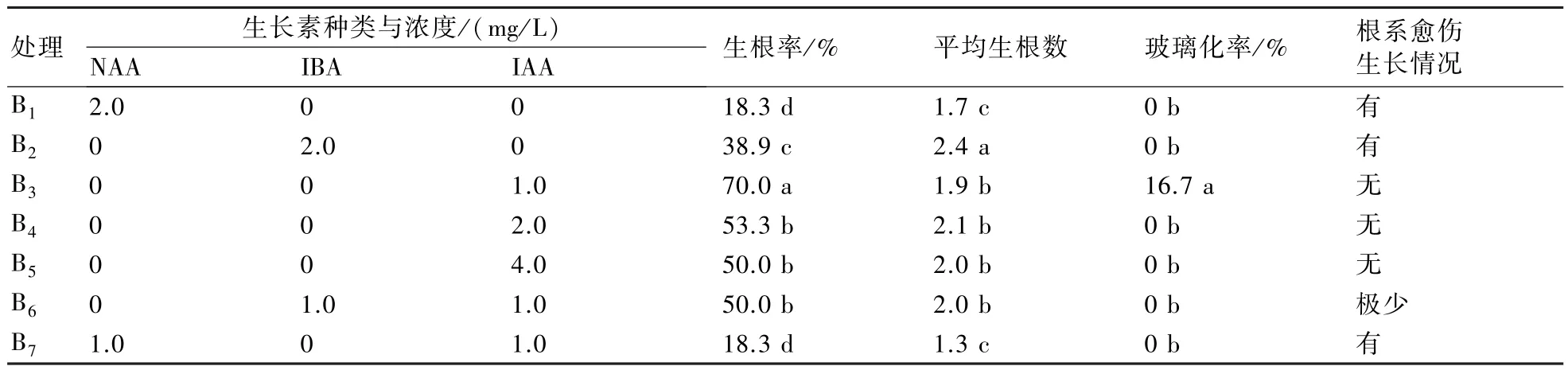
表3 不同激素种类、浓度对生根的影响
2.5 不同蔗糖浓度对生根的影响
随着蔗糖浓度不断升高,生根率有不断下降的趋势,当蔗糖浓度为1%时生根率最高,为56.7%,但玻璃化率高达27.8%,与其它处理达显著差异水平。当蔗糖浓度提高到8%时,生根率只有16.7%,玻璃化率为6.7%,但平均生根数最多,为3.3;当蔗糖浓度为2%时,生根率为53.3%,平均生根数为2.1,与加入1%蔗糖的处理差异不显著,与其它两个处理达显著差异水平(表4)。比较发现,所有处理根系均无愈伤生长,说明不同蔗糖浓度对愈伤产生并无明显影响。
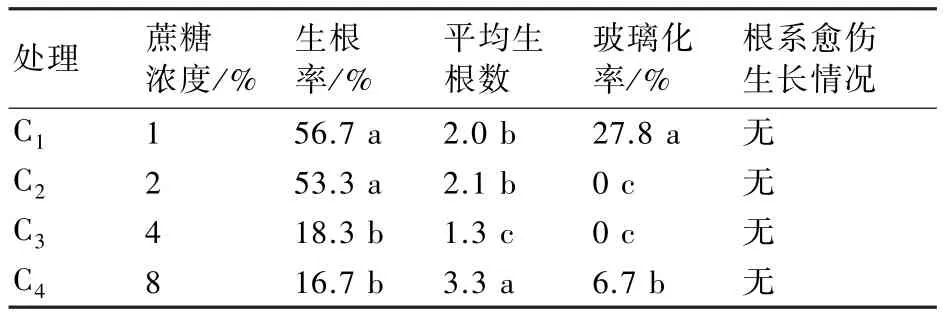
表4 不同蔗糖浓度对生根的影响
2.6 不同暗培养时间对生根的影响
从表5中看出,接种后先经过暗培养再光照培养的处理生根率均有所下降;接种后直接常温光照培养的处理生根率最高,达53.3%,平均生根数最多,为2.1;进行暗培养后生根率都有不同程度下降,暗培养3周时,生根率下降到25%,且根部会产生少量愈伤,不利于生根;在暗培养2周时生根率为45%,玻璃化率显著提高到9.1%,而其它处理无玻璃化现象产生。

表5 不同光照培养时间对生根的影响
2.7 不同活性炭浓度对生根的影响
从表6可知,随着活性炭浓度的不断升高,生根率也不断下降,在不加活性炭的处理中生根率最高,为36.7%,与其它处理达显著差异水平,平均生根数达2.0,无玻璃化现象产生;在加入0.5%活性炭的处理中生根率下降到5%,平均生根数与加入0.1%活性炭的处理相当,为1.0;比较发现,加入活性炭并不有利于生根,也未对玻璃化有所缓解,且发现所有处理根部均无愈伤产生。
2.8 愈伤的诱导
接种好的培养皿先在低温5℃下培养4周,拿出冰箱时叶片颜色鲜绿,伤口无变化。光照培养9 d后伤口开始膨大,其中以叶柄处较为明显。叶片接种方式对愈伤产生没有明显影响,可以从叶面产生,也可以从叶背产生。培养前期愈伤生长较慢,到第3周时愈伤生长较快。比较发现,在同样浓度的TDZ和IBA中,加入2,4-D的处理中愈伤生长较多,致密,而没有2,4-D的处理中愈伤相对较少,且以高浓度的TDZ和2.4-D利于愈伤的诱导,生长素浓度对愈伤诱导影响较小;处理E8和 E10中加入TDZ 5.0 mg/L和2,4-D 2.0 mg/L结果较为理想,其愈伤诱导率可达 100%(表 7)。

表6 不同活性炭浓度对生根的影响
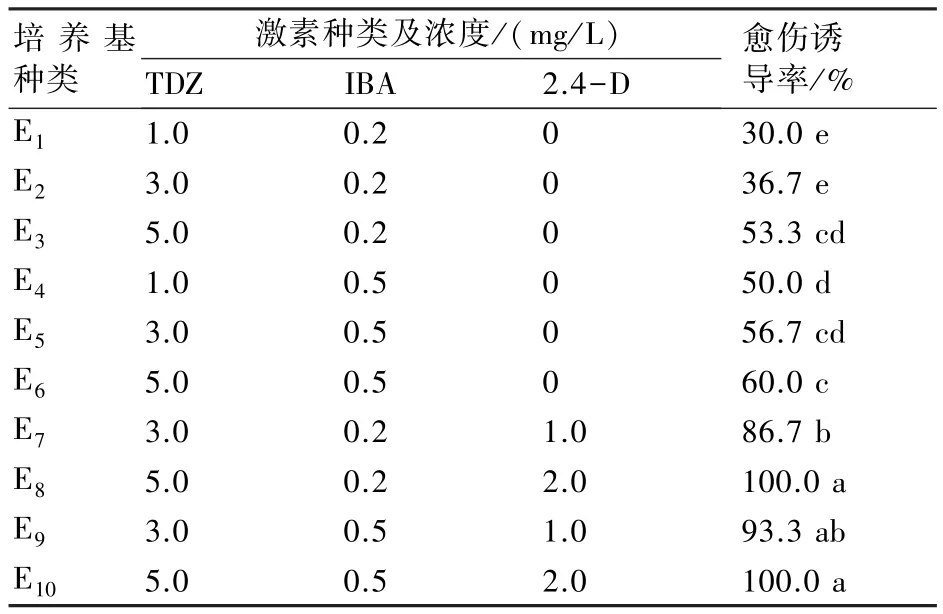
表7 不同激素种类、浓度对愈伤诱导的影响
2.9 褐化的防止
褐化是抑制愈伤产生的重要原因,其中抗氧化剂对酚类物质具有一定的抑制作用。本试验对照中不加任何抗氧化剂,在愈伤生长初期无褐化现象,经过4周的光照培养后,从伤口处开始褐化;加入AgNO3的处理,由于AgNO3见光易分解,分解物对叶片产生刺激作用,使叶片无法生长;加入PVP的处理具有较好的抗氧化作用,从愈伤诱导初期到愈伤长出,切口及愈伤均保持鲜绿。
3 讨论与结论
不同培养基所含基本化学元素的种类和比例之间差异较大,选择合适的基本培养基是离体培养的基础。本实验初代将消毒过的芽接种到WPM和MS两种不同的基本培养基中,发现生长一个月后,MS培养基中生长的植株较WPM培养基中植株叶色更绿,生长势更强,可能由于MS培养基中含有较多氮元素,更有利于其生长。
针对不同的树种、品种应选择不同的适宜培养基,而激素在所有因素中起关键作用。目前常用的激素很多,如 6-BA、KT、ZT、TDZ、NAA、IBA、IAA 等。植物生长处于一个动态变化过程,所以不同阶段应选择适宜的激素种类和浓度,才能达到较好的效果。钟士传等[8]增殖用培养基 MS+6-BA 0.5 mg/L+NAA 0.1 mg/L,增殖系数为 6.9;庄丽娟等[9]的欧李试管苗增殖系数为4.99;孙新政等[10]用改良的培养基MS+6-BA 2.0 mg/L+NAA 0.02 mg/L+GA30.2 mg/L,增殖系数达11.8,但经过几次继代后有玻璃化现象产生。本试验中,当6-BA浓度达4.0 mg/L时,增殖系数在6.8以上,但易玻璃化,有效芽数量明显减少,与前人报道的结论[11-13]一致。 可能是由于高浓度 6-BA 导致组培苗内源激素比例失调,从而产生玻璃化,所以在诱导不定芽时配置好细胞分裂素与生长素的关系才能获得健壮一致的芽。植物在不同生长阶段所需激素种类不同,生长素更利于促进生根,但不同植物所需种类及浓度不同[7-10,14],本试验中加入 2.0 mg/L IAA更利于霞晖6号的生根。
长苗和生根分别在两种不同培养基中进行,本试验中MS全量培养基诱导生根率最高,但有效生根苗少;MS所有元素减半的培养基生根率最低,反映出霞晖6号试管苗生根对营养物质需求的特点。这可能是因为过多或过少的营养物质同时造成了渗透压比高或低,进而改变了细胞生理状态[15],限制了细胞分裂。在本试验中MS(大量元素减半)的基本培养基更适合桃生根,该结果与韩新柱等[16]发现枣在生根诱导时以1/2MS培养基为宜结果一致。试验中发现如果生长素种类、浓度以及其它培养方式不合适,则都可能会导致愈伤组织产生,愈伤组织生根与组培苗的主茎没有维管联系,容易脱落,给后期移栽带来一定的困难。当MS为基本培养基时,生根率高达72.2%,但根系基部有愈伤,因此仍以MS(大量元素减半)更适合霞晖6号桃的生根诱导。
组织培养中常用的活性炭在诱导生根中有两面性,一方面吸附培养基中的非极性物质和色素等有害物质而有利于生根[17-18],另一方面,也会吸附生根所必需的生长激素及其他营养物质而抑制生根[19]。本试验在生根时加入一定质量的活性炭后并未对生根起到促进作用,加入活性炭的处理生根率明显低于不加活性炭的处理,可能是由于加入生长素浓度本身不多,活性炭加入后又吸附掉部分促进生根的生长素所致。有报道[20-21]在植物微繁殖中应用抗氧化剂来抑制褐变,而提高芽诱导率。抗氧化剂防止组织培养褐化主要是通过抑制酚类物质氧化。本研究中加入抗氧化剂PVP具有较好的防褐化效果,而加入AgNO3的处理叶片生长不良,与前人报道结果一致[22],可能与加入AgNO3浓度有关,具体有待进一步探究。
[1]左覃元,朱更瑞,王力荣.中国桃果产业的现状及展望[J].果树科学,1997,14(1):61-63.
[2]蔡志翔,马瑞娟,俞明亮,等.桃树苹果花叶病(APMV)的RT-PCR 检测[J].江苏农业科学,2009(5):42-44.
[3]尚敏克,姜国斌,尹伟伦,等.晚熟桃的离体组织培养[J].辽宁林业科技,2002(3):5-7,20.
[4]白美发.桃树的组培快繁试验[J].落叶果树,2004(3):7-8.
[5]许建兰,周懋,马瑞娟,等.帚形山桃离体快繁技术研究[J].江苏农业科学,2013,41(10):40-41.
[6]李佳莹,俞明亮,马瑞娟,等.三种桃砧木的离体快繁技术研究[J].江苏农业学报,2009,25(3):635-639.
[7]白晓燕,王力荣,王新卫,等.桃砧木组织培养和扦插生根的解剖学观察[J].果树学报,2015,32(1):74-78.
[8]钟士传,王侠礼,于军香,等.植物激素对钙果组织培养的影响[J].山东农业大学学报:自然科学版,2005,36(1):39-41.
[9]庄丽鹃,苏福才.欧李试管苗的快繁[J].内蒙古农业大学学报,2005,26(1):16-19.
[10]孙新政,申顺先,李庆伟,等.钙果4号欧李组织培养技术研究[J].果树学报,2007,24(1):80-83.
[11]高红兵,唐晓杰,孟庆繁.高浓度6-BA诱导酸樱桃苗的玻璃化苗内源激素含量变化[J].林业科学研究,2006,19(4):488-490.
[12] Alababneh SS, Shiblir A.Cryop reservation of bitter almond(Amygdalus communis L.) shoot tips by encapsulation dyhydration and vitrification[J].Advances in Horticultural Science, 2003, 17(1): 15-20.
[13] Curtiso F,Shettyk.Growth medium effects of vitrification,total phenolics, chlorophyll, and water content of in vitro propagated oregano clones[J].Act Horticulturae,1996, 426:489-497.
[14] 高相福.刺梨离体快繁研究[J].西南农业学报,1994,7(2):113-115.
[15]Etuenne H,Berger A,Carron M P.Wate stress of callusfrom heave brasiliensis during induction of somatic embryogenesis[J].Physiologia Plantrum, 1991(82): 213-218.
[16]韩新柱,王素心,张世荃,等.枣树组织培养获得再生植株[J].林业科技通讯,1998(10):28-29.
[17]卜学贤,陈维伦.活性炭对培养基中植物生长调节物质的吸附作用[J].植物生理学报,1988,14(4):401-405.
[18]刘用生,李友勇.植物组织培养中活性炭的使用[J].植物生理学通讯,1994,30(3):214-217.
[19]陈龙清,鞠庆坤.活性炭对几种植物试管苗生根的影响[J].华中农业大学学报,1995,14(6):600-602.
[20]张卫芳,高疆生,欧勇慧,等.抑制核桃组织培养中的褐化现象初探[J].落叶果树,2003(3):4-7.
[21]庞勇.果树组织培养中褐化现象的研究进展[J].甘肃农业科技,2004(1):16-18.
[22]刘娟,汤浩茹,刘玲梅.AgNO3对梨叶片不定梢再生过程中抗氧化酶活性的影响[J].果树学报,2008,25(4):467-472.
