HPLC结合响应面法优化柳叶蜡梅总黄酮提取工艺及其抑菌活性研究
2018-03-02温慧萍肖建中雷伟敏纪佳娜
温慧萍,肖建中,*,雷伟敏,纪佳娜
(1.丽水学院 生态学院,浙江 丽水 323000; 2.丽水出入境检验检疫局 综合技术服务中心,浙江 丽水 323000)
21世纪,天然产物被认为是潜在的药物来源,来自自然界的各种植物化学物质,如多糖、生物碱、类黄酮和苯乙烯化合物,因其生物效益而受到关注[1-2]。黄酮是植物中最重要的活性成分之一,具有抗氧化、抗菌、抗病毒、抗肿瘤、抗衰老等药理作用[3-5],蜡梅属植物主要活性成分为生物碱、黄酮、倍半萜及香豆素[6-7]。柳叶蜡梅(Chimonanthussalicifolius)为蜡梅科蜡梅属半常绿灌木,有祛风解表、理气健脾、消食化积之功效,药理研究表明,它具有镇咳、解热、抗菌、抗炎的作用[8-10],其黄酮类成分的开发及利用研究具有重要的意义。考虑到提取产率以及目标化合物的最大化,本实验以黄酮类成分芦丁、槲皮素、山奈酚含量为指标,采用高效液相色谱法(high performance liquid chromatography,HPLC)结合星点设计- 响应面法对提取工艺加以优化,同时利用滤纸片法检测柳叶蜡梅黄酮提取物的抑菌作用,为柳叶蜡梅的进一步开发利用提供参考。
1 材料与方法
1.1 材料
1.1.1 材料及试剂
柳叶蜡梅茎叶采自浙江丽水。无水乙醇(AR级,杭州龙山精细化工有限公司,批号20160401),甲醇(杭州高晶精细化工有限公司,批号20160409),乙腈(色谱级),芦丁对照品(上海源叶生物科技有限公司,批号Y22S653719,纯度≥98.0%)、槲皮素(上海源叶生物科技有限公司,批号C2016Y1722,纯度≥98.0%)、山奈酚(上海源叶生物科技有限公司,批号R03F6C1,纯度≥98.0%)等。
1.1.2 菌株及培养基
阪崎肠杆菌ATCC25944、鼠伤寒沙门菌ATCC14028 、大肠埃希菌ATCC25922、腊样芽孢杆菌[CMCC(B)63303]由丽水出入境检验检疫局惠赠;肠炎沙门菌[CMCC(B)50335]、乙型副伤寒沙门氏菌[CMCC(B)50094]和福氏志贺氏菌[CMCC(B)51572]购于上海鲁微科技有限公司。
LB培养基:准确称取酵母浸粉5 g、蛋白胨10 g、NaCl 10 g溶于1 L蒸馏水中,用5 mol·mL-1的NaOH溶液调节pH值大小至7.4。若配制固体培养基则加入琼脂粉15 g,加热煮沸直至琼脂粉充分溶解,若配置液体培养基则不加琼脂粉。
1.1.3 实验仪器
AE- 240电子分析天平;安捷伦HPLC1260;步琦旋转蒸发仪;电热鼓风干燥箱(上海精宏实验设备有限公司);电热恒温水浴锅(上海徐吉电气有限公司);SANYO恒温培养箱(三洋电机株式会社);超净工作台、全温培养振荡器(上海精宏实验设备有限公司);游标卡尺(上海宝工工具有限公司);FE- 20K型PH计(瑞士梅特勒托利多仪器有限公司)等。
1.2 方法
1.2.1 柳叶蜡梅黄酮类成分的提取
供试品制备:精密称取适量过3号筛的柳叶蜡梅1 g,按照单因素及响应面设计的条件回流提取,将其提取液浓缩过滤,再加入甲醇溶解,于25 mL容量瓶定容,经0.22 μm微孔滤膜过滤即得柳叶蜡梅总黄酮提取液。
单因素实验设计:称取1 g样品于50 mL圆底烧瓶,按照预先设计的方法提取柳叶蜡梅中黄酮类成分,选取不同提取温度(50、60、70、80、90、100 ℃)、不同乙醇浓度(30%、40%、50%、60%、70%、80%)、不同提取时间(0.5、1.0、1.5、2.0、2.5、3.0 h)、不同料液比(1∶5、1∶10、1∶15、1∶20、1∶25、1∶30)等因素进行试验,分析其对柳叶蜡梅中黄酮类成分的影响。每个处理重复3次,取平均值。
响应面实验设计:根据单因素实验结果和响应面实验设计原理,同时考虑到溶剂量对后期浓缩处理的影响以及工业生产的实际能耗,因此,固定料液比为1∶15,选取乙醇浓度(X1)、提取时间(X2)、提取温度(X3)3个因素作为自变量,以柳叶蜡梅总黄酮含量(Y)作为因变量,进行响应面分析,优化柳叶蜡梅总黄酮提取工艺。因素水平见表1。
表1因素水平及编码
Table1Factor levels and coding

水平Levels因素Factors乙醇浓度Ethanolconcentra-tion/%提取时间Extracttime/h温度Temperature/℃-1701.0700801.5801902.090
1.2.2 黄酮类物质提取及含量测定
按照下列色谱条件测定其芦丁、槲皮素、山奈酚含量,以芦丁、槲皮素、山奈酚含量之和作为总黄酮含量。
色谱条件:安捷伦ZORBAX Extend- C18液相色谱柱(250 × 4.6 mm, 5 μm);流动相(A)为乙腈,流动相(B)为0.2%冰醋酸;检测波长λ=365 nm;流速1 mL·min-1;柱温35 ℃;进样量10 μL。按0~10 min,5%~10% A;10~20 min,10%~32% A;20~26 min,32%~42%A;26~30 min,42%~60%A;30~35 min,60%~90% A进行梯度洗脱。
标准曲线的绘制:分别精密称取芦丁、槲皮素、山奈酚对照品适量,加甲醇制成1 mg·mL-1溶液,作为对照品母液,根据实验需要进行稀释,制备标准曲线。将芦丁对照品分别稀释为0.005、0.010、0.015、0.020、0.025、0.030 mg·mL-1的标准溶液,将槲皮素对照品分别稀释为0.020、0.025、0.030、0.035、0.040、0.045 mg·mL-1的标准溶液,将山奈酚对照品分别稀释为0.010、0.015、0.020、0.025、0.030、0.035 mg·mL-1的标准溶液。准确吸取制备的标准溶液按照上述色谱条件分别进样,以对照品标准溶液浓度(mg·mL-1)为横坐标,以其色谱峰面积为纵坐标,绘制标准曲线。得到芦丁、槲皮素、山奈酚的回归方程分别为:Y1=9630.9714X-3.9353,(R2=0.999 5),Y2=19396.6286X-31.4021(R2=0.999 6),Y3=16916.8571X-21.8776(R2=0.999 4),线性范围分别为0.004 0~0.032 0、0.0031~0.045 0、0.003 6~0.035 0 mg·mL-1。
根据线性回归方程计算芦丁、槲皮素、山奈酚的质量浓度A,各成分含量测定参照下面公式:
黄酮类成分含量Y=(A×B)/W。
式中:A为提取各黄酮类成分的质量浓度(mg·mL-1);B为提取液的稀释体积(mL);W为柳叶蜡梅质量(g),Y表示芦丁、槲皮素、山奈酚含量。
1.2.3 抑菌实验
采用滤纸片琼脂扩散法[11]。将响应面法最优条件提取的柳叶蜡梅黄酮提取液进行浓缩,用DMSO配制成1 000 mg·mL-1,并稀释至500、250、125、62.5 mg·mL-1。用打孔器将定性滤纸制作成直径为6 mm的圆形纸片,121 ℃高压灭菌20 min。用滤纸片浸取以上不同浓度的提取液,平整地放置于已经涂布0.1 mL浓度为105~106cfu·mL-1不同菌液的培养基上,每个浓度重复5次,用DMSO浸取的滤纸片作阴性对照。将培养基置于37 ℃培养箱中培养24 h后,用游标卡尺测量抑菌圈直径,并通过T- test检验分析抑菌能力。
1.3 数据分析
本实验使用DesignExpert 8.0.5软件,采用响应面设计分析方法进行线性回归和二项拟合,利用DesignExpert 8.0.5中optimization choice模块的point prediction功能优化工艺条件,并进行预实验分析。抑菌试验数据以x±s表示,由T- test统计软件分析。
2 结果与分析
2.1 单因素实验
2.1.1 提取温度对总黄酮含量的影响
从图1可知,随着提取温度的升高,柳叶蜡梅总黄酮含量先缓慢升高后降低。提取温度增加至80 ℃,柳叶蜡梅总黄酮含量升至最高,随着温度的进一步升高,总黄酮含量反而降低。考虑到高温对黄酮类成分结构有一定的影响,所以选择80 ℃为适宜的提取温度。
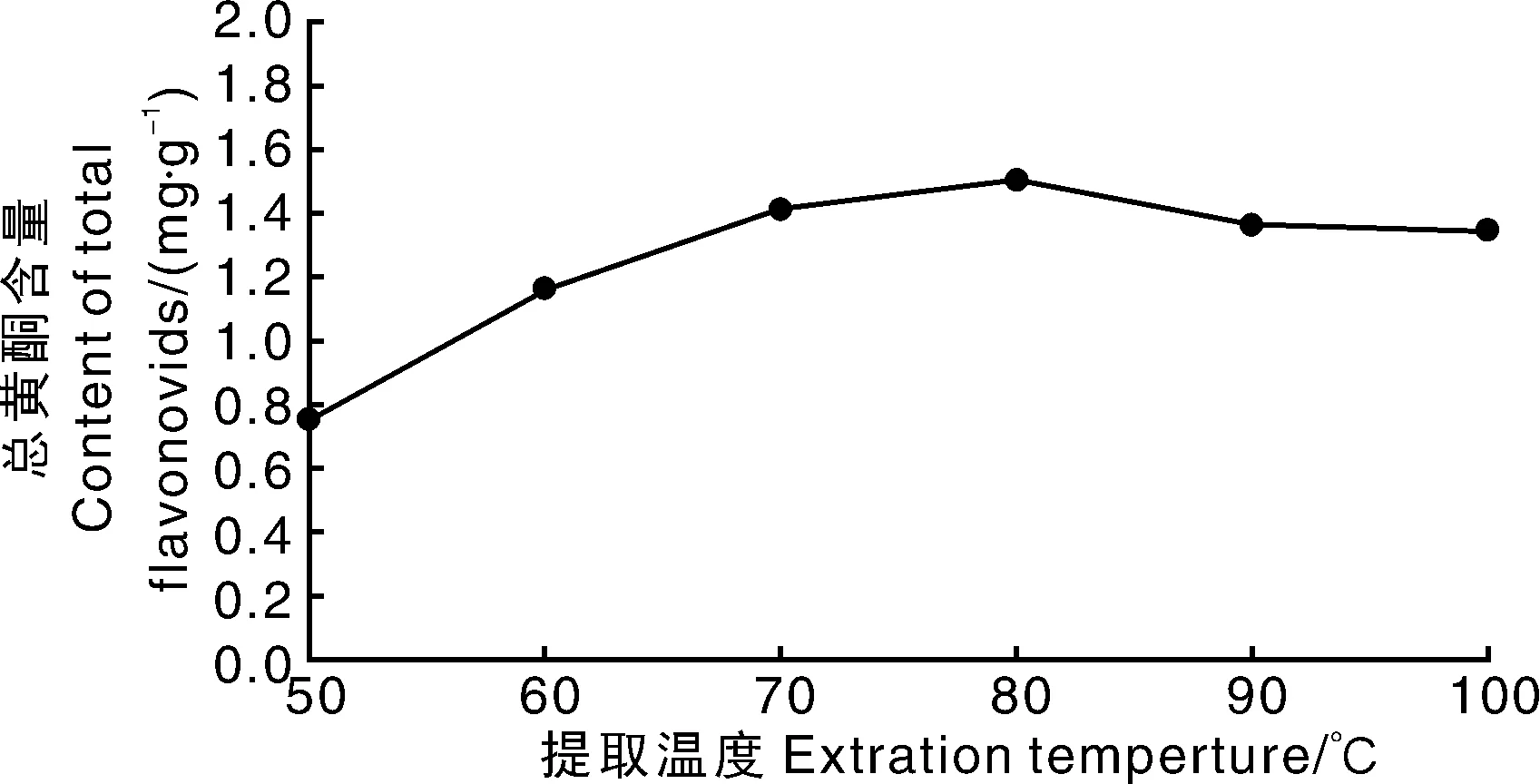
图1 提取温度对提取柳叶蜡梅总黄酮含量的影响Fig.1 Effect of extraction temperature on content of total flavonoids from C. salicifolius
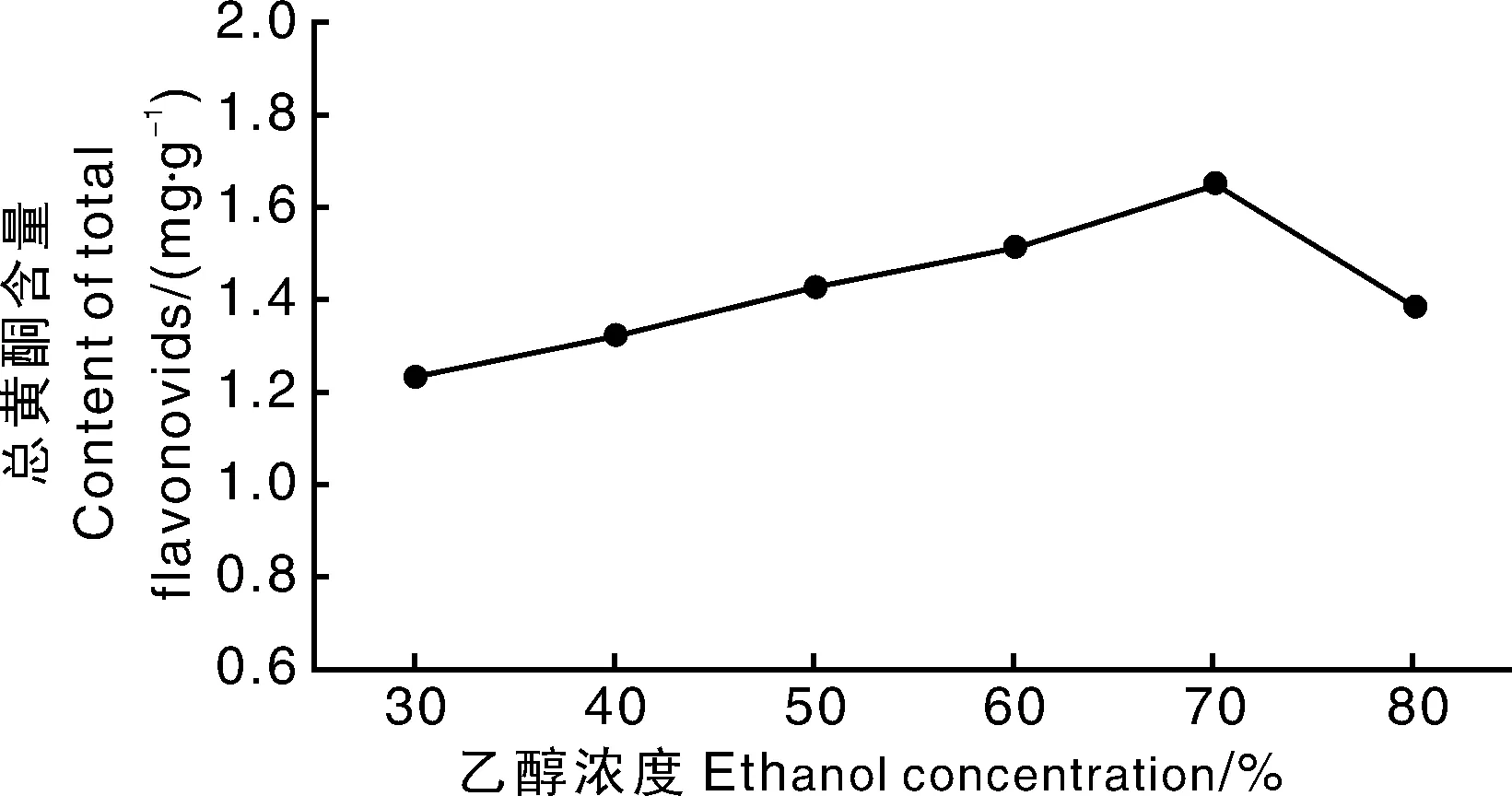
图2 乙醇浓度对提取柳叶蜡梅总黄酮含量的影响Fig.2 Effect of ethanol concentrations on content of total flavonoids from C. salicifolius
2.1.2 乙醇浓度对总黄酮含量的影响
从图2可知,随着乙醇浓度的增加,柳叶蜡梅总黄酮含量先逐渐升高后降低,乙醇浓度为70%时达到最大值。表明适当增加提取剂中乙醇含量有助于溶出黄酮,但乙醇含量过高时,进入提取液的醇溶性杂质增加,使总黄酮的得率降低。初步确定乙醇浓度为70%较适宜。
2.1.3 提取时间对总黄酮得率的影响
从图3可知,随着提取时间的延长,柳叶蜡梅总黄酮含量先升高后逐渐降低,提取1.5 h时总黄酮含量达到最大。考虑到工时及能耗,选择提取时间为1.5 h,进行后续响应面优化试验。
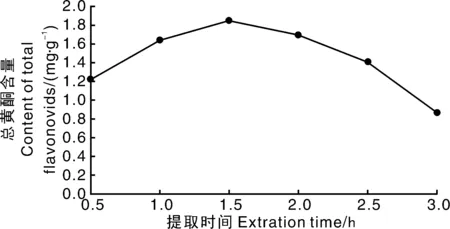
图3 提取时间对柳叶蜡梅总黄酮含量的影响Fig.3 Effect of extraction time on content of total flavonoids from C. salicifolius
2.1.4 料液比对总黄酮得率的影响
从图4可知,料液比从1∶5增加至1∶15,柳叶蜡梅总黄酮含量逐渐升高,随后保持稳定;料液比超过1∶20,总黄酮含量逐渐下降。由于浸提液在后期需要浓缩,若加水过多,后序工序能耗过大,效率降低,故确定最佳料液比为1∶15左右。
2.2 响应面实验结果与优化分析
2.2.1 响应模型的建立与分析
响应面分析结果见表2,对表2的实验结果进行多元线性回归及二项式方程拟合,芦丁、槲皮素、山奈酚的回归模型见表3。回归方程方差分析表明其多项式回归方程中P值小于0.05,表明该模型得到的回归方程比较可靠;各个方程拟合相关系数R2均大于0.9,表明估计值与预测值之间匹配度较好。在选取的因素水平范围内,比较各因素的F值,可得出各因素对实验结果的影响大小顺序为乙醇浓度>提取时间>提取温度。
从表4可以看出,失拟项值为0.084,即方程模型失拟不显著。方差分析的结果表明方程的总模型、各单因素对总黄酮类成分的提取率影响极显著(P<0.01),乙醇浓度(X1)、提取时间(X2)以及提取温度(X3)对总黄酮提取率的影响均达到极显著水平(P<0.01),而交互项乙醇浓度与提取温度、提取时间与提取温度对总黄酮提取率的影响达显著水平(P<0.05)。
2.2.2 响应面优化
利用DesignExpert 8.0.5软件绘制响应面分析图,结果见图5~图8。从图可知各响应面曲线较陡峭,也反映出三者交互作用对各黄酮类成分的影响较为明显,当乙醇浓度以及提取时间适当增加时,芦丁、槲皮素、山奈酚以及总黄酮得率均增大,且均有稳定的最大值;因此,适当增加乙醇浓度及延长提取时间有助于提高黄酮类成分得率;当提取温度一定时,适当延长提取时间,槲皮素、芦丁山奈酚以及总黄酮得率均升高,随着提取时间的增加,其得率增加趋势逐渐变缓慢。各图底部为等高线图,等高线形状反映了交互效应的强弱,椭圆形表示两因素交互影响显著,圆形则与之相反。由图5可知乙醇浓度与提取温度交互作用较强,对柳叶蜡梅总黄酮得率影响较显著(P<0.01),其等高线呈椭圆形。从图6~8可知,各因素相互作用的等高线并没有呈现明显的椭圆形,响应曲线相对较平缓,说明各因素之间交互作用并不显著。结合芦丁、槲皮素、山奈酚、总黄酮含量响应面的最大值得出自变量的最佳参考值,结果见表5。确定最佳工艺条件为乙醇浓度79%,提取时间1.70 h、提取温度90 ℃,料液比1∶15。
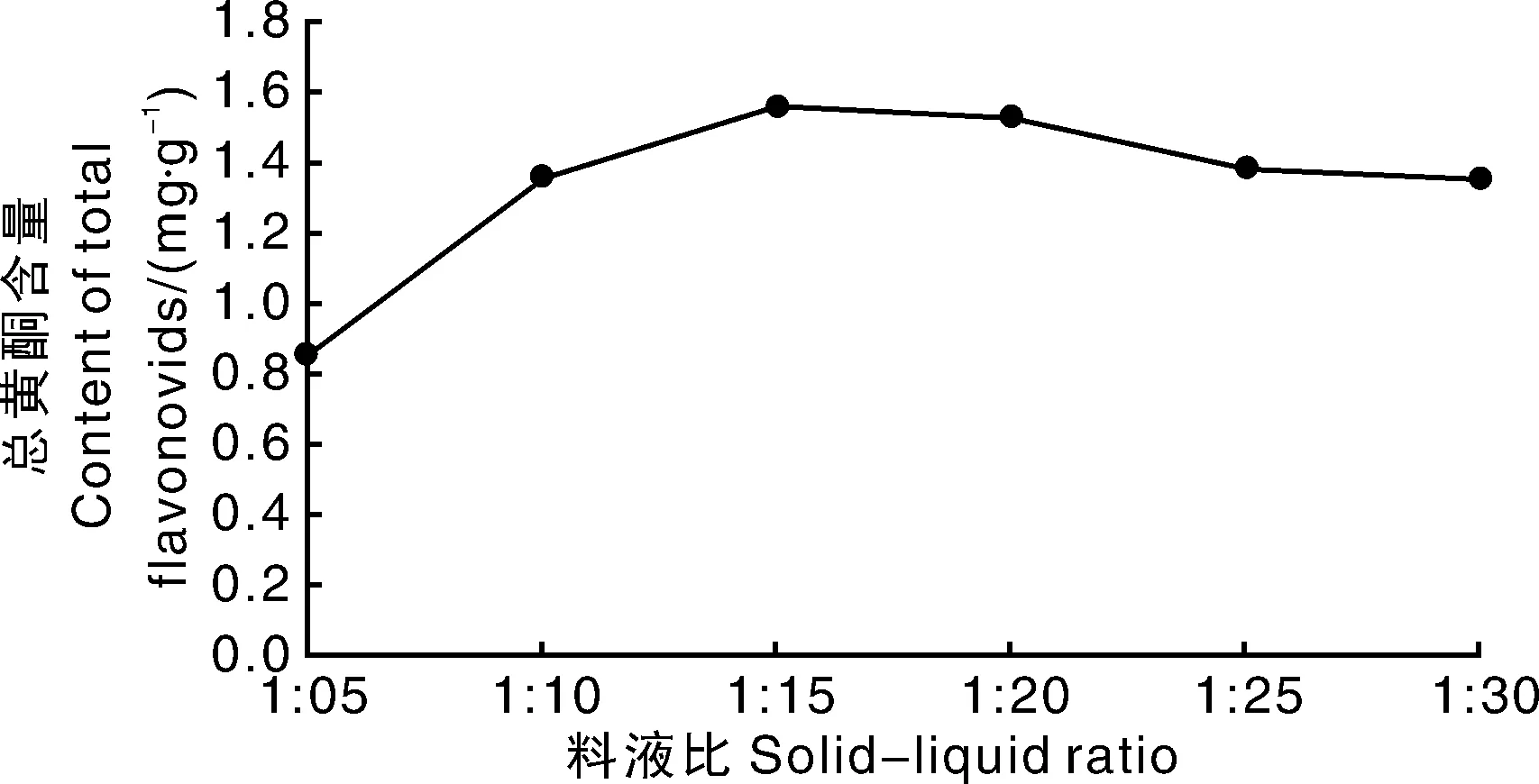
图4 料液比对柳叶蜡梅总黄酮得率的影响Fig.4 Effect of different liquid ratio on extraction efficiency of total flavonoids from C. salicifolius
表2响应面分析结果
Table2Results of response surface analysis
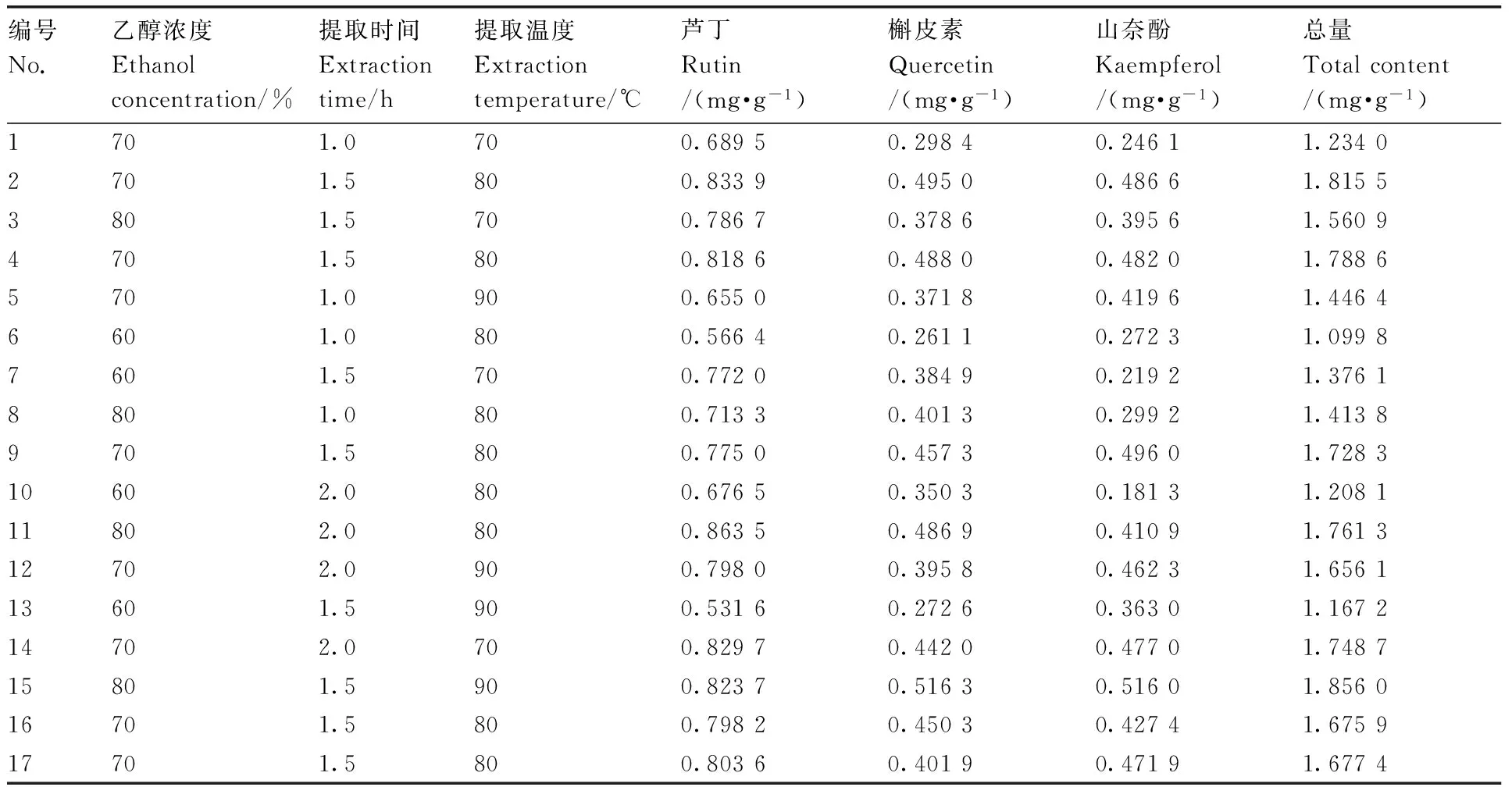
编号No.乙醇浓度Ethanolconcentration/%提取时间Extractiontime/h提取温度Extractiontemperature/℃芦丁Rutin/(mg·g-1)槲皮素Quercetin/(mg·g-1)山奈酚Kaempferol/(mg·g-1)总量Totalcontent/(mg·g-1)1701.0700.68950.29840.24611.23402701.5800.83390.49500.48661.81553801.5700.78670.37860.39561.56094701.5800.81860.48800.48201.78865701.0900.65500.37180.41961.44646601.0800.56640.26110.27231.09987601.5700.77200.38490.21921.37618801.0800.71330.40130.29921.41389701.5800.77500.45730.49601.728310602.0800.67650.35030.18131.208111802.0800.86350.48690.41091.761312702.0900.79800.39580.46231.656113601.5900.53160.27260.36301.167214702.0700.82970.44200.47701.748715801.5900.82370.51630.51601.856016701.5800.79820.45030.42741.675917701.5800.80360.40190.47191.6774
表3二项式回归方程
Table3Binomial regression equation

组分Component二项式回归方程BinomialregressionequationP值Pvalue失拟项MisjudgmentR2CV/%Y1Y1=-0.0517+0.0304X1+0.50264X2-0.0207X3+0.02X1X2+0.00693X1X3+0.0014X2X3-0.00058X21-0.17277X22-0.0019617X230.00020.30320.96963.38Y2Y2=-1.79693+0.00745X1+1.1448X2+0.02052X3-0.00018X1X2+0.00063X1X3-0.00598X2X3-0.000363X21-0.18940X22+0.00341X230.00160.98370.94037.06Y3Y3=-6.44383+0.114356X1+1.04126X2+0.1472X3-0.01014X1X2-0.00585X1X3-0.00941X2X3-0.00105X21-0.30811X22+0.000055X230.00280.92950.929611.02YY=-8.29243+0.18137X1+2.6870X2+0.14482X3+0.011960X1X2+0.00126X1X3-0.01525X2X3-0.0019882X21-0.67028X22-0.000048X23<0.00010.57450.97483.90
Y1,芦丁含量;Y2,槲皮素含量;Y3,山奈酚含量;Y,总黄酮含量。X1,乙醇浓度;X2,提取时间;X3,提取温度。表5、6同。
Y1, Rutin yield;Y2, Quercetin yield;Y3, Kaempferol yield; Y, Total flavonoid content.X1, Ethanol concentration;X2, Extraction time;X3, Extraction temperature。The same as Table 5 and 6.
2.3 最佳提取工艺条件的验证
根据自变量最优预测范围(表5),选取最佳提取工艺条件:料液比1∶15、乙醇浓度79%、提取时间1.70 h、提取温度90 ℃。提取3批样品,与预测值相比,各考察指标偏差均较小(表6),表明所建立的数学模型具有良好的预测性,所选的条件重复性良好,该提取工艺可行。
表4芦丁、槲皮素、山奈酚三者之和的响应面方差分析
Table4Analysis of variance for the sum of rutin, quercetin and kaempferol response surface quadratic model
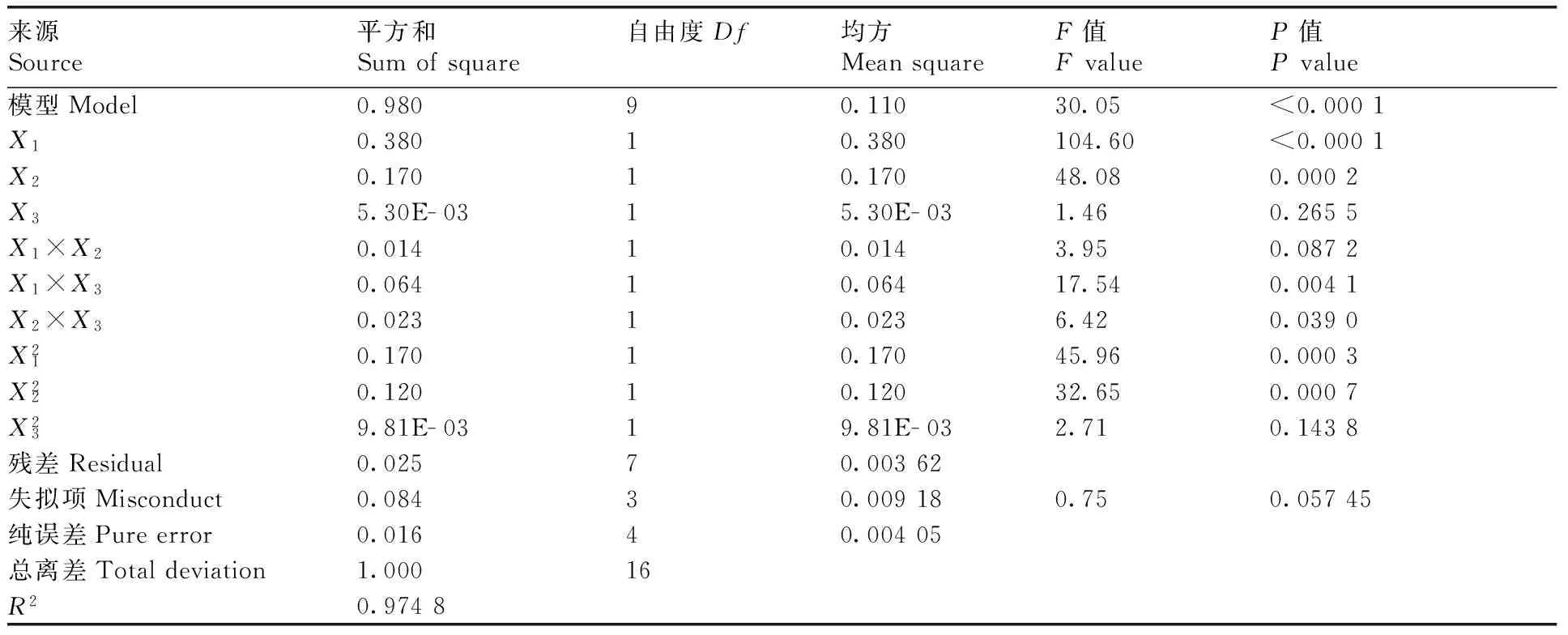
来源Source平方和Sumofsquare自由度Df均方MeansquareF值FvalueP值Pvalue模型Model0.98090.11030.05<0.0001X10.38010.380104.60<0.0001X20.17010.17048.080.0002X35.30E-0315.30E-031.460.2655X1×X20.01410.0143.950.0872X1×X30.06410.06417.540.0041X2×X30.02310.0236.420.0390X210.17010.17045.960.0003X220.12010.12032.650.0007X239.81E-0319.81E-032.710.1438残差Residual0.02570.00362失拟项Misconduct0.08430.009180.750.05745纯误差Pureerror0.01640.00405总离差Totaldeviation1.00016R20.9748
X1,乙醇浓度;X2,提取时间;X3,提取温度。
X1, Ethanol concentration;X2, Extraction time;X3, Extraction temperature.

图5 两因素交互作用对柳叶蜡梅总黄酮提取量影响的响应面图Fig.5 Response surface of two factors interaction effects on the extraction of total flavonoids from C.salicifolius
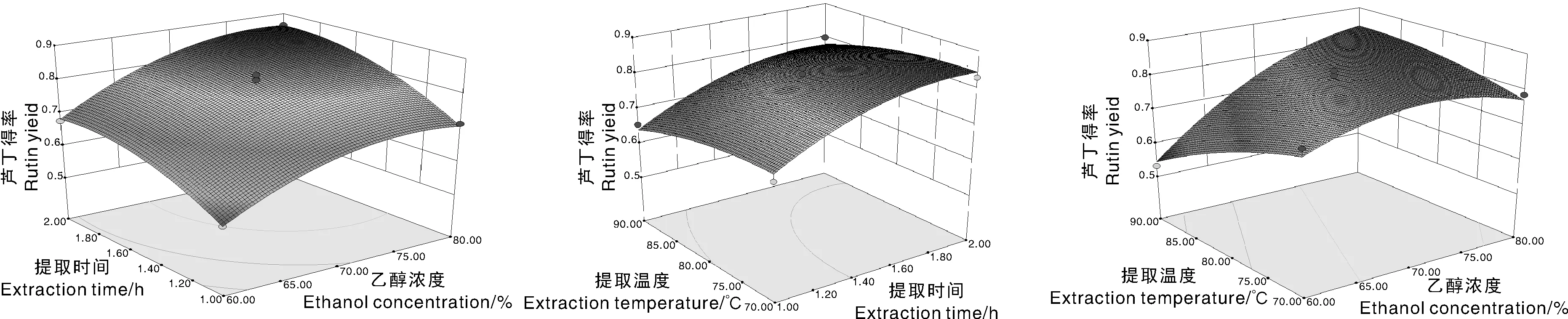
图6 两因素交互作用对柳叶蜡梅芦丁得率影响的响应面图Fig.6 Response surface of two factors interaction effects on the extraction of rutin from C. salicifolius

图7 两因素交互作用对柳叶蜡梅山奈酚得率影响的响应面图Fig.7 Response surface of two factors interaction effects on the extraction of kaempferol from C.salicifolius
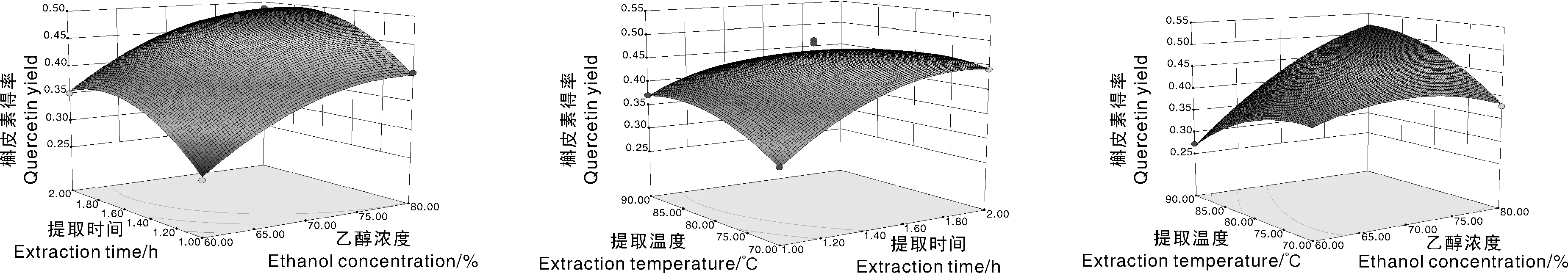
图8 两因素交互作用对柳叶蜡梅槲皮素得率影响的响应面图Fig.8 Response surface of two factors interaction effects on the extraction of quercetin from C. salicifolius
表5响应面优化工艺的最佳提取参数
Table5Optimum parameters of surface optimization process

评价指标EvaluationindexX1/%X2/hX3/℃Y175.52~79.901.70~1.9979.49~87.51Y279.25~79.981.67~1.7485.99~89.30Y379.15~79.351.37~1.6890Y79.09~79.351.64~1.6890
2.4 柳叶蜡梅黄酮提取物的抑菌效果研究
从表7可以看出,与DMSO阴性对照组相比,柳叶蜡梅总黄酮具有较强的抑菌作用,且其抑菌效果与浓度呈正相关关系,尤其对蜡样芽孢杆菌和大肠埃希菌有较显著的抑制作用(P<0.05)。
3 讨论
响应面法优化考察因素,具有精密度高、预测效果准确的优点。目前,国内外对响应面法提取的应用较多[12-15],徐萌等[16]用响应面法对柳叶蜡梅叶黄酮的提取工艺进行优化,但该法目标产物不够明确。本研究在单因素实验的基础上,设计了三因素三水平共17个试验点安排试验,利用Design Expert 8.05软件设计响应面实验,优化柳叶蜡梅中黄酮的提取工艺,并结合高效液相色谱仪对目标成分进行定量分析。结果表明,乙醇浓度对总黄酮提取量的影响最大,提取时间次之,交互项乙醇浓度与提取温度、提取时间与提取温度对总黄酮提取率的影响显著。确定最佳提取工艺为提取温度90 ℃,加入15倍量的79%乙醇提取1.7 h,柳叶蜡梅芦丁得率0.861 mg·g-1,与预测值偏差0.26%;槲皮素得率0.504 mg·g-1,与预测值偏差2.4%;山奈酚得率0.492 mg·g-1,与预测值偏差2.9%;总黄酮提取量为1.857 mg·g-1,与预测值偏差1.5%,充分验证了所建模型的可靠性,说明采用响应面分析法可优化柳叶蜡梅黄酮类成分的提取工艺。本实验通过HPLC测定各有效成分的含量,结合响应面法对提取物的溶剂浓度、提取温度和提取时间进行优化,实现提取产率以及目标化合物的最大化。这种通过常规提取技术结合定量分析来优化目标产物的提取过程有助于目标产物的开发,分析自变量对响应变量的影响,该实验方法允许生成可描述研究实验领域过程的数学模型[17-20],能更精准地评价提取条件的优劣。
表6最佳提取工艺实验验证
Table6Verification of the best extraction process
表7不同浓度柳叶蜡梅总黄酮提取物的抑菌圈直径
Table7Inhibition zone diameter of total flavonoids fromC.salicifoliusunder different concentrations

总黄酮浓度Concentrationoftotalflavonoids/(mg·mL-1)抑菌圈直径Inhibitionzonediameter/mm鼠伤寒沙门菌S.typhimurium肠炎沙门菌S.enteritidis阪崎肠杆菌B.sakazakii乙型副伤寒沙门氏菌S.paratyphiB腊样芽孢杆菌W.bacillus大肠埃希菌E.coli福氏志贺氏菌S.castellani10009.79±1.41*9.02±0.88*10.32±3.09*9.51±0.27*13.21±0.47**11.18±0.37**10.11±1.49*5008.77±0.81*8.94±0.69*9.49±1.29*8.93±0.70*10.21±0.39*10.04±1.71*9.78±0.29*2507.78±0.47*8.89±0.69*9.11±1.11*8.75±1.69*9.84±0.17*9.09±0.91*9.45±1.42*1257.71±0.57*8.7±0.39*6.10±0.148.39±0.93*8.14±0.74*8.47±1.48*8.46±0.06*62.57.11±0.08*6.16±0.406.11±1.496.01±0.577.29±1.73*8.38±0.43*8.15±0.19*DMSO6.05±0.126.11±0.236.06±0.096.08±0.36.18±0.036.13±0.116.04±0.25
*和**表示与DMSO处理相比,分别在P<0.05和P<0.01水平差异显著。
* and ** mean significant differences at the levels ofP<0.05 andP<0.01 compared with DMSO treatment, respectively.
近年来,抗生素的滥用越来越严重,寻找可替代抗生素的天然植物抗生素已经成为研究热点。研究表明,许多植物中提取的黄酮类成分具有较好的抗菌作用[21-26]。本实验通过响应面法优化提取柳叶蜡梅中的黄酮,再对其黄酮类提取物进行抑菌效果评价。结果表明,柳叶蜡梅黄酮类成分对革兰氏阳性菌及阴性菌均具抑菌作用,尤其是对蜡样芽孢杆菌、大肠埃希菌有较强的抑制作用,这可能是其能治疗肠道腹泻的原因。本研究优选出的最佳实验条件,对今后有效开发和利用柳叶蜡梅中的黄酮类成分有一定的指导意义。
[1] GECHEV T S, HILLE J, WOERDENBAG H J, et al. Natural products from resurrection plants potential for medical applications[J].BiotechnologyAdvances, 2014, 32(6): 1091-1101.
[2] LANZOTTI V. Drugs based on natural compounds: recent achievements and future perspectives[J].PhytochemistyReviews, 2014, 13(4): 725-726.
[3] FERREIRA A, POUSINHO S, FORTUNA A, et al. Flavonoid compounds as reversal agents of the P- glycoprotein- mediated multidrug resistance: biology, chemistry and pharmacology[J].PhytochemistyReviews, 2015, 14(2): 233-272.
[4] CAO J G, XIA X, CHEN X F, et al. Flavonoids contents, antioxidant and anticancer activities of 78 species of ferns from China[J].Biomedical.Papers, 2012, 15(6): 33.
[5] PAVLOVA S I, ALBEGOVA D Z, VOROBEVA Y S, et al. Flavonoids as potential immunosuppressants affecting intracellular signaling pathways (a review)[J].PharmaceuticalChemistryJournal, 2016, 49(10): 645-652.
[6] LIU H T, CAO M P, ZHANG X F, et al. HPLC fingerprints establishment of chemical constituents in genusChimonanthusleaves[J].ChinaJournalofChineseMateriaMedica, 2013, 38(16): 1560-1561.
[7] PAN X H, SHI X J, ZHANG X F, et al. Constituents ofChimonanthussalicifoliusand their antioxidant activity[J].ChineseJournalofExperimentalTraditionalMedicalFormulas, 2012, 18(1): 99-102.
[8] WANG KW, DAN L, BIN W, et al. New cytotoxic dimeric and trimeric coumarins fromChimonanthussalicifolius[J].PhytochemistryLetters, 2016, 16: 115-120.
[9] 刘忠达, 袁宙新, 张尊敬, 等. 柳叶蜡梅提取物对人胃癌SGC- 7901细胞的作用机制研究[J]. 中华中医药杂志, 2011, 26(10): 2420-2423.
LIU Z D, YUAN Z X, ZHANG Z J, et al. Inhibitory effect of extract ofChimonanthussalicifoliuson SGC- 7901 cell and the possible mechanism[J].ChineseJournalofTraditionalChineseMedicine, 2011, 26(10): 2420-2423. (in Chinese with English abstract)
[10] 王凌云, 张志斌, 邹峥嵘, 等. 蜡梅属植物化学成分和药理活性研究进展[J]. 时珍国医国药, 2012, 23(12): 3104-3106.
WANG L Y, ZHANG Z B, ZOU Z R, et al. Chemical constituents and pharmacological activities of the research progress ofChimonanthus[J].LishizhenMedicineandMateriaMedicaResearch, 2012, 23(12): 3104-3106. (in Chinese with English abstract)
[11] 王宇翎, 张艳, 方明, 等. 白花蛇舌草总黄酮的抗炎及抗菌作用[J].中国药理学通报, 2005, 21(3): 348-350.
WANG Y L, ZHANG Y, FANG M, et al. Anti- inflammatory and antibacterial effects of total flavones of olden landia diffusa willd[J].ChinesePharmacologicalBulletin, 2005, 21(3): 348-350. (in Chinese with English abstract)
[12] XIE R F,SHI Z N, LI Z C, et al. Optimization of high pressure machine decocting process for Dachengqi Tang using HPLC fingerprints combined with the Box- Behnken experimental design[J].JournalofPharmaceuticalAnalysis, 2015, 5(2): 110-119.
[13] SEVERINI C, DIEROSS A, FIORE A G. Ultrasound- assisted extraction to improve the recovery of phenols and antioxidants from spent espresso coffee ground: a study by response surface methodology and desirability approach[J].EuropeanFoodResearchandTechnology, 2017, 243(5): 835-847.
[14] ALEXANDRE E M C, ARAUJO P, FREITAS V D, et al. experimental design, modeling and optimization of high- pressure- assisted extraction of bioactive compounds from pomegranate peel[J].FoodandBioprocessTechnology, 2017, 10(5): 886-900.
[15] TARANTINO T B, BARBOSA I S, PERRIRA M D G, et al. Microwave- Assisted digestion using diluted nitric acid for multi- element determination in rice by ICP OES and ICP- MS[J].FoodAnalyticalMethods, 2017, 10(4): 1007-1015.
[16] 徐萌,张经纬, 张金凤. 响应面法优化柳叶蜡梅总黄酮叶的提取工艺[J]. 分子植物育种, 2016, 14(2): 496-500.
XU M, ZHANG J W, ZHANG J F. Optimizing extraction process of the flavonoids inChimonanthuspraecoxleaves by response surface method[J].MolecularPlantBreeding, 2016, 14(2): 496-500. (in Chinese with English abstract)
[17] MILUTINOVIC M, RADOVANOVIC N, COROVIC M, et al. Optimisation of microwave- assisted extraction parameters for antioxidants from wasteAchilleamillefolimdust[J].IndustrialCropsandProducts, 2015, 77: 333-341.
[18] SNEZANA F, BRANINMINR P, SENKA V, et al. Optimization of microwave- assisted extraction of polyphenolic compounds fromOcimumbasilicumby response surface methodology[J].FoodAnalyticalMethods, 2017, 10(7): 2270-2280.
[19] ZEKOVIC Z, VLADIC J, VLADIC S, et al. Optimization of microwave- assisted extraction (MAE) of coriander phenolic antioxidants- response surface methodology approach[J].JournaloftheScienceofFoodandAgriculture, 2016, 96(13): 4613-4622.
[20] CHENG Z Y, SONG H Y , CAO X L, et al. Simultaneous extraction and purification of polysaccharides fromGentianascabraBunge by microwave- assisted ethanol- salt aqueous two- phase system[J].IndustrialCropsandProducts, 2017, 102: 75-87.
[21] JAERAL R, THAKUR S, SAKINAH M, et al. Potent anticancer, antioxidant and antibacterial activities of isolated flavonoids fromAspleniumnidus[J].JournalofKingSaudUniversity-Science, 2016. doi.org/10.1016/j.jksus.2016.11.006.
[22] WANG L J, YANG X S, QIN P Y, et al. Flavonoid composition, antibacterial and antioxidant properties of tartary buckwheat bran extract[J].IndustrialCropsandProducts, 2013, 49(8): 312-317.
[23] AHMADU A A, ONANUGA A, EBESHI B U. Isolation of antibacterial flavonoids from the aerial parts ofIndigoferasecundiflora[J].PharmacognosyJournal, 2011, 3(19): 25-28.
[24] XIA X, CAO J G, ZHENG Y X, et al. Flavonoid concentrations and bioactivity of flavonoid extracts from 19 species of ferns from China[J].IndustrialCropsandProducts, 2014, 58(1): 91-98.
[25] JARIAL R, SHARD A, THAKUR S, et al. Characterization of flavonoids from fernCheilanthestenuifoliaand evaluation of antioxidant, antimicrobial and anticancer activities[J].JournalofKingSaudUniversity-Science, 2017. doi.org/10.1016/j.jksus.2017.04.007.
[26] INAMULAH F, FATIMAL I, KHAN S, et al. New antimicrobial flavonoids and chalcone fromColuteaarmata[J].ArchivesofPharmacalResearch, 2017, 40(8): 915-920.
