基于体液斑痕中特征成分检验刻画供体特征的研究进展
2018-03-01李昕潼张云峰权养科于忠山
李昕潼,张云峰,杨 煜,权养科,黄 健,王 炯,常 靖,于忠山
(1. 中国人民公安大学,北京 100038;2. 公安部物证鉴定中心,北京 100038)
物证检验鉴定正在多专业和多种检验技术水平上实现交叉合作,故对微量、疑难物证检材的综合提取、检测和分析等各种能力的提高既有现实需求又具推广价值,并能对物证材料相关供体特征的刻画起帮助作用。通常,案件现场提取到的体液斑痕有血液、唾液、汗液斑痕、精斑等,体液斑痕中的某些特征成分能够反映斑痕供体的相关信息。目前,这些体液斑痕主要通过DNA分析和潜指印显现而被检验,然而在没有嫌疑人或侦查范围不明确时,这些技术就难以发挥作用。而若经由多领域交叉研究,更深入地挖掘这些体液斑痕中的隐藏信息,将能进一步确定侦查和办案方向。例如,对于长期吸烟、吸毒、高血压、高血糖和高血脂等需经常服药的人群,其血液、唾液、汗液等斑痕中均含有尼古丁及其代谢物可替宁、毒品、抗高血压药、抗高血糖药和抗高血脂药等特征成分,如对这些特征成分进行检验,就可为涉案现场物证的微量体液斑痕供者的特征刻画(是否吸烟、吸毒、高血压、糖尿病、高血脂等较稳定特征)提供科学依据,从而能为办案提供侦查线索,缩小犯罪嫌疑人排查范围,提高破案效率。
1 汗液斑痕中特征成分分析
自19世纪后期以来,指纹因其人各不同、终生不变的特征而被认为是司法鉴定的证据之首,被世界各国广泛应用于鉴别犯罪嫌疑人和受害者的身份。因指纹在犯罪现场发现及提取效率高、鉴定结论可靠、可直接作个体认定及可通过数据库快速查询等优特点,故其一直在刑事案件侦查破案中发挥着重要作用[1]。对于犯罪现场中遗留的汗液斑痕(主要指潜指纹、掌纹),一方面公安机关已经形成了一套完备的显现、提取、分析、鉴定方法,能通过犯罪现场勘查对指纹纹线的分析判断出遗留指位,从而可为犯罪现场重建提供依据;另一方面,指印中的DNA还可以准确地进行个体识别。虽然,指纹、掌纹中隐藏着大量的信息,但并不能在实际案件中全部获取。原因是:1)现代社会信息资讯发达、传播迅速,大多数作案人能知晓指、掌纹的鉴定价值,故其作案时都会戴手套,以免留下指印和DNA。2)犯罪现场遗留的指纹大多模糊不清,往往不能进行同一认定。3)指纹显现与DNA提取间往往存在矛盾,常需择一而行。4)犯罪现场指印的DNA极易污染,为达到证据链完整性还需补充证据。5)受仪器设备灵敏度的限制,汗液斑痕中的特征成分检测存在困难。6)全国性的指纹库和DNA数据库仍需完善补充。因此,进行多学科的交叉研究从而深入挖掘汗液斑痕中的存在信息,很有必要和价值。其实,指印中有很多重要的物证信息未得到充分的挖掘。例如,药物、毒物在体内代谢后其原型药物、毒物或其代谢物会通过汗液排出,因此,分析汗液斑痕中的这些特征成分可以进一步判断供体特征。当然,由于汗液斑痕中特征成分含量甚微,检测需要灵敏度很高的仪器,研究及推广会受到一定的限制。20世纪90年代,随着大气压电离技术的发展,色谱技术获得了极大的发展,光谱技术被应用于鉴定科学中,为指印中痕量的特征成分分析奠定了基础。
1.1 光谱成像技术
光谱成像技术又称化学成像,通过成像方法记录和分析被检验物体光谱信息而显示出物体化学成分分布的影像[1]。2003年,澳大利亚人Claude等[2]使用液晶可调波长滤光镜(LCTF)光谱成像装置进行了指印纹线影像的初步实验研究,成为物证鉴定领域广泛研究光谱成像检验技术的开端。随后,David[3]和Edward[4]等利用光谱成像技术进行加强指纹显现的研究,取得了一定的进展。但是,光谱成像技术不仅可以获取清晰指纹,还可以获知指纹中的物质成分。2004年,Day等[5]使用拉曼光谱检测潜指纹中的滥用毒品,如磷酸可待因、盐酸可卡因、硫酸安非他明、巴比妥、尼美西泮等药物和5种外观相似并经常用于添加到滥用药物中的咖啡因、阿司匹林、对乙酰氨基酚、淀粉和云母等非管控物质。这是光谱技术第一次用于检测指纹中的毒、药物成分,随后光谱成像成为指纹成分分析的研究热点,所用仪器主要是傅里叶红外光谱(FTIR)和拉曼光谱(Raman spectra),提高光谱仪器的灵敏度是此项研究的关键。2006年,Chan[6]使用焦平面阵列探测器(PDA)的FTIR成像方法检验指纹中痕量物质咖啡因,有效提高了FTIR的灵敏度,这是传统FTIR所不能企及的。2008年,West等[7-8]人用铝粉和铁粉显现指纹后,先用胶带粘取,然后以拉曼光谱对指印进行检测并成功检测出指印中的摇头丸、可卡因、氯胺酮、安非他明和非处方(OTC)止痛剂。该实验不仅使用常规方法显现了指纹而且成功地检测出了指纹中的痕量物质,使之可有效地应用于犯罪现场勘查和物证鉴定中。2009年,Widjaja[9]继续对此展开研究,利用拉曼光谱成像技术结合胶带转移法(tape-lift)和多变量数据分析(multivariate data analysis)检测潜指纹中的化学信息和痕量物质,建立了两个药物分析模型,一个是包含布洛芬、L-精氨酸和重碳酸钠在内的药物分析模型,另一个是包括蔗糖和天门冬氨酰苯丙氨酸甲酯的添加剂分析模型,不仅可以根据这些化合物的纯拉曼光谱特征准确地鉴定出这些化合物,而且还可以确定其空间分布。近年来,表面增强拉曼散射(SERS)因其灵敏度高、指纹图像呈现性好而成为了研究热点。2015年,杨天喜、郭晓宇等[10]用纳米颗粒磁性复合材料(AMN)与六磷酸肌醇(IP6)以SERS方法对指印的形貌进行图像呈现,筛选出了宽度在100 nm指印中的痕量药物。
光谱技术可以对汗液斑痕中的物质进行定性和半定量分析,可以区分汗液斑痕中外源和内源性物质,其最大优势是对证据的无损性,有利于证据的保全和复勘复验。但其仍有不足,对于体液斑痕的检测存在选择性差、灵敏度低等缺点。故提高光谱成像技术的灵敏度,充分发挥其确定化学成分的能力,是未来光谱成像技术的发展方向。此外,光谱成像分析还可检测出药、毒物成分的盐型,这是色谱技术无法做到的。
1.2 质谱成像技术
质谱成像(mass spectrometry imaging, MSI)是一种新型的成像技术,可以直接从生物组织切片表面获得多种蛋白质或小分子代谢物的空间分布信息。质谱成像于1997年被应用于研究生物组织中蛋白质的分布,与免疫组化、荧光标记、核磁共振等技术相比,质谱成像可直接从组织表面分析多种蛋白质和代谢物,具有较高的空间分辨率,因而被广泛用于代谢物和药物的分布、医学研究等领域中[11]。
质谱成像在指纹成分分析中的应用始于2007年左右。其前期主要集中在免疫粉末和显现粉末的研究。2009年,Frederick[12]课题组用疏水纳米二氧化硅粉末显现潜在汗液手印,经胶带粘取后,再用基质辅助激光解析离子化飞行时间质谱仪(MALDI-TOFMS)检测胶带粉末手印纹线,有效地检测出了潜在汗液手印中的多种药物和毒品及其代谢物(如口服美沙酮等)等成分,同时他们还将这种方法用于检测玻璃杯和金属表面吸烟者留下的手印。免疫粉末存在局限性,且成本高昂,不易大规模推广。同年,Ifa[13]等人使用解吸电喷雾电离法(DESI),对玻璃杯以及纸张上的指印进行检验,成功检测到其中所带有的可卡因和四氢大麻酚。DESI在法庭科学领域还有待进一步探索,特别是涉及现场分析的应用,其中包括分子影像和通过化学反应及添加适当的化学试剂的电离来快速检测物质的特异性。
1.3 色谱技术
色谱技术中,最常用于分析潜指纹中物质的方法为气相色谱-质谱法(GC–MS)。20世纪70年代末,GC–MS已经达到了很高的水平,近年来又有长足进展,由于其普及程度高,目前已是法医毒物学实验室的一种重要分析仪器。2007年,Hartzell-Baguley等[14]利用GC-MS对指印做研究分析,发现指印中的物质有五个特定来源:外分泌汗液、顶分泌汗液、皮质分泌物、表皮物质和来自于外部环境的物质,为后续的研究奠定了理论基础。与光谱技术不同的是,色谱技术研究的物质主要是内源性物质。2008年,杨瑞琴等[15]利用GC-MS对手印残留物中的氨基酸进行了研究分析,检出限为5 ng。2013年, Michalski等[16]利用GC-MS确定了指印中成分的脂肪酸比率,结果表明,指印的脂肪酸比率和性别、指印来源所处地区,均具有相关性。气相色谱质谱技术结合衍生化可以检测出大多数易挥发且稳定的有机物,但是难以检测汗液斑痕中某些受热易分解的药物,如阿司匹林等药物。
液相色谱-质谱(LC-MS)法一般是指由高效液相色谱(HPLC)或超高压液相色谱(UPLC)与高分辨质谱串联而成。在鉴证科学领域,LC-MS是案件定性、定量最通用的方法之一。2008年,Shana等[17]对戒断治疗所中服用美沙酮的吸毒人员,取其指纹用LC-MS/MS定量分析,检测到美沙酮及其去甲基代谢物EDDP,单枚指纹中美沙酮及EDDP的含量分别为 0.90~9.20 ng和 0.07~0.08 ng。2009年,Goucher等[18]利用LC-MS/MS技术分析了指纹中的劳拉西泮及其代谢物。实验过程中,健康志愿者口服2mg单剂量的劳拉西泮,证实药物在指纹中直接出现的原因是该药物可代谢至汗液中。2013年,Kuwayama等[19]对指尖中的咖啡因及其代谢物进行了研究,实验人员在被试人员饮用80 mg咖啡因后的1、3、5、7 h均在其指纹内检测到了咖啡因及其代谢物。2015年,张婷等[20]以指纹汗液为研究对象,借助灵敏的高效液相色谱-电喷雾离子阱质谱联用技术,检测指纹汗液中的咖啡因及其代谢物成分。在14 h后仍可于指纹中检验到咖啡因,其代谢物副黄嘌呤则从服用咖啡因3至14 h内可检出。实验提取客体为湿润的滤纸,在考察提取条件时,发现温度、超声时间会对提取效率产生影响。此实验不涉及到指纹显现与DNA提取的过程,提取客体由于提取效率的原因也仅选择了提取效率最高的湿润滤纸。因此,该方法或不能适用于实际案件中指印的特征成分分析。
LC-MS相比于GC-MS的优点在于,卓越的灵敏度、精密度以及分析范围广、分析时间短,对于热不稳定化合物、非挥发性物质以及极性化合物、大分子物质具有特殊优势,以及在前处理方面,仅需对少数物质衍生化,故检测效率大大提高。但要将LC-MS应用于检测体液斑痕特征成分而刻画供体特征,还需建立大量的标准图谱库。
1.4 免疫技术
1954年,Yallow和Berson建立了放射性标记免疫分析法,免疫分析法因此而成为分析化学、医学领域中非常重要的方法,特别适用于色谱技术难以分析的药物[21]。但由于其灵敏度、选择性限制和交叉反应等固有问题,在鉴定科学中的使用受到一定的制约,因此使用免疫技术检测指纹特征成分的研究较少。
1981年,美国科学家Smith等[22]用放射免疫法检测出了汗斑中的苯巴比妥。从一个用苯巴比妥治疗者的内衣腋下部位和腰部剪取约7 cm2的布片,剪成4 cm×4 cm的正方形,用4 mL 0.1 %的十二烷基磺酸钠(SDS)盐水溶液提取1h,用放射免疫法测定。内衣腋下部位和腰部均检测出苯巴比妥,检出量均为100 ng,样品总含量均为400 ng。2007年,Leggett[23]用经过抗体功能化的纳米金颗粒显现潜在汗液指印,在显现指印的同时利用免疫反应揭示或证明汗液指印中存在的代谢物成分,可反映指印主人摄入毒品、药物和食物等生活和身体特征的信息。他们用经过荧光标记的可替宁(香烟主要成分尼古丁的代谢物)抗体功能化纳米金颗粒,以小粒子悬浮液原理显现潜在汗液指印,结果吸烟者的汗液指印以显著高反差的荧光清晰显现出来,而不吸烟者的潜在汗液指印没有荧光发生。但这个方法只能简单地应用于犯罪现场的潜指纹分析,如要将其呈现为法庭证据,还应通过GC–MS来加以确认。
2 唾液斑痕中特征成分分析
在犯罪现场中唾液斑痕也常被发现,其主要的客体有烟头、水杯、体表、地面等,唾液斑痕经确证实验后,可进行DNA检测。然而,目前的DNA数据库并不能覆盖全部在中国生活的人,一旦检材DNA与数据库没有比中,检测价值就留待观察。因此,如果可以对唾液斑痕中特征成分进行检测,从而刻画出遗留供体的特征,那就可以进一步为刑事侦查提供方向,使检材充分发挥其作用。
唾液作为滥用药物检测样本,由于其自身的优越性,在很多研究领域中能代替传统的血液、尿液检材而被使用。唾液检材主要优势有:1)获取方便,对客体侵犯性小;2)唾液中杂质少、组成成分简单,与血液相比,可以不经复杂的前处理步骤,直接进行色谱分析;3)唾液中毒物浓度与血浆中未结合部分的毒物相关,而毒物的毒性作用是与血浆中未结合部分相关的,因而测定唾液浓度比血浓度更有意义[24]。但是唾液检材在实际应用中也存在pH值不恒定等问题。此外,对于唾液研究往往采用的是新鲜唾液,然而在案件现场,能够提取的多为唾液斑痕,与新鲜唾液相比,唾液斑痕检验还应考虑对斑痕的显现研究。
20世纪60年代中期有研究报道药物可以从血液渗透至唾液,在体内,许多药物会与蛋白质高度结合,具备用作分析药物滥用的理想条件[25],一系列的相关研究也从此展开。但是,研究多数为唾液中毒物、药物成分的检测,对于微量唾液斑痕中痕量物质的检测则较少。1981年,Smith等[22]用放射免疫法检测出了过滤嘴香烟中的苯巴比妥,香烟过滤嘴中未检出苯巴比妥,香烟烟纸片上检测出苯巴比妥,检出量为3.79 ng,样品总含量为15.2 ng。放射免疫法是检测药物中毒和药物代谢的常用方法,可以直接分析小样品量的体液,与色谱技术相比,不需要复杂的样品制备,因此适合于检测痕量唾液斑痕。
此后的研究大多为唾液中毒、药物的检测。1989年,Suzuki和Inoue[26]建立了质量碎片谱法(Mass Fragmentography)分析唾液中的安非他明类药物。唾液样本使用甲醇萃取,并在分析之前进行衍生化,唾液中检测出甲基苯丙胺,受灵敏度限制未检出其代谢物苯丙胺。1992年,Schramm和Richard[27]论述了滥用毒品在唾液中的研究。该文章总结了定量测定唾液中不同的药物滥用的研究,以阐明当时这一领域的研究进展。大麻、可卡因、苯环利定、阿片类、巴比妥类、安非他明和二氮杂卓(或其代谢物)等已全部可以在唾液中通过各种分析方法检测出来,包括免疫测定法、气相色谱-质谱。
2.1 免疫技术
从鉴定科学角度,针对于唾液检测,免疫技术更倾向于在犯罪现场经快速检验而使用,各种商用免疫分析试剂盒(条)可满足此目的。2000年,Samyn和Haeren[28]用涂有免疫试剂的测定条对可卡因、阿片制剂、安非他明和大麻素滥用者的唾液等进行现场快速检验,并再以GC-MS实验确证。实验表明,在快速检验中,唾液是一种获取方便且适用于毒品分析的基质。试剂条使用非常方便,2 min即能获取结果。现场快速检验结果与精确实验结论几乎没有差异。2003年,宋朝锦等[29]建立了甲基苯丙胺放射免疫分析法初步实验,定量检测人体唾液中的甲基苯丙胺。试验灵敏度测试结果为11.8 ng/mL。此实验甲基苯丙胺放射免疫检验法符合放射免疫分析行业要求,故已被应用于案件中。
2.2 色谱技术
对于唾液基质,色谱技术研究的重点,一方面是优化前处理方法以减小基质效应,另一方面是高效地富集样品。1997年,Cone、Oyler、Darwin[30]建立了气相色谱-质谱法检测静脉注射和鼻内及抽烟吸食可卡因的唾液检测方法,证实了该法在唾液这种基质中检验不同吸食途径的可卡因的有效性。2003年,Wood、Boeck、Samyn[31]建立了人类血液和唾液中安非他明的LC-MS/MS快速、灵敏的检测方法。该法仅需要50 μL的检材,包括样本制备的总实验时间小于20 min,与上述的气相色谱-质谱法相比具有简单、快速等诸多优点。2009年,王燕燕等[32]建立了一种人体唾液中苯丙胺(AM)、甲基苯丙胺(MAM)、3,4-亚甲二氧基苯丙胺(MDA)、3,4-亚甲二氧基甲基苯丙胺(MDMA)毒品的超声波液液萃取-气相色谱-质谱-选择离子检测方法。此后,这个团队[33]又建立了灵敏度高、重复性好、操作简便的唾液中阿片类毒品的硅烷化和酰化GC-MS-SIM检测方法,用于对吸毒者唾液中阿片类毒品的检测和分析。经比较空白唾液添加毒品的硅烷化和酰化方法,从2种衍生化产物的色谱图看,阿片类毒品的硅烷化产物的保留时间要更长;而分离度和色谱峰形两者差别则不大;但硅烷化灵敏度明显高于酰化,不过产生的基质噪音却也高一些。2012年11月,陈跃等[34]建立了超高效液相色谱-串联质谱测定唾液中甲基苯丙胺、吗啡、O6-单乙酰吗啡这三种毒品及其代谢物的方法,检测限分别为0.05、0.05、0.02 μ g/L。实验还比较了液-液萃取、分散液-液微萃取、乙腈沉淀蛋白法这三种前处理方法的添加回收率,乙腈沉淀蛋白法效果最优。此外,实验还考察了唾液基质对毒品检测的影响,由结论可知,同一基质对不同化合物或同一化合物的不同离子对的影响均存在差异,因此应使用同位素内标法定量以消除样品基质对检测的影响。
2.3 毛细管电泳法
毛细管电泳(CE)与高效液相色谱(HPLC)一样同是液相分离技术,它们遵循不同的分离机理,也都有许多的分离模式,在很大程度上两者可互为补充。但是无论从效率、速度、样品用量和成本来说,毛细管电泳显示出一定优势。2008年,王燕燕等[35]建立唾液中苯丙胺类毒品的毛细管区带电泳在线富集检测的方法,采用毛细管区带电泳(CZE)中的场放大样品堆积(FASS)技术对唾液中的苯丙胺类毒品进行检测,与常规毛细管区带电泳比较,灵敏度提高达上千倍。
目前,FASS技术已广泛用于鉴定科学检验中。对于法医毒物学中的常见生物检材如体液、脏器,毛细管电泳与超高效液相色谱(HPLC)相比,具有足够的分离能力和耐脏性。此外,柱效高、实用范围广,消耗成本低也是FASS技术的优势。
近年来,薄层色谱、离子色谱、气相色谱质谱、液相色谱质谱、毛细管电泳以及各种免疫分析等检测方法应用于毒物检验,多数药物和毒物均可在唾液中检出,因此,在此基础上,模拟刑事案件现场中唾液斑痕的形态和保存条件,检测唾液斑痕中的药物是可行的。此外,由于生物学、免疫学、生化学理论和技术的不断发展,近年来对唾液(斑)个体识别的研究有重大突破,故可用于个人识别的蛋白和酶的研究也应是未来唾液检测的发展方向。
3 血迹斑痕中特征成分分析
刑事案件犯罪现场中,血迹斑痕是更常见的体液斑痕。现场勘查专家经常会通过血迹形态分析判断作案过程,DNA实验室也会通过DNA分析判断血迹供体,但是从法医毒物学角度研究血迹斑痕中毒物、药物成分来推断血迹供体特征的研究较少。
犯罪现场勘查往往在案发后数小时,在此期间犯罪现场中的血迹因水分蒸发而会成为干燥血迹斑痕,与新鲜血液相比,干燥血迹斑痕的常温稳定性更好,其中特征成分不会因放置时间过久而消失。因此,临床医学中常使用干燥血斑来确定患者的药物暴露量,但是在鉴定科学中,尚未开展系统的干燥血迹斑痕的药物、毒品检测研究。
上世纪80年代有2篇文献报道采用放射免疫分析法(RIA)检测血液斑中的可卡因代谢物和苯巴比妥药物成分,灵敏度达到0.5 ng/mL,但该法需要放射性标记抗原并仅可作为初筛之用。对于血迹斑痕的研究主要集中在临床医学领域,对血迹斑痕的研究大多使用色谱质谱联用技术进行检测(表1)。
对于血迹斑痕中药物、毒物分析的研究多集中于临床医学中,血迹斑痕的检测客体多为滤纸片。然而,在实际刑事案件应用中,血迹斑痕的客体多种多样,如:非渗透性客体(地板、瓷砖、塑料、桌面、门把手等)、渗透性客体(纸张、快递盒、床单等)、半渗透性客体(墙壁、牛皮纸、皮革、纺织物等)以及其他特殊客体等。因此,针对各种客体上血迹斑痕高效的提取方法就成为了法医毒物学家的研究重点。此外,目前相关文献报道干燥血斑的保存条件均为室温下干燥2~3 h,但是实际案件中血斑保存条件千差万别,此对血斑中毒物、药物检测产生的影响还有待深入研究。
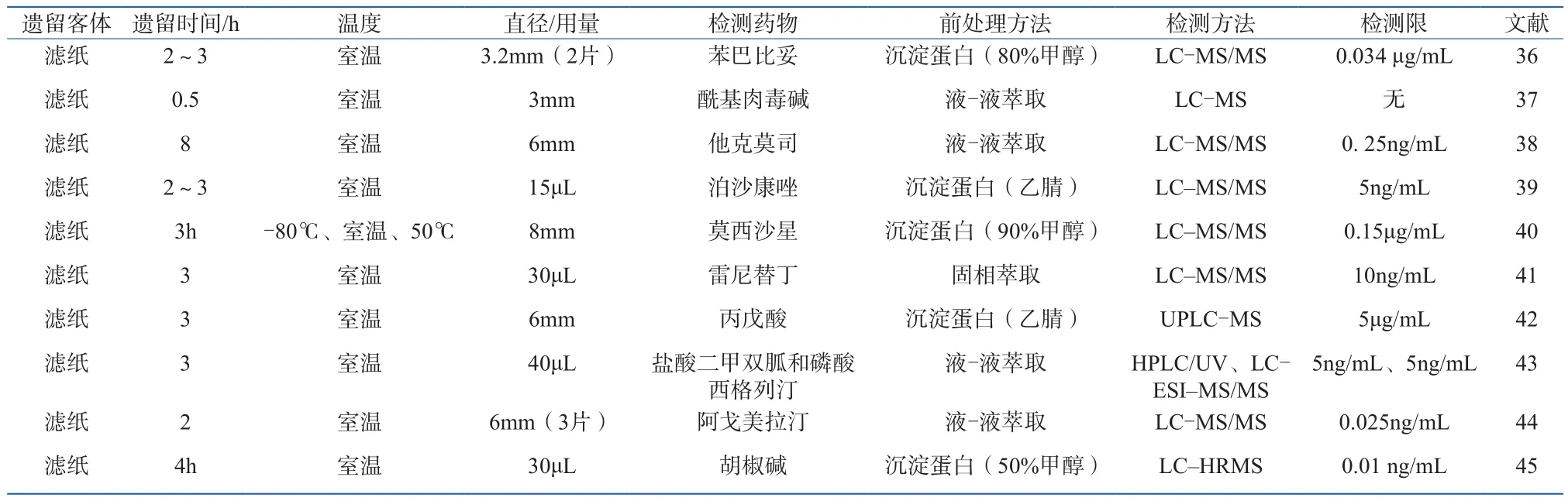
表1 血迹斑痕中毒、药物成分检验研究进展Table 1 Research advances on detection of toxic and drug’s components from bloodstains
4 总结与展望
由于血液、唾液、汗液等体液斑痕检材量极少,而其中某些特定成分含量又甚微,故对提取方法和仪器检测灵敏度要求极高,临床医学中的技术并不能应用于鉴定科学的实际案件中,因此还需对此进行移植研究。要建立多种保存条件下,不同客体上血液、唾液和汗液斑痕中常见特征成分的收集与检验方法,为通过斑痕中特征成分检验从而推断涉案人员的生理特征、行为习性、生活习惯等信息,为侦查确定方向,缩小侦查范围提供科学依据。从鉴证科学角度,加强毒理学、DNA检测和痕迹检验等多学科的交叉综合应用,是未来的发展方向。
[1] 王桂强. 指印检验新方面[J]. 刑事技术,2010(2): 3-7.
[2] EXLINE D L, WALLACE C, ROUX C, et al. Forensic applications of chemical imaging: latent fingerprint detection using visible absorption and luminescence[J]. J Forensic Sci, 2003,48(5): 1-7.
[3] EXLINE D L, SCHULER R L, TREADO P J, et al. Improved fi ngerprint visualization using luminescence and visible re fl ectance chemical imaging[J]. Forensic Science Communication,2003, 5(3): 37-46.
[4] BARTICK E, SCHWARTZ R, BHARGAVA R, et al. Spectrochemical analysis and hyperspectral imaging of latent fingerprints [C]//Proceedings of the 16th Meeting of the International Association of Forensic Sciences, 2002: 61-64.
[5] DAY J S, EDWARDS H G, DOBROWSKI S A, et al. The detection of drugs of abuse in fi ngerprints using Raman spectroscopy I: latent fi ngerprints[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2004, 60(3): 563-568.
[6] ANDREWK L, CHAN, SERGEI G. Detection of trace materials with Fourier transform infrared spectroscopy using a multichannel detector[J]. Analyst, 2006, 131(1): 126-131.
[7] WEST M J, WENTM J. The spectroscopic detection of exogenous material in fi ngerprints after development with powders and recovery with adhesive lifters[J]. Forensic Science International, 2008, 174: 1–5.
[8] WESTM J, WENTM J. The spectroscopic detection of drugs of abuse in fingerprints after development with powders and recovery with adhesive lifters[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2009, 71: 1984 –1988.
[9] WIDJAJA E. Latent fi ngerprints analysis using tape-lift, Raman microscopy and multivariate data analysis methods[J]. Analyst,2009, 134(4): 769-775.
[10] YANG T, GUO X, WANG H, et al. Magnetically optimized SERS assay for rapid detection of trace drug-related biomarkers in saliva and fi ngerprints[J]. Biosensors & Bioelectronics, 2015,6(68): 350-357.
[11] 郭帅,李智立. 质谱成像及其在生物医学领域的应用[J]. 生物物理学报,2011, 27(12): 1008-1018.
[12] RWOELL F, HUDSON K, SEVIOUR J. Detection of drugs and their metabolites in dusted latent fi ngermarks by mass spectrometry[J]. Analyst, 2009, 134(4): 701-707.
[13] IFA D R, JACKSON A U, PAGLIA G, et al. Forensic applications of ambient ionization mass spectrometry[J]. Analytical &Bioanalytical Chemistry, 2009, 394: 1995–2008.
[14] HARTEZLL-BAGULEY B, HIPPR E, MORGANN R, et al.Chemical composition of latent fi ngerprints by gas chromatography-mass spectrometry[J]. Journal of Chemical Education,2007, 84: 207-211.
[15] 杨瑞琴,赵永峰. 气相色谱-质谱联用法分析手印残留物中氨基酸的研究[J]. 分析测试学报,2008, 27: 276-277.
[16] MICHALSKI S, SHALER R, DORMANF L. The evaluation of fatty acid ratios in latent fingermarks by gas chromatography/mass spectrometry analysis[J]. Journal of Forensic Sciences.2013, 58: 215-220.
[17] JACOB S, JICKELLS S, WOLFF K, et al. Drug testing by chemical analysis of fi ngerprint deposits from methadone-maintained opioid dependent patients using UPLC-MS/MS [J]. Drug Metabolism Letters, 2008, 2: 245 – 247.
[18] GOUCHER E, KICMAN A, SMITH N, et al. The detection and quanti fi cation of lorazepam and its 3-O-glucuronide in fi ngerprint deposits by LC-MS/M [J]. Journal of Separation Science,2009, 32: 2266 – 2272.
[19] KUWAYAMA K, KENJI T, HAJIME M. Time-course measurements of caffeine and its metabolites extracted from fi ngertips after coffee intake: a preliminary study for the detection of drugs from fingerprints [J]. Analytical & Bioanalytical Chemistry,2013, 405: 3945–3952.
[20] 张婷,陈学国,杨瑞琴,等. 液相色谱-质谱法测定指纹汗液中咖啡因及其代谢物[J]. 理化检验,2015, 51(6): 795-799.
[21] 毛茅,钱晓萍. 免疫分析法在体内药物分析中的应用[J]. 海峡药学,2007, 19(7): 93-96.
[22] SMITH F P, POMPOSINI D A. Detection of phenobarbital in bloodstains, semen, seminal stains, saliva, saliva stains, perspiration stains, and hair[J]. Journal of Forensic Sciences, 1981,26(3): 582-586.
[23] LEGGETT R, LEE-SMITH E, JICKELLS S, et al. “Intelligent”fingerprinting: simultaneous identification of drug metabolites and individuals by using antibody-functionalized nanoparticles[J]. Angewandte Chemie, 2007, 46(22): 4178-4181.
[24] 张志荣. 唾液在毒物的法医学检测中的应用价值[J]. 中国法医学杂志,1989(1): 54-57.
[25] 申文静,朱军,刘耀. 人唾液中苯丙胺类药物检测方法进展[J]. 中国法医学杂志,2007, 22(3): 179-181.
[26] SUZUKI S, INOUE T, HORI H, et al. Analysis of methamphetamine in hair, nail, sweat and saliva by mass fragmentography[J].Journal of Analytical Toxicology, 1989, 13(3): 176-178.
[27] SCHRAMM W, SMITH R H, CRAIG P A, et al. Drugs of abuse in saliva: A review [J]. Journal of Analytical Toxicology, 1992,16(1): 1-9.
[28] SAMYN N, HAEREN C V. On-site testing of saliva and sweat with Drugwipe and determination of concentrations of drugs of abuse in saliva, plasma and urine of suspected users[J]. International Journal of Legal Medicine, 2000, 113(3): 150-154.
[29] 宋朝锦,郭伟正,王美中,等. 体液中甲基苯丙胺的放射免疫分析法[J]. 中国法医学杂志,2003, 18(1): 46-48.
[30] CONE E J, OYLER J, DARWIN W D. Cocaine disposition in saliva following intravenous, intranasal and smoked administration[J]. Journal of Analytical Toxicology, 1997, 21(6): 465-475.
[31] WOOD M, BOECK D, SAMYN N, et al. Development of a rapid and sensitive method for the quantitation of amphetamines in human plasma and oral fluid by LC-MS-MS[J]. Journal of Analytical Toxicology, 2003, 27(2): 78-87.
[32] 王燕燕,孟品佳. 超声液相萃取-GC MS-SIM法定量检测唾液中苯丙胺类毒品[J]. 分析试验室,2009, 28(3): 27-31.
[33] 王燕燕,孟品佳,王川,等. 唾液中鸦片类毒品的衍生化GC/MS-SIM分析研究[J]. 药物分析杂志,2010(9): 1658-1663.
[34] 陈跃,朱军,于忠山,等. 超高效液相色谱-串联质谱法检测唾液中3种毒品及其代谢物[J]. 色谱,2012, 30(11):1148-1152.
[35] 王燕燕,孟品佳. 唾液中苯丙胺类毒品的毛细管区带电泳在线富集检测[J]. 分析测试学报,2008, 27(5): 463-466.
[36] LA MARCA G, MALVAGIAG S, FILIPPI L, et al. A new rapid micromethod for the assay of phenobarbital from dried blood spots by LC-tandem mass spectrometry[J]. Epilepsia, 2009,50(12): 2658-2662.
[37] TU W J, DAI F, WANG X Y, et al. Liquid chromatographytandem mass spectrometry for analysis of acylcarnitines in dried blood specimens collected at autopsy from neonatal intensive care unit[J]. Chinese Medical Sciences Journal, 2010, 25(2):109-114.
[38] LI Q, CAO D, HUANG Y, et al. Development and validation of a sensitive LC-MS/MS method for determination of tacrolimus on dried blood spots[J]. Biomedical Chromatography, 2013,27(3): 327-334.
[39] REDDY T M, TAMA C I, HAYES R N. A dried blood spots technique based LC–MS/MS method for the analysis of posaconazole in human whole blood samples[J]. Journal of Chromatography B, 2011, 879(30): 3626-3638.
[40] VU D H, KOSTER R A, ALFFENAAR J W, et al. Determination of moxi fl oxacin in dried blood spots using LC-MS/MS and the impact of the hematocrit and blood volume[J]. Journal of Chromatography B (Analytical Technologies in the Biomedical and Life Sciences), 2011, 879(15): 1063-1070.
[41] YAKKUNDI S, MILLERSHIP J, COLLIER P, et al. Development and validation of a dried blood spot LC-MS/MS assay to quantify ranitidine in paediatricsamples[J]. Journal of Pharmaceutical & Biomedical Analysis, 2011, 56(5): 1057-1063.
[42] 黄钺. 超高压液相色谱—串联质谱法检测干血滤纸片上丙戊酸血药浓度的研究[D]. 上海:复旦大学,2013.
[43] SCHERF-CLAVEL M, HÖGGER P. Analysis of metformin,sitagliptin and creatinine in human dried blood spots[J]. Journal of Chromatography B, 2015, 997: 218-228.
[44] 戴晓健, 钟大放, 陈笑艳. LC-MS/MS法测定干血斑样品中阿戈美拉汀[J]. 药物分析杂志, 2015, 16(3): 486-490.
[45] RAMESH B, VADAPARTHI P, SUKUMAR G et al. LCHRMS determination of piperine on rat dried blood spots: A pharmacokinetic study[J]. Journal of Pharmaceutical Analysis,2016, 6(1): 18-23.
