基于田间表型和Bru1基因检测分析甘蔗褐锈病抗性遗传
2018-03-01许莉萍苏亚春吴期滨孙婷婷高世武
李 竹 许莉萍 苏亚春 吴期滨 成 伟 孙婷婷 高世武
福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室, 福建福州 350002
甘蔗(Saccharum spp.)是最主要的糖料作物, 2015年超过 110个国家种植甘蔗达 2380万公顷, 蔗茎产量为177 000万吨[1]。甘蔗褐锈病因其产孢量大、流行性强并导致产量和蔗糖分的严重损失而成为甘蔗生产上最主要的病害之一, 该病由黑顶柄锈菌(Puccina melanocephala H. Sydow & P. Sydow)担孢子侵入气孔所致, 已遍布世界各甘蔗产区[2-4]。锈病还导致主栽品种的淘汰, 如 1980s以来, 美国、印度等甘蔗主产国的主栽品种CP78-1247、Co745、CL41-23等因感染褐锈病而被取消商业化种植[5-6],我国蔗区生产性品种如桂糖 15、台糖 86-1626、桂糖 17等已不再种植的主要原因也是感褐锈病[7]。甘蔗育种概率极低且周期长, 一般认为从实生苗育成品种的概率约为1/100 000~300 000, 耗时8~10年。目前, 我国甘蔗年生产杂交组合超过3000个, 年种植实生苗60~80万株, 一般每公顷种植3.00~3.75万株, 一般在种植后第2年对宿根蔗进行选择。可见, 甘蔗杂交育种人力物力投入巨大, 但对某一主要流行性病害的抗性不足, 足以导致其难以大面积推广应用。近几年新释放的高糖高产甘蔗品种粤糖 60因高感褐锈病, 推广面积因之下降; 而近 2年新审(鉴)定的品种福农41、桂糖46等以及目前正在进行国家区域试验的云蔗 09-1601等, 都表现出了高感褐锈病。因此, 需要从源头, 也即亲本选择与组合配制上加强针对性研究,而惟有了解抗病性遗传和亲本的抗病性, 才能有预见性地配制杂交组合, 有效提高分离群体创制中抗病个体的几率。此外, 抗病育种另一必不可少的环节就是建立并应用经济有效的技术手段与方法, 实现对褐锈病抗性的鉴定。
由于甘蔗复杂的遗传背景——异源多倍体特性, 现代甘蔗栽培种的基因组尚未被测序, 导致具有实际应用价值的标记开发困难, 迄今只有基于抗褐锈病的主效基因Bru1所开发的2个标记具有实用性。该标记是 1996年法国科学家Daugrois等[8]利用R570自交后代所构建的遗传图谱发现的, 距离为10 cM。而后, 该团队的Asnaghi等[9]在自交后代田间抗褐锈病性鉴定基础上, 利用集群分离分析法(bulked segregant analysis, BSA)结合AFLP (amplified fragment length polymorphism)标记技术, 在10 cM区间内, 获得了440个标记, 其中位于Bru1基因两侧的2个标记距离最近(1.9 cM和2.2 cM)。最后D’Hont团队通过高粱、水稻比较作图和染色体步移方法, 最终定位了与Bru1基因紧密连锁的标记R12H16和9020-F4, 距离该基因为0.28 cM和0.14 cM[10]。此后, 这2个标记被广泛用于评价甘蔗种质资源、品种和育种材料的抗病性[11-12,14-16]。但是,研究也发现表型抗病但标记检测呈阴性的现象[14,16], 提示了可能存在其他的抗病基因。此外, 由于当时还无条件进行抗病基因检测, 目前虽已有多篇有关甘蔗褐锈病抗性遗传的报道[17-20], 但都是基于田间表型发病情况的分析,且不同的研究所获得的结论并不一致。Tai等[17]认为甘蔗杂交后代的褐锈病抗性分离属于偏感病性分离, 且抗性遗传效应是由基因的非加性效应所决定的。但王建南等[19]的研究则认为甘蔗杂交后代的褐锈病抗性分离属于偏抗病性分离, 甘蔗对锈病的抗性遗传主要是由基因的加性效应所控制[18]。国内前人的研究[19-20]所用的试验基地是在非甘蔗主产区的福建省福州市, 发病条件并不充分, 这从研究报告[19]中杂交后代6级(感病)及以上的个体很少也说明了这一点, 因此, 非常有必要在适宜甘蔗褐锈病流行的主产蔗区试验, 并把田间表型调查与抗病基因的分子标记检测相结合, 来探讨抗病性遗传。
本研究以4个甘蔗杂交组合分离群体为材料, 在适宜褐锈病发生和流行的甘蔗主产区, 于自然诱发条件下进行抗病性表型鉴定, 并采集叶片进行 Bru1基因检测, 以期了解甘蔗褐锈病抗性遗传情况, 并为抗褐锈病育种提供新抗原以及挖掘抗病新基因和开发新标记的材料。
1 材料与方法
1.1 材料
选用 4个甘蔗(Saccharum spp. hybrid)杂交组合ROC25×柳城 03-1137、ROC25×粤糖 84-3、CP94-1100×ROC25、CP84-1198×云蔗89-7的分离群体的实生苗材料, 以栽培面积最大的主栽品种 ROC22为抗病对照,高感品种粤糖60为感病对照。将其种植在我国甘蔗锈病发生与流行最严重的蔗区云南省德宏傣族景颇族自治州陇川县。Bru1基因检测所用阴性对照为不含 Bru1基因且高感甘蔗褐锈病的甘蔗品种粤糖 60, 阳性对照为含Bru1基因且抗褐锈病的甘蔗品种R570, 后者也是甘蔗界Bru1基因检测通用的模式种。
1.2 田间发病率调查
2015年6月, 将上述4个杂交组合的实生苗定植在田间, 行距 1.1 m, 株距 0.4 m, 连续种植, 每个组合两行,每行70~75株, 常规管理。在新植季褐锈病流行期间, 先后2次调查发病情况。第1次在病害流行盛期(2015年9月 2日), 先调查该组合总株数和病株数, 以便获得该组合F1分离群体的发病率, 再调查15株感病植株及15株无病害症状的植株, 要求病斑面积占叶片总面积 35%以上,均一一标记, 以备后续对应调查, 并采集病株和健株无病害症状的–1叶片, 用于检测Bru1基因; 第2次在病害流行末期(2016年1月20日), 对第1次调查并标记的每组合各 30株的甘蔗植株病害发生情况逐一记录。判断第 1次调查正处于发病盛期且褐锈病的发病条件是充分的依据是, 作为抗病对照的主栽品种 ROC22未感病, 未发现带有病害症状的植株; 作为感病对照的甘蔗品种粤糖 60,其+2和+3叶有极多孢子堆, 病斑占叶片总面积50%以上。在参考前人[13]基于叶片侵染状况定性描述与划分的基础上, 结合李文凤等[14]的定量描述确定甘蔗对褐锈病抗、感类型与分级标准, 详见表1。
1.3 Bru1基因的分子检测
参照 Costet等[21]的方法, 设计检测甘蔗抗褐锈病Bru1基因标记R12H16和9O20-F4的PCR引物, 委托上海生工生物工程技术服务有限公司合成。其中, R12H16标记的扩增产物长度为570 bp, 其下游引物为5′-CTTATG TTAGCGTGACCTATGGTC-3′, 上游引物为 5′-CTACGAT GAAACTACACCCTTGTC-3′; 9O20-F4标记的扩增产物长度为200 bp, 上游引物为5′-TACATAATTTTAGTGGCACT CAGC-3′, 下游引物为 5′-ACCATAATTCAATTCTGCAGG TAC-3′。利用CTAB法[22], 提取供试甘蔗材料的叶片基因组DNA, 包括 120份分离群体的个体、配制 4个杂交组合的6个杂交亲本和抗、感对照种各1个。利用紫外分光光度计(NanoVue plus, GE, USA)测定样品浓度和纯度,–20°C冰箱保存备用。参照前人[23]的 PCR体系和各组分含量以及反应程序进行 PCR扩增, 其中 R12H16标记的PCR产物采用1.5%的琼脂糖凝胶电泳分离检测, 9O20-F4标记的PCR产物采用Rsa I的酶解产物以2%琼脂糖凝胶电泳检测进行判别。

表1 甘蔗褐锈病抗病性鉴定评价标准Table 1 Identification standard of sugarcane resistance to brown rust disease
2 结果与分析
2.1 F1代群体褐锈病田间表型鉴定情况
不同组合分离群体的褐锈病发病率为13.0%~54.3%。高感父本粤糖84-3与高抗母本所配制的杂交分离群体的褐锈病发生率仍高达 54.3%, 相对而言, 感病性稍低的感病父本柳城 03-1137与同为高抗的母本所获得的杂交后代发病率下降(39.0%), 尤其值得强调的是, 高抗母本CP84-1198与高抗父本云蔗 89-7的杂交后代发病率低,仅13.0% (表2)。说明母本和父本的抗病性均影响杂交后代的抗病性, 但父系成分对杂交后代的抗病性影响更大。
2.2 抗褐锈病基因Bru1分子标记的稳定性分析
为了进一步利用抗病主效基因Bru1的分子标记来验证亲本和杂交后代的抗、感病性, 以抗病模式对照种R570和高感对照种粤糖60为模板进行Bru1基因检测的技术体系稳定性验证。结果显示, 抗病对照能稳定扩增出Bru1基因特异标记之一的R12H16的特征带, 长度为570 bp, 同时, 还扩增出该基因的另一特异标记 9O20-F4, 其PCR产物经酶切显示特征带长度为200 bp, 上述2个特异标记的特征带大小与预期片段大小一致, 而感病对照种粤糖60和空白对照均未扩增出特异性的条带(图1), 表明在本实验的检测系统中, Bru1基因能被2个特异性标记R12H16和9O20-F4有效检出。
2.3 F1代分离个体褐锈病田间表型的稳定性和 Bru1基因检测
4个杂交组合F1代分离群体的田间发病率与Bru1基因检出率如表3所示。各组合在褐锈病发生盛期所调查的15 (共60)株病株中, 发病末期有57株表现病害症状; 而发病盛期所调查的15株(共60株)健株中, 有50株仍无病害症状。R12H16和9O20-F4标记检测结果显示, 发病盛期60份感病材料中, 58份未检测到Bru1基因, 占供试材料的 96.7%, 其余 2份(组合 ROC25×粤糖 84-3的 4、12号植株)检测到Bru1基因, 目标片段的检测电泳图如图2。为了进一步确认组合 ROC25×粤糖 84-3编号为4、12号的感病植株所检测到的片段是否能支撑检测到Bru1基因,我们将分子标记R12H16和9O20-F4检测出的片段进行克隆、测序, 并与阳性对照样品所获得的 Bru1基因序列比对, 发现序列具有一致性, 不存在碱基差异。说明利用基于Bru1基因所开发的2个分子标记R12H16和9O20-F4,在检测表型为感病的植株时, 个别也能呈阳性。此外, 两次调查均未发病的50份材料中, 33份检测到Bru1基因,占供试材料的66.0%; 17份未检测到Bru1基因, 占供试材料的 34.0%, 未检测到 Bru1基因的材料分布在组合CP94-1100 × ROC25 和 CP84-1198×云蔗 89-7。说明CP84-1198和云蔗89-7的抗病性是由不同于Bru1基因的抗病基因所控制。

表2 甘蔗杂交亲本及其分离群体的褐锈病抗性、Bru1基因及发病率鉴定结果Table 2 Identification results of brown rust resistance, Bru1 gene and incidence rate in sugarcane crossing parents and their segregation population

图1 基于特异标记R12H16 (A)和9O20-F4 (B)检测甘蔗褐锈病抗病和感病对照种中的Bru1基因Fig. 1 Detection of Bru1 gene in sugarcane brown rust resistant and susceptible control varieties based on the markers of R12H16 (A)and 9O20-F4 (B)
3 讨论
前人[24]在证明甘蔗抗褐锈病主效基因Bru1对不同来源的褐锈病分离物具有广谱抗性的基础上, 经过一系列研究[9,25], 最后由Costet等[10]针对该基因, 开发出了与其密切关联的两个分子标记R12H16和9O20-F4, 被国内外广泛应用于不同国家所保育的甘蔗种质资源、品种和候选品系的检测[26-28], 为抗病种质的利用提供了科学依据。但在研究中也发现了表型抗病却未检出 Bru1基因[14,16,26]或表型感病却检出 Bru1基因[12]的情况。本研究组合之一ROC25×粤糖84-3中出现了2份检测出Bru1基因的感病材料, Glynn等[11]的研究也有类似发现, 推测极有可能因为黑顶柄锈菌发生小种进化使得抗性基因Bru1失效。我们采用杂交分离群体为材料的研究, 也发现表型抗病却未检出 Bru1基因的情况, 尽管不同杂交组合后代出现这种未检出Bru1基因的概率不同, 如组合CP84-1198×云蔗89-7的概率达到100%, 以CP94-1100为亲本的杂交后代也有小概率发生, 仅有2个组合ROC25×柳城03-1137和ROC25×粤糖84-3未发现表型抗病但未检出Bru1基因的情况。说明甘蔗基因池中不仅有主效基因Bru1所决定的褐锈病抗性, 还有未知的主效基因所决定的抗性。在所测试的亲本中, CP84-1198和云蔗89-7的抗病性是由不同于Bru1基因的新抗褐锈病基因所控制。因此, 就挖掘新的抗褐锈病基因而言, 高抗亲本 CP84-1198和云蔗 89-7值得特别关注。
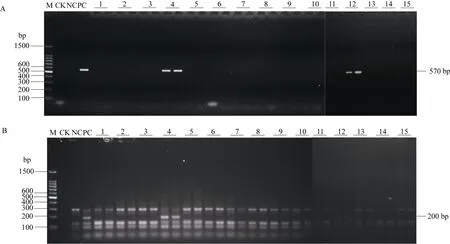
图2 用R12H16和9O20-F4标记检测组合ROC25 × Yuetang 84-3感病植株中的Bru1基因Fig. 2 Detection of resistance gene Bru1 with R12H16 and 9O20-F4 markers in susceptible plants of hybrid combination ROC25×Yuetang 84-3

表3 4个杂交组合分离群体的田间抗性表现与Bru1基因检出情况Table 3 Brown rust resistance and detection of Bru1 in segregation population derived from four sugarcane hybrid combinations
考虑到我们在田间试验中未针对褐锈病的病原菌深入研究, 因此, 是否存在Glynn等[11]所推测的病原菌小种变异不得而知, 但是, 我们的研究获得了在阴性对照未检出条带的情况下, 2份检测出Bru1基因的感病材料与同组合抗病材料和阳性对照材料的 PCR产物测序结果一致,同时, 所研究的 4个杂交组合中有一个组合(CP84-1198×云蔗89-7)无论抗、感个体, 均未检测出Bru1基因的存在。鉴于甘蔗对褐锈病抗性属于质量性状, 因此, 我们的研究更倾向于认为这2个感病株系可能存在Bru1基因的某一区段发生变异或某些位点发生突变而导致该基因失效,而组合CP84-1198×云蔗89-7中则更大可能是存在不同于Bru1基因的新基因。相关的其他前人研究中, 也有报道表型抗病的材料中标记阳性率低的情况。如Parco等[12]在对美国路州部分甘蔗品种和候选品系的研究中, 发现其Bru1基因的标记阳性率仅占 4.3%, 并存在标记检测阳性但表型感褐锈病的基因型如 L10-146, 或标记检测阴性但品种抗褐锈病如L99-233等。此外, 在有的研究中, 表型鉴定为抗病但未检测到与Bru1基因连锁的2个标记的材料占了相当大的比例, 如Racedo等[16]报道了在49个表型抗病的甘蔗基因型中, 只有8个(占16.3%)检测到Bru1基因, 再对 190份所保育的甘蔗种质进行检测, 发现仅 7%可检测到Bru1基因。鉴于此, 在甘蔗抗褐锈病育种中, 我们依然可以利用这2个与Bru1基因紧密连锁的特异性标记来选择抗病的种质, 因为它提供了一种有效的对褐锈病抗性进行标记辅助鉴定的技术方法, 只要标记检出阳性, 基本可判断为具有抗褐锈病性。但是, 该标记在应用于杂交后代分离个体的辅助选择时, 则要根据亲本的情况而定, 也就是要考虑其杂交亲本中是否存在该基因, 如存在Bru1基因, 则可以根据标记R12H16和9020-F4的存在进行判定, 反之则不行。研究结果还提示后续研究的线索, 也即针对甘蔗基因池中所存在的异于 Bru1基因的新基因进行鉴定和连锁标记研究的必要性, 目的是为甘蔗抗褐锈病育种提供新的基因资源以及选育具有复合抗褐锈病基因的品种。
甘蔗杂交后代抗褐锈病性状的分离情况以及父母本对杂交后代抗病性的影响, 对指导甘蔗抗褐锈病育种具有重要意义, 不仅直接影响亲本选择与组合配制, 还直接关系到所创制的分离群体中抗病个体的几率, 从而直接影响抗病育种的成效。目前, 已报道的有关甘蔗杂交后代对褐锈病抗性的分离情况研究结论不一致。Tai等[17]利用13个甘蔗杂交组合和2个自交群体, 根据田间表型抗病和感病表现, 认为杂交后代对褐锈病抗性呈偏感病性的偏态分离, 而国内的研究结论是呈偏抗病性的偏态分离[19]。分析原因主要是由于国内的研究是在非甘蔗产区进行的,病害胁迫压力小, 病害发生与流行的条件也不充分, 这从其所调查的数据中 6~9级的感病个体在分离群体中只占很小比例(2.92%), 就能说明这一点, 这直接导致了该研究得出杂交后代呈偏抗病性的偏态分离的研究结论。
在遗传效应研究上, 国内研究[20]认为甘蔗对锈病的抗性遗传主要是由基因的加性效应所控制, 母本对后代抗性的影响较大。基于该结论, 在甘蔗抗褐锈病育种中, 就要特别强调和重视母本的抗病性。但在 Tai等[17]的研究中, 则认为甘蔗对锈病的抗性遗传主要是由基因的非加性效应所控制。同时, 后续国外的多篇研究[21,24]却证明甘蔗对褐锈病的抗性是由主效基因控制的质量性状, 并且鉴定出主效基因 Bru1[8-10], 开发出与该基因紧密连锁的特异性标记R12H16和9020-F4, 已被国际甘蔗界广泛应用[11-12,15,27,29]。我们基于田间抗、感病性表型与Bru1基因检测相结合的研究, 认为甘蔗基因池中存在控制褐锈病抗性的主效基因, 同时, 除已经被鉴定出来的Bru1基因外, 还存在目前还未被鉴定的不同于 Bru1的主效基因, 且倾向于父系组分对杂交后代抗病性影响大于母系。分析原因可能是该研究中用于分析的数据源来自王建南等[19], 也即存在发病条件不充分, 从而导致估算的偏差所致。在父系还是母系组分对杂交后代的影响更大的研究上, 我们的研究结论与Tai等[17]的不一致, 我们所采用的组合数较少, 存在不足, 但分析数据是基于表型和 Bru1基因检测相结合, 且田间设置了高抗(ROC22)和高感(粤糖 60)对照, 并显示发病条件充分, 同时, 以高抗亲本 ROC25作为母本所配制的2个杂交组合中, 与高感父本(粤糖84-3)配制的杂交后代的发病率(54.3%)明显高于与感病父本(柳城 03-1137)配制的杂交后代的发病率(39.0%), 同时, 以同一高抗亲本ROC25作为父本的组合中, 与感病母本(CP94-1100)配制的杂交后代的发病率明显下降(28.4%)。Tai等[17]的早期研究所采用的组合数量更多, 但该研究当时无条件进行Bru1基因检测, 仅根据田间表型数据, 同时, 其田间试验也未见设置高感或感病对照种, 因此, 无从判断病害发生条件是否充分。
致谢: 国家甘蔗产业技术体系植保岗位专家云南农业科学院黄应昆研究员提供柳城03-1137的褐锈病抗病鉴定结果, 实验材料种植在云南省德宏自治州甘蔗科学研究所基地, 本实验室周定港、凌辉、刘峰等同学帮助样品DNA提取和质量检测, 特此致谢。
[1]Avellaneda M C, Hoy J W, Pontif M J. Screening for resistance to sugarcane brown rust with controlled-conditions inoculation.Plant Dis, 2015, 99: 1633–1639
[2]黄鸿能. 警惕甘蔗锈病在蔗区蔓延. 甘蔗糖业, 1991, (6):17–19 Huang H N. Maintain vigilance for the spread of rust in sugarcane area. Sugar Canes, 1991, (6): 17–19 (in Chinese with English abstract)
[3]Bernard F A. Considerations of the appearance of sugarcane rust disease in the Dominican Republic. Plant Pathol, 1980, 17: 1382–1386
[4]Purdy L H, Liu L J, Dean J L. Sugarcane rust: a newly important disease. Plant Dis, 1983, 11: 1292–1296
[5]Comstock J C, Shine J M, Raid R N. Effect of rust on sugarcane growth and biomass. Plant Dis, 1992, 76: 175–177
[6]Comstock J C, Shine J M, Raid R N. Effect of early rust infection on subsequent sugarcane growth. Sugar Canes, 1992, 4: 7–9
[7]李文凤, 王晓燕, 黄应昆, 张荣跃, 单红丽, 尹炯, 申科, 罗志明. 甘蔗抗褐锈病基因 Bru1分子检测体系的建立与应用. 植物保护, 2015, 41(2): 120–124 Li W F, Wang X Y, Huang Y K, Zhang R Y, Shan H L, Yin J,Shen K, Lou Z M. Establishment and application of molecular detection system for sugarcane rust resistance gene Bru1. Plant Prot, 2015, 41(2): 120–124 (in Chinese with English abstract)
[8]Daugrois J H, Grivet L, Roques D, Hoarau J Y, Lombard H,Glaszmann J C, D’Hont A. A putative major gene for rust resistance linked with a RFLP marker in sugarcane cultivar ‘R570’.Theor Appl Genet, 1996, 92: 1059–1064
[9]Asnaghi C, Roques D, Ruffel S, Kaye C, Hoarau J Y, lismart H T,Girard J C, Raboin L M, Risterucci A M, Grivet L, D’Hont A.Targeted mapping of a sugarcane rust resistance gene (Bru1)using bulked segregant analysis and AFLP markers. Theor Appl Genet, 2004, 108: 759–764
[10]Cunff L L, Garsmeur O, Raboin L M, Pauquet J, Telismart H,Selvi A, Grivet L, Philippe R, Begum D, Deu M, Costet L, Wing R, Glaszmann J C, D’Hont A. Diploid / polyploid syntenic shuttle mapping and haplotype–specific chromosome walking toward a rust resistance gene (Bru1) in highly polyploid sugarcane (2n approximately 12× approximately 115). Genetics, 2008, 180:649–660
[11]Glynn N C, Laborde C, Davidson R W, Irey M S, Glaz B, D’Hont A, Comstock J C. Utilization of a major brown rust resistance gene in sugarcane breeding. Mol Breed, 2013, 31: 323–331
[12]Parco A S, Avellaneda M C, Hale A, Hoy J W, Kimbeng C A,Pontif M J, Gravois K A, Baisakh N. Frequency and distribution of the brown rust resistance gene Bru1 and implications for the Louisiana sugarcane breeding programme. Plant Breed, 2014,133: 654–659
[13]许莉萍, 陈如凯. 甘蔗锈病抗性指标及甘蔗无性系的抗性评价. 福建农业大学学报, 1996, 25(2): 128–131 Xu L P, Chen R K. The assessment of rust–resistant indexes and rust–resistance in sugarcane clones. J Fujian Agric Univ, 1996,25 (2): 128–131 (in Chinese with English abstract)
[14]李文凤, 王晓燕, 黄应昆, 张荣跃, 单红丽, 尹炯, 罗志明. 31份甘蔗野生核心种质资源褐锈病抗性鉴定及Bru1基因的分子检测. 作物学报, 2015, 41: 806–812 Li W F, Wang X Y, Huang Y K, Zhang R Y, Shan H L, Yin J, Luo Z M. Identification of brown rust resistance and molecular detection of Bru1 gene in 31 sugarcane wild core germplasm resources.Acta Agron Sin, 2015, 41: 806–812 (in Chinese with English abstract)
[15]Li W F, Wang X Y, Huang Y K, Zhang H Y, Shan H L, Yin J, Luo Z M. Molecular detection of Bru1 gene and identification of brown rust resistance in Chinese sugarcane germplasm. Sugar Tech, 2016, 19: 183–190
[16]Racedo J, Perera M F, Bertani R, Funes C, Gonzalez V, Cuenya M I, D’Hont A, Welin B, Castagnaro A P. Bru1 gene and potential alternative sources of resistance to sugarcane brown rust disease.Euphytica, 2013, 191: 429–436
[17]Tai P Y P, Miller J D, Dean J L. Inheritance of resistance to rust in sugarcane. Field Crops Res, 1981, 4: 261–268
[18]Hogarth D M, Ryan C C, Taylor P W J. Quantitative inheritance of rust resistance in sugarcane. Field Crops Res, 1993, 34:187–193
[19]王建南, 林彦铨, 邓祖湖, 陈如凯. 甘蔗对锈病的抗性遗传与育种策略: I. F1群体对锈病抗性的分析. 福建农业大学学报,1994, 23: 140–144 Wang J N, Lin Y Q, Deng Z H, Chen R K. Inheritance and breeding strategies of resistance to rust in sugarcane: I. An analysis of the resistance to rust of F1population. J Fujian Agric Univ,1994, 23: 140–144 (in Chinese with English abstract)
[20]邓祖湖, 林彦铨. 甘蔗对锈病的抗性遗性与育种策略: II. 亲本组合抗锈病的配合力. 福建农业大学学报, 1994, 23:249–252 Deng Z H, Lin Y Q. Inheritance and breeding strategies of resistance to rust in sugarcane: II. Combining ability of parental combinations for resistance to rust. J Fujian Agric Univ, 1994, 23:249–252 (in Chinese with English abstract)
[21]Costet L, Le C L, Royaert S, Raboin L M, Hervouet C, Toubi L,Telismart H, Garsmeur O, Rousselle Y, Pauquet J, Nibouche S,Glaszmann J C, Hoarau J Y, D’Hont A. Haplotype structure around Bru1 reveals a narrow genetic basis for brown rust resistance in modern sugarcane cultivars. Theor Appl Genet, 2012,125: 825–836
[22]Aljanabi S M, Parmessur Y, Moutia Y, Saumtally S, Dookun A.Further evidence of the association of a phytoplasma and a virus with yellow leaf syndrome in sugarcane. Plant Pathol, 2001, 50:628–636
[23]傅华英, 肖胜华, 刘营航, 孙生仁, 吴小斌, 陈如凯, 高三基.我国甘蔗锈病病原菌及甘蔗品系抗褐锈病基因Bru1的分子检测. 热带作物学报, 2016, 37: 958–963 Fu H Y, Xiao S H, Liu Y H, Sun S R, Wu X B, Chen R K, Gao S J. Molecular detection of causal pathogens causing rust disease and Bru1 resistance gene in elite sugarcane clones. Chin J Trop Crop, 2016, 37: 958–963 (in Chinese with English abstract)
[24]Asnaghi C, D’ Hont A, Glaszmann J C, Rott P. Resistance of sugarcane cultivar R570 to Puccinia melanocephala isolates from different geographic locations. Plant Dis, 2001, 85: 282–286
[25]Mcintyre C L, Whan V A, Croft B, Magarey R, Smith G R. Identification and validation of molecular markers associated with pachymetra root rot and brown rust resistance in sugarcane using map– and association–based approaches. Mol Breed, 2005, 16:151–161
[26]Molina B L, Rosales-Longo F, Queme J L. Comparative analysis between phenotype and Bru1 marker for incidence to brown rust in sugarcane. XXVIII ISSCT Congress, 2013, 28: 1–4
[27]李文凤, 王晓燕, 黄应昆, 张荣跃, 单红丽, 罗志明, 尹炯.101份中国甘蔗主要育种亲本褐锈病抗性鉴定及Bru1基因的分子检测. 作物学报, 2016, 42: 1411–1416 Li W F, Wang X Y, Huang Y K, Zhang R Y, Shan L H, Luo Z M,Yin J. Identification of resistance to brown rust and molecular detection of Bru1 gene in 101 main sugarcane breeding parents in China. Acta Agron Sin, 2016, 42: 1411–1416 (in Chinese with English abstract)
[28]Zhang J, Sharma A, Yu Q Y, Wang J P, Li L T, Zhu L, Zhang X T,Chen Y Q, Ming R. Comparative structural analysis of Bru1, region homeologs in Saccharum spontaneum, and S. officinarum.BMC Genomics, 2016, 17: 1–20
[29]Glynn N. Screening for resistance to brown rust of sugarcane: use of Bru1 resistance gene prospects and challenges. J Am Soc Sugar Canes Technol, 2012, 32: 82
