CoFe2O4, CoFe2, CoFe2/CoFe2O4磁性粒子合成与光催化应用
2018-03-01马永青孙筱雨阮奕然
马永青,孙筱雨,祝 翔,阮奕然
(安徽大学 物理与材料科学学院,安徽 合肥 230601)
用水热法结合溶胶凝胶法制备4种磁催化剂材料,并用X射线衍射、透射电子显微镜、超导量子干涉仪和紫外-可见谱仪研究它们的结构、形貌、磁性及对污染物亚甲基蓝的催化降解性能,目的是获得具有强磁性的催化剂材料,便于水处理后的回收利用.4种磁载催化剂材料中,催化性能最好的样品在150 min内能去除水中84%的亚甲基蓝污染物;CoFe2/TiO2有较高的降解效率(72%),且有很好的磁分离能力.分析认为,催化性能与粒子大小、界面成分、结晶性、TiO2与磁性粒子的比例有关,是多种因素的协同效应.
磁性粒子;TiO2;光催化;磁分离
TiO2是光催化剂中的标杆材料,它无毒、化学稳定性好、价格低廉,广泛应用于污水有机污染物降解[1-5]、分裂水制氢[6]和自清洁[7-9]等领域.锐钛矿TiO2是一种氧化物半导体,其带隙宽度约3.2 eV.当用能量大于带隙宽度的光子辐照TiO2时,TiO2晶体就产生电子空穴对.光生空穴与水或OH-反应产生羟基自由基OH·,光生电子与O2反应生成超氧自由基O2-·.这些自由基具有很强的氧化能力,它们与有机污染物反应,使污染物降解成无毒的CO2和水.
TiO2粒子很小,但具有较大的比表面积,从而表面有更多的活性位置,更有利于光催化降解.另一方面,小粒子在水中难以重力沉降,不利于分离,从而造成二次污染.为解决这一问题,研究人员尝试用玻璃纤维[10]、聚合物[11]等固定TiO2.然而,这种固定方法往往使TiO2的光催化性能降低[12],另一种可供选择的途径是用TiO2包覆磁性粒子,这样在废水处理以后,可以通过磁场对催化剂进行回收.目前TiO2包覆的磁性粒子多数为铁氧体磁性粒子,如Fe3O4[13],γ-Fe2O3[14],CoFe2O4[15]和NiFe2O4[16].但这几种粒子作为磁性载体也存在一些不足,它们具有亚铁磁性[17-18],磁化强度不很大,特别是用TiO2包覆后,由于TiO2的稀释作用,使磁化强度变低,废水处理后难以彻底回收,造成二次污染.因此,用强磁性粒子作为TiO2的载体是十分必要的.
Co-Fe合金是所有二元合金中磁性最强的[19],因此笔者用水热法制备CoFe2O4纳米粒子,使CoFe2O4纳米粒子在氢气/氮气混合气体中还原,制备CoFe2合金.为尽量避免还原过程中磁性粒子严重聚集,用MgO将CoFe2O4纳米粒子隔开,然后进行还原.将还原后的CoFe2@MgO在马弗炉中400 ℃和1 000 ℃氧化,用盐酸溶液去除MgO. 400 ℃处理后获得了CoFe2@CoFe2O4粒子,1 000 ℃处理后CoFe2又被氧化成CoFe2O4,将制备的磁性粒子CoFe2O4,CoFe2合金,CoFe2@CoFe2O4用TiO2包覆制成磁载催化剂材料,研究它们的磁性和对水中有机污染物亚甲基蓝的降解性能.
1 实 验
用水热法制备CoFe2O4纳米粒子.将定量的Fe(NO3)3·9H2O,Co(NO3)3·6H2O,C6H5Na3O7·2H2O溶解于去离子水中,加入NaOH作为沉淀剂,搅拌使溶液混合均匀,然后将混合溶液置于1 000 mL哈氏合金反应釜(Parr 4577, USA)中,80 ℃反应24 h.当反应釜自然冷却到室温,取出混合液,用离心机进行分离,用乙醇和去离子水清洗几次,然后在烘箱中80 ℃烘干,即获得CoFe2O4纳米粒子,记为CFO1.
将CoFe2O4纳米粒子加入Mg (NO3)2·6H2O溶液,搅拌后干燥,并经过800 ℃晶化处理,即制成CoFe2O4/MgO(记为CFO1/MgO).将CoFe2O4/MgO在H2/N2混合气体中(500 sccm,96% N2+ 4% H2)800 ℃还原4 h,获得CoFe2/MgO(记为CF/MgO).CoFe2/MgO在马弗炉中400 ℃和1 000 ℃氧化1 h,分别制成CoFe2/CoFe2O4/MgO(记为CF/CFO/MgO)和CoFe2O4/MgO(记为CFO2/MgO).
用稀盐酸溶液溶解CoFe2/MgO,CoFe2/CoFe2O4/MgO,CoFe2O4/MgO中的MgO,并用乙醇清洗,获得的CoFe2,CoFe2/CoFe2O4,CoFe2O4分别记为CF,CF/CFO,CFO2.
用TiO2包覆磁性粒子的过程如下:将CFO1,CF,CF/CFO,CFO2磁性粒子分别加入异丙醇,超声处理30 min,使磁性粒子在异丙醇中尽量均匀分散.加入二亚乙基三胺,超声处理10 min,再加入钛酸异丙酯(TIP)超声处理5 min,倒入50 mL反应釜中,200 ℃反应24 h.反应釜自然冷却至室温后,取出溶液,经过离心分离和洗涤后,80 ℃烘干.最后在氮气保护下,400 ℃处理2 h使其晶化.所制备样品分别记为CFO1/TiO2,CF/TiO2,CF/CFO/TiO2,CFO2/TiO2.样品合成过程如图1所示.
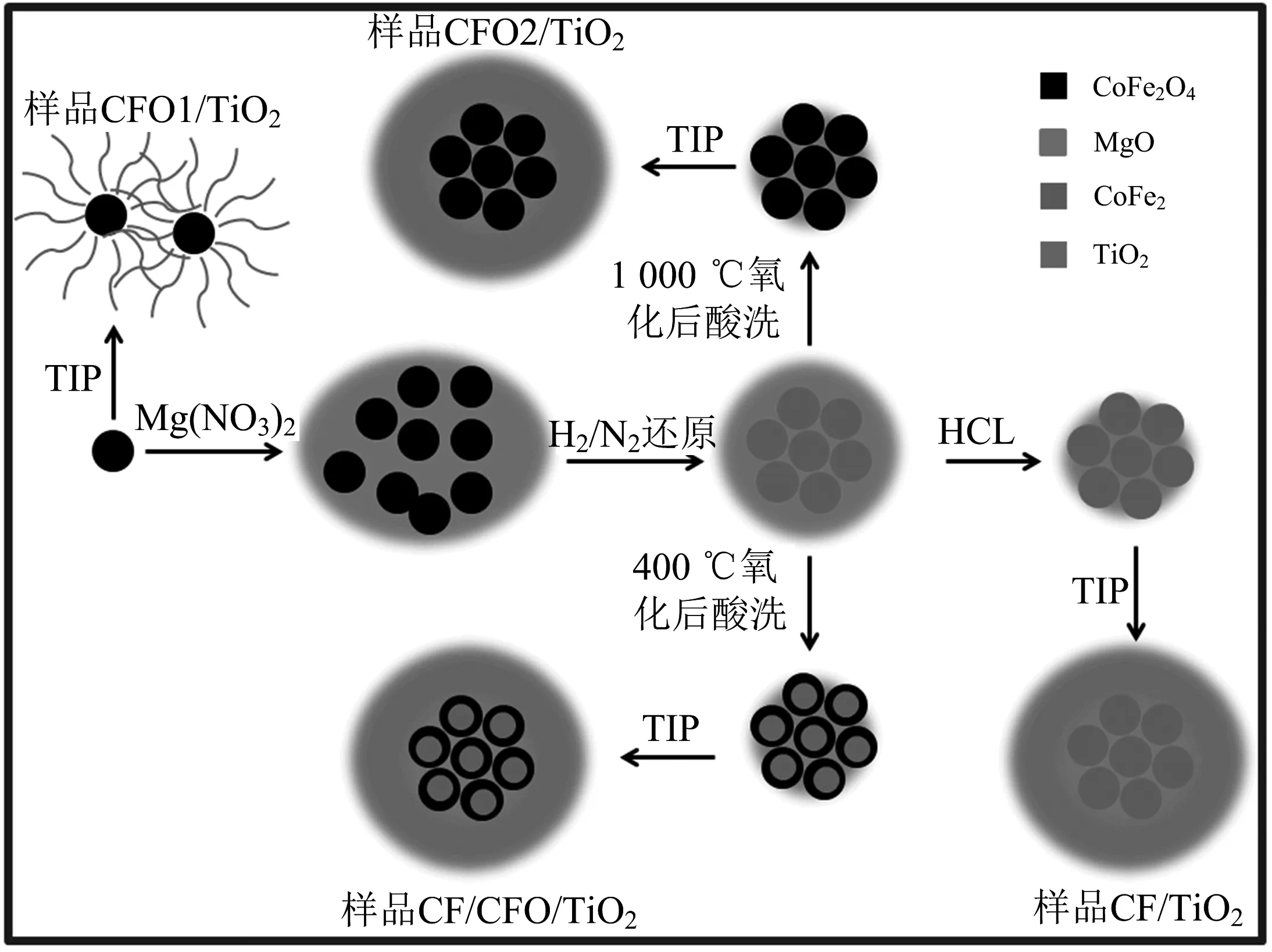
图1 4个催化剂样品的合成过程示意图
用X射线衍射仪(XRD;DX-2000 SSC)表征样品的晶体结构,用透射电子显微镜(TEM;JEOL JEM-2100)观察样品的形貌特征,用超导量子干涉仪PPMS系统(PPMS EC-II)测量磁化强度,用氙灯作为光催化实验光源.具体过程如下:配置浓度为8 mg·L-1的亚甲基蓝溶液100 mL;在打开光源之前,让溶液在暗室中搅拌60 min,使吸附-退吸附达到平衡;然后打开光源,每隔10 min提取溶液少许,用紫外-可见谱仪(UV-3200S)测试溶液中亚甲基蓝的浓度.
2 结果与讨论
2.1 结构与形貌表征
图2a为水热法制备CFO1样品的X射线衍射图.图2a中,对照CoFe2O4的标准X射线衍射(PDF)卡片 (No. 22-1086),可知水热法制备的样品为单相立方尖晶石结构的CoFe2O4.根据谢乐公式,可计算出CFO1的晶粒大小约为8 nm.MgO包覆CFO1之后,样品CFO1/MgO的XRD如图2b所示,样品中除了CFO1的衍射峰之外,对照PDF卡片(No. 45-0946),可知其余的衍射峰源自MgO.
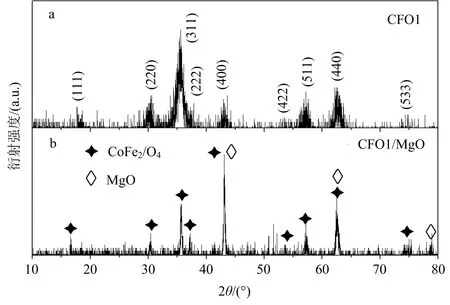
图2 CFO1(a),CFO1/MgO(b)的X射线衍射图
为了获得强磁性的CoFe2合金粒子,CFO1/MgO在H2/N2混合气体中800 ℃还原并用盐酸溶液去除MgO之后,所获得样品的XRD如图3a所示.比照标准的PDF卡片(No. 65-4131),样品可以标定为单相CoFe2合金 (No. 65-4131),说明CoFe2O4已被完全还原.还原反应所遵循的反应式为CoFe2O4+4H2→CoFe2+4H2O[20].CoFe2/MgO在马弗炉中400 ℃和1 000 ℃氧化后,再用稀盐酸溶液溶解去除MgO,所获得样品CF/CFO和CFO2的XRD如图3b,c所示.对比标准PDF卡片,可以确定400 ℃氧化的样品中包含CoFe2和CoFe2O4两相.MgO的最强峰与CoFe2O4的衍射峰重叠,可知样品含有少量MgO.而1 000 ℃氧化后,CoFe2合金完全晶化成CoFe2O4,由谢乐公式可知,此处的CoFe2O4的晶粒大小为18 nm,大于80 ℃水热制备的CoFe2O4即CFO1的晶粒大小,这是因为1 000 ℃氧化后CoFe2O4的结晶性更好,1 000 ℃氧化的样品中也含有少量MgO.氧化反应方程式为CoFe2+2O2→ CoFe2O4.
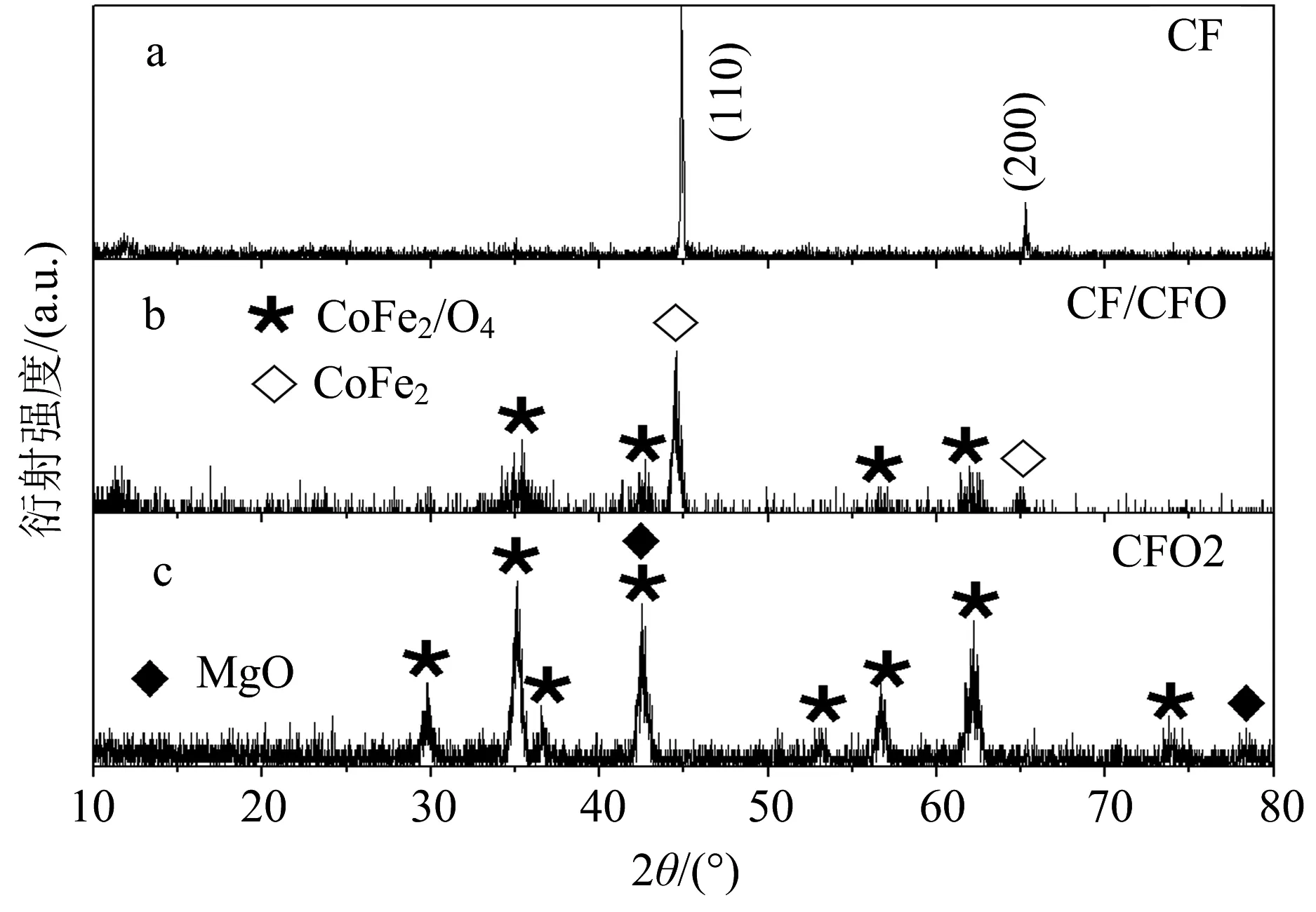
图3 CF(a),CF/ CFO(b),CFO2(c)的X射线衍射图
用TiO2包覆上述CFO1,CF,CF/CFO,CFO2磁性粒子,制得CFO1/TiO2,CF/TiO2,CF/CFO/TiO2,CFO2/TiO2磁载催化剂.图4为 CFO1/TiO2,CF/TiO2,CF/CFO/TiO2,CFO2/TiO2的X射线衍射图.由图4可知,所有样品除了有图2,3中磁性粒子的衍射峰之外,均出现了锐钛矿TiO2衍射峰.
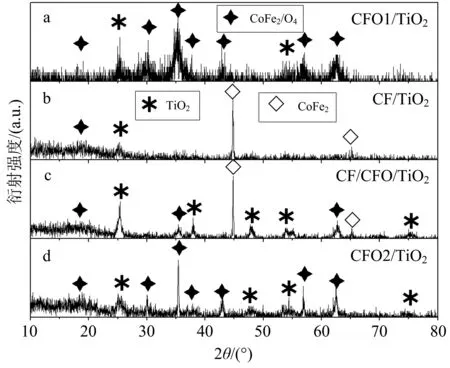
图4 CFO1/TiO2(a),CF/TiO2(b),CF/CFO/TiO2(c),CFO2/TiO2(d)的X射线衍射图
图5为CFO1,CFO1/TiO2,CF,CF/TiO2,CFO2,CFO2/TiO2的透射电镜显微图.水热制备的CFO1样品由分散的纳米粒子构成,粒径大小为5~10 nm,如图5a所示.包覆TiO2之后,如图5b所示,可以看到絮状的TiO2包裹在CFO1纳米粒子上.对于CF样品和CFO2样品,从图5c,e可以看出,粒子明显变大,大小为100~200 nm,原因是高温还原或氧化使得小粒子烧结到一起,形成更大的粒子.TiO2包覆CF和CFO2之后的形貌如图5d,f所示,明显可看到TiO2包覆在磁性粒子上,TiO2的形貌也呈絮状特征,与图5b相似.

图5 CFO1(a),CFO1/TiO2(b),CF(c),CF/TiO2(d),CFO2(e),CFO2/TiO2(f)的透射电镜显微图
2.2 磁性质
为了获得磁性粒子被TiO2包覆后磁化强度(M)的变化情况,在室温(26.85 ℃)下,测量了磁化强度M与外加磁场强度H间的变化曲线,即磁滞回线.图6为CFO1,CF,CF/CFO,CFO2被TiO2包覆前后的室温磁滞回线.所加磁场大小为- 40 kOe到+ 40 kOe,最大磁场对应的最大磁化强度记为Mmax.CFO1的Mmax值为29.8 emu·g-1,比块体的CoFe2O4的磁化强度值小很多.CF样品即CoFe2合金的Mmax值在所有磁性粒子中最大,其值为124.1 emu·g-1.对于CF/CFO,其包含CoFe2合金和CoFe2O4铁氧体,其Mmax值为64.6 emu·g-1,介于CoFe2合金和CoFe2O4的Mmax值之间.CFO2的Mmax值为35.2 emu·g-1,该样品也是CoFe2O4,与水热制备的CFO1是同一物质,但Mmax值稍大于水热制备的CoFe2O4,原因是经过高温1 000 ℃氧化处理,CFO2的结晶性更好,图2,3中XRD的结果也证明了这一点.
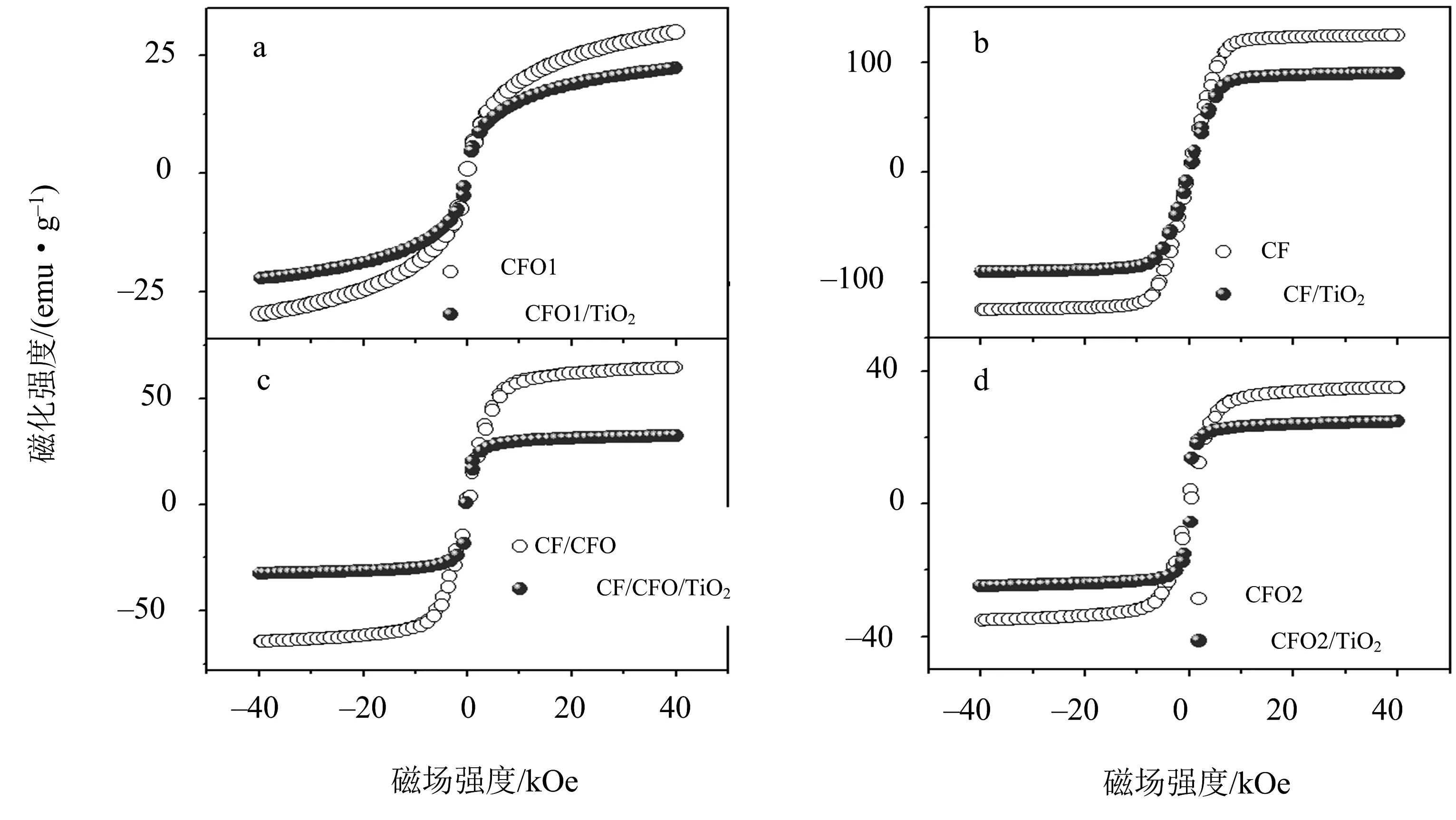
图6 CFO1(a),CF(b),CF/CFO(c),CFO2(d)被TiO2包覆前后的室温磁滞回线
对于被TiO2包覆后的磁载催化剂CFO1/TiO2,CF/TiO2,CF/CFO/TiO2,CFO2/TiO2,它们的Mmax值分别为22.3,89.9,32.4,24.8 emu·g-1.被TiO2包覆后,Mmax都减小,原因是磁性粒子经过TiO2稀释,磁载催化剂中既有磁性粒子也有非磁性的TiO2,因此,被TiO2包覆后Mmax值减小.从图6可以看出,CF/TiO2的Mmax值最大,更容易被外场驱动,有利于光催化降解后,用磁体将催化剂从水中分离出来,达到催化剂的回收再利用目的.它们被TiO2包覆后的Mmax与被包覆前的比值分别为0.75,0.72,0.50,0.70,说明磁性粒子与TiO2的质量比不相等,也就是同质量的磁性粒子外的TiO2质量是不等的,原因是样品制备过程中,分离和清洗环节均有部分TiO2流失.
2.3 光催化性质
图7为在CFO1/TiO2,CF/TiO2,CF/CFO/TiO2,CFO2/TiO2催化剂作用下,亚甲基蓝浓度C/C0随时间的变化,其中C0为初始时刻亚甲基蓝的浓度,C为任意时刻亚甲基蓝的浓度.降解系数De定义为(C0-C)/C0,其可用来评价催化剂的降解性能.由相关计算结果可知,150 min降解后,4种催化剂的De分别为56%,72%,45%,84%.影响降解系数的因素十分复杂,对于此处的4个磁载催化剂,几种因素对降解系数影响的分析如下:(1)磁性粒子的大小不同,导致TiO2与磁性粒子的界面面积大小不同.(2)对于CFO1/TiO2和CFO2/TiO2,与TiO2接触的都是CoFe2O4,但CoFe2O4的粒子大小明显不同.CFO2经过了1 000 ℃氧化处理,而CFO1仅在水热条件下80 ℃合成,结晶性不同.再者,从图1可知,CFO2中可能存在极少量的MgO,尽管XRD结果中没有显示出MgO的衍射峰,因此CFO2/TiO2的界面处可能存在MgO.(3)对于CF/TiO2,与TiO2接触的是强磁性的CoFe2合金,界面处的成分与其他催化剂明显不同.(4)磁性粒子与TiO2的质量比不同.
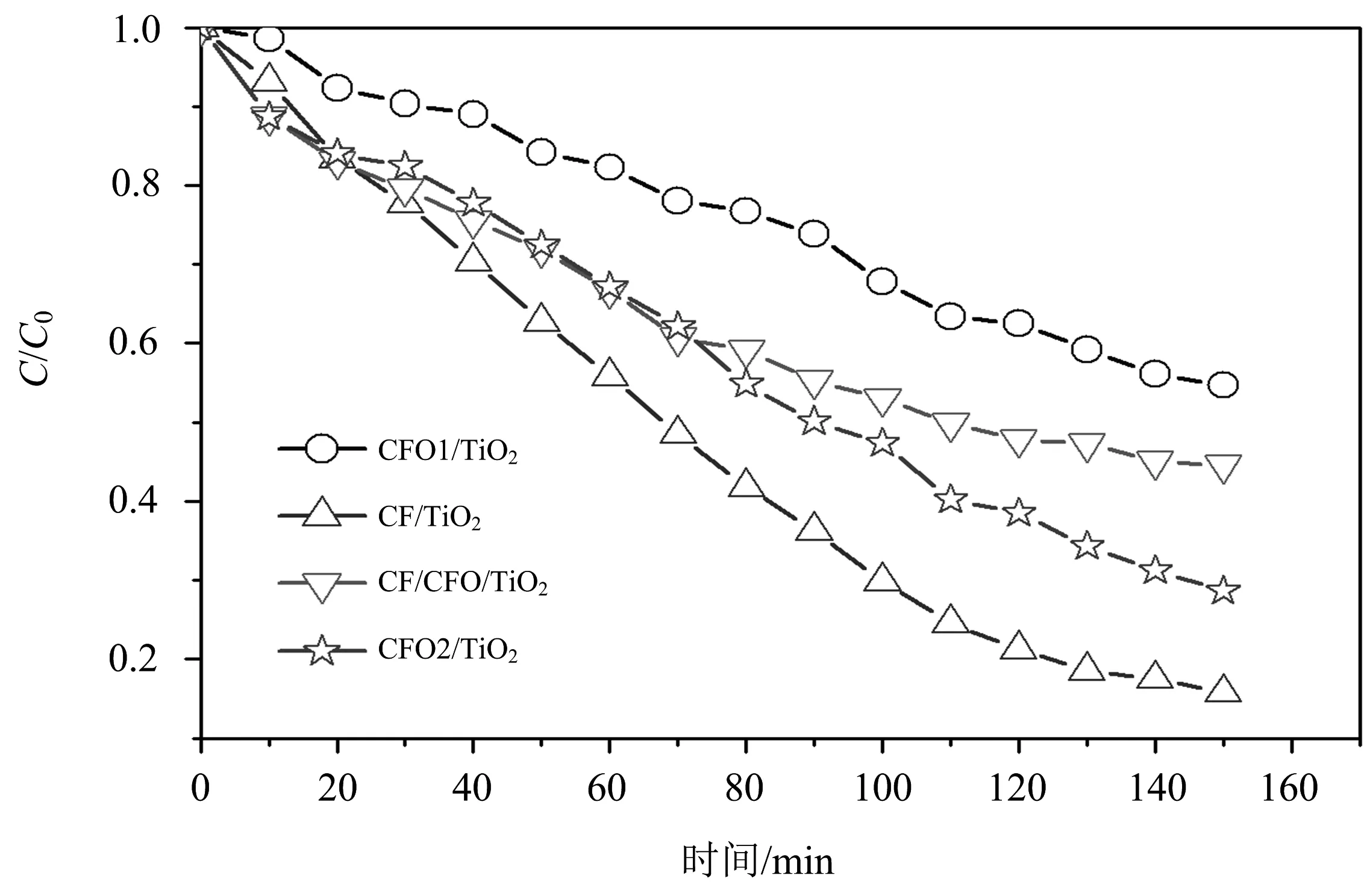
图7 在CFO1/TiO2,CF/TiO2,CF/CFO/TiO2 ,CFO2/TiO2催化剂作用下,亚甲基蓝浓度C/C0随时间的变化
笔者检测了磁性较强的CF/CFO/TiO2和CF/TiO2催化剂在光降解后的磁分离能力.图8为CF/CFO/TiO2和CF/TiO2的磁分离图片,这两个图中,左边的玻璃瓶是起始时刻亚甲基蓝溶液,溶液中没有催化剂,右边的玻璃瓶是降解后的溶液.从图8a可以看出,磁体作用后,大部分催化剂被吸引到磁体附近,但瓶子的底部和溶液中还有部分残留催化剂,也就是催化剂没有被彻底回收.从图8b可以看出,磁分离后,残留的催化剂较少,溶液更透明.所以,CF/TiO2有较高的降解效率,并且有很好的磁分离能力,便于催化剂的回收利用.

图8 CF/CFO/TiO2(a)和CF/TiO2(b)的磁分离图片
3 结束语
笔者制备了CoFe2O4,CoFe2合金,CoFe2/CoFe2O4复合物磁性粒子,然后用TiO2进行包覆.所制备的磁载催化剂材料中,催化性能最好的样品在150 min内能去除水中84%的亚甲基蓝污染物.CoFe2/TiO2有较高的降解效率(72%),且有很好的磁分离能力,便于催化剂的回收利用.分析认为,催化性能与粒子大小、界面成分、结晶性、TiO2与磁性粒子的比例有关,是多种因素的协同效应.
[1] WANG J G, RAO P H, AN W, et al. Boosting photocatalytic activity of Pd decorated TiO2nanocrystal with exposed (001) facets for selective alcohol oxidations[J]. Applied Catalysis B: Environmental, 2016, 195: 141-148.
[2] LUE Y H, CAO X F, JIANG H Y, et al. Rapid photocatalytic debromination on TiO2with in-situ formed copper co-catalyst: enhanced adsorption and visible light activity[J]. Applied Catalysis B: Environmental, 2016, 194: 150-156.
[3] BODSON C J, HEINRICHS B, TASSEROUL L, et al. Efficient P- and Ag-doped titania for the photocatalytic degradation of waste water organic pollutants[J]. Journal of Alloys and Compounds, 2016, 682: 144-153.
[4] DHADA I, SHARMA M, NAGAR P K. Quantification and human health risk assessment of by-products of photo catalytic oxidation of ethylbenzene, xyleneand toluene in indoor air of analytical laboratories[J]. Journal of Hazardous Materials, 2016, 316: 1-10.
[5] MARIEN C B D, COTTINEAU T, ROBERT D, et al. TiO2Nanotube arrays: influence of tube length on the photocatalytic degradation of paraquat[J]. Applied Catalysis B: Environmental, 2016, 194: 1-6.
[6] CAO B, LI G S, LI H X. Hollow spherical RuO2@TiO2@Pt bifunctional photocatalyst for coupled H2production and pollutant degradation[J]. Applied Catalysis B: Environmental, 2016, 194: 42-49.
[7] KALE B M, WIENER J, MILITKY J, et al. Coating of cellulose-TiO2nanoparticles on cotton fabric for durable photocatalytic self-cleaning and stiffness[J].Carbohydrate Polymers, 2016, 150: 107-113.
[8] CHEN X B, SHEN S H, GUO L J, et al. Semiconductor-based photocatalytic hydrogen generation[J]. Chemical Review, 2010, 110: 6503-6570.
[9] FUJISHIMA A, ZHANG X T, TRYK D A. TiO2photocatalysis and related surface phenomena[J]. Surface Science Reports, 2008, 63: 515-582.
[10] SUN P, XUE R Y, ZHANG W, et al. Photocatalyst of organic pollutants decomposition: TiO2/glass fiber cloth composites[J]. Catalysis Today, 2016, 274: 2-7.
[11] TEIXEIRA S, MARTINS P M, LANCEROS M S, et al. Reusability of photocatalytic TiO2and ZnO nanoparticles immobilized in poly(vinylidene difluoride)-co-trifluoroethylene[J]. Applied Surface Science, 2016, 384: 497-504.
[12] CARP O, HUISMAN C L, RELLER A. Photoinduced reactivity of titanium dioxide[J]. Progress in Solid State Chemistry, 2004, 32: 33-177.
[13] XU J W, GAO Z D, HAN K, et al. Synthesis of magnetically separable Ag3PO4/TiO2/Fe3O4heterostructure with enhanced photocatalytic performance under visible light for photoinactivation of bacteria[J]. ACS Applied Materials & Interfaces, 2014, 6: 15122-15131.
[14] TARIQ Q M, ASLAM M, ISMAIL I M I, et al. The assessment of the photocatalytic activity of magnetically retrievable ZnO coated γ-Fe2O3in sunlight exposure[J]. Chemical Engineering Journal, 2016, 283: 656-667.
[15] LI H S, ZHANG Y P, WANG S Y, et al. Study on nanomagnets supported TiO2photocatalysts prepared by a sol-gel process in reverse microemulsion combining with solvent-thermal technique[J]. Journal of Hazardous Materials, 2009, 169: 1045-1053.
[16] JI H Y, JING X C, XU Y G, et al. Magnetic g-C3N4/NiFe2O4hybrids with enhanced photocatalytic activity[J]. RSC Advance, 2015, 5: 57960-57967.
[17] 马倩, 马永青, 张贤, 等. Ni-Zn 铁氧体的掺杂研究与磁相互作用分析[J]. 稀有金属材料与工程, 2014, 43(S1): 397-401.
[18] 张贤, 马永青, 吴丹丹, 等. 溶胶-凝胶自燃烧合成法制备SrFe12O19及其磁性能研究[J]. 功能材料与器件学报, 2011, 17 (6): 573-578.
[19] 马永青, 黄松, 徐士涛. 硬磁CoFe2O4/软磁CoFe2复合物的磁性研究[J]. 安徽大学学报 (自然科学版), 2016, 40 (1): 37-41.
[20] GENG B Q, MA Y Q, XU S T, et al. High magnetic performance of cobalt ferrite and anomalous magnetizing behavior of CoFe2/oxide derived from ferrite[J]. Ceramics International, 2016, 42: 317-324.
