纳豆激酶分批补料发酵的研究
2018-02-28吴燕梁向峰刘会洲李英波肖建辉
吴燕,梁向峰,刘会洲,李英波*,肖建辉
1(遵义医学院附属医院,医药生物技术研究所,贵州 遵义,563003) 2(中国科学院过程工程研究所,中国科学院绿色过程与工程重点实验室,北京,100190) 3(中国科学院青岛生物能源与过程研究所,中国科学院生物基材料重点实验室,山东 青岛,266101)
纳豆激酶(nattokinase, NK)是一种由纳豆枯草杆菌(Bacillussubtilisnatto)分泌的具有强大溶栓活性的丝氨酸蛋白酶[1]。药理研究表明,该酶可以通过直接溶解纤维蛋白和激活体内的纤溶酶原两种途径来发挥其溶栓作用[2-4]。此外,与目前临床上常用的尿激酶、蚓激酶和纤溶酶原激活剂等溶栓药物相比,该酶具有可口服、安全、持久和廉价等优势[5],因此被认为是极具开发潜力的功能性食品和溶栓药物。
纳豆激酶可通过固体发酵和液体发酵进行生产。液体发酵传质均匀,过程易于监测、控制和放大,近年来已成为纳豆激酶生产的主要手段。目前,国内外有关纳豆激酶液体发酵的研究主要集中在高产菌种的筛选或构建,培养基和发酵条件的优化[6-8]。培养基中的碳源和氮源,既是菌体生长的营养物质,也是纳豆激酶的前体物质。适宜的碳源和氮源是促进纳豆激酶合成的关键[9]。然而,如果一次性在培养基中添加大量碳源或氮源,可能会导致菌体生长受到抑制,并影响体系的传质和溶氧,使酶产量显著下降[10]。分批补料发酵既可保证发酵过程中营养物质的供给,又可以有效地消除某些底物对产物合成所产生的阻遏或抑制效应[11]。因此,通过分批补料发酵将有可能缓解此矛盾,从而促进菌体生长和提高纳豆激酶的产量。
以枯草芽孢杆菌LSSE-22(BacillussubtilisLSSE-22)为生产菌株,通过考察补料底物、补料方式和补料时间对产酶的影响,建立了摇瓶分批补糖发酵工艺。在此基础上,进行了7.5 L发酵罐分批补料发酵放大研究,以期进一步推动纳豆激酶的商业化生产和应用。
1 材料与方法
1.1 菌株、试剂与培养基
产纳豆激酶的枯草芽孢杆菌BacillussubtilisLSSE-22由本实验室从豆酱制品筛选获得,菌株保存于中国微生物菌种保藏管理委员会普通微生物中心,其保藏编号为:CGMCC No. 4970[12]。
凝血酶、纤维蛋白原,美国Sigma公司;PBS缓冲液,无锡傲锐东源生物科技有限公司;尿激酶,中国食品药品检定研究院;琼脂糖,美国NOVON公司;葡萄糖、MgSO4、NaCl、CaCl2、K2HPO4、蔗糖、苯酚,西陇化工股份有限公司;胰蛋白胨、酵母粉,英国Oxoid公司;琼脂粉,日本Japan公司;浓H2SO4、氨水、HCl,北京化工厂;大豆蛋白胨、牛肉膏,北京奥博星生物技术有限责任公司;甘油,天津市大茂化学试剂厂;乳糖、麦芽糖,国药集团化学试剂有限公司;糖蜜,上海正和实业有限公司。
种子培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10,pH 7.2;
发酵培养基(g/L):葡萄糖10,大豆蛋白胨30,K2HPO42,MgSO4·7H2O 0.85,NaCl 5,CaCl20.22,pH 7.2。
1.2 仪器与设备
超净工作台,北京市冠鹏净化设备有限公司;LDZX-75KBS蒸汽灭菌锅,上海申安医疗器械厂;752s紫外可见分光光度计,上海棱光技术有限公司;PHSJ-4F pH计,上海仪电科学仪器股份有限公司;DHZ-CA恒温振荡器, 太仓市实验设备厂;HC-2518高速离心机,安徽中科中佳科学仪器有限公司;5424离心机,德国Eppendorf公司;BIOFLO 3000发酵罐,美国NBS公司。
1.3 实验方法
1.3.1 种子培养
在LB固体培养基平板上挑选较大的单菌落,接种于种子培养基,37 ℃,180 r/min,恒温振荡培养10 h。
1.3.2 摇瓶发酵培养
将4 mL种子液转接至装有50 mL发酵培养基的250 mL三角瓶中,37 ℃,200 r/min,恒温振荡培养。定时取样测定菌体量、残糖量和纳豆激酶产量。
1.3.3 碳源及其浓度的影响
分别用20 g/L葡萄糖、麦芽糖、蔗糖、甘油、乳糖和糖蜜为碳源进行发酵,以生物量和纳豆激酶产量为指标,确定最优碳源,随后研究最优碳源质量浓度(5、10、20和30 g/L)对发酵的影响。每个条件均设3个重复。
1.3.4 氮源及其浓度的影响
在确定合适的碳源的基础上,分别以30 g/L大豆蛋白胨、胰蛋白胨、酵母粉和牛肉膏为氮源进行发酵,以生物量和纳豆激酶产量为指标,确定最优氮源,并研究最优氮源质量浓度(10、30、50和70 g/L)对发酵的影响。每个条件均设3个重复。
1.3.5 补料底物的影响
在葡萄糖初始浓度为10 g/L的条件下,当发酵进行24 h(此时葡萄糖浓度消耗至2 g/L以下),在摇瓶中分别一次性补加如下底物:(1)0.8 mL的0.5 g/mL葡萄糖溶液;(2)0.8 mL的1.5 g/mL大豆蛋白胨溶液;(3)0.86 mL含0.5 g/mL的葡萄糖和1.5 g/mL的大豆蛋白胨的复合培养液,进行分批补料发酵。
1.3.6 补料方式的影响
在摇瓶中,用0.5 g/mL的葡萄糖溶液按以下补料方式进行分批补料发酵:(1)在发酵进行24 h,一次补加0.5 g/mL的葡萄糖溶液,使葡萄糖质量浓度达到5 g/L;(2) 在发酵进行24 h,一次补加0.5 g/mL的葡萄糖溶液,使葡萄糖质量浓度达到10 g/L;(3)分别在第24 h和40 h分两次补加0.5 g/mL的葡萄糖溶液,每次使培养基中葡萄糖质量浓度保持在5 g/L左右。
1.3.7 补料时间的影响
分别在发酵时间的第24、32 h开始补加0.5 g/mL的葡萄糖溶液至5 g/L。
1.3.8 7.5 L发酵罐培养
在发酵条件为37 ℃,溶氧20%,通气量2 vvm,葡萄糖初始质量浓度10 g/L的条件下进行培养。装液量3 L,接种量为240 mL。通过预实验,发现葡萄糖在发酵罐中比在摇瓶中消耗得快,因此调整补糖策略,即在发酵的第12、20 h,由蠕动泵将0.5 g/mL的葡萄糖加入发酵罐内,使葡萄糖质量浓度控制在5 g/L左右。在其他条件相同的情况下,以不补加葡萄糖发酵作为对照组。每隔4 h取样,检测发酵液中菌体生物量和纳豆激酶酶活性。
1.3.9 细胞干重的测定
空离心管85 ℃烘干2 h称重,取混合均匀的发酵液50 mL移至离心管中。10 000 r/min离心5 min,弃上清。重复上述步骤2次,弃上清,在85 ℃烘箱烘干24 h后称重。
1.3.10 残糖的测定
采用浓硫酸-苯酚法[13]测定培养基中残糖浓度。
制作葡萄糖标准曲线。配置100 mg/L的葡萄糖标准溶液,按比例稀释至20、40、60、80、100 mg/L。分别取1 mL于试管中,加入9%的苯酚溶液0.5 mL,充分混匀。迅速加入2.5 mL浓硫酸混匀。待冷却至室温后,在485 nm处测定吸光值,做出标准曲线。
取-20 ℃保存的发酵液,10 000 r/min离心5 min,取上清,根据浓度变化稀释10~60倍,再以同样的条件进行测定,根据标准曲线计算残糖浓度。
1.3.11 纳豆激酶活性的检测
采用纤维蛋白平板法[14]测定纳豆激酶活性。
配置纤维蛋白平板:称60 mg纤维蛋白原,溶解于10 mL PBS溶液中。另称取0.1 g琼脂糖,加入10 mL PBS溶液,加热至完全溶解。待琼脂糖溶液温度冷却至40 ℃左右,在纤维蛋白原溶液中加入750 μL凝血酶混匀,然后迅速将两种溶液混合,倒入培养皿中,待其凝固制成平板。室温放置1 h后,用孔径为0.3 cm的打孔器打孔。
用PBS缓冲液配置尿激酶标准品溶液,并分别稀释成500、400、300、200、100 IU/mL的浓度梯度,然后各取10 μL注入纤维蛋白平板的孔中,37 ℃恒温孵育18 h后测量其透明圈两条相互垂直的直径,并计算其面积。以尿激酶活力为横坐标,透明圈面积为纵坐标,绘制标准曲线。
培养结束后的发酵液10 000 r/min离心5 min,取上清。将纳豆激酶样品点于平板上,37 ℃恒温孵育18 h,测其溶解圈直径。根据标准曲线以尿激酶活力单位表示其纤溶活性。
2 结果与讨论
2.1 碳源及其质量浓度对细胞生长和纳豆激酶产量的影响
为选择适宜的发酵碳源,分别考察葡萄糖、蔗糖、甘油、乳糖、麦芽糖、糖蜜对菌体生长和纳豆激酶产量的影响,浓度为20 g/L,结果见表1。表1表明以葡萄糖作为碳源,菌体量和酶产量均为最高,分别达到1.79 g/L和1 029 IU/mL,其次为麦芽糖和蔗糖。朱健辉等[15]研究发现麦芽糖是合成纳豆激酶的最适碳源,而BERENJIA等[7]的研究表明,最适碳源为甘油,均与本研究结果不同。这可能与不同产酶菌株对碳源的偏好不同有关。综上,确定葡萄糖为纳豆激酶发酵的碳源。

表1 不同碳源对枯草芽孢杆菌细胞生长和NK产量的影响
为选择适宜的初始碳源质量浓度,进一步考察葡萄糖质量浓度为5、10、20、30 g/L时菌体生长和产酶情况(图1)。结果表明,在5~20 g/L质量浓度的范围内,菌体量和酶产量均随葡萄糖质量浓度的增加而增加。当葡萄糖质量浓度为10和20 g/L时,菌体量和酶产量变化不大,且两者在发酵48 h时达到最大值,分别为1.75 g/L和1 014.22 IU/mL。当葡萄糖的质量浓度增加至30 g/L,细胞生长和酶产量均受到严重的抑制。此外,在所试验的糖浓度下,酶的合成过程和菌体的生长是一致的,表明产物的形成和菌体的生长具有紧密的关联性。在初始糖质量浓度大于20 g/L的条件下,随着发酵的进行,发酵液愈加黏稠,营养物质的运输和氧的分布均受到影响,造成碳源的利用不充分,酶产量增长有限。故选择10 g/L为发酵初始浓度。
图1 葡萄糖质量浓度对细胞生长和NK产量的影响Fig.1 Effect of glucose concentration on cell growth and NK production
2.2 氮源及其质量浓度对细胞生长和纳豆激酶产量的影响
在质量浓度为30 g/L的条件下,考察了大豆蛋白胨、酵母粉、胰蛋白胨、牛肉膏对细胞生长和酶产量的影响。从表2可以看出,当氮源为大豆蛋白胨时,菌体量和酶产量均为最高,分别为1.94 g/L和1 107.00 IU/mL。其次为酵母粉和牛肉膏。胰蛋白胨的效果最差,用其为氮源所获得的酶产量仅为大豆蛋白胨的1/2。这与谢秋玲[10]和LIU[9]等人的研究结果一致。目前,大豆蛋白胨促进纳豆激酶合成的机理尚不清楚,前人通过实验推测纳豆激酶产量的提高是由于大豆蛋白胨中某种独特小分子物质发挥的诱导作用[10],然而,对于该诱导物质结构的确定需要进一步深入研究。
进一步研究大豆蛋白胨初始浓度的影响。由图2-A可以看出,菌体量随着大豆蛋白胨质量浓度的增加而增加,且在质量浓度为50 g/L时菌体量达到最大值。当大豆蛋白胨质量浓度达到70 g/L时,细胞的生长受到严重抑制。酶产量在大豆蛋白胨质量浓度为30和50 g/L时相差不大,最高产量为1 210.87 IU/mL。但在质量浓度为70 g/L的条件下,酶的合成也受到显著的抑制。由此可见,氮源质量浓度过低,不能满足菌体生长的需求,菌体生长缓慢,不利于纳豆激酶的合成;氮源质量浓度过高,则可能会引起培养基渗透压的升高,菌体量下降,酶产量也随之下降。因此,选择氮源的初始浓度为30 g/L。
表2 不同氮源对枯草芽孢杆菌细胞生长和NK产量的影响
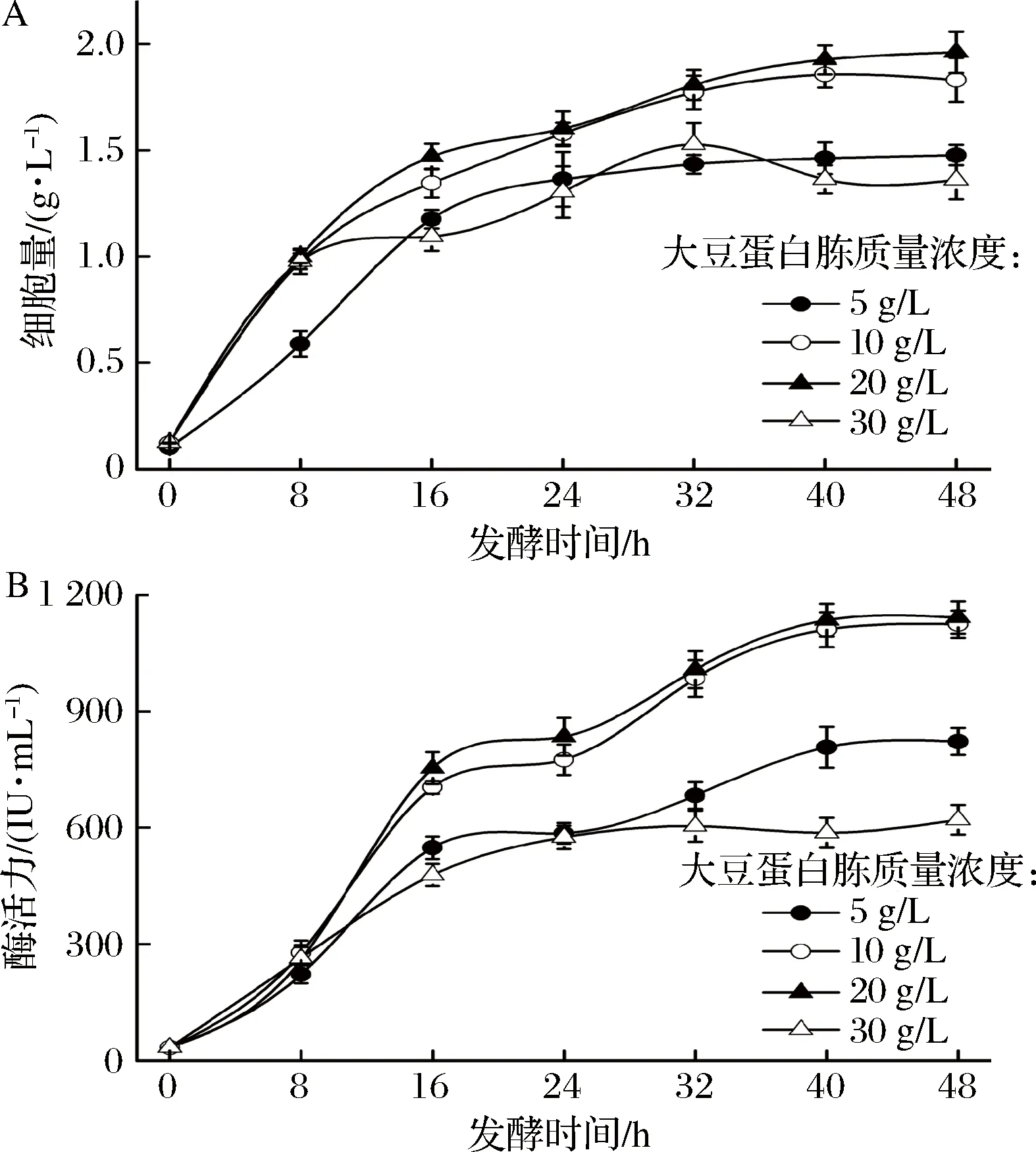
图2 大豆蛋白胨质量浓度对细胞生长和NK产量的影响Fig.2 Effect of glucose concentration on cell growth and NK production
2.3 摇瓶分批补料发酵
以上研究结果表明纳豆激酶的合成属于生长关联型。因此,可以通过促进细胞的生长来实现酶产量的提高。菌体的生长和营养的供给紧密相关,过高或过低的底物浓度均不利细胞生长。为此,以下实验研究了分批补料发酵对菌体生长和产酶的影响。
2.3.1 补料底物对纳豆激酶发酵过程的影响
补料底物对细胞生长和酶产量的影响如图3所示。由图3可知,所有补料底物均能够不同程度地提高菌体量和酶产量。其中,当补加底物为葡萄糖时,细胞量和酶产量的增长最为显著。最高酶产量达到1 376.07 IU/mL,比分批培养提高了16.21%。补加复合底物也可以明显提高酶产量,但略低于补加葡萄糖组。补加氮源和补加复合底物的情况相差不大,但与CHO等人报道的补加氮源能够将酶产量提高2.5倍的结果不同[16]。究其原因,一方面可能是由于本研究中所用发酵培养基中氮源是相对充足的;另一方面可能由于本研究所用菌株与文献中所用的菌株存在差异,氮源对本研究中纳豆激酶的合成并不是关键因素。此外,糖的消耗在补加葡萄糖时明显快于补加复合底物(图3-C),这和细胞的生长情况吻合良好。由此可见,补加葡萄糖是一种提高纳豆激酶产量的有效策略。

图3 补料底物对细胞生长和NK产量的影响Fig.3 Effect of fed-batch substrate on cell growth and NK production
2.3.2 补料方式对纳豆激酶发酵过程的影响
进一步考察葡萄糖的补料方式对纳豆激酶发酵过程的影响。图4表明,采用一次少量的补加葡萄糖更利于细胞的生长和纳豆激酶的合成。在一次补糖至5 g/L的条件下,最高酶产量可达到1 437.34 IU/mL,比分批培养提高了21.38%。一次补糖至10 g/L和分两次补加的方式虽然也可以促进细胞生长和纳豆激酶的合成,但不及一次补糖至5 g/L的方式好。这表明补加少量的葡萄糖对于菌体的生长和酶合成已经足够,而一次性补加过多的葡萄糖则可能会引起糖的抑制效应。
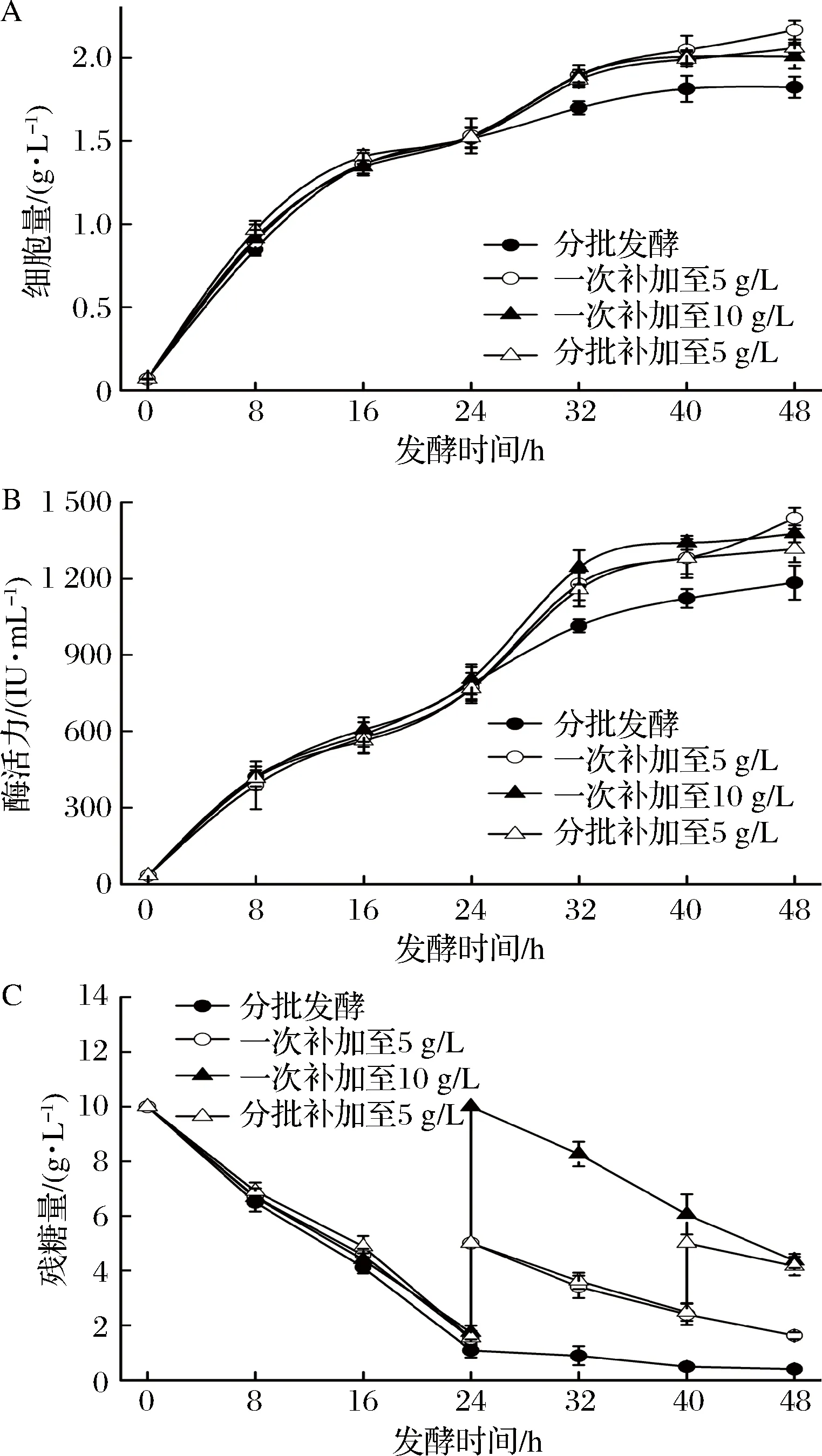
图4 补料方式对细胞生长和NK产量的影响Fig.4 Effect of fed-batch method on cell growth and NK production
2.3.3 补料时间对纳豆激酶发酵过程的影响
根据糖的消耗情况,分别在24 h和32 h进行补加葡萄糖。由图5可以看出,菌体在发酵的前24 h处于对数生长期,生长代谢活动较强,葡萄糖消耗迅速。在发酵前16 h,葡萄糖质量浓度仍然较高,过早补充碳源可能会抑制菌体生长。当发酵进行至24 h时,残糖质量浓度已低于2 g/L。在此时间点补加葡萄糖后,菌体量和酶产量均比对照组有显著的提高(图5-A),最高酶产量为1 429.85 IU/mL。而在第32 h(此时残糖质量浓度低于1 g/L)进行补糖,菌体量和酶产量没有明显变化。分析其原因,可能是枯草芽孢杆菌在第32 h时已进入稳定期,其对糖的代谢利用能力有所下降。因此,选择在第24 h进行补糖较为合适。
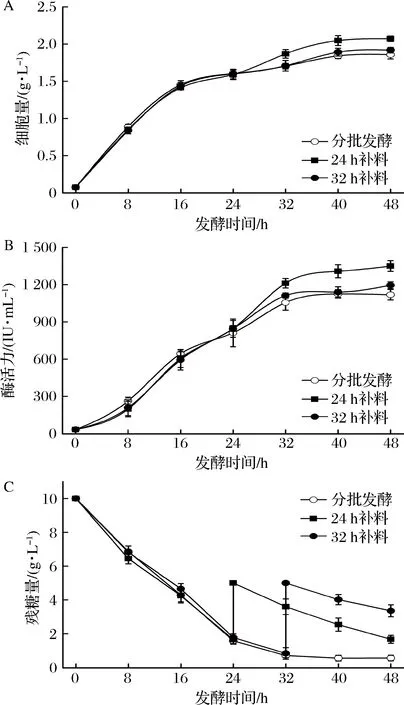
图5 补糖时间对细胞生长和NK产量的影响Fig.5 Effect of fed-batch time on cell growth and NK production
2.4 7.5 L发酵罐中分批发酵与分批补料发酵结果比较
为进一步验证补糖策略的可行性,在7.5 L发酵罐中进行了放大培养实验。通过图5和图6的对比可以看出,无论是分批发酵还是分批补料发酵,发酵罐中的菌体量、酶产量、生长速率和产酶速率均比摇瓶显著提高。相应地,发酵罐中糖的消耗速率也明显提高。例如,在摇瓶中,当发酵进行16 h时,葡萄糖才几乎被消耗50%,而在发酵罐中,在同样的时间点,葡萄糖几乎被消耗殆尽。究其原因,可能是发酵罐一直保持比较合适的溶氧水平,促进了菌体对糖的利用。这和前人的研究结果一致[16]。
从图6-A还可以看出,通过补糖,不但延长了枯草芽孢杆菌的对数生长期,而且显著提高了菌体量。菌体量在第32 h达到 3.09 g/L,比对照组提高了19.2%。酶产量在28 h达到最高值(图6-B),为2 046.47 IU/mL,比分批培养纳豆激酶的产量提高了29.77%。这些结果进一步表明,分批补糖发酵是提高酶产量的有效方法。
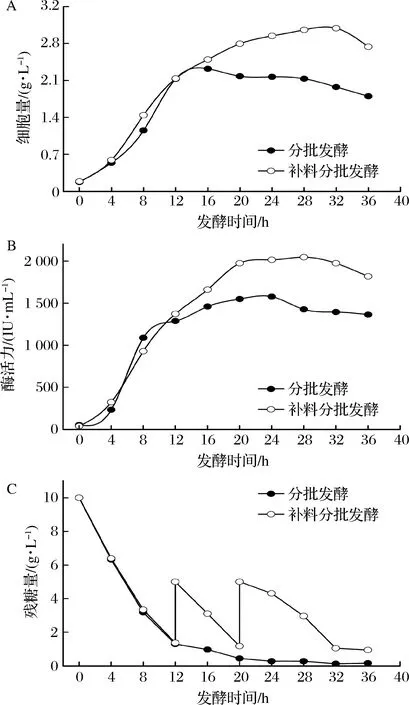
图6 葡萄糖分批补料培养对细胞生长和NK产量的影响Fig.6 Effect of glucose fed-batch on cell growth and NK production
3 结论
本研究通过考察不同碳源和氮源对纳豆激酶发酵的影响,得到适合纳豆激酶生产的碳源和氮源分别为10 g/L葡萄糖和30 g/L大豆蛋白胨。进一步通过分批补糖策略,纳豆激酶在摇瓶中的最高产量达到1 437.34 IU/mL,比分批培养提高了21.38%。最后,将该策略在7.5 L发酵罐中进行放大实验,获得最高的纳豆激酶产量为2 046.47 IU/mL,比分批培养提高了29.77%,验证了补糖策略是一种实现纳豆激酶高产的有效方法。研究结果表明,该策略具有一定的可行性和可操作性,可为纳豆激酶的放大生产和应用提供良好的借鉴作用。
[1] SUMI H, HAMADA H, TSUSHIMA H, et al. A novel fibrinolytic enzyme (nattokinase) in the vegetable cheese Natto; a typical and popular soybean food in the Japanese diet [J]. Experientia, 1987, 43(10): 1 110-1 111.
[2] YATAGAI C, MARUYAMA M, KAWAHARA T, et al. Nattokinase-promoted tissue plasminogen activator release from human cells [J]. Pathophysiology of Haemostasis and Thrombosis, 2007, 36(5): 227-232.
[3] KUMADA K, ONGA T, HOSHINO H, et al. The effect of natto possessing a high fibrinolytic activity in human plasma [J]. Igaku to Seibutsugaku, 1994, 128(3): 117-119.
[4] URANO T, IHARA H, UMEMURA K, et al. The profibrinolytic enzyme subtilisin NAT purified fromBacillussubtilisCleaves and inactivates plasminogen activator inhibitor type1 [J]. Journal of Biological Chemistry, 2001, 276(27): 24 690-24 696.
[5] PENG Yong, YANG Xiao-juan, ZHANG Yi-zheng. Microbial fibrinoiytic enzymes: an overview of source, production, properties, and thrombolytic activity in vivo [J]. Applied Microbiology and Biotechnology, 2005, 69(2): 126-132.
[6] CAI Dong-bo, ZHU Cheng-jun, CHEN Shou-wen. Microbial production of nattokinase: current progress, challengeand prospect [J]. World Journal of Microbiology and Biotechnology, 2017, 33(5): 84.
[7] BERENJIAN A, MAHANAMA R, KAVABAGH J, et al. Nattokinase production: Medium components and feeding strategy studies [J]. Chemical Industry and Chemical Engineering Quarterly, 2014, 20(4): 541-547.
[8] 祝亚娇, 宋嘉宾, 陈杨阳, 等. 地衣芽胞杆菌工程菌高产纳豆激酶的发酵罐工艺优化及中试放大[J]. 食品与发酵工业, 2016, 42(1): 37-41.
[9] LIU Jun-guo, XING Jian-min, CHANG Tian-shi, et al. Optimization of nutritional conditions for nattokinase production byBacillusnattoNLSSE using statistical experimental methods [J]. Process Biochemistry, 2005, 40(8): 2 757-2 762.
[10] 谢秋玲. 纳豆激酶液体发酵的条件优化及其调控的研究 [D]. 广州: 华南理工大学, 1999.
[11] 杨庆胜, 闫玉洁, 马洋, 等.BacillusmucilaginosusSM-01补料分批发酵产胞外多糖[J]. 食品与发酵工业, 2015, 41(6): 20-23.
[12] 刘会洲, 魏雪团, 罗明芳, 等. 一种枯草芽孢杆菌LSSE-22及其应用: 1030243040[P]. 2012-02-13.
[13] DUBOIS M, GULLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356.
[14] ASTRUP T, MÜLLERTZ S. The fibrin plate method for estimating fibrinolytic activity [J]. Archives of Biochemistry and Biophysics, 1952, 40(2): 346-351.
[15] 朱健辉,杜连祥,路福平,等.高产纳豆激酶液态发酵工艺的优化[J]. 工业微生物, 2007, 37(1):20-24.
[16] CHO Y H, SONG J Y, KIM K M, et al. Production of nattokinase by batch and fed-batch culture ofBacillussubtilis[J]. New Biotechnology, 2010, 27(4): 341-346.
