分子印迹聚合物在真菌毒素检测中的应用
2018-02-28柴银皎李响敏熊勇华马尉蔡小霞苑静郭亮
柴银皎,李响敏,熊勇华,马尉,蔡小霞,苑静,郭亮*
1(南昌大学 食品科学与技术国家重点实验室,江西 南昌, 330047)2(南昌大学中德联合研究院,江西 南昌, 330047)
分子印迹技术(molecularly imprinted technology,MIT)又称分子模板技术或分子钥匙技术,是指以目标分子或其结构类似物(虚拟模板)为模板分子,由模板分子经共价或非共价键与功能单体预组装后通过聚合反应在模板分子周围形成高度交联的三维网状聚合物的技术。通过该技术制备的产物称为分子印迹聚合物(molecularly imprinted polymers,MIPs)。当模板分子去除后,其内部留有与模板分子三维空间结构互补的空腔,且空腔内壁含可与模板分子结合的具有特定空间排布的一个或多个识别基团。因此,MIPs能在复杂样品基质中特异性识别并分离富集待测分子。
MIT具有三大显著特点。首先,分子印迹技术是以目标为导向的技术,可根据不同需求制备MIPs;其次,MIPs具有与天然生物分子识别系统,如酶与底物、抗原与抗体、受体与激素类似的亲和性及选择性,可高效专一地吸附目标物;最后,与天然分子识别系统不同,MIPs理化性质稳定,能在各种复杂环境中应用,且兼具重复使用率高及易储存等优点。基于构效可设计性、专一识别性和高稳定性等特点,MIPs被广泛应用于固相萃取、色谱分离,尤其是仿生传感器等领域[1]。据统计,从1993年开始,相关研究呈指数型增长。
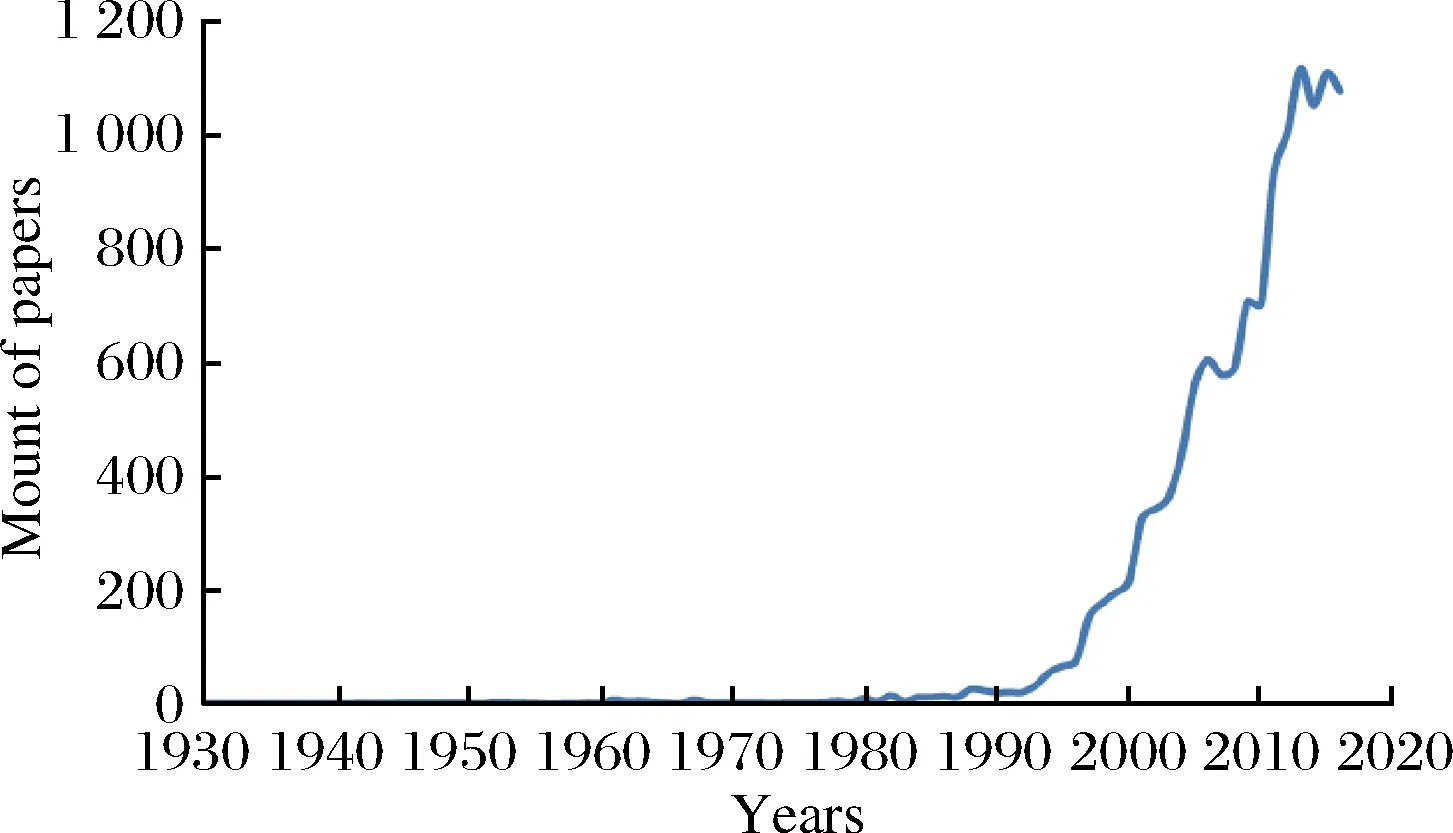
图1 SMI 提供的历年分子印迹相关论文发表情况[1]Fig.1 Situation of paper publishment of molecular imprinting over the years from SMI[1]
真菌毒素(mycotoxins)是由部分丝状真菌在适宜环境中产生的有广泛毒性的次级代谢产物[2],目前已知约有300余种。其毒性主要包括三致作用及免疫抑制作用,对肝、肾和生殖系统均可造成损害[3-4]。真菌毒素广泛污染农作物、农产品及发酵食品,痕量真菌毒素通过食物链进入人体即可严重危害人类健康。因此,建立灵敏、简便、稳定性好的食品基质中真菌毒素的检测方法已成为预防真菌毒素中毒、维护食品安全的迫切需要。
常用的真菌毒素检测方法有快速筛检法和仪器确证法[5-7]。其中快速筛检法主要包括基于抗原抗体识别的酶联免疫吸附法、生物传感技术及蛋白芯片技术。仪器确证法则以色谱法为主,包括液/气相色谱法、液/气相色谱-质谱联用法(LC/GC-MS)及薄层色谱法等。上述检测方法虽已被广泛使用,但仍存在一些有待解决的问题。如色谱法检测时间长且分离物极性相差较小时分离效果差;免疫学检测法虽能对待检物进行高效且灵敏的大规模筛选,但其使用的真菌毒素全抗原和抗体均为生物材料,对外界环境敏感,因此限制了该方法的应用。真菌毒素MIPs因其高结合特异性和高稳定性等特点,运用于固相萃取可取代传统的免疫亲和柱(immunoaffinity column,IAC),在实现特异性净化富集的同时,降低样品前处理成本和对前处理操作条件的要求;作为色谱固定相应用于高效液相色谱(HPLC)检测,可提高色谱分离效果;而以MIPs替代抗体作为识别元件的仿生传感器,则兼具稳定、灵敏及可重复使用等特点,可实现真菌毒素的快速定量检测。本文将对近年来MIPs在真菌毒素样品前处理、色谱分析、真菌毒素仿生传感器等领域的应用进展以及相关MIPs制备方法分别进行介绍,以期为相关科研工作者及基层工作人员提供一定的理论参考依据。
1 MIPs在真菌毒素样品前处理中的应用
样品中真菌毒素含量通常很低,且样品基质可干扰检测,因此选择恰当的样品前处理技术对真菌毒素的净化富集至关重要。最先被广泛使用的样品前处理技术是液液萃取技术,但其特异性差,且需要使用大量的有机试剂,操作复杂,耗时长。为提高特异性,真菌毒素常使用IAC净化富集。然而IAC价格昂贵且吸附性能易受有机溶剂、酸碱度及温度等因素影响。

表1 MIPs在样品前处理中的应用
注:一,表示文献中未报道;*,表示方法检出限、定量限;#,表示样品检出限、定量限。表2与此相同。
目前,固相萃取(solid-phase extraction,SPE)技术是最为常用的样品前处理技术。与液液萃取相比,SPE具有富集倍数高、适用范围广、试剂用量少、易于实现自动化等优点;与IAC法相比,SPE具有成本低、稳定性好等优点。但是传统SPE是利用分析物和吸附剂之间的非特异性相互作用吸附目标物,所以当应用于复杂基质时常发生共萃的现象[8]。1994年SELLERGREN[9]首次将分子印迹材料应用于SPE,奠定了分子印迹-固相萃取技术(molecularly imprinted-solid phase exaction,MISPE)发展的基础。该方法兼具常规SPE法和IAC法的优点,可从复杂的生物或环境样品体系中简便地特异性吸附目标分子,提高分析检测的精密度和准确性,因此近年来被广泛应用(见表1)。
1.1 分子印迹固相萃取柱法(molecularly imprinted solid phase extraction,MISPE)
分子印迹固相萃取柱法是将MIPs填装至柱管内进行固相萃取的方法。根据操作方式不同,MISPE可分为离线型分子印迹固相萃取柱法 (off-line MISPE)和在线型分子印迹固相萃取柱法(on-line MISPE )。
1.1.1 离线型分子印迹固相萃取柱法
目前MISPE柱法多基于离线模式。离线型分子印迹-固相萃取装置主要由固相萃取小柱(柱管、垫片、填料)和辅件(真空泵和进样器)构成。该装置仅为后续检测分析提供样品,样品前处理与分析过程分开独立进行。因此,洗脱溶剂的pH值和组成等不需要和检测仪器相匹配,利于MISPE吸附及洗脱条件的优化。
CAO等[10]利用商品化赭曲霉毒素A(ochratoxin A,OTA)MISPE柱建立了分子印迹固相萃取-超高效液相色谱-荧光检测器联用系统(MISPE-UPLC-FLD)用于检测生姜样品中的OTA。该方法检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)分别为0.09、0.30 ng/mL。MISPE柱法阴性生姜样品加标回收率为88%~95%,与IAC法检测结果相近,但是,MISPE柱重复使用41次后回收率仍大于80%,具有极佳的稳定性及可重复使用性。此后该课题组[11]利用相同检测系统,进一步建立了啤酒、红酒、葡萄汁样品中OTA的净化富集、分离检测方法。其LOQ和LOD分别为0.08、0.025 ng/mL。加标回收实验表明,在啤酒、红酒、葡萄汁中加标质量浓度为0.1 ng/mL时,回收率可达94%~100%,RSD为1.8%~4.1%。BRYA等[12]亦使用商品化的AFFINIMIP FumoZON MISPE柱分离富集玉米面、小麦产品中的伏马菌素B1、B2、B3(fumonisin B1、B2、B3,FB1、FB2、FB3),并与LC-MS联用进行定量分析,LOD满足欧盟要求。此外,PRELLE等[13]从加标回收率、重现性、LOD、LOQ四个方面比较了几种商品化萃取柱(IAC、MIP柱、MycosepTM229、 MycospinTM和OasisTMHLB)对不同样品中OTA的吸附性能。结果表明,对于咖啡中的OTA,MIP柱具有比其他萃取柱更高的加标回收率和更低的LOD和LOQ。但是IAC或MycosepTM229分别更适合红酒、啤酒或辣椒中OTA的净化富集。因此作者认为,需要进一步研究确认何种基质成分及净化条件会干扰MIP柱对OTA的吸附,且针对不同样品应该选择不同的商品化SPE柱。
使用商品化MISPE柱虽然方便,但由于市售种类较少,目前研究人员大多根据需要自行制备。MISPE柱经典制备方法是本体聚合法。大致过程是先将单体、模板分子、交联剂和致孔剂混合物经除氧密封后,通过光、热或引发剂引发聚合得到块状MIP聚合物,再将块状聚合物研磨、粉碎、过筛得到所需粒径大小的MIPs颗粒后装柱。整个制备过程操作简单,无需复杂仪器且成本较低。传统MIPs制备方法常以待测物为模板分子,但是因为真菌毒素毒性大、价格昂贵且残留在MIPs内部的真菌毒素可造成假阳性检测结果,所以一般以真菌毒素结构类似物作为虚拟模板来合成真菌毒素MIPs。GIOVANNOLI等[14]采用本体聚合法,以N-(4-氯-1-羟基-2-萘甲酰氨基)-L-苯丙氨酸为虚拟模板[15],甲基丙烯酸为功能单体制备得到OTA本体MIPs。以其作为SPE柱填料用于意大利不同地区17种红酒中OTA的浓缩富集,通过HPLC 检测,加标回收率为88%~102%,LOD和LOQ分别为0.075、0.225 ng/mL。与IAC法相比,两种前处理方法检测结果显示出良好的一致性(r2=0.981 7),表明MISPE柱可替代IAC。APPELL等[16]亦通过本体聚合法,以吡啶甲酸为虚拟模板制备得到镰刀菌酸(fusaric acid,FA)MIPs。以其作为吸附剂富集玉米提取液中的FA,加标回收率为84%~92%。
由于一种食品可被多种真菌毒素同时污染,因此若MISPE能同时特异性富集多种真菌毒素,则可简化前处理过程,实现多种真菌毒素同时、快速检测。BAYRAM等[17]以黄曲霉毒素B1、B2、G1、G2(AFB1、AFB2、AFG1、AFG2)4种主要的黄曲霉毒素(aflatoxin,AF)混合物为模板采用本体聚合法制备了多功能MISPE柱。在加标回收实验及榛子、花生、干无花果、红辣椒等实际样品检测中,多功能MISPE柱与商品化一次性IAC(AflaPrep)具有相似的加标回收率。重复使用多功能MISPE柱10次,4种AF回收率的RSD为4.1%~5.6%,说明该柱具有良好的稳定性,可多次重复使用。
除本体聚合法外,牺牲硅胶骨架法及微乳法亦被用于真菌毒素MIPs的制备。这2种合成方法可直接制备MIPs颗粒,无需碾磨、筛分等步骤。牺牲硅胶骨架法是将预聚体在具有孔隙的硅胶中聚合,在印迹完成后,硅胶作为牺牲材料(sacrificial material)用氢氟酸溶解除去,由此制备的MIPs具有更大的孔体积和比表面积,吸附效果更佳。RAHMA[18]等采用牺牲硅胶骨架法首次制得交链孢酚(alternariol,AOH)MIPs。作者首先合成了4种AOH结构类似物作为虚拟模板,然后利用组合筛选法从4种虚拟模板、8种功能单体中挑选出特异性吸附量最佳的组合,最后通过牺牲硅胶骨架法制备MIPs并作为MISPE柱填料用于西红柿中AOH的富集。通过HPLC-FLD检测分析,AOH的加标回收率为81%~103%,RSD<4%,而非分子印迹聚合物(nonmolecularly imprinted polymers,NIPs)加标回收率低于10%。WEI等[19]采用微乳法,将司盘80/CTAB水溶液和AFB1/MAA/EGDMA的氯仿溶液混合后经超声形成微乳液,再加入AIBN通过热聚合得到AF分子印迹微球。微球装柱后用于富集花生油、啤酒及饲料样品中的AFM1和AFB1,其加标回收率与市售IAC相近。
上述Off-line MISPE均为与HPLC-检测器联用进行检测,需要经过HPLC分离步骤。若在保证检测灵敏度足够高的前提下,能省略HPLC步骤,将Off-line MISPE直接与检测器联用,则可缩短检测时间并减少大型设备的使用,利于现场快速检测。MISHRA等[20]首次将MISPE与竞争适配子传感器联用,通过差分脉冲伏安法(differential pulse voltammetry,DPV)检测可可豆中的OTA。检测时,经MISPE富集得到的OTA直接与生物素化OTA竞争结合电极表面的OTA适配子,再加入亲和素修饰的碱性磷酸酶及其底物进行酶催化反应。通过测定电极上氧化电流的变化对OTA进行定量检测,其LOD为0.07 ng/mL。将等质量浓度(2.5 ng/mL)的赭曲霉毒素B(ochratoxin B,OTB)与生物素化OTA混合进行竞争吸附,所得信号响应值与仅添加生物素化OTA时一致,表明该传感器具有良好的特异性。此外,BUENO等[21]利用OTA可产生荧光的特性,开发了一种低成本的便携式荧光设备用于现场检测可可豆中的OTA。该设备由发光二极管(light emitting diode,LED)和用来获得传感分子图像的色互补金属氧化物半导体微相机组成。与商品化荧光发光检测仪(Thermo Scientific Fluoroskan Ascent FL)相比,在检测相同浓度的OTA时,该新型荧光设备具有更强的荧光响应信号。实际样品检测时,样品中的OTA由商品化OTA-MIP柱净化富集后可不经HPLC分离直接利用该荧光设备进行快速定量检测,检测耗时50 min,LOD为1.25 ng/g,检测结果与HPLC-FLD方法一致。
值得指出的是,自2001年PILETSKY等[22]将计算机模拟技术应用MIPs制备以来,计算机模拟技术在MIPs制备过程中发挥着越来越大的作用。通常在MIPs合成时,对功能单体的选择、模板与功能单体比例等合成条件的优化主要依赖人工筛选。而利用计算机模拟进行定量计算和辅助设计使得单体选择和实验设计更加快速、合理,大大减少了盲目性。ZHAO等[23]使用HYPERCHEM软件成功分析并确定了包括功能单体、溶剂种类以及模板与单体用量等最佳MIP合成条件。按该条件制备的MIPs装柱后用于富集苹果汁中的展青霉素(patulin,PAT),与液液萃取方法相比,该MISPE柱具有更大的加标回收率。
1.1.2 在线型分子印迹固相萃取柱法
On-line MISPE的净化富集原理与off-line MISPE一致,差别仅在于洗脱时用液相系统的流动相作为洗脱溶剂将待测物从MISPE柱上解析下来并直接进入色谱柱进行分离。由于富集净化产物直接进入检测仪器,因此可缩短样品处理时间,避免分步处理造成分析物损失,减少人工操作误差,从而提高分析的精确度和精密度。VIDAL等[24]通过本体聚合法制备OTA-MIP作为MISPE吸附剂,采用on-line MISPE模式检测小麦样品中的OTA,加标回收率为84%~102%,LOD为1.2 ng/mL,低于欧盟规定的未加工谷类粮食中OTA的限量标准(5.0 ng/g)。YANG等[25]则采用表面分子印迹技术,通过溶胶-凝胶法在硅球表面聚合制备了PAT核壳型分子印迹微球并建立了On-line MISPE HPLC-UV检测方法,方法检出限为0.5 ng/mL。
1.2 分子印迹微固相萃取(molecularly imprinted-Micro solid phase extraction,MI-μSPE)
MI-μSPE是将MIPs吸附剂包裹在多孔聚丙烯薄膜袋内,然后将其加至样品溶液中在搅拌辅助下萃取目标物的样品前处理方法。该方法具有无需装柱,有机溶剂用量少,且聚丙烯薄膜作为滤膜可消除部分基质干扰等优点。LEE等[26]将OTA-MIP包裹在聚丙烯薄膜中建立了MI-μSPE-HPLC-FLD检测体系。采用该方法对咖啡、葡萄汁、尿液样品中OTA进行检测,LOD分别为0.06、0.02、0.02 ng/mL。新方法检测结果与使用商品化IAC前处理的检测结果无显著性差异,且MI-μSPE萃取袋反复使用15次后吸附性能不变。
1.3 磁分子印迹固相萃取(magnetic molecularly imprinted solid-phase extraction,m-MISPE)
磁分子印迹固相萃取是指在磁性材料表面聚合形成分子印迹层作为吸附剂应用于固相萃取的方法。这种在载体表面印迹聚合的方法称为表面分子印迹技术。表面分子印迹聚合物更易接近待测物的识别位点和具有更大的比表面积,故吸附/洗脱效率更高且不易出现“模板泄漏”现象。而当以纳米磁性粒子作为载体时,比表面积比使用微米级载体更大,且通过外加磁场即可简便、快速回收,可进一步提高吸附效率、简化前处理流程并减少耗时。URRACA等[27]以2-奈甲酸为虚拟模板,N-3, 5-双(三氟甲基)苯基-N′-4-乙烯基苯基脲和甲基丙烯酰胺为功能单体,在Fe3O4磁性纳米粒子表面印迹聚合制备得到橘霉素(citrinin,CIT)磁性表面分子印迹聚合物。以其为吸附剂进行固相萃取并与HPLC-UV联用检测大米中的CIT,回收率为94%~98% ,RSD<3.4%且该吸附剂重复使用30次性能无明显降低。
1.4 分子印迹搅拌棒吸附萃取(stir bar sorption extraction,SBSE)
SBSE具有萃取容量高、无需外加搅拌子、可避免竞争性吸附等优点。但是SBSE使用的磁性搅拌子的表面萃取相多为聚二甲基硅氧烷,吸附选择性低,难以满足复杂基质中痕量物质的分析要求。采用MIPs涂层可对待测分子特异性富集,能消除复杂基质对检测的干扰。磁性分子印迹搅拌棒(magnetic molecularly imprinted-stirring bar,MMIP-SB)的制备一般是在磁力搅拌子的表面聚合MIPs涂层或在其周围本体聚合形成整体柱搅样棒。DIAZ-BAO等[28]建立了一种简便、快速的分子印迹整体柱搅拌棒制备方法,即在MIPs本体聚合体系中直接添加Fe3O4粒子后再进行聚合,无需使用现成的搅拌子。将按该方法制备的AFM1-MMIP-SB用于萃取婴幼儿配方奶粉中的AFM1和婴儿谷物食品中的AFB1、B2、G1、G2,与液质联用检测的LOD分别为0.3×10-3、0.9×10-3、0.7×10-3、1.0×10-3和1.7×10-3ng/g。
2 在液相色谱固定相中的应用
色谱分离过程的本质是待分离物质在固定相和流动相之间分配平衡的过程。传统液相色谱柱一般利用待检物、干扰物与固定相间的极性、疏水或静电相互作用进行分离。因此当被分离物极性相差很小时分离效果不好。1977年,WULFF[29]首次将MIPs作为色谱固定相用于手性物质的分离。由于可特异性结合目标物,以MIPs作为分离介质的色谱柱对结构差异很小的类似物仍有极佳的分离效果。通常,MIPs以填充物或整体柱材料的形式作为色谱固定相应用于高效液相色谱、毛细管液相色谱分析中。与填充柱相比,整体柱多以原位聚合法制备,无装柱过程,制备相对简单。SZUMSKI等[30]采用WYSZOMIRSKI[31]以计算机模拟技术确定的虚拟模板和功能单体,通过原位紫外光聚合法成功制备AF毛细管分子印迹整体柱,并分别从流体动力学和色谱特性2个方面对其进行了评价。将其应用于在线色谱分离,该MIP整体柱表现出良好的渗透性,AFB1的印迹因子为2.21,AFB1与虚拟模板5,7-二甲氧基香豆素(DMC)的相对印迹因子为0.68,可很好地分离水溶液中的AFB1、AFB2、AFG1、AFG2和DMC。
3 在真菌毒素仿生传感器中的应用
以MIPs为识别元件的传感器称为分子印迹传感器(molecularly imprinted sensor)。分子印迹传感器不仅可特异性识别、吸附目标分子,实现快速、微量分析,还具有生物传感器无法比拟的耐高温、高压、有机溶剂、酸、碱和能够多次重复使用等优点。因此,近年来分子印迹传感器发展迅速(表2)。根据检测原理不同,分子印迹传感器可分为电化学型传感器、光学型传感器和压电型传感器。
3.1 电化学型传感器
分子印迹电化学传感器(molecularly imprinted electrochemical sensing,MIECS)是现今应用最广泛、发展最成熟的一类分子印迹传感器。根据响应信号的不同,可分为电流型、电位型、电导型、电容型、场效应晶体管型等。其中以电流型传感器研究最为深入,其原理是依据分子印迹聚合物选择性识别目标分子前后的电流信号变化来分析待检物。电流型传感器可以对电活性物质进行直接检测。检测时,电活性待测物被吸附至电极表面上MIP层的印迹孔穴内并发生得失电子反应,由此产生与待检物浓度成线性关系的电流信号。然而大多数真菌毒素不是电活性物质,因此通常需要外加铁氰化钾等电活性材料作为信号探针进行检测。真菌毒素则通过影响铁氰化钾的氧化还原反应改变传感器产生的峰电流。

表2 MIPs在真菌毒素仿生传感器中的应用
与传统传感器相比,基于纳米材料修饰的电化学传感器具有更高的灵敏度和更快的检测速度。例如贵金属纳米颗粒具有极佳的比表面积,活性位点多,具备优良的电催化活性;而碳纳米材料如石墨烯和碳纳米管亦具有超大的比表面积及良好的导电性。因此,用贵金属纳米粒子负载型碳纳米管或石墨烯修饰电极可显著加快电化学反应速率,并提高分子印迹电流型传感器的检测灵敏度[32-33]。ATAR等[34]设计了一种新颖的电流型分子印迹传感器并利用DPV检测黑麦样品中的CIT。该传感器将修饰有多金属氧酸盐(H3PW12O40,POM)和铂纳米粒子(PtNPs)的还原氧化石墨烯(rGO)滴加在玻璃碳电极(glassy carbon electrode,GCE)表面,然后以电聚合法在电极(PtNPs/POM/rGO/GCE)表面进行印迹得到CIT分子印迹电流型传感器。该传感器的输出信号为电荷转移电阻(Rct)。当样品中无CIT时,Rct值低;一旦吸附CIT,由于CIT可阻碍K3[Fe(CN)6]发生电化学反应使得Rct增加。由于结合了POM、PtNPs和rGO三者的电催化活性高及比表面积巨大等优势,该传感器具有极高的检测灵敏度,其LOD为5.0×10-5ng/mL。此外该传感器还具有良好的选择性,与OTA、OTB、AF及洛伐他汀的相对选择系数分别为10、10、15和11。同年12月,该课题组将上述CIT传感器中的铂纳米粒子改换成银纳米粒子,以同样的合成方法制备得到OTA分子印迹电流型传感器,方法检出限为6.4×10-3ng/mL[35]。将该传感器放置30 d后,其信号值仍高达最初值的95.7%,具有良好的稳定性。
双金属复合纳米材料由于两种金属成分间的正协同作用,具有比单一组分材料更佳的电催化活性和电子转移效率。因此,将双金属纳米材料与碳纳米材料联用修饰电极可进一步提高传感器的检测灵敏度。WANG等[36]通过多步修饰法先将多壁碳纳米管(multiwalled carbon nanotubes,MCNTs)包裹在GCE表面,再在MCNTs上原位修饰Au/Pt双金属纳米粒子,最后以邻苯二胺为功能单体通过电聚合在Au/PtNPs-MCNTs-GCE表面制备AFB1分子印迹膜得到AFB1电化学传感器。该传感器的LOD为9.0×10-3ng/mL,且储存4周后,峰电流值仅下降3.1%。使用该传感器检测地沟油和菜籽油中的AFB1,回收率达到96%~111%,RSD为2.3%~4.7%。此外,地沟油中常见的硬脂酸、亚麻油酸、苯并芘、胆固醇及芥酸等成分几乎不影响检测。
金属-有机骨架材料(metal-organic frameworks,MOFs)是过渡金属离子或金属簇与有机配体通过自组装形成的具有周期性网络结构的晶体多孔材料,具有孔隙率高、比表面积大、孔道规则、孔径可调等优点。因此,MOFs在分析化学领域,如样品前处理、色谱固定相及传感器中均显示出良好的应用潜力。JIANG等[37]将金纳米粒子与对氨基苯硫酚通过电聚合在金电极表面形成MIP-MOF膜制备得到基于金属有机骨架的AFB1分子印迹电化学传感器。该传感器制备方法简单,却具有极高的灵敏度,LOD为3.0×10-7ng/mL,远低于其他AFB1传感器。同时该传感器亦显示出极佳的选择性,产生相同的信号响应值时AFB2、AFG1和OTA所需浓度分别是AFB1浓度的109、109和107倍。此外,其印迹因数达10,说明印迹效果极佳。该传感器的上述优良特性表明,这种制备方法简单的MOFs传感器具有很好的应用前景。
3.2 光学型传感器
光学型分子印迹传感器主要包括化学发光、荧光、表面等离子共振3种类型。
3.2.1 化学发光传感器(chemiluminescence sensor,CL sensor)

3.2.2 荧光传感器(fluorescence sensors)
MIP荧光传感器检测分为两类:直接荧光检测和间接荧光检测。直接荧光检测法要求待检物自身可产生强烈的荧光。由于真菌毒素荧光较弱,采用直接荧光检测法灵敏度较低,因此真菌毒素一般采用间接荧光检测法检测。间接荧光检测法是在检测体系中引入强荧光物质,利用待测物对荧光物质的荧光增强或淬灭效应进行检测。引入强荧光物质的方式通常有以下两种。第1种方法是在制备MIPs过程中使用荧光功能单体代替非荧光功能单体,如芘衍生物、1,8-萘内酰亚胺染料等。TON等[40]以荧光单体N-(2-(6-(4-甲基哌嗪-1-基)-1, 3-二氧代-1H-苯并[de]异喹啉-2(3H)-基-乙基)丙烯酰胺(FIM)和非荧光单体4-乙烯基吡啶(4-VPY)为共功能单体合成CIT分子印迹微球后将其覆盖在聚丙乙烯纤维上建立了CIT-MIP荧光传感器。FIM是基于萘二甲酰亚胺的荧光单体,当其与含羧基的分子结合时荧光可发生显著增强。因此,该传感器荧光强度与样品中CIT(含有羧基)浓度成正比。需要指出的是,虽然CIT自身产荧光,但其只占总荧光强度的2%。这种基于FIM的MIP荧光传感器设计思路亦可用于其他含羧基的弱荧光或非荧光待测物的检测。第2种方法是在MIPs内掺杂荧光物质,如量子点。FANG等[41]在CdSe/ZnS量子点表面印迹聚合得到分子印迹荧光材料(MIOM)用以检测谷类样品中的玉米赤霉烯酮(zearalenone,ZEN)。由于ZEN的紫外吸收与MIOM的带隙相近,MIOM导带里的电荷能够转移到ZEN最低的空分子轨道中,因此MIOM与ZEN结合可导致荧光猝灭。该传感器的方法检出限为0.64 ng/mL,应用于玉米、大米、小麦粉中ZEN的检测时加标回收率大于84%。但是这类MIP@QD型传感器中的QDs被包裹在MIPs内部,荧光被部分屏蔽,从而影响其检测灵敏度。
3.2.3 表面等离子共振传感器(surface plasmon resonance sensor,SPR sensor)
表面等离子共振法是一种基于传感器表面折光率变化的微量分析物光学检测方法。该方法无需标记,可方便快捷检测浑浊样品中的待检物。CHOI等[42]通过电聚合法在金膜表面聚合厚约5~6 nm的脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)分子印迹膜,制备得到DON分子印迹表面等离子共振传感器,其检测线性范围为0.1~100 ng/mL。此外,DON的2种乙酰化结构类似物所致SPR共振角变化值分别是DON的19%、44%,说明传感器具有较好的选择性。目前大多数MIP传感器的制备是直接在传感器或经修饰后的传感器表面聚合形成MIPs,可能出现印迹位点包埋过深及分布不规则等缺陷,进而影响SPR传感器的检测灵敏度。因此,ATAR等[43]提出先配制分子印迹反应体系,再通过旋涂法在金表面形成薄且均匀的液膜,然后再引发聚合制备MIPs印迹层。用原子力显微镜表征以该方法制备的CIT-MIP SPR传感器,MIP层厚度为(25.33±1.60) nm。在实际样品加标检测中,其LOD和LOQ分别为1.7×10-3ng/mL、5.0×10-3ng/mL,回收率达98%~101%。
3.3 压电型传感器
压电型传感器是一类以重量为信号的传感器。其中石英晶体微天平(quartz crystal microbalance,QCM)因为简单、成本低、尺寸小且灵敏度高[44]应用最为广泛,较适合用于建立分子印迹压电型传感器。FANG等[45]制备了一种新型的3D分子印迹石英晶体微天平用于检测谷类粮食中的痕量CIT。其制备过程是先将掺杂Au纳米粒子(AuNPs)的介孔碳(CMK-3)固定在石英晶体Au电极(Au electrode,AuE)上,然后在AuNPs@CMK-3/AuE表面以电聚合法制备MIP层。该传感器灵敏度高(LOD 0.45 ng/mL)、重现性好(RSD 4.3%)。且室温放置2周和1个月后,其信号值仍有最初的94%和86%,具有良好的稳定性。
4 拟ELISA检测(pseudo-ELISA)
PILETSKY[46]以MIPs纳米粒子(nano MIPs)替代抗体采用ELISA模式实现了对大分子及小分子物质的检测。与其他基于MIPs的pseudo-ELISA不同的是,PILETSKY没有采用在96孔板中原位合成MIPs的方式,从而避免了孔间平行性差、模板分子不易洗脱及聚合体系成分与板材不相容等问题。由于ELISA法应用非常广泛,而pseudo-ELISA无需增添新型检测设备,因此具有极佳的应用前景。Nano MIPs采用固相合成方法制备(Solid-phase synthesis)[47],即先将模板分子共价连接至固相支持物表面后再进行印迹聚合,然后经装柱、洗涤去除弱结合nano MIPs及NIPs,最终通过加热分离模板分子得到高亲和力的nano MIPs。固相合成方法制备的nano MIPs印迹位点位于颗粒表面,固相支持物-模板分子复合物可重复使用,且整个制备过程仅耗时1周,远低于抗体制备所需时间。该课题组的SMOLINSKA-KEMPISTY[48]将FB2固定在氨基化玻璃珠的表面,以N-(3-氨基丙基)甲基丙烯酰胺为单体在水相中聚合得到粒径为(93.6±3.9)nm的nano MIPs。然后用nano MIPs包被Nunclon 96孔板,采用竞争ELISA模式检测FB2。与基于抗体的ELISA方法相比,pseudo-ELISA方法具有更低的LOD(4.4×10-3ng/mL)和更宽的线性范围(1~104pmol/L)。
5 结语
综上所述,MIPs以吸附剂、色谱固定相及传感器识别元件等形式已被广泛应用于食品样品中真菌毒素的检测。在实现待测物的特异性富集净化、待测物与干扰物的高效分离以及提高传感器灵敏度的同时,大大提高了相关材料或装置的稳定性和重复使用性,降低了检测成本。但是,目前MIPs在真菌毒素检测中的应用仍有较大的局限性,且面临诸多问题和挑战。例如在真菌毒素样品前处理中,使用的MIPs大多采用本体聚合法合成,很少有纳米MIPs材料及表面MIPs材料的应用;未见针对水溶性真菌毒素的水相容性分子印迹材料合成及应用;吸附效率高且操作简单的m-MISPE和on-line MISPE应用少。因此,在真菌毒素MIPs吸附剂的合成中应加强纳米分子印迹材料及表面分子印迹技术的应用,尤其是基于(磁性)纳米材料的表面分子印迹;加快研发水相容性MIPs,为建立水溶性真菌毒素的水相富集方法以及HPLC流动相含水的on-line MISPE方法奠定基础。此外,目前商业化MISPE柱和分子印迹色谱柱仍然较少,说明方法稳定且能大规模合成性能优良的MIPs的制备技术仍然十分欠缺。因此应进一步探索真菌毒素MIPs的制备方法,如设计新功能单体,采用多模板或多功能单体印迹技术,利用计算机模拟辅助合成,以及借鉴化学合成领域的新进展、新技术如固相合成、活性/可控自由基聚合、点击化学[49]等技术,以期获得吸附容量大、在复杂基质中选择性好、耐高压以及水相容性好的MIPs的新方法。在传感器设计方面,则应灵活应用表面化学及纳米技术,通过减小MIP壳层厚度、将纳米材料及多孔结构材料应用于MIPs层与电极表面之间的结构设计以及应用比率荧光法定量等方法进一步提高其灵敏度。
[1] http://mipdatabase.com/index.php#
[2] VIDAL J C, BONEL L, EZQUERRA A, et al. Electrochemical affinity biosensors for detection of mycotoxins: A review[J]. Biosensors and Bioelectronics, 2013, 49: 146-158.
[3] AFSAH-HEJRI L, JINAP S, HAJEB P, et al. A review on mycotoxins in food and feed: Malaysia case study[J]. Comprehensive Reviews in Food Science and Food Safety, 2013, 12(6): 629-651.
[4] MOK C H, SHIN S Y, KIM B G. Aflatoxin, deoxynivalenol, and zearalenone in swine diets: Predictions on growth performance[J]. Revista Colombiana de Ciencias Pecuarias, 2013, 26(4): 243-254.
[5] ROSEANU A, JECU L, BADEA M, et al. Mycotoxins: an overview on their quantification methods[J]. Rom J Biochem, 2010, 47(1): 79-86.
[6] MENEELY J P, RICCI F, VAN EGMOND H P, et al. Current methods of analysis for the determination of trichothecene mycotoxins in food[J]. TrAC Trends in Analytical Chemistry, 2011, 30(2): 192-203.
[7] RAN Ran, WANG Can-hua, HAN Zheng, et al. Determination of deoxynivalenol (DON) and its derivatives: current status of analytical methods[J].Food Control, 2013, 34(1): 138-148.
[8] SHAO S Q, DUNCAN A M, YANG R, et al. Systematic evaluation of pre-HPLC sample processing methods on total and individual isoflavones in soybeans and soy products[J]. Food Research International, 2011, 44(8): 2 425-2 434.
[9] SELLERGREN B. Direct drug determination by selective sample enrichment on an imprinted polymer[J]. Analytical Chemistry, 1994, 66(9): 1 578-1 582.
[10] CAO Ji-liang, ZHOU Shu-jun, KONG Wei-jun, et al. Molecularly imprinted polymer-based solid phase clean-up for analysis of ochratoxin A in ginger and LC-MS/MS confirmation[J]. Food Control, 2013, 33(2): 337-343.
[11] CAO Ji-liang, KONG Wei-jun, ZHOU Shu-jun, et al. Molecularly imprinted polymer-based solid phase clean-up for analysis of ochratoxin A in beer, red wine, and grape juice[J]. Journal of Separation Science, 2013, 36(7): 1 291-1 297.
[13] PRELLE A, SPADARO D, DENCA A, et al. Comparison of clean-up methods for ochratoxin A on wine, beer, roasted coffee and chili commercialized in Italy[J]. Toxins, 2013, 5(10): 1 827-1 844.
[14] GIOVANNOLI C, PASSINI C, NARDO F D, et al. Determination of ochratoxin A in Italian red wines by molecularly imprinted solid phase extraction and HPLC analysis[J]. Journal of Agricultural and Food Chemistry, 2014, 62(22): 5 220-5 225.
[15] BAGGIANI C, BIAGIOLI F, ANFOSSI L, et al. Effect of the mimic structure on the molecular recognition properties of molecularly imprinted polymers for ochratoxin A prepared by a fragmental approach[J]. Reactive and Functional Polymers, 2013, 73(6): 833-837.
[16] APPELL M, JACKSON M A, WANG L C, et al. Determination of fusaric acid in maize using molecularly imprinted SPE clean-up[J]. Journal of separation science, 2014, 37(3): 281-286.
[17] BAYRAM E, YILMAZ E, UZUN L, et al. Multiclonal plastic antibodies for selective aflatoxin extraction from food samples[J]. Food Chemistry, 2017, 221: 829-837.
[18] ABOU-HANY R A G, URRACA J L, DESCALZO A B, et al. Tailoring molecularly imprinted polymer beads for alternariol recognition and analysis by a screening with mycotoxin surrogates[J]. Journal of Chromatography A, 2015, 1 425: 231-239.
[19] WEI Shou-lian, LIU Yong, YAN Zi-jun, et al. Molecularly imprinted solid phase extraction coupled to high performance liquid chromatography for determination of aflatoxin M 1 and B 1 in foods and feeds[J]. RSC Advances, 2015, 5(27): 20 951-20 960.
[20] MISHRA R K, HAYAT A, CATANANTE G, et al. Sensitive quantitation of Ochratoxin A in cocoa beans using differential pulse voltammetry based aptasensor[J]. Food Chemistry, 2016, 192: 799-804.
[21] BUENO D, MISHRA R K, HAYAT A, et al. Portable and low cost fluorescence set-up for in-situ screening of Ochratoxin A[J]. Talanta, 2016, 159: 395-400.
[22] PILETSKY S A, KARIM K, PILETSKA E V, et al. Recognition of ephedrine enantiomers by molecularly imprinted polymers designed using a computational approachElectronic Supplementary Information available. See http://www. rsc. org/suppdata/an/b1/b102426b[J]. Analyst, 2001, 126(10): 1 826-1 830.
[23] ZHAO Da-yun, JIA Jing-fu, YU Xue-lei, et al. Preparation and characterization of a molecularly imprinted polymer by grafting on silica supports: a selective sorbent for patulin toxin[J]. Analytical and Bioanalytical Chemistry, 2011, 401(7): 2 259-2 273.
[24] VIDAL J C, DUATO P, BONEL L, et al. Molecularly imprinted on-line solid-phase extraction coupled with fluorescence detection for the determination of ochratoxin A in wheat samples[J]. Analytical Letters, 2012, 45(1): 51-62.
[25] YANG Yu-kun, LI Qian-qian, FANG Guo-zhen, et al. Preparation and evaluation of novel surface molecularly imprinted polymers by sol-gel process for online solid-phase extraction coupled with high performance liquid chromatography to detect trace patulin in fruit derived pro ducts[J]. RSC Advances, 2016, 6(59): 54 510-54 517.
[26] LEE T P, SAAD B, KHAYOON W S, et al. Molecularly imprinted polymer as sorbent in micro-solid phase extraction of ochratoxin A in coffee, grape juice and urine[J]. Talanta, 2012, 88: 129-135.
[27] URRACA J L, HUERTAS-PéREZ J F, CAZORLA G A, et al. Development of magnetic molecularly imprinted polymers for selective extraction: determination of citrinin in rice samples by liquid chromatography with UV diode array detection[J]. Analytical and Bioanalytical Chemistry, 2016, 408(11): 3 033-3 042.
[29] WULFF G, VESPER W, GROBE‐EINSLER R, et al. Enzyme-analogue built polymers, 4. On the synthesis of polymers containing chiral cavities and their use for the resolution of racemates[J]. Macromolecular Chemistry and Physics, 1977, 178(10): 2 799-2 816.
[30] SZUMSKI M, GRZYWINSKI D, PRUS W, et al. Monolithic molecularly imprinted polymeric capillary columns for isolation of aflatoxins[J]. Journal of Chromatography A, 2014, 1 364: 163-170.
[31] WYSZOMIRSKI M, PRUS W. Molecular modelling of a template substitute and monomers used in molecular imprinting for aflatoxin B1 micro-HPLC analysis[J]. Molecular Simulation, 2012, 38(11): 892-895.
[32] SANGHAVI B J, HIRSCH G, KARNA S P, et al. Potentiometric stripping analysis of methyl and ethyl parathion employing carbon nanoparticles and halloysite nanoclay modified carbon paste electrode[J]. Analytica Chimica Acta, 2012, 735: 37-45.
[33] ATAR N, EREN T, YOLA M L. Ultrahigh capacity anode material for lithium ion battery based on rod gold nanoparticles decorated reduced graphene oxide[J]. Thin Solid Films, 2015, 590: 156-162.
[34] ATAR N, YOLA M L, EREN T. Sensitive determination of citrinin based on molecular imprinted electrochemical sensor[J]. Applied Surface Science, 2016, 362: 315-322.
[35] YOLA M L, GUPTA V K, ATAR N. New molecular imprinted voltammetric sensor for determination of ochratoxin A[J]. Materials Science and Engineering: C, 2016, 61: 368-375.
[36] WANG Zhi-hua, LI Jin-shu, XU Li-juan, et al. Electrochemical sensor for determination of aflatoxin B1 based on multiwalled carbon nanotubes-supported Au/Pt bimetallic nanoparticles[J]. Journal of Solid State Electrochemistry, 2014, 18(9): 2 487-2 496.
[37] JIANG Meng-juan, BRAIEK M, FLOREA A, et al. Aflatoxin B1 detection using a highly-sensitive molecularly-imprinted electrochemical sensor based on an electropolymerized metal organic framework[J]. Toxins, 2015, 7(9): 3 540-3 553.
[38] WANG Qing-ling, CHEN Miao-miao, ZHANG Hai-qing, et al. Solid-state electrochemiluminescence sensor based on RuSi nanoparticles combined with molecularly imprinted polymer for the determination of ochratoxin A[J]. Sensors and Actuators B: Chemical, 2016, 222: 264-269.
[39] WANG Qing-ling, CHEN Miao-miao, ZHANG Hai-qing, et al. Enhanced electrochemiluminescence of RuSi nanoparticles for ultrasensitive detection of ochratoxin A by energy transfer with CdTe quantum dots[J]. Biosensors and Bioelectronics, 2016, 79: 561-567.
[40] TON X A, ACHA V, BONOMI P, et al. A disposable evanescent wave fiber optic sensor coated with a molecularly imprinted polymer as a selective fluorescence probe[J]. Biosensors and Bioelectronics, 2015, 64: 359-366.
[41] FANG Guo-zhen, FAN Chao, LIU Hui-lin, et al. A novel molecularly imprinted polymer on CdSe/ZnS quantum dots for highly selective optosensing of mycotoxin zearalenone in cereal samples[J]. RSC Advances, 2014, 4(6): 2 764-2 771.
[42] CHOI S W, CHANG H J, LEE N, et al. A surface plasmon resonance sensor for the detection of deoxynivalenol using a molecularly imprinted polymer[J]. Sensors, 2011, 11(9): 8 654-8 664.
[43] ATAR N, EREN T, YOLA M L. A molecular imprinted SPR biosensor for sensitive determination of citrinin in red yeast rice[J]. Food Chemistry, 2015, 184: 7-11.
[44] GUPTA V K, YOLA M L, ATAR N. A novel molecular imprinted nanosensor based quartz crystal microbalance for determination of kaempferol[J]. Sensors and Actuators:B. Chemical, 2014, 194: 79-85.
[45] FANG Guo-zhen, LIU Gui-yang, YANG Yu-kun, et al. Quartz crystal microbalance sensor based on molecularly imprinted polymer membrane and three-dimensional Au nanoparticles@ mesoporous carbon CMK-3 functional composite for ultrasensitive and specific determination of citrinin[J]. Sensors and Actuators:B. Chemical, 2016, 230: 272-280.
[47] CANFAROTTA F, POMA A, GUERREIRO A, et al. Solid-phase synthesis of molecularly imprinted nanoparticles[J]. Nature Protocols, 2016, 11(3): 443.
[48] SMOLINSKA-KEMPISTY K, GUERREIRO A, CANFAROTTA F, et al. A comparison of the performance of molecularly imprinted polymer nanoparticles for small molecule targets and antibodies in the ELISA format[J]. Scientific Reports, 2016,6: 37 638.
[49] BARNER-KOWOLLIK C, DU PREZ F E, ESPEEL P, et al. “Clicking” polymers or just efficient linking: what is the difference?[J]. Angewandte Chemie International Edition, 2011, 50(1): 60-62
