浸提对甜橙果皮中黄烷酮和多甲氧基黄酮的影响及其抗氧化活性研究
2018-02-28聂超赵梓燕刘珞忆董昕颖周志钦
聂超,赵梓燕,刘珞忆,董昕颖,周志钦,2*
1(西南大学 园艺园林学院,重庆,400715) 2(西南大学 南方山地园艺学教育部重点实验室,重庆,400715)
甜橙(CitrussinensisOsbeck)是柑橘重要的栽培类型之一,味道甜美多汁。既适于鲜食,又可用于生产橙汁。甜橙加工后,产生大量皮渣等副产物,造成资源的浪费[1-2]。国内外研究表明,甜橙果皮中富含具有抗氧化、抗炎、抗衰老等功能的黄酮类物质,对慢性疾病的防治有一定功效[3-5]。黄烷酮(flavanones,FLAs)和多甲氧基黄酮(polymethoxyflavones,PMFs)是甜橙果皮中主要的黄酮类物质。其中PMFs是一类高度甲氧化的黄酮类化合物,几乎仅存在于柑橘属水果中[6],因其易于吸收,且活性高于一般黄酮,所以受到人们的广泛关注[7]。
黄酮类物质的提取主要有溶剂浸提、超声波、微波、超临界提取等方法[8]。其中溶剂浸提法操作简单,广泛用于工业化提取[9]。在优化提取方法上,前人的研究大多根据比色法测定总黄酮含量,以此来优化提取条件[10]。比色法测定黄酮存在有一定的缺陷,不能精确反映具体物质的变化。朱攀攀[11]等利用高效液相色谱法(HPLC),研究了不同超声参数对血橙皮渣中芸香柚皮苷和橙皮苷的影响。但针对柑橘多甲氧基黄酮提取的研究鲜有报道。
大孔树脂吸附、溶剂萃取、水沉法等富集纯化方法,常用于黄酮物质的精制,能够有效除去糖酸、蛋白质等水溶性杂质[12]。水沉法具有收率高,工艺简便,成本较低等优点,因此更适于实际生产[13]。吴婉莹[14]等对比采用水沉法与大孔树脂法桑叶总黄酮,发现两种方法精制后的产物纯度没有明显差异。目前,关于水沉法精制柑橘黄酮的研究报道较少。
本实验研究浸提参数对甜橙果皮中黄烷酮与多甲氧基黄酮的影响,针对不同极性的黄酮类物质,确定最佳提取条件。利用水沉法精制粗提取物,研究精制后提取物对DPPH、ABTS等自由基的清除作用。
1 材料与仪器
1.1 材料与试剂
甜橙于2016年12月中下旬采自重庆市国家果树种质资源柑橘圃(National Citrus Germplasm Repository, Citrus Research Institute, Chinese Academy of Agricultural Sciences, Chongqing, China)。洗净,晾干,削皮,果皮于50 ℃烘箱烘干,经粉碎机粉碎后过80目筛子,置于干燥器中备用。
标准品芸香柚皮苷、橙皮苷、香蜂草苷、甜橙黄酮、川陈皮素、橘皮素,购于美国Sigma公司。甲醇(色谱纯),购于美国Sigma公司;甲酸(色谱纯),购于美国Fisher公司;无水乙醇(分析纯),购于成都市科龙试剂厂。
1.2 主要仪器和设备
密理博Milli-Q Advantange A10超纯水系统,美国密理博(Millipore)公司;电热恒温鼓风干燥箱(DHG-9240A),上海齐欣科学仪器有限公司;高效液相色谱仪(Waters e2695)、光电二极管阵列检测器(Waters 2998),美国Waters公司;电子天平(Sartorius BSA224S,感量0.1 mg,Max 220 g),赛多利斯科学仪器(北京)有限公司;水浴恒温振荡器(SHA-C),金坛市宏业实验仪器厂;EYEL4 FDU-2000小型冷冻干燥机,旋转蒸发仪,日本东京理化器械株式会社。
2 实验方法
2.1 黄酮含量测定
2.1.1 色谱条件
采用高效液相色谱法测定黄烷酮和多甲氧基黄酮的含量。参考张元梅[15]等方法,色谱柱:Sunfire-C18柱(5 μm,250 mm×4.6 mm);柱温:25 ℃;进样量:10 μL;流动相:A(0.1% 甲酸超纯水)和B(甲醇),采用梯度洗脱,洗脱程序为:(1)0~20 min,37%~50% B;(2)20~35 min,50%~80% B;(3)35~40 min,80%~100% B;(4)40~50 min,100% B;(5)50~60 min,37% B,流速:0.7 mL/min。在特定波长范围内对3种黄烷酮类(芸香柚皮苷、橙皮苷、香蜂草苷),3种多甲氧基黄酮(甜橙黄酮、川陈皮素、橘皮素)进行检测。其中黄烷酮的检测波长为283 nm,多甲氧基黄酮的检测波长为330 nm。
2.1.2 标准品溶液配制
精确称取各标准品物质10.0 mg,甲醇定容至10.0 mL,得浓度为1 mg/mL的母液。将母液稀释成不同浓度,按照上述HPLC条件分别进样,以峰面积为纵坐标,标准品溶液浓度为横坐标绘制标准曲线。
2.1.3 提取液中黄酮含量测定
取甜橙果皮黄酮提取液,经0.22 μm滤头过滤,滤液装入棕色进样瓶,按照2.1.1所述方法测定。采用单标法对其进行定性,根据标准曲线进行定量分析。
2.2 不同条件下提取甜橙果皮中黄烷酮和多甲氧基黄酮的含量
称取5.0 g的甜橙果皮粉末,分别考察溶剂体积分数、浸提温度、浸提时间、料液比对提取液中黄烷酮和多甲氧基黄酮含量影响。(1)溶剂体积分数,选择60%、70%、80%、90%、100%的乙醇。在料液比为1∶20,90 ℃下加热回流浸提4 h;料液比为1∶10,60 ℃下加热回流浸提2 h。(2)浸提温度,设置电加热套温度60、70、80、90、100、110 ℃。以70%乙醇为溶剂,在料液比为1∶20下加热回流浸提4 h;80%乙醇为溶剂,在料液比为1∶10下加热回流浸提2 h。(3)浸提时间。料液比为1∶20,在90 ℃下以70%乙醇加热回流浸提0.5、1、2、3、4、5 h;料液比为1∶10,在60 ℃下以80%乙醇加热回流浸提0.5、1、2、3、4、5 h。测定提取液中黄烷酮和多甲氧基黄酮的含量(4)料液比。以1∶5,1∶10,1∶20,1∶30,1∶40为料液比,在90 ℃下,70%乙醇加热回流浸提4 h;60 ℃下,80%乙醇加热回流浸提2 h。测定提取液中黄烷酮和多甲氧基黄酮的含量。
2.3 甜橙果皮总黄酮提取物的精制
水沉法是中药生产中常用精制工艺,按照2.2所得出的最优条件提取甜橙果皮中的总黄酮,将提取液冷却后过滤。参照陈华丽[13]等方法,稍作修改,在45 ℃减压浓缩滤液,按照浸膏∶水=1∶4(g∶mL)加水沉淀,4 ℃静置2 h,5 000 r/min离心10 min,将沉淀进行真空冷冻干燥。采用HPLC测定精制前后黄酮组成与含量,方法参照2.1,使用标准曲线法进行定量,各峰对应的黄酮物质含量相加即为总黄酮含量,同时考察水洗次数对总黄酮纯度和保留率的影响。具体计算公式如下:

(1)

(2)
2.4 甜橙果皮总黄酮提取物的体外抗氧化活性研究
2.4.1 DPPH自由基清除能力测定
DPPH自由基清除能力测定参考GORINSTEIN等[16]的方法,稍做修改。准确称取0.019 7 g DPPH标准品,甲醇定容至500 mL,标准品浓度为0.1 mmol/L。取0.1 mL待测样液加到3.9 mL DPPH溶液中,振荡均匀后避光反应30 min,于517 nm处测定吸光值。不同浓度提取物的抗氧化能力采用DPPH消除率表示,具体计算公式如下:
(3)
其中:A0,0.1 mL乙醇加到DPPH标准液的吸光值;A测,0.1 mL样品溶液和DPPH标准液混合的吸光值。
2.4.2 ABTS自由基清除能力测定
ABTS自由基清除能力测定参照ALMEIDA等[17]的方法,稍作修改。分别配制140 mmol/L过硫酸钾溶液和7 mmol/L ABTS+溶液待用,取176 μL过硫酸钾溶液与10 mL ABTS+溶液混合均匀后避光反应12~16 h。将混合液用乙醇稀释到吸光值为(0.7±0.002),即为ABTS工作液。取0.1 mL待测样品液加到3.9 mL ABTS溶液中,摇匀后反应10 min,于734 nm处测定吸光值。样品溶液的抗氧化能力采用ABTS自由基消除率表示,具体计算公式如下:
(4)
其中:A0,0.1 mL乙醇加到ABTS标准液的吸光值;A测,0.1 mL样品溶液和ABTS标准液混合的吸光值。
2.5 统计分析
采用Excel和SPSS 19软件对数据进行统计分析,采用Origin 8作图,试验重复3次,以“均值±标准差”表示。
3 结果与分析
3.1 黄酮标准品HPLC分析与标准曲线绘制
6种主要类黄酮标准品回归方程、相关系数如表1所示。本方法测定的芸香柚皮苷、橙皮苷等标准品浓度与峰面积呈良好线性关系,符合定量要求。

表1 黄酮物质标准品回归方程、相关系数、线性范围
3.2 不同提取条件下甜橙果皮黄酮含量变化
研究了不同提取条件下黄酮含量变化,结果表明,甜橙果皮中黄酮主要分为黄烷酮和多甲氧基黄酮,且黄烷酮的含量远高于多甲氧基黄酮,其中橙皮苷是含量最高的黄烷酮,这与WANG[18]等研究结果一致。在不同提取条件下,总黄酮的含量为(8.74±0.26)~(24.04±0.75) mg/g,与LIU[19]等研究结果相似。
3.2.1 不同体积分数乙醇提取对甜橙果皮中黄酮类物质含量的影响
不同体积分数乙醇提取,所得提取液中黄烷酮和多甲氧基黄酮的含量变化如图1所示。随着乙醇体积分数的增加,黄烷酮和多甲氧基黄酮的变化规律略有差异。对于黄烷酮,橙皮苷和香蜂草苷的含量最大值出现在乙醇体积分数为70%时,而芸香柚皮苷含量最大值出现在乙醇体积分数为60%时。进一步提高乙醇体积分数,3种黄烷酮含量均出现明显的下降。YANG[20]等在研究黄烷酮提取时发现,存在一个最佳乙醇体积分数,进一步增加乙醇体积分数会导致提取效率下降。这可能是高体积分数的乙醇极性偏小,不适用于黄烷酮的提取[21]。
随着乙醇体积分数的变化,3种多甲氧基黄酮含量的变化趋势相似,呈先增加后降低最后趋于平稳的趋势。在80%体积分数乙醇提取下,3种多甲氧基黄酮含量均达到最大值。其中,甜橙黄酮的含量从(0.60±0.04) mg/g增加到(0.87±0.01) mg/g。随着乙醇体积分数的增加,多甲氧基黄酮的含量开始降低并趋于平稳。LIBRN[22]等发现,在85%的乙醇体积分数提取下,多甲氧基黄酮含量最高,这与我们研究结果相似。由于多甲氧基黄酮极性偏小,根据相似相溶原理,高体积分数乙醇有利于多甲氧基黄酮提取。进一步提高乙醇体积分数,极性开始改变,导致提取效率下降。也有学者认为,高体积分数的乙醇可能破坏细胞壁性质,使得酚类物质不易溶出,同时对酚类物质的转移也有一定影响[23]。
综上所述,我们认为,乙醇体积分数为70%时,黄烷酮和总黄酮得率最高,乙醇体积分数为80%时,有利于多甲氧基黄酮。

图1 不同乙醇浓度对对果皮中黄酮类物质含量的影响Fig.1 Effect of water content in ethanol on the yield of flavonoids
3.2.2 不同浸提温度对甜橙果皮中黄酮类物质含量的影响
温度对果皮中黄酮类物质含量的影响如图2所示。由图2可知,黄烷酮的含量变化规律大致相同,呈先增加后降低的趋势。温度从60 ℃增加到90 ℃,芸香柚皮苷、橙皮苷和香蜂草苷等含量迅速增高,这与朱攀攀[11]等研究结果一致。随着温度升高,溶剂分子运动加速,有利于黄酮类物质提取[24]。其中橙皮苷的含量从(6.46±0.53) mg/g提高到(15.22±1.28) mg/g,增加了1倍多。当浸提温度超过90 ℃后,黄烷酮的含量开始下降。这可能是由于温度升高,破坏了黄酮化合物的结构[25]。
多甲氧基黄酮的含量随温度的变化与黄烷酮的变化明显不同,提取温度从60 ℃升高到110 ℃,多甲氧基黄酮含量无明显变化。M’HIRI[26]等在提取多甲氧基黄酮时发现,随着温度的增加,其含量无明显变化。KO[27]等的研究证明,在较高温度时,多甲氧基黄酮类物质具有良好的稳定性,能够保持较高的提取率,但其糖苷类物质却开始降解。我们推测,相较于黄烷酮,多甲氧基黄酮在高温下更加稳定。
由黄烷酮和多甲氧基黄酮的变化趋势可以看出,提取温度为90 ℃黄烷酮和总黄酮等物质提取量最高,而温度为60 ℃就可以较好地提取多甲氧基黄酮。
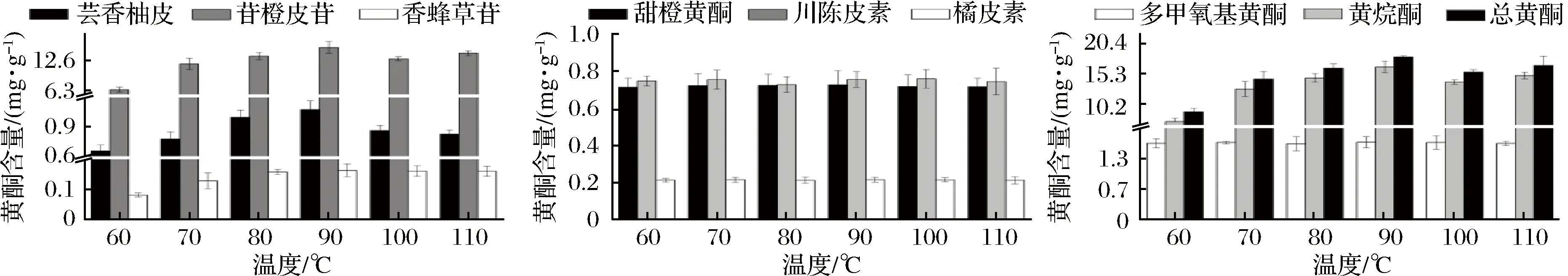
图2 不同浸提温度对对果皮中黄酮类物质含量的影响Fig.2 Effect of extraction temperature on the flavonoids yield
3.2.3 浸提时间对甜橙果皮中黄酮类物质含量的影响
黄烷酮和多甲氧基黄酮的含量随提取时间的变化规律由图3所示。由图3可知,提取时间从0.5 h增加到4 h,芸香柚皮苷和橙皮苷的含量均明显上升,4 h时达到最大值分别为:(1.11±0.08)、(18.10±0.75) mg/g。当提取时间超过4 h后,含量开始下降。香蜂草苷最大值出现在2 h,随后含量开始下降。时间[28]是影响黄酮提取的重要因素,CHEIGH[24]等在研究橙皮苷和芸香柚皮苷提取时发现,时间对提取含量的影响主要与溶解性和热稳定性有关,提取时间太短不利于物质的溶解,提取时间太长容易造成黄烷酮的降解。
多甲氧基黄酮含量随着提取时间的变化规律不同。其中甜橙黄酮的变化趋势与黄烷酮相似,随着提取时间的增加呈先上升后下降趋势,最大值出现在2 h,和香蜂草苷相同。但川陈皮素和橘皮素的变化规律与甜橙黄酮不同,其含量随时间的增加先增加后趋于平稳,没有出现下降的趋势,最大值均出现在1 h,较早于甜橙黄酮。XU[29]等也发现川陈皮素、甜橙黄酮等含量随着提取时间的增加并没有发生下降的现象,这可能与其结构有关[30]。同时相较于黄烷酮,多甲氧基黄酮类物质更易提取[27],所需时间较短。
溶剂浸提法最大缺点就是时间太长,从多甲氧基黄酮提取来看,提取时间为1~2 h,即可获得较高含量。而黄烷酮和总黄酮的提取时间需要4 h才能达到最大值。

图3 浸提时间对果皮中黄酮类物质含量的影响Fig.3 Effect of extraction time on the flavonoids yield
3.2.4 料液比对甜橙果皮中黄酮类物质含量的影响
液料比是影响提取的关键因素之一,合适的料液比可以促进物质的溶解,增加提取效率。由图4可知,黄烷酮和多甲氧基黄酮的产量都随料液比的提高呈先增加后降低趋势。橙皮苷和香蜂草苷在料液比为1∶20时含量达到最高,芸香柚皮苷含量的最大值出现在料液比为1∶10,而后随着料液比的增加,含量开始下降。同时我们发现,在料液比从1∶5提高到1∶20时,橙皮苷的含量显著增加,这与许鹭[31]等研究相同,增加料液比利于黄酮物质的提取。
多甲氧基黄酮的含量变化规律相似,呈先增加后降低趋势。与黄烷酮不同的是,甜橙黄酮、川陈皮素、橘皮素3种多甲氧基黄酮均在料液比为1∶10时含量达到最高。李成平[33]等发现料液比为1∶15时多甲氧基黄酮得率较高,这与我们的研究结果相近。
在料液比为1∶10时多甲氧基黄酮含量即可达到最高值,而黄烷酮和总黄酮的最大值则出现在料液比为1∶20时,我们推测是由于多甲氧基黄酮相较于黄烷酮较易溶出所致。随着料液比继续增加,黄酮的提取效率开始下降,这可能是料液比的提高,其他物质如多糖和蛋白质的溶解性提高,阻碍了黄酮的溶解,不利于提取[32]。

图4 不同料液比对果皮中黄酮类物质含量的影响Fig.4 Effect of solid-liquid ratio on the flavonoids yield
3.3 甜橙果皮总黄酮提取物的精制
甜橙果皮粗提取物中含有大量的糖、有机酸、色素等物质以及一些油脂类杂质,致使样品不易冻干,且容易吸潮。如图5所示,水沉法可以有效等除去糖、酸等杂质。水沉次数对精制效果的影响如表2所示,综合考虑纯度、保留率以及用水量,选择水沉两次为宜。精制后提取物中总黄酮纯度从12.34%提高到42.05%。李春美[34]等利用AB-8大孔树脂分离纯化柚皮黄酮,产物纯度为39.67%,芦柑总黄酮经大孔树脂纯化后,纯度可达63.1%[35]。本实验得到的提取物纯度介于两者之间,且方法简便快捷,易于操作。

A-标准品;B-精制前;C-精制后;1-芸香柚皮苷; 2-橙皮苷:3-香蜂草苷;4-甜橙黄酮;5-川陈皮素;6-橘皮素图5 六种标准品和精制前后总黄酮提取物的HPLC图谱Fig.5 The HPLC spectra of six standards and extracts of total flavonoids before and after purification
表2 水沉次数对精制效果的影响
Table 2 Effect of different times of water precipitation on the results
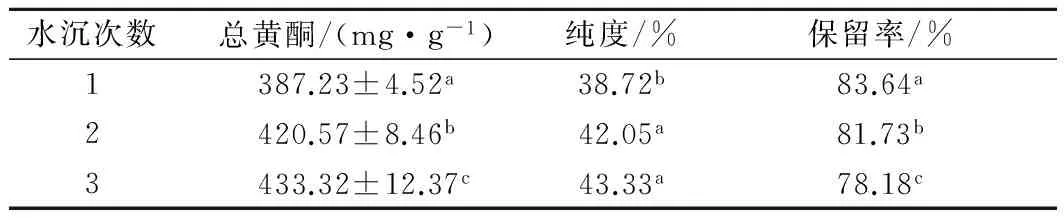
水沉次数总黄酮/(mg·g-1)纯度/%保留率/%1387.23±4.52a38.72b83.64a2420.57±8.46b42.05a81.73b3433.32±12.37c43.33a78.18c
注:表2结果表示为3次测定的平均值±标准差;同一列不同小写字母表示在0.05显著性水平上差异显著。
3.4 甜橙果皮总黄酮提取物的抗氧化活性
3.4.1 甜橙果皮总黄酮提取物对 DPPH和ABTS自由基的清除能力
不同浓度甜橙果皮提取物对 DPPH、ABTS自由基的清除能力如图6所示。由图6看出,甜橙果皮提取物对DPPH、ABTS自由基均表现出较好的清除作用。同一浓度下,甜橙果皮提取物对ABTS的清除能力高于DPPH,这与不同自由基本身性质有关[36]。
另外,随着果皮提取物浓度的增加,其对DPPH、ABTS自由基的清除率也逐渐增大,剂量效应关系明显。甜橙果皮提取物对DPPH、ABTS自由基的IC50分别为(1.12±0.13)、(0.22±0.01) mg/mL。LIU[37]在研究甜橙黄酮提取物对DPPH的清除能力时发现,其IC50为(1.19±0.12) mg/mL,与本研究结果一致。
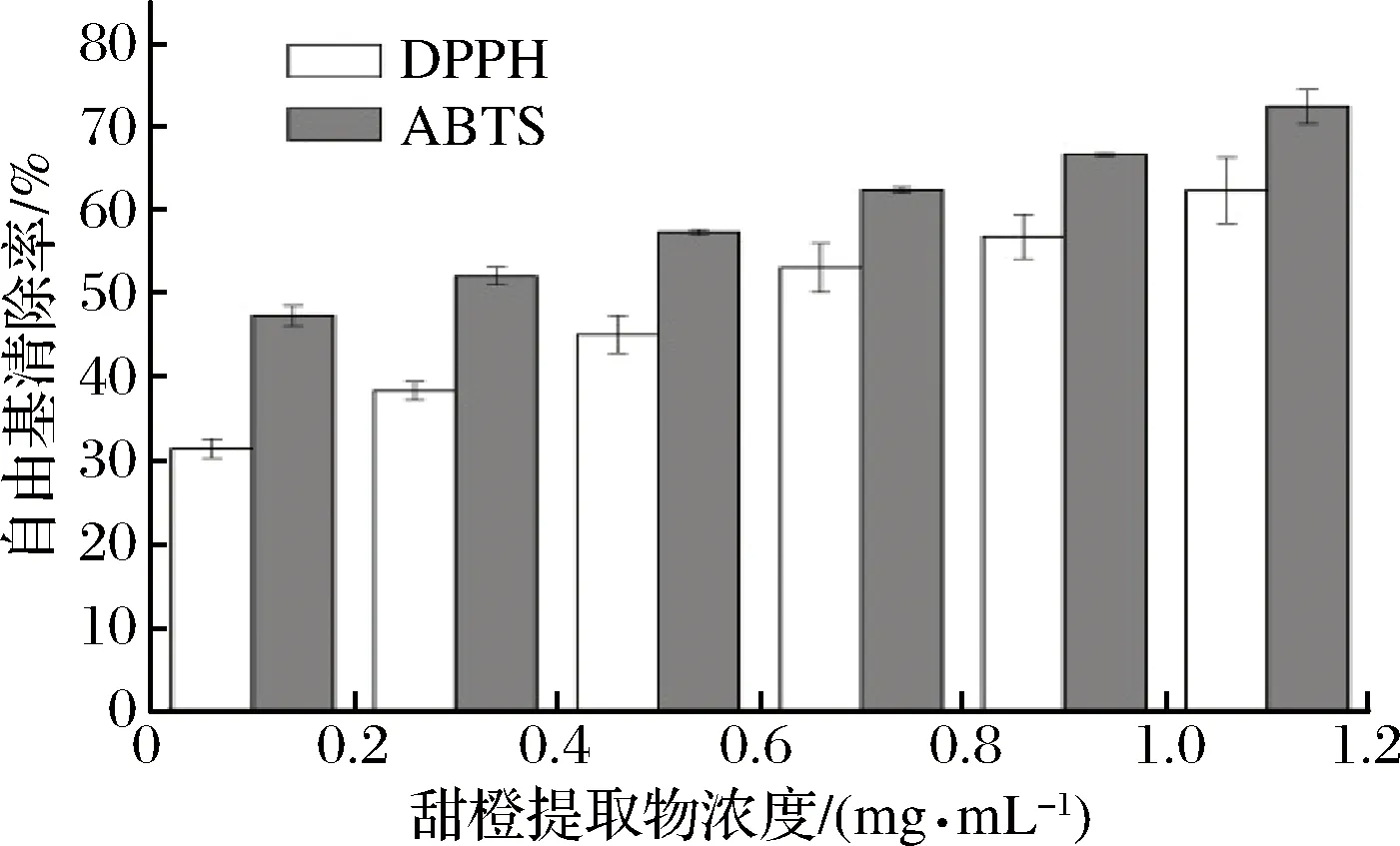
图6 不同浓度的甜橙果皮提取物中黄酮对自由基的清除作用Fig.6 scavenging potency of extract of orange peels with different concentration
3.4.2 甜橙果皮总黄酮含量与DPPH和ABTS自由基清除能力相关性分析
对甜橙果皮提取物中黄酮含量与抗氧化活性进行相关性分析,结果如图7所示。果皮提取物中黄酮含量与DPPH(R2=0.959 7,p<0.01)、ABTS(R2=0.985 7,p<0.01)自由基清除能力均呈显著正相关关系,这说明提取物中黄酮的含量与抗氧化性极相关,提取物中的黄酮类物质是抗氧化的主要物质,这与LOU[38]等在研究金橘总黄酮含量与抗氧化能力的相关性时,得到的结果相似。但万利秀[39]等研究发现,柑橘果皮中总黄酮含量与DPPH自由基清除能力无关,分析其原因可能是,提取液中存在其他杂质,影响了实验结果。

图7 甜橙果皮提取物中黄酮含量与自由基清除能力的相关性分析Fig.7 Analysis of the correlation between the radical scavenging ratios (%) and the total flavonoids of the extracts from orange peels
4 结论
甜橙果皮中的黄酮类物质主要为黄烷酮和多甲氧基黄酮,本实验主要采用加热浸提法提取甜橙果皮中的黄酮类物质并利用HPLC对不同提取条件下黄烷酮和多甲氧基黄酮进行了精确的定量,筛选出了最优的提取条件。研究结果发现,黄烷酮的最佳提取条件为:以70%体积分数的乙醇作为溶剂,料液比为1∶20,90 ℃提取4 h,提取效果最佳,达到(24.74±0.42) mg/g;多甲氧基黄酮提取的最佳条件为:以80%乙醇作为提取溶剂,料液比为1∶10,60 ℃提取2 h,多甲氧基黄酮的提取效果最佳,达到(2.47±0.08) mg/g。
采用水沉法精制甜橙黄酮提取物,经HPLC检测分析,精制后提取物中的总黄酮纯度达到42.05%,其中多甲氧基黄酮含量为(19.93±0.14) mg/g。利用DPPH、ABTS两种体外抗氧化体系评价精制后甜橙果皮提取物总黄酮的抗氧化作用,发现甜橙果皮提取物总黄酮对ABTS的清除作用较强,且总黄酮含量与抗氧化能力呈极显著正相关,甜橙果皮提取物中的黄酮类物质是主要的抗氧化成分。
[1] 付复华,李忠海,单杨,等.柑橘皮渣综合利用技术研究进展[J].食品与机械,2009(5):178-184.
[2] 杨文晶,许泰百,冯叙桥,等.果蔬加工副产物的利用现状及发展趋势研究进展[J].食品工业科技,2015,36(14):379-383.
[3] ZOU Z, XI W, HU Y,et al.Antioxidant activity of Citrus fruits[J].Food Chemistry,2016,196: 885-896.
[4] HUANG Y S,HO S C.Polymethoxy flavones are responsible for the anti-inflammatory activity of citrus fruit peel[J].Food Chemistry,2010,119(3): 868-873.
[5] APRAJ V D,PANDITA N S.Evaluation of skin anti-aging potential of Citrus reticulatablancopeel[J].Pharmacognosy Research,2016, 8(3): 160.
[6] MANTHEY J A,GROHMANN K.Phenols in citrus peel byproducts. Concentrations of hydroxycinnamates and polymethoxylated flavones in citrus peel molasses[J].Journal of Agricultural and Food Chemistry,2001,49(7): 3 268-3 273.
[7] LI S,SANG S,PAN M H,et al.Anti-inflammatory property of the urinary metabolites of nobiletin in mouse[J].Bioorganic& Medicinal Chemistry Letters,2007,17(18):5 177-5 181.
[8] M’HIRI N,IOANNOU I,GHOUL M,et al.Extraction methods of citrus peel phenolic compounds[J].Food Reviews International,2014,30(4):265-290.
[9] 郭丽琼,苏霞,蒋国林,等.柑橘类黄酮提取方法的研究进展[J].食品工业科技,2012,33(14):412-416.
[10] 李敏,何亚萍,柴娟.柑橘皮总黄酮的提取及抗氧化性研究[J].应用化工,2016(3):501-503.
[11] 朱攀攀,马亚琴,窦华亭,等.超声处理条件对血橙皮渣中黄酮类物质的影响[J].食品与发酵工业,2015,41(1):126-130.
[12] 吴亚红.苦参总黄酮的提取纯化及其片剂的制备[D].天津:天津大学,2009.
[13] 陈华丽.三七醇提与水沉工艺研究[D].杭州:浙江大学,2015.
[14] 吴婉莹,杨洲,侯晋军,等.总丹参酮不同纯化工艺的比较[J].中草药,2008,39(12):1 815-1 818.
[15] ZHANG Y,SUN Y,XI W,et al.Phenolic compositions and antioxidant capacities of Chinese wild mandarin (CitrusreticulataBlanco) fruits[J].Food Chemistry,2014,145(7): 674-680.
[16] GORINSTEIN S,ZACHWIEJA Z,JASTRZEBSKI Z,et al.,Bioactive compounds and antioxidant potential in fresh and dried Jaffa sweeties, a new kind of citrus fruit[J].Journal of the Science of Food and Agriculture,2004,84(12):1 459-1 463.
[17] ALMEIDA M M B,ARRIAGArriagaM C,MAIA G A,et al. Bioactive compounds and antioxidant activity of fresh exotic fruits from northeastern Brazil[J].Food Res Int,2011,44(7):2 155-2 159.
[18] WANG Y C,CHUANG Y C,HSU H W.The flavonoid, carotenoid and pectin content in peels of citrus cultivated in Taiwan[J].Food chemistry,2008,106(1):277-284.
[19] LIU S C, TSAI C W.Effects of heating time on the antioxidative capacities of citrus fruit (Citrussinensis(L.) Osbeck) by-products[J].Food Science and Technology Research,2012,18(4):505-513.
[20] YANG L,JIANG J G,LI W F,et al. Optimum extraction process of polyphenols from the bark of Phyllanthusemblica L. based on the response surface methodology[J].Journal of Separation Science,2009, 32(9):1 437-1 444.
[21] GARCIA-CASTELLO E M,RODRIGUEZ-LOPPEZ A D,MAYOR L, et al.Optimization of conventional and ultrasound assisted extraction of flavonoids from grapefruit (CitrusparadisiL.) solid wastes[J].LWT-Food Science and Technology,2015, 64(2):1 114-1 122.
[23] ZUO Y B,ZENG A W,YUAN X G,et al.Extraction of soybean isoflavones from soybean meal with aqueous methanol modified supercritical carbon dioxide[J].Journal of Food Engineering,2008,89(4):384-389.
[24] CHEIGH C I,CHUANG E Y,CHUANG M S.Enhanced extraction of flavanones hesperidin and narirutin from Citrus unshiu peel using subcritical water[J].Journal of Food Engineering,2012,110(3):472-477.
[25] KO M J,CHEIGH C I,CHUNG M S.Relationship analysis between flavonoids structure and subcritical water extraction (SWE)[J].Food Chemistry,2014,143(1):147-155.
[26] M’HIRI N,IOANNOU I,BOUDHRIOUA N M,et al.Effect of different operating conditions on the extraction of phenolic compounds in orange peel[J].Food and Bioproducts Processing,2015,96:161-170.
[27] KO M J,KWON H L,CHUNG M S.Pilot-scale subcritical water extraction of flavonoids from satsuma mandarin (Citrus unshiuMarkovich) peel[J] Innovative Food Science & Emerging Technologies,2016,38:175-181.
[28] WANG L,WELLER C L.Recent advances in extraction of nutraceuticals from plants[J].Trends in Food Science & Technology,2006,17(6):300-312.
[29] XU G H,CHEN J C,LIU D H,et al.Minerals, phenolic compounds, and antioxidant capacity of citrus peel extract by hot water[J].Journal of Food Science,2008,73(1):C11-C18.
[30] INOUE T,TSUBAKI S,OGAWA K,et al.Isolation of hesperidin from peels of thinned citrus unshiu fruits by microwave-assisted extraction[J].Food Chemistry,2010,123(2):542-547.
[31] 许鹭.柚皮中柚皮苷的提取、分离纯化及其固体分散体与卵磷脂复合物的制备及表征[D].广州:华南理工大学,2015.
[32] YANG L,CAO Y L,JIANG J G,et al.Response surface optimization of ultrasound‐assisted flavonoids extraction from the flower ofCitrusaurantiumL. var. amaraEngl[J].Journal of Separation Science,2010,33(9):1 349-1 355.
[33] 李成平,田红梅,单伟光,等.微波辅助提取橘皮中川陈皮素和橘红素的工艺研究[J].食品科技,2011,36(5):224-228.
[34] 李春美,钟朝辉,谢笔钧,等.大孔树脂分离纯化柚皮黄酮的研究[J].农业工程学报,2006,22(3):153-157.
[35] 骆党委,叶静,肖美添,等.AB-8大孔吸附树脂精制芦柑皮总黄酮及黄酮类化合物的分离[J].食品科学,2014,35(6):30-35.
[36] XI W,ZHANG Y,SUN Y,et al.Phenolic composition of Chinese wild mandarin (CitrusreticulataBalnco.) pulps and their antioxidant properties[J].Industrial Crops and Products,2014,52(1):466-474.
[37] SHIH-CHUAN L I U,CHIEN-WEN T.Effects of heating time on the antioxidative capacities of citrus fruit (Citrussinensis(L.) Osbeck) by-products[J].Food Science and Technology Research,2012,18(4):505-513.
[38] LOU S N,LAI Y C,HUANG J D,et al.Drying effect on flavonoid composition and antioxidant activity of immature kumquat[J].Food Chemistry,2015,171:356-363.
[39] 万利秀,肖更生,蒋爱民,等.不同品种柑橘皮中黄酮化合物含量及抗氧化性分析[J].食品与发酵工业,2011,37(4):73-77.
