NO处理对鲜切胡萝卜生理生化变化的影响
2018-02-28赵蕾胡文忠刘文玲陈晨姜爱丽刘程惠
赵蕾,胡文忠*,刘文玲,陈晨,姜爱丽,刘程惠
1(大连民族大学 生命科学学院,辽宁 大连,116600) 2(生物技术与资源利用教育部重点实验室,辽宁 大连,116600)
胡萝卜营养丰富,含有大量的维生素、蛋白质、膳食纤维、矿物质等人体所必须的营养物质,所以有“土人参”,“金笋”之美称[1-3]。鲜切果蔬是以新鲜果蔬为原料,经清洗、去皮、切割等工序而制成的新鲜果蔬产品,鲜切果蔬也被叫作微加工果蔬、轻度加工果蔬或半加工果蔬,具有天然、新鲜、卫生、方便等优点[4-6]。但是鲜切果蔬在切割过程中会受到机械损伤并导致一系列不良的生理生化变化,严重影响产品品质[7]。NO是近年来发现的一种小分子信号物质,在植物体内作为一个关键调节因子调控基因的表达以实现植物对生命活动的调控[8]。现已有实验证明,NO处理可有效抑制鲜切番茄中乙烯的生物合成和苹果的乙醇脱氢酶活性,进而改善产品感官质量、延长贮藏期;NO处理可通过减少过氧化氢含量积累来延迟新鲜生菜的衰老,降低了鲜切桃片的膜渗透性,保护了细胞膜微结构;NO处理降低了竹笋中的活性氧代谢、抑制了丙二醛含量积累,延迟了脂质过氧化发生进程[9-13]。本实验以硝普钠为NO供体,研究了其对鲜切胡萝卜生理生化变化的影响,旨在为鲜切胡萝卜的伤害生理和货架期延长奠定理论基础。
1 材料与方法
1.1 材料与试剂
胡萝卜,购于大连经济技术开发区乐购超市;硝普钠(SNP,分析纯),购于天津市科密欧化学试剂开发中心。
体积分数为30%的H2O2、Na2HPO4、NaH2PO4、硼砂、甲醇、L-苯丙氨酸、抗坏血酸、聚乙烯吡咯烷酮、亚油酸钠、三聚乙酸(TCA)、硫代巴比妥酸(TBA)、无水乙醇、丙酮、愈创木酚、邻苯二酚、浓HCl(以上试剂均为分析纯),购于天津市科密欧化学试剂开发中心;乙二胺四乙酸(EDTA,生化试剂)、H3BO3(分析纯),购于国药集团化学试剂有限公司。
1.2 仪器与设备
电热恒温水浴锅(DK-S26),上海精宏实验设备有限公司;电子分析天平(AL240),Mettler-Toledo instr:Ltd,紫外可见分光光度计(UV-9200),北京瑞利分析仪器有限公司;匀浆机(T-25),德国IKA;电热恒温鼓风干燥箱(DHG39053A),上海精宏实验设备有限公司;台式高速冷冻离心机(BR4i),法国Jouan;冰箱(BCD-257DVC),青岛海尔股份有限公司;制冰机(SiM-F140),日本三洋。
1.3 样品的预处理
挑选大小和成熟度基本一致、无机械伤、病虫害的胡萝卜。切割前用自来水冲洗、风干(无需去皮)。用消毒的不锈钢刀将胡萝卜切割成2~3 mm厚片状,将切割好的胡萝卜片于0.1 mmol/L硝普钠(NO供体)溶液中浸泡2 h,取蒸馏水浸泡作为对照。将处理完的样品取出后,均匀放到一次性托盘中,每盘10片,每片约为3.5 g;并将托盘放到无菌操作台中送风处理1 min,取出后用保鲜膜包好,置于湿度85%~90%,4 ℃冷库中贮藏。分别取0、2、4、6、8、10、13、15 d,每个处理样各取3盘进行胡萝卜的感官品质和生理生化指标的测定,每项指标重复3次。
1.4 鲜切胡萝卜生理指标的测定
1.4.1 白度值的测定
白度值的测定参考LAVELLI[14]等方法,运用参数L*,a*和b*。其中L*为明亮度,a*为绿/红指数,b*为蓝/黄指数。按公式(1)计算:
WI=100-[(100-L*)2+a*+b*]1/2
1.4.2 酶活性的测定
酶提取液的制备:取5 g样品,加0.1 g聚乙烯吡咯烷酮(PVPP)于20 mL经4 ℃预冷的0.2 mol/L磷酸提取缓冲液(pH=6.4)中,冰浴研磨匀浆,并于4℃、12 000 r/min离心30 min,取上清液为酶的粗提液,供PPO、POD、PAL共用,低温保存备用。
PPO、POD活性的测定参考CHEN[15]等稍作修改。PPO活性:将0.5 mL粗酶提取液加入3 mL 0.5 mol/L的邻苯二酚溶液中,加盖迅速混匀后,扫描并记录30 s内398 nm处吸光值变化。POD活性:取2mL 0.05%愈创木酚溶液于小试管中加入0.5 mL酶液混匀后置于30 ℃水浴锅中保温5 min,然后加入1 mL 0.08% H2O2溶液后扫描1 min内460 nm处吸光值变化。
PAL活性的测定参照马跃[16]等方法。取1支试管,加入3 mL 0.1 mol/L磷酸缓冲液和0.5 mL 20 mmol/L L-苯丙氨酸溶液,在37 ℃预保温10 min,再加入0.5 mL酶液,混合后,迅速测定该混合液在290 nm处的吸光值作为反应的初始值(OD0)。然后将反应管置于37 ℃保温60 min。保温结束时,再立即测定反应混合液在290 nm处的吸光值作为反应的终止值(OD1)。根据保温前后样品管溶液吸光值的变化计算PAL活性。
CAT、LOX、APX活性的测定参照闫媛媛[17]等方法。CAT活性:酶提取液同上。取3 mL 20 mmol/L H2O2和0.5 mL酶提取液于比色皿中快速摇匀立即扫描混合液在240 nm处3 min内的吸光值,蒸馏水进行调零。
LOX活性:2.7 mL 0.2 mol/L的磷酸缓冲液(pH=6.4)中加入0.2 mL 0.5%的亚油酸钠溶液,然后加入0.1 mL酶液,5 s后扫描混合物在234 nm下吸光值的变化。
APX活性:向试管中加入2.6 mL反应缓冲液和0.1 mL酶提取液,最后加入0.3 mL 2 mmol/L H2O2启动酶促反应。振荡混匀后测定30 s内反应体系在290 nm的吸度值。
1.4.3 其他指标的测定
总酚含量的测定采用福林酚法[18],5 g样品加20 mL甲醇溶液冰浴匀浆,并于4 ℃、12 000 r/min离心30 min,取上清液于25 mL容量瓶中,加入1 mL福林酚溶液后振荡混匀,再加入10 mL 7% Na2CO3溶液,最后定容至刻度。室温放置90 min后,测定其在750 nm处的吸光值,结果用mg/g表示。
类黄酮含量的测定采用HCL-甲醇法[18],向装有10 g鲜切胡萝卜的研钵中加入少许预冷的1% HCl-甲醇溶液,在冰浴条件下研磨匀浆后,转入20 mL刻度试管中。用1% HCl-甲醇溶液漂洗,漂洗后一并转移到试管中,定容至20 mL混匀,于4 ℃避光条件下提取20 min,期间数次摇晃过滤,收集滤液待用。以1% HCl-甲醇溶液做空白进行调零,取滤液于325 nm测定溶液的吸光度值。
电导率的测定参照张向阳[19]等方法稍作修改,胡萝卜经切分后,用打孔器切取大小一致的薄片15个。蒸馏水清洗2次置于三角瓶中,加蒸馏水150 mL,立即测电导率P0,放置20 min后测电导率P1,然后煮沸10 min,冷却至室温,加水至原始刻度,平衡10 min测其电导率P2。
丙二醛(MDA)含量测定采用硫代巴比妥酸法[19],称取5 g样品加入10mL TCA溶液冰浴研磨匀浆,并于4 ℃、12 000 r/min离心20 min,取上清液为酶的粗提液,低温保存备用。取2 mL酶提取液和2 mL含0.5%TBA的TCA溶液混匀。热水加热15 min后,迅速取出并用冰水冷却,然后分别测定在532 nm和600 nm处吸光值。
1.5 数据处理
上述实验均进行3次平行重复,用Excel计算数据标准偏差和均值,用SPSS数据软件进行显著性分析。
2 结果与分析
2.1 NO处理对鲜切胡萝卜颜色的影响
胡萝卜经鲜切处理后主要颜色变化就是发生白变。鲜切胡萝卜发生白变现象主要是因为以下两方面:(1)胡萝卜经去皮、切割处理导致表面细胞受损发生脱水干燥现象使表面颜色变淡;(2)经切割处理后使大部分细胞破裂,进而加速了合成木质素的酶促过程,在破损表面形成白色物质(木质素)[20]。反映胡萝卜颜色变化的主要指标为白度值(WI),贮藏期间该指标的变化如图1所示,随着贮藏时间的延长,2组白度值均呈现稳定上升的趋势。经NO处理过的鲜切胡萝卜白度值显著低于空白组(p<0.05),这说明NO处理能有效减少胡萝卜表面脱水和木质素的合成进而减缓胡萝卜白化进程。

图1 NO处理对鲜切胡萝卜白度值的影响Fig.1 Effect of NO treatment on whiteness of fresh-cut carrots
2.2 NO处理对鲜切胡萝卜抗氧化酶活性的影响
果蔬的衰老主要是因为活性氧的积累,受到切割后活性氧的产生和清除平衡遭到破坏,果蔬衰老加剧[18]。CAT和APX都能分解果蔬代谢产生的过氧化氢(H2O2)进而有效地清除自由基。如图2所示。

图2 NO处理对鲜切胡萝卜过氧化氢酶活性的影响Fig.2 Effect of NO treatment on the activity of catalase in fresh-cut carrots
在整个贮藏期内CAT活性呈现先上升后下降的趋势,经NO处理过的胡萝卜其CAT活性显著高于空白组(p<0.05)且后期下降速率慢。这说明经NO处理能有效提高CAT活性,提高活性氧清除速率,延迟鲜切胡萝卜的衰老。
APX是以抗坏血酸为电子供体的专一性强的过氧化物酶,能催化抗坏血酸与H2O2发生氧化-还原反应,是植物体内清除H2O2的关键酶,APX活性的升高有利于植物体内H2O2的清除[21]。如图3所示,随贮藏时间的延长APX活性呈波动下降的趋势,但经NO处理的胡萝卜其APX活性明显高于空白组(p<0.05)。这说明NO处理能够提高鲜切胡萝卜的APX活性,减少切割过程中H2O2。

图3 NO处理对鲜切胡萝卜抗坏血酸过氧化物酶活性的影响Fig.3 Effect of NO treatment on the activity of ascorbate peroxidase in fresh-cut carrots
2.3 NO处理对鲜切胡萝卜膜脂过氧化进程的影响
电导率是反映植物膜系统状况的一个重要指标,当植物受到逆境伤害或其他损伤时,细胞膜受损,胞液外渗进而导致电导率增大[22]。如图4所示,2组电导率在贮藏期间均呈现相对上升趋势,但NO处理能有效抑制电导率上升的速率,在整个贮藏过程中处理组的电导率值明显低于空白组(p<0.05)。这表明NO 处理可以有效减少细胞膜受伤害程度,降低膜脂过氧化反应发生速率。
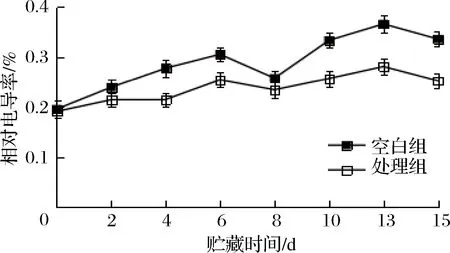
图4 NO处理对鲜切胡萝卜相对电导率的影响Fig.4 Effect of NO treatment on relative electrolytic leakage fresh-cut carrots
LOX作为催化膜脂过氧化反应的关键酶,与果蔬细胞膜脂过氧化关系密切。LOX一方面破坏植物细胞的膜系统,一方面生成脱落酸促进乙烯含量的增加,加速果蔬衰老[18]。如图5所示,2组LOX活性随贮藏时间的延长均呈现上升的趋势。但经NO处理过的胡萝卜其活性显著小于空白组(p<0.05),这说明NO处理能有效抑制LOX活性,阻碍胡萝卜膜脂过氧化进程。
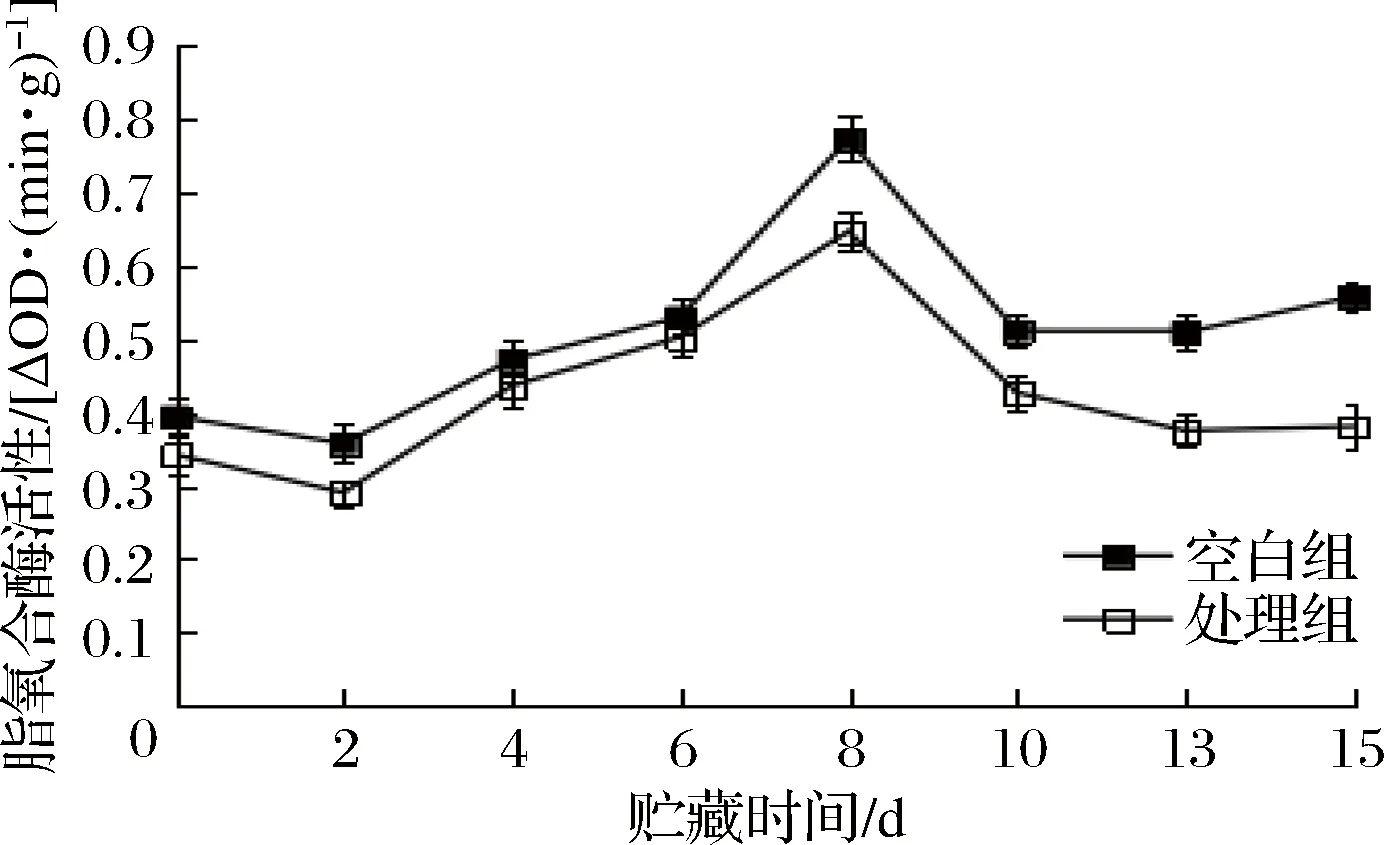
图5 NO处理对鲜切胡萝卜脂氧合酶活性的影响Fig.5 Effect of NO treatment on activity of lipoxygenase in fresh-cut carrots
果蔬在成熟衰老过程中,遭到机械损伤后会产生膜脂过氧化现象,丙二醛是膜脂过氧化作用的主要产物之一,其含量是衡量脂膜过氧化程度的重要指标[23]。丙二醛含量的积累对果蔬细胞的质膜和细胞器会造成一定的伤害。如图6所示,空白组与处理组的丙二醛含量总体变化一致,均呈现先上升后下降的趋势。处理组的丙二醛含量明显小于空白组(p<0.05),这说明NO处理后鲜切胡萝卜细胞受损程度低,膜脂过氧化进程缓慢,在一定程度上延迟了胡萝卜的衰老。

图6 NO处理对鲜切胡萝卜丙二醛含量的影响Fig.6 Effect of NO treatment on the content of malondialdehyde in fresh-cut carrot
2.4 NO处理对鲜切胡萝卜苯丙烷代谢的影响
PPO通常被认为是引起果蔬发生褐变的重要酶,也是在果蔬伤害反应中发挥重要作用的酶[24]。如图7所示,在整个贮藏期内PPO活性呈现先上升后下降的趋势,经NO处理的胡萝卜其PPO活性显著低于空白组(p<0.05)。这与WANG[25]等研究结果相一致,切割后PPO活性均有所上升。PPO活性上升可能是因为由于胡萝卜受到切割后导致体内结合态的酶变成游离态的酶、也可能是在翻译水平上提高了酶活、还可能是2种可能共同作用的结果[26]。后期PPO活性下降可能是因为胡萝卜组织衰老导致的。这说明NO处理能有效抑制PPO活性的升高,降低鲜切胡萝卜白化发生速率。

图7 NO处理鲜切胡萝卜多酚氧化酶活性的影响Fig.7 Effect of NO treatment on the activity of peroxidase in fresh-cut carrots
POD广泛的存在于植物体中,是活性较高的一种酶。在植物生长发育过程中其活性不断发生变化[27]。有研究表明POD也是木质化所必须的酶,其活性因切割而增强[28]。如图8所示,随着贮藏时间的延长,POD活性呈现波动上升下降的趋势。经NO处理过的鲜切胡萝卜其POD活性明显低于空白组(p<0.05)。这说明NO处理能够有效抑制POD活性的升高,延缓果蔬衰老,延长贮藏期。这与 CHAUHAN等在胡萝卜条中的测定结果相同[29]。
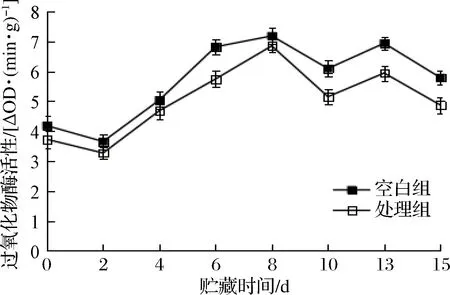
图8 NO处理鲜切胡萝卜POD活性的影响Fig.8 Effect of NO treatment on the activity of POD in fresh-cut carrots
PAL是果蔬苯丙烷代谢的关键酶,在植物生长发育中起关键作用,被认为是植物主要防御酶之一。现已有研究表明,果蔬在采后处理中的伤害可以诱导PAL活性增加,PAL活性增加可以促进木质素、酚类等次级代谢产物合成[30]。如图9所示,在整个贮藏期内,随着时间的延长PAL活性呈现先上升后下降的趋势。经NO处理过的鲜切胡萝卜其PAL活性显著低于空白组(p<0.05)。这说明经NO处理能有效的降低果蔬受伤害程度,进而降低PAL活性。

图9 NO处理鲜切胡萝卜苯丙氨酸解氨酶活性的影响Fig.9 Effect of NO treatment on the activity of phenylalanine ammonia lyase in fresh-cut carrots
鲜切胡萝卜经切割受损后,激活了体内苯丙烷代谢途径,诱导了PAL活性上升,促进组织细胞产生酚类、类黄酮、木质素等次级代谢产物积聚在组织伤口及其临近部位来抵御伤口受损[31]。如图10所示,在整个贮藏期间内2组总酚含量均呈现平缓上升趋势,NO处理后鲜切胡萝卜总酚含量始终低于空白组。随着贮藏时间的延长类黄酮含量呈现波动上升的趋势,经NO处理的鲜切胡萝卜的类黄酮含量始终低于空白组(p<0.05)(见图11)。鲜切胡萝卜受到机械伤害后机体会发生木质化,使其表面产生白色的次生代谢物质—木质素,影响产品感官、降低产品价值。总酚是木质素的合成前体,减少总酚含量能够抑制木质素的合成,延迟了胡萝卜的白化进程,保持了产品的外观质量。总体说明NO处理过的鲜切胡萝卜经切割后组织细胞受损程度低,保持了其外观品质,延长了贮藏期。

图10 NO处理对鲜切胡萝卜总酚含量的影响Fig.10 Effect of NO treatment on total phenols content of fresh-cut carrots
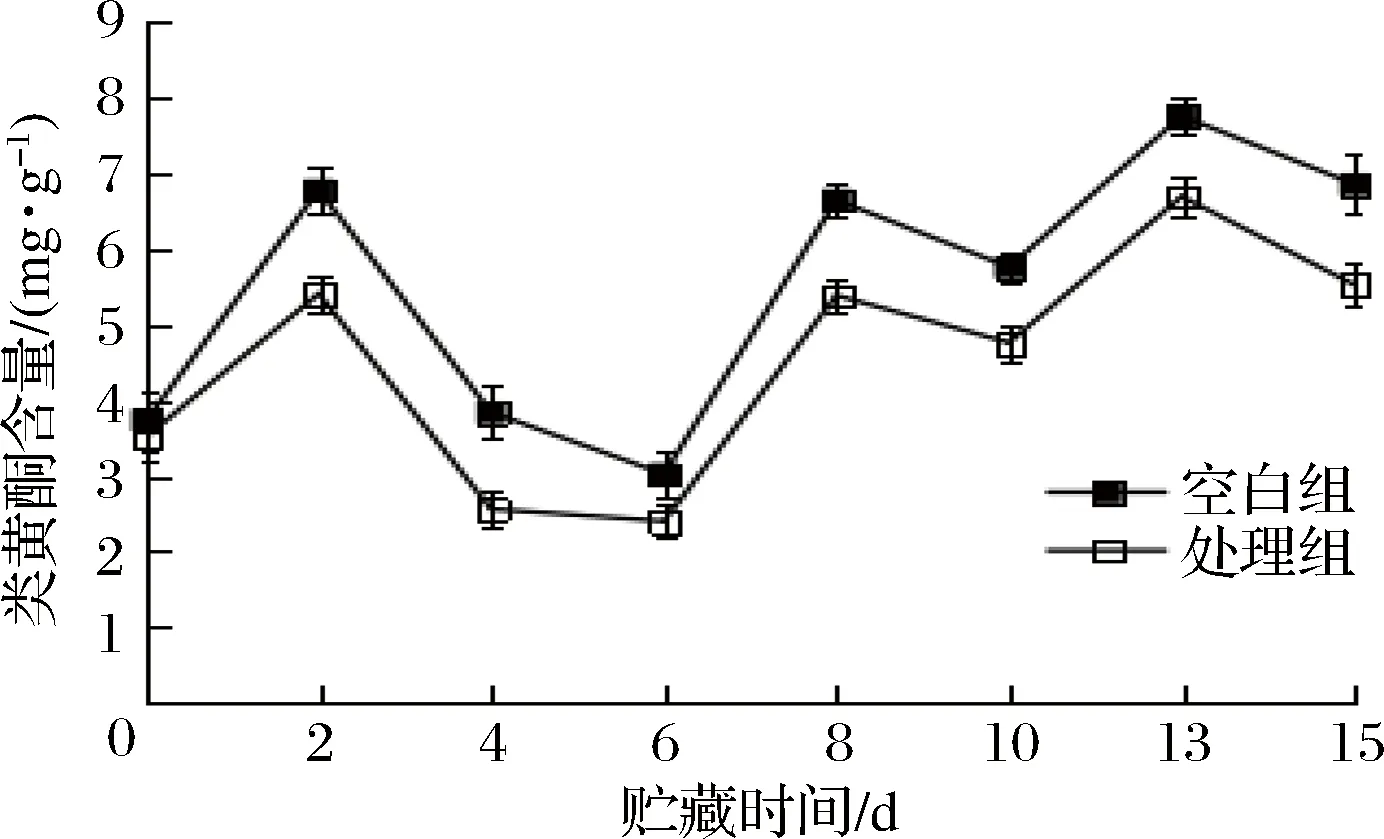
图11 NO处理对鲜切胡萝卜类黄酮含量的影响Fig.11 Effect of NO treatment on the flavonoid content of fresh-cut carrots
3 结论
胡萝卜经去皮、切割后其表面细胞干燥脱水,易导致白变现象发生。受到切割伤害后植物组织会启动体内抗氧化防御系统中的抗氧化物酶,如APX、CAT等清除活性氧,减轻植物氧化损伤,从而延缓其衰老[32]。苯丙烷代谢在植物防御过程中起到重要作用,代谢相关酶如PAL、PPO、POD等和代谢产物如总酚、类黄酮等的变化与植物各类生理变化密切相关[33]。本研究结果显示,经NO处理过的鲜切胡萝卜能够诱导其组织内抗氧化酶APX和CAT活性增强,并抑制LOX活性,降低电导率、减少丙二醛含量积累,从而有效提高胡萝卜组织内抗氧化能力,降低过氧化物引起的膜功能和结构的破坏,延缓鲜切胡萝卜的衰老进程。此外,NO处理降低胡萝卜中参与植物苯丙烷代谢关键酶PAL及PPO、POD的活性,显著减少了苯丙烷代谢产物总酚和黄酮含量,延迟了胡萝卜白化进程的发生,保持了胡萝卜的外观品质。综上所述,NO处理可以通过提高鲜切胡萝卜的抗氧化和降低苯丙烷代谢的能力,减少总酚等次级代谢产物的积累来延长其衰老,保持其感官品质。
[1] KENNY O, O’BEIRNE D. Antioxidant phytochemicals in fresh-cut carrot disks as affected by peeling method.[J]. Postharvest Biology & Technology, 2010, 58(3):247-253.
[2] GONÇALVES E M. Carrot (DaucuscarotaL.) peroxidase inactivation, phenolic content and physical changes kinetics due to blanching.[J]. Journal of Food Engineering, 2010, 97(4):574-581.
[3] 范腾, 董海洲, 王兆升. 海藻酸钠复合涂膜对鲜切胡萝卜白变的影响[J]. 食品与发酵工业, 2011, 37(1):206-210.
[4] 田欣, 陈斌, 王勇,等. 不同温度和薄膜包装对鲜切胡萝卜货架期品质变化的影响[J]. 食品工业科技, 2007,29(7):184-185.
[5] WANG C, CHEN Y, YUJUAN X U, et al. Effect of dimethyl dicarbonate as disinfectant of the quality of fresh-cut carrot (Daucuscarota. L)[J]. Journal of Food Processing & Preservation, 2013, 37(37):751-758.
[6] 张向阳, 王丹, 马越,等. 不同清洗处理对鲜切胡萝卜储藏期品质变化的影响[J]. 食品科技, 2012(11):40-44.
[7] SURJADINATA B B, CISENEROS-ZEVALLOS L. Biosynthesis of phenolic antioxidants in carrot tissue increases with wounding intensity.[J]. Food Chemistry, 2012, 134(2):615-624.
[8] 屠荫华, 惠伟, 李彩香,等. 硝普钠(SNP)对蒜苔保鲜效果的影响[J]. 食品工业科技, 2008,30(10):244-247.
[9] ABOULSOUD M A M. Exogenous nitric oxide negatively impacts on ethylene emissions from intact and fresh-cut tomato fruit.[J]. Research Journal of Biological Sciences, 2010, 5(2):209-214.
[10] AMISSAH J G, HOTCHKISS J H, WATKINS C B. Nitric oxide inhibition of alcohol dehydrogenase in fresh-cut apples (MalusdomesticaBorkh).[J]. Journal of Agricultural & Food Chemistry, 2013, 61(46):11 076-11 081.
[11] IAKIMOVA E T, WOLTERING E J. Nitric oxide prevents wound-induced browning and delays senescence through inhibition of hydrogen peroxide accumulation in fresh-cut lettuce[J]. Innovative Food Science & Emerging Technologies, 2015, 30:157-169.
[12] ZHU L Q, ZHOU J, ZHU S H, et al. Inhibition of browning on the surface of peach slices by short-term exposure to nitric oxide and ascorbic acid.[J]. Food Chemistry, 2009, 114(1):174-179.
[13] YANG H Q, WU F H, CHENG J Y. Effects of nitric oxide treatment on active oxygen metabolism and flesh lignification in bamboo shoots[J]. Journal of Horticultural Science & Biotechnology, 2011, 86(5):499-504.
[14] LAVELLI V, PAGLIARINI E, AMBROSOLI R, et al. Physicochemical, microbial, and sensory parameters as indices to evaluate the quality of minimally-processed carrots[J]. Postharvest Biology & Technology, 2006, 40(1):34-40.
[15] CHEN Chen, HU Wen-zhong, HE Yu-bo, et al. Effect of citric acid combined with UV-C on the quality of fresh-cut apples[J]. Postharvest Biology and Technology, 2016, 111:126-131.
[16] 闫媛媛, 胡文忠, 姜爱丽,等. 茉莉酸甲酯和乙烯利处理对鲜切苹果膜质过氧化反应的影响[J]. 食品工业科技, 2015, 36(14):345-349.
[17] 马跃, 胡文忠, 程双,等. 鲜切胡萝卜的生理生化及品质变化的研究[C].北京:2009食品科技(北京)论坛会议, 2009:352-355.
[18] 胡文忠, 姜爱丽, 杨宏,等. 茉莉酸甲酯对鲜切苹果生理生化变化的影响[J]. 食品工业科技, 2012, 33(16):338-341.
[19] 张向阳, 王丹, 马越,等. 清洗方式对鲜切胡萝卜处理效果的影响[J]. 食品与机械, 2012, 28(5):189-192.
[20] SONG Z, LI F, GUAN H, et al. Combination of nisin and ε-polylysine with chitosan coating inhibits the white blush of fresh-cut carrots[J]. Food Control, 2016,74:34-44.
[21] 马杰, 胡文忠, 毕阳, 等. 外源乙烯和茉莉酸甲酯对鲜切甘蓝活性氧代谢的影响[J]. 食品工业科技,2013,35(20):336-339,343.
[22] 陈守江, 王海鸥. 鲜切茭白短期贮藏过程中的电导率变化[J].安徽技术师范学院学报,2004(3):20-22.
[23] 周拥军, 郜海燕, 陈杭君,等. 减压贮藏对杏鲍菇采后活性氧代谢的影响[J]. 核农学报, 2015, 29(6):1 108-1 113.
[24] 任丽芳,李军. 贮藏温度对鲜切胡萝卜品质的影响[J]. 食品科技,2014(5):30-33.
[25] WANG X, KONG D, MA Z, et al. Effect of carrot puree edible films on quality preservation of fresh-cut carrots[J]. Irish Journal of Agricultural & Food Ressearch, 2016, 54(1):64-71.
[26] 马跃, 胡文忠, 程双, 等. 1-MCP处理对鲜切胡萝卜生理生化变化的影响[J]. 食品工业科技,2011,33(4):341-344.
[27] 周春丽,苏虎,李玉萍,等. 外源NO处理对韭菜抗氧化酶活性的影响[J]. 安徽农业科学, 2011(36): 22 294-22 296.
[28] 张红敏. 超高压处理对鲜切胡萝卜质地和颜色品质影响的研究[D].杭州:浙江大学,2013.
[29] CHAUHAN O P, RAJU P S, RAVI N, et al. Effectiveness of ozone in combination with controlled atmosphere on quality characteristics including lignification of carrot sticks[J]. Journal of Food Engineering, 2011, 102(1):43-48.
[30] 任丽芳, 李军, 国石磊, 等. 高氧气调包装对鲜切胡萝卜的保鲜效果[J]. 食品工业科技,2014,36(9):254-257.
[31] 王玲平, 周生茂, 戴丹丽,等. 植物酚类物质研究进展[J]. 浙江农业学报, 2010, 22(5):696-701.
[32] 霍宪起. 正己醇处理对桑葚采后生理与抗氧化酶的影响[J]. 食品科学, 2012,36(6):252-255.
[33] 姜爱丽, 胡文忠, 孟宪军,等. 外源水杨酸处理对采后蓝莓果实苯丙烷代谢的影响[J]. 食品工业科技, 2013, 34(6):334-337.
