高酯果胶对酸化大豆蛋白凝胶流变及质构特性的影响
2018-02-28曾瑞琪张明政张甫生郑炯
曾瑞琪,张明政,张甫生,郑炯*
1(西南大学 食品科学学院,重庆, 400715) 2(食品科学与工程国家级实验教学示范中心(西南大学),重庆,400715)
大豆蛋白因其优良的胶凝性、乳化性、起泡性及持水性通常被用作胶凝剂、稳定剂或乳化剂。但与大多数蛋白质一样,大豆蛋白的功能性质往往会受到环境因素的影响[1],如在等电点附近大豆蛋白溶解性降低,通过盐离子或经过热变性处理后,大豆蛋白通常会发生絮凝聚集产生沉淀,从而使得大豆蛋白及其加工制品的流变特性和质构特性发生显著变化,而影响其加工及食用品质,限制了大豆蛋白的食用范围,因此通常需要对大豆蛋白进行修饰改性来提高其自身的功能特性,扩大其应用范围。
多糖与蛋白质间的相互作用对蛋白质的结构与功能性质有极大的影响,通常被用作蛋白质的一种修饰手段,利用多糖与蛋白质间的相互作用来扩大食品配料表已成为食品领域研究的热点[1-4]。多糖与蛋白质相互作用决定多数食品体系的结构、稳定性、口感等性质。此外,二者的复合还可被用作界面稳定剂、微胶囊、可食用性膜等食品功能性成分,甚至还能作为脂肪或肉制品的替代物。
果胶是一种结构复杂的酸性杂多糖,属于阴离子型聚电解质[5],主要由半乳糖醛酸单元组成,是植物细胞壁的主要成分之一。按照果胶分子中的甲基酯化度通常将果胶分为高酯果胶与低酯果胶,低酯果胶凝胶性能受Ca2+的影响,且Ca2+作用会因低酯果胶酯化度的不同产生较大差异[6-8],而高酯果胶在较低的pH条件下具有较好的凝胶性能,同时因其具有较高的酯化度而对产品的溶解性、增稠性、凝胶性质有显著的影响。研究表明,在较低pH值条件下,高酯果胶带有较多的负电荷,能通过静电相互排斥的作用对蛋白质起到稳定的作用[9],因此在低于等电点的酸性条件下,大豆蛋白与高酯果胶具有较好的复配效果,但目前高酯果胶对大豆蛋白凝胶特性影响的研究鲜有报道。因此,本实验以大豆蛋白为原料,在pH值为3.5的酸性条件下考察了高酯果胶对大豆蛋白动态流变学性质、质构性质及微观结构的影响。
1 材料与方法
1.1 材料与试剂
大豆蛋白(食品级,蛋白质含量为92%),深圳一诺食品配料有限公司;高酯果胶(食品级)酯化度:65%,广州鸿易食品添加剂有限公司;Na2HPO4(分析纯),成都市科龙化工试剂厂;NaH2PO4(分析纯),成都市科龙化工试剂厂;葡萄糖酸内酯(GDL,食品级),郑州食全食美商贸有限公司;蔗糖(分析纯),成都市科龙化工试剂厂;2-甲基硅油(分析纯),成都市科龙化工试剂厂。
1.2 仪器与设备
FA2004A电子分析天平,上海精天电子仪器有限公司;pHS-3C酸度计,成都世纪方舟科技有限公司;AR-G2旋转流变仪,美国TA公司;CT3物性测定仪,美国Brookfield公司;1580高速台式离心机,香港基因有限公司;Nano-ZS & MPT-2 Zeta电位及纳米粒度仪,英国 Malvern公司;JSM-6510LV钨灯丝扫描电子显微镜,日本电子株式会社(JEOL)。
1.3 实验方法
1.3.1 样品的制备
参照夏晓凤[10]的方法稍有改动,选定pH 3.5,将质量浓度为50 g/L的大豆蛋白溶解在纯水中,在90 ℃条件下加热30 min,待大豆蛋白充分变性溶解后,分别加入0%、0.2%、0.4%、0.6%、0.8%的高酯果胶并继续加热,加热过程中用搅拌器不断搅拌,在90 ℃条件下加热30 min后取出混合液,待混合液稍冷后加入0.58%GDL,加入GDL后即刻搅拌均匀,并再次放入90 ℃水浴锅中静置加热,直至充分形成凝胶,待凝胶形成后取出凝胶样品,冷却,于4 ℃冰箱中静置24 h后进行流变及质构性质测定。
1.3.2 流变特性的测定
动态黏弹性的测定:取制备好的大豆蛋白凝胶样品,采用平板-平板测量系统,平板直径60 mm,设置间隙1.5 mm,用一次性滴管滴加样品,用刮板除去平板外多余样品,表面涂硅油以防止水分蒸发,在温度25 ℃条件下,扫描应变值为5%,振荡频率设定为0.1~10 Hz,保留时间300 s,测定样品储能模量G′、损耗模量G″以及损耗正切角tanδ随角频率的变化。
动态时间扫描测定:在温度25 ℃条件下,扫描应变值设定为5%,扫描频率为1 Hz,扫描时间3 600 s,记录扫描过程的储能模量(G′)、损耗模量(G″)及损耗角正切值(tanδ)。
动态温度扫描测定:温度以5 ℃/min的速度从25 ℃升高到85 ℃,保留10 min后再以5 ℃/min的速度从85 ℃降温到25 ℃,扫描应变值为5%,频率1 Hz,记录整个过程中储能模量G′、损耗模量G″随时间和温度的变化情况。
1.3.3 质构特性的测定
采用CT3物性测定仪对样品进行质地剖面分析(TPA)测定。测定条件为:探头P/0.5;测前速度1.00 mm/s;测试速率1.00 mm/s;返回速度1.00 mm/s;触发力20.0 g;压缩形变程度20%。每组测试均做3次平行测定,实验结果为平均值。
1.3.4 持水性的测定
将凝胶切成大小约3 mm×3 mm×3 mm,体积均一的小块,加入到离心管中进行持水性测定,离心条件为:转速 5 000 r/min ,时间30 min,温度室温,每个样品测量3次取其平均值。公式(1)计算持水性:
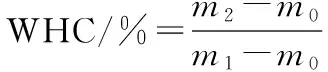
(1)
式中:m0为50 mL空离心管的质量;m1为离心前总质量;m2为离心后去除上层水之后的离心管质量。
1.3.5 微观结构的观察
将刚加入GDL的混合样品迅速倒入90 mm的培养皿中,在90 ℃条件下加热至凝胶充分形成,待凝胶形成后取出培养皿冷却至室温,放入冰箱冻藏室中冻藏24 h,待水分完全结冰后,放入冷冻干燥箱中,在-50 ℃条件下进行抽真空冷冻干燥72 h,使样品完全干燥。将干燥好后的样品安装在双面导电的铝片上,并涂上一薄层钯金合金,使用离子溅渡机使样品具有导电性。样品在15 kV的加速电压和2~6k×的放大率下进行观察和拍照。
1.3.6 Zeta电位的测定
吸取50 μL样品溶液于25 mL容量瓶中,加入去离子水定容,将大豆蛋白稀释500倍后采用 Malvern纳米粒度仪测定添加高酯果胶后的大豆分离蛋白溶液的 Zeta电位。测定条件如下:比色池规格为1 cm聚苯乙烯池,用一对0.45 cm2铂电极,距为0.4 cm。测定温度为 25 ℃,平衡时间 2 min。每组包含10~50次测量,依数据重现性而定,计算3次重复得到平均值为测定值。
1.4 数据处理
2 结果与分析
2.1 高酯果胶对大豆蛋白凝胶流变特性的影响
2.1.1 动态黏弹流变特性
图1为复配体系储能模量(G′)与损耗模量(G″)随角速度变化曲线图。

图1 大豆蛋白凝胶动态模量随角速度变化曲线Fig.1 Curves of dynamic modylus with angular frequency of soybean protein gel
由图1可知,随着角频率的增加复配体系G′与G″均呈上升趋势,但在整个扫描过程中G″均小于G′,表明大豆蛋白凝胶主要表现为较强的胶体行为,其弹性性质占主导地位[11]。同时图1表明,高酯果胶的加入对大豆蛋白的凝胶性质产生了较大影响,当体系未添加果胶时,单一大豆蛋白G′值处于较低状态,且在整个频率扫描测试过程中无明显变化,在较高频率测试阶段表现出较稳定的状态,与单一大豆蛋白凝胶相比,添加果胶的大豆蛋白凝胶性质则表现出明显变化,当果胶添加量为0.2%时,体系G′增幅显著,表明此时的凝胶强度显著增加,且在整个测试阶段G′处于上升趋势,果胶含量为0.4%的复配体系在所测样品中具有最大的G′,表明此添加量的凝胶具有最强的凝胶强度,且对外界作用力具有一定程度的抵抗性能,其恢复自身凝胶状态的能力强于其大豆蛋白。这可能是因为在酸性条件下,大豆蛋白带有正电荷,与带有负电荷的果胶产生了强静电作用[12],随着果胶添加量的增加,大豆蛋白分子中包裹的电荷逐渐暴露并与果胶上的负电荷结合,两者形成稳定的复合物,静电作用使大豆蛋白与果胶形成均匀致密的网状结构,增强体系的凝胶强度,其结果表现为体系弹性性能大大增强。
当高酯果胶添加量再增加时,体系的G′明显降低,且低于单一大豆蛋白凝胶体系,当多糖分子质量大于一定值或添加量较大时,会造成絮凝物的出现[13]。由于蛋白质和多糖同属于食品大分子物质,当多糖浓度达到一定值后,食品大分子间出现相分离,形成了不同相的浓度差异,因而使得物质结构和性质出现较大的差异[14]。当果胶的添加量达到0.8%时,大豆蛋白与果胶间的静电作用已经饱和,果胶中还存在多余的负电荷,而多余的负电荷间产生的相互排斥作用对大豆蛋白结构产生影响,使得大豆蛋白分子聚集,产生絮凝,形成网络结构较差的凝胶体系,从而导致弱的凝胶结构,体系弹性性能下降。
在动态黏弹性的表示中,通常将应力与应变的相位差角δ称为损耗角,tanδ为损耗正切,又可称为衰减率[15],损耗正切可表示为损耗模量与储能模量的比值,相位角的存在,表示黏弹性体同黏性液体一样,在振动中产生流动。图2为动态黏弹性测试中,tanδ随频率的变化曲线。从图2中可以看出,大豆蛋白凝胶在振动过程中均表现出流动性质,表明复配体系为典型的黏弹性体,随着频率的增加,体系的tanδ均呈上升趋势,这说明在振动过程中,体系所对应的应力与应变间的相位角逐渐增加,反映在G′与G″上则为G″的增幅大于G′,说明在高频率的振动作用下,体系更加趋于黏性流体,当添加0.4%的果胶时,这种性质表现得更加突出。
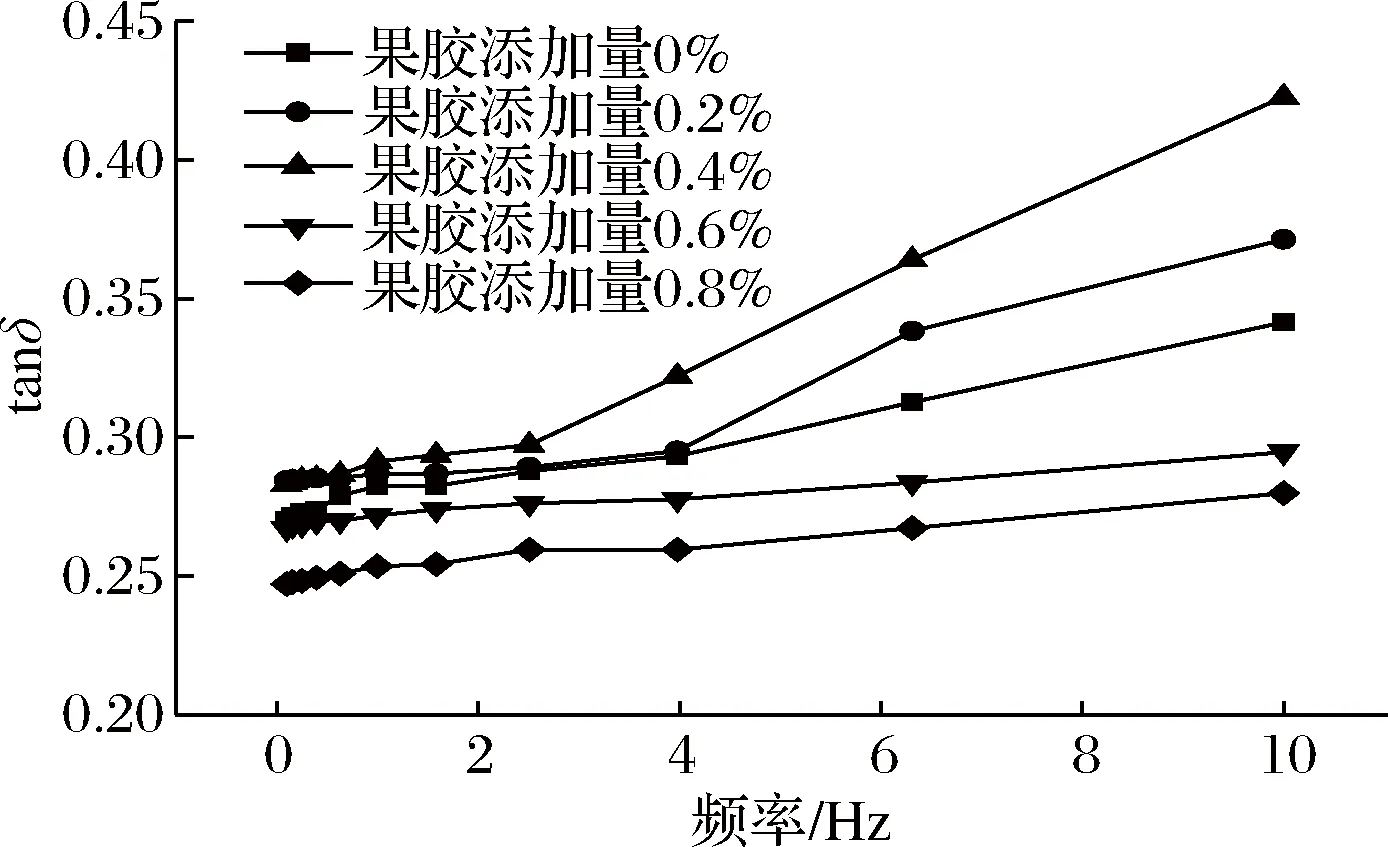
图2 损耗正切值随频率变化曲线Fig.2 Curves of tanδ with frequency of soybean protein
2.1.2 动态时间扫描
图3所示为大豆蛋白凝胶在1 h内G′与G″随时间变化的曲线。由图3-(A)可知,在1 h的振荡测试中,复配体系的G′与相对应的G″呈平行状态,且始终有G′>G″,表明体系在该阶段仍主要表现出弹性固体特征,当添加0.2%的高酯果胶后,这种弹性特征表现得更加明显,而添加量达到0.4%的复配体系G′值升高将近为单一大豆蛋白体系的1倍。在整个时间扫描测定范围内,体系的G′随时间的变化先出现略微的降低,而后表现出稳定的弹性性能,这可能是由于复配体系凝胶在最初受到测试的250 s内对测试应力有一个适应过程,当体系适应该测试应力后,体系本身表现出的抵抗外界应力的能力与施加在体系上的应力相平衡而表现出较稳定的状态,这与动态黏弹性测试表现出的结果相一致。
第一方面,事业单位需要进一步加快国有资产管理信息系统,对其作出动态监督和管理。在对其进行具体实施过程中,要谨遵相应构架以及部署,例如站在横向角度进行分析,要求结合财政部门——主管部门——事业单位等进行。与此同时,要求相应管理人员对部分当中的预算和政府采购、国库集中制等系统进行有效连接,然后将这一系统纳入到其中,方便相关人员对所需要的信息进行查询和分析,能够对信息进行有效共享。与此同时,相关单位还需要积极建立国有资产统计表制度,对不同单位进行有效监督并更新,要适当提升实效性,以防止出现滞后现象,最终促使账务和实际相互符合。
同时,G″也表现出与G′相同的变化趋势,对于黏弹性物质,G″ 代表了物料在受力时,阻碍其自身流动的性质,其大小显示了物料受力时流动的难易程度[16]。图3-(B)中,体系的G″随着果胶添加量的加大呈现先升高后降低的趋势,当果胶添加量在0.4%时,体系的G″达到最大,该体系在受到与其他体系相同的外界应力时,表现出的流动性质最强,该组合下的凝胶体系所形成的黏弹性体趋于黏性液体的能力越强,而这种趋于黏性液体的性质也可以看作是对外界应力的适应,以便能使自身在应力作用下稳定存在,这种凝胶性质有利于食品在剧烈搅拌或剪切作用的加工条件下保持自身状态稳定。当果胶的添加量大于0.4%时,体系所表现出的对自身流动性的阻碍开始增大,体系趋于黏性液体的能力开始下降,在面对外界应力作用时,其稳定性变差。

图3 大豆蛋白/高酯果胶复配体系储能模量(A)与损耗模量(B)随时间变化曲线Fig.3 Curves of storage modylus(A) and loss modylus (B) with time of soybean protein/ high-ester pectin mixed system
2.1.3 动态温度扫描
图4为大豆蛋白凝胶动态温度扫描测定结果示意图。
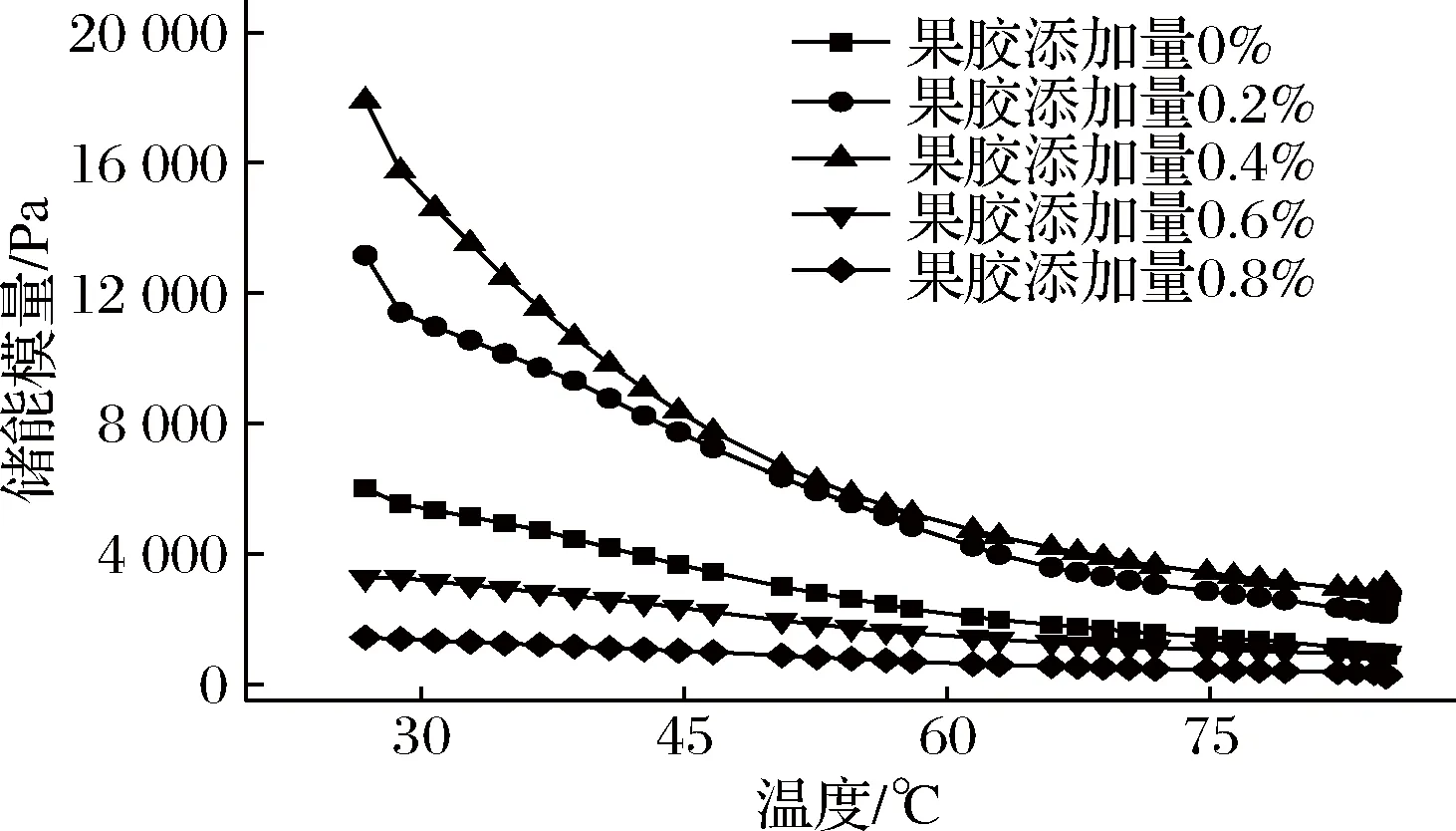
图4 大豆蛋白/高酯果胶复配体系储能模量 随温度变化曲线Fig.4 Curves of storage modylus with temperature of soybean protein/ high-ester pectin mixed system
不同高酯果胶添加量的复配体系G′随温度变化的趋势相似,随着温度的升高,体系的G′呈现下降趋势,在30~45 ℃之间下降速度较快,当温度升高至60 ℃时,G′下降逐渐趋于缓慢,在73~85 ℃温度区间内,G′几乎稳定在某一数值。而复配体系的G′值在总体上随着果胶添加量的增加先上升后下降,这与动态黏弹性测试及动态时间扫描测试结果一致。对于G′随着温度的升高而降低,YUAN[17]认为大豆蛋白与多糖之间存在强静电引力,因此体系呈现放热状态,在升温过程中,热量的不断增加使得放热状态受到抑制,因此体系趋于不稳定,表现为结构强度下降,弹性性能降低;同时,由于大豆蛋白/高酯果胶所形成的复合凝胶属于不可逆凝胶,体系具有较强的不平衡性,这2种聚电解质所形成的胶体在动力学上属于动力学冻结结构[18],由于这种特殊的结构,大豆蛋白/高酯果胶复配体系在温度的作用下G′出现显著变化。
图5为温度扫描测试升温终点,各复配体系G′与高酯果胶添加量的柱状关系图。由图5可以看出,添加0.4%果胶的复配体系在升温终点具有显著高于其他复配体系的G′,这表明,相较于其他复配体系,该体系在高温状态下仍能保持较稳定的固态特征。在较高温度的作用下,复配体系中大豆蛋白的二硫键的稳定性受到影响,使得大豆蛋白分子间的交联结构受到破坏,从而引起凝胶强度的下降,但适量的果胶能缓和由于二硫键受到破坏所造成的凝胶恶化的情况,这可能是由于果胶能作为复配体系中大豆蛋白分子间的“桥梁”,通过静电相互作用将大豆蛋白间接串联起来,从而形成均匀致密的网络结构,使得凝胶具有的凝胶强度增加[19]。但当添加过多的果胶后,体系的凝胶强度又开始降低,说明此时凝胶结构的致密性变差。

图5 不同高酯果胶添加量升温终点储能模量Fig.5 The storage modylus at the end of temperature ramp with different addition amount of high-ester pectin
2.2 对大豆蛋白凝胶质构特性的影响
表1呈现了大豆蛋白凝胶的质构特性随高酯果胶添加量的变化规律。从表1可以看出,复配体系的硬度随高酯果胶添加量的增加先升高后降低,当添加量为0.4%时,硬度值达到最大,并与其他复配体系之间存在显著性差异;弹性则能反应物体在外力作用下发生形变后,恢复其原状的能力,随着果胶添加量的逐渐增加,复配凝胶体系的弹性性能也在逐渐增加,这表明大豆蛋白/高酯果胶复配体系形成的凝胶网络结构逐渐致密,并且具有相当的弹性,此时的凝胶体系表现出明显的弹性固体特征,这与动态流变特性测试结果相类似,而当果胶的添加量再进一步增大时,凝胶体系结构从致密均匀的双连续型凝胶向颗粒状凝胶结构转变,复配体系网络结构受到破坏,凝胶中的大豆蛋白聚缩成团状颗粒,分子间的缝隙增加,因而体现在质构特性上即表现为弹性降低,固体特征减弱。
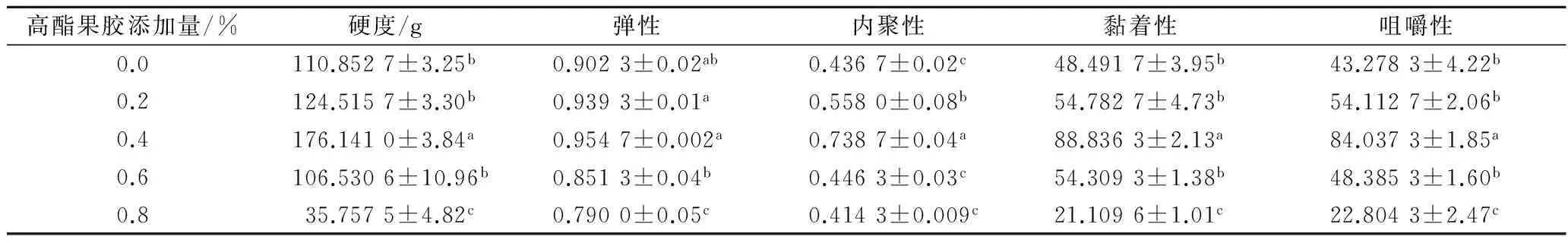
表1 大豆蛋白凝胶质构参数
注:在同一列中的平均值(±标准差)所带的不同字母表示差异显著(p<0.05)。
咀嚼性是描述固态食品食用口感的重要指标,大豆蛋白常被加工作为肉类替代食品,对于这类食品即需要类似于肌肉组织的良好咀嚼性。从表1看出,适量添加果胶的大豆蛋白可使其咀嚼性具有明显的提高,添加0.4%的果胶后,大豆蛋白的咀嚼性近乎增加了1倍,表明此时的大豆蛋白可在口腔中滞留的时间增长,用该类大豆蛋白制作的肉食替代品可比单一大豆蛋白制作的替代产品具有更好的食用口感,更能满足消费者的食用需求。大豆蛋白凝胶的黏着性在添加0.2%~0.4%的果胶后有一定提高,该现象可能是由高酯果胶自身的高黏度所造成,较高的黏着性可在一定程度上缓解大豆蛋白在形成凝胶过程中速度过快的问题[20]。
2.3 对大豆蛋白凝胶持水性的影响
持水性是大豆蛋白品质一个重要指标,是指食品在经脱水处理后保持水分或其他食品汁液的能力大小[21]。图6为大豆蛋白持水性随高酯果胶添加量的柱状关系图。大豆蛋白的持水能力主要取决于参与形成凝胶的大豆蛋白分子的多少以及凝胶的结构,当参与形成凝胶的大豆蛋白分子越少时,凝胶的孔径越大,其结构则表现的较为粗糙,这种凝胶的持水能力也就相对较差。
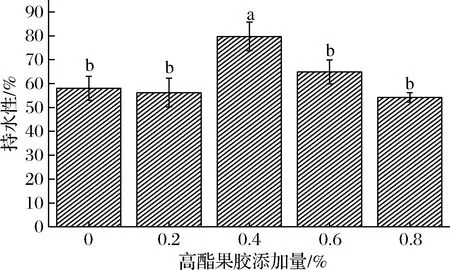
图6 高酯果胶对大豆蛋白凝胶持水性的影响Fig.6 Effect of high-ester pectin on water holding capacity of soybean protein gel
由图6可以看出,每一种复配体系中,大豆蛋白几乎都全部参与了凝胶的形成,因此,各体系的持水能力差别较小,仅在果胶添加量为0.4%时表现出显著性差异,这可能是由于果胶与大豆蛋白形成的网络结构使得凝胶的孔径减小,凝胶中孔径数量增多,此时大豆蛋白凝胶的微观结构变得致密、均匀,大豆蛋白对水分的束缚能力增强,而再增加果胶含量后,复配凝胶体系中发生微相分离[22-23],大豆蛋白的聚集相尺寸增大,果胶被镶嵌在大豆蛋白凝胶网络中,聚集相体积膨大,从而使得凝胶孔径增加,结构致密性变差,最终使复配体系的持水能力再次降低。
2.4 对大豆蛋白凝胶微观结构的影响
图7-(A)为未添加高酯果胶的大豆蛋白凝胶微观结构示意图。单一的大豆蛋白分子间形成的凝胶结构较为无序,凝胶网络稀疏,网络间的孔径大小不均一。从图7-(A)中可以看出,单一的大豆蛋白形成的凝胶网络性状复杂,某些部份呈现连续的凝胶网络,而某些部分则呈现出颗粒状的网络结构,连续部分的网络结构孔径数量较多且孔径较小,可具有较好的凝胶强度与较高的持水性,而颗粒状的网状结构则表现出较差的凝胶强度与较低的持水性,因而单一大豆蛋白的流变与质构性质及持水性是这2种凝胶网络结构的综合表现。
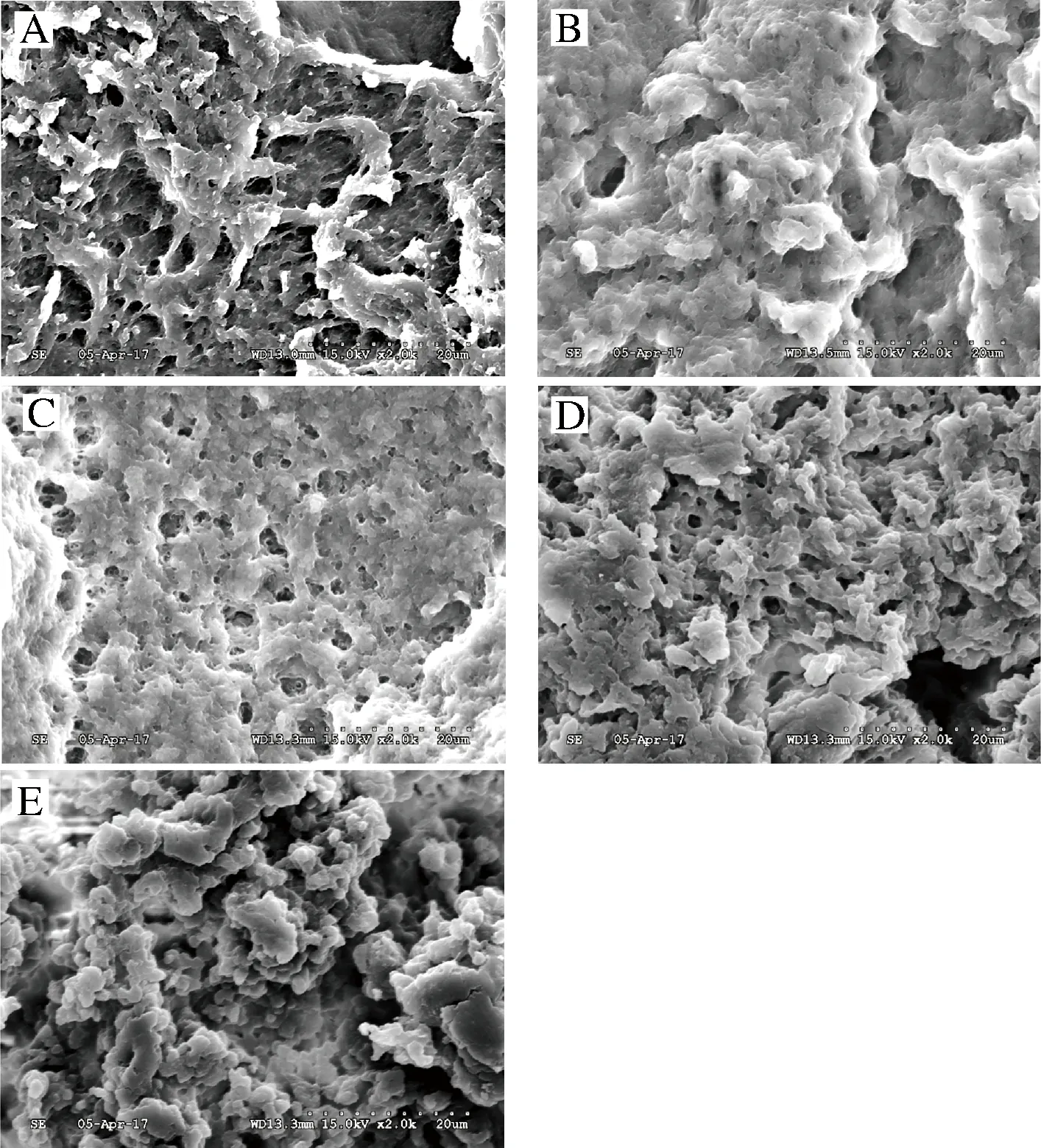
高酯果胶添加量:A-0%;B-0.2%;C-0.4%;D-0.6%;E-0.8%图7 不同高酯果胶添加量的大豆蛋白凝胶扫描电镜图Fig.7 SEM of soybean protein gel with different addition amount of high-ester pectin
图7-(B)为添加0.2%高酯果胶的大豆蛋白凝胶微观结构示意图。此时的大豆蛋白与果胶间产生静电相互作用,开始逐步形成相分离凝胶结构,与单一大豆蛋白凝胶结构相比,该体系下的凝胶中孔径大小相对均匀,体系的凝胶结构开始趋于连续的双连续网络凝胶结构[25]。
图7-(C)为添加0.4%高酯果胶的大豆蛋白凝胶微观结构示意图。此添加量下的大豆蛋白凝胶结构发生显著变化。大豆蛋白与果胶在强静电相互作用下,形成了致密的双连续型网络凝胶结构,此时复配体系具有的网络孔径分布均匀、数量较多且直径较小。大面积的连续网络结构赋予了复合凝胶相当程度的强度,这种连续网络结构能使凝胶在受到外界剪切作用或在温度较高的情况下保持一定的抗性,凝胶的固态物体特征不易被破坏[25],因此,这种连续网络结构也能更好地解释在动态流变特性的测试中,0.4%的果胶与大豆蛋白所形成的复配体系总是比其他体系具有更高的储能模量,且该种复合凝胶可适用于条件较为剧烈的加工食品的原辅料。
图7-(D)为添加0.6%高酯果胶的大豆蛋白凝胶微观结构示意图。当果胶添加量超过0.4%以后,大豆蛋白开始逐渐形成聚集体,孔径大面积消失,凝胶网络结构再次变得复杂无序。
图7-(E)为添加0.8%高酯果胶的大豆蛋白凝胶微观结构示意图。随着果胶含量的进一步加大,大豆蛋白间形成的聚集体体积变大,聚集体的比表面积减小,大豆蛋白中能暴露出的表面疏水基团与自由电荷急剧减少,聚集体的存在导致了大豆蛋白分子间相互交联程度下降,进而表现出弱的凝胶强度。
2.5 对大豆蛋白Zeta电位的影响
Zeta电位对维持体系的稳定性以及对形成不同类型的聚集体有重要作用[26],大豆蛋白为典型的两性电解质,其pI约为4.5,当大豆蛋白在pH值低于4.5的环境条件下时带正电荷,在pH值高于4.5时带有负电荷,大豆蛋白表面所带电荷的多少以及电荷的正负对大豆蛋白的Zeta电位具有较大的影响[27]。图8为高酯果胶对大豆蛋白Zeta电位的影响。
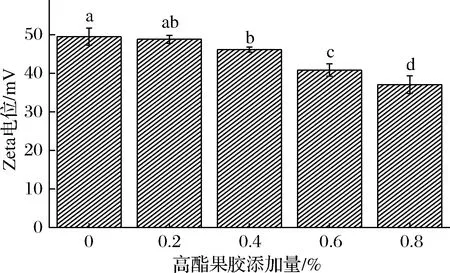
图8 高酯果胶对大豆蛋白Zeta电位的影响Fig.8 Effects of high-ester pectin on Zeta potential of soybean protein
由图8可知,以大豆蛋白作为主体,所有测试样品的Zeta电位均为正值,表明在pH 3.5时,大豆蛋白带有较多的正电荷,随着高酯果胶的添加量逐渐增多,大豆蛋白的Zeta电位值逐渐降低,且不同高酯果胶添加量的大豆蛋白间的Zeta电位存在显著性差异(p<0.05)。
高酯果胶属于阴离子多糖,其表面带有大量的负电荷,当添加适量的高酯果胶时,高酯果胶中的负电荷与大豆蛋白所带的正电荷结合,使得大豆蛋白与高酯果胶能通过较强的静电相互作用交联。高酯果胶添加量为0.2%时,这种静电相互作用可能由于引入的负电荷较少从而表现得较为微弱,当添加量达到0.4%时,高酯果胶带入的负电荷数量增加,静电相互作用开始明显地显现,由于强静电作用大豆蛋白与高酯果胶间的联结紧密,能形成有序的凝胶网络结构。随着高酯果胶的进一步添加,负电荷的数量越来越多,大豆蛋白表面所带有的同性电荷数量开始下降,静电排斥作用减弱,体系的稳定性将会随之降低[28]。Zeta电位的测定与微观结构观察表现出类似的结果,添加过多的高酯果胶后,大豆蛋白表面的疏水基团内卷,包埋在大豆蛋白分子内部,其表面疏水性下降,从而使得体系中的蛋白质趋向于相互聚集,当高酯果胶添加量在0.8%时,这种聚集现象最为明显,此时大豆蛋白凝胶网络恶化,呈现较为分散的团块状,Zeta电位的测试结果也能从静电相互作用的层面解释大豆蛋白凝胶流变特性的变化规律。
3 结论
在pH值为3.5的酸性条件下,适量的高酯果胶对大豆蛋白的凝胶特性具有一定的修饰作用。添加0.4%的高酯果胶能显著改变大豆蛋白的弹性和黏性性能等流变特性,并能提高其凝胶强度,适当改善大豆蛋白的持水能力,微观结构也表现出致密均匀的状态,大豆蛋白Zeta电位的测定,解释了大豆蛋白凝胶结构的变化规律。因此若将该种复配体系应用在食品领域中,可提高食品加工的条件以提高加工效率,该种复配凝胶也适合于作为一种新型食品原料,代替某些功能性质欠佳的传统食品原料。
[1] BRIME B, MORENO M A, FRUTOS G ,al. Amphotericin B in oil-water lecithin-based microemulsions: Formulation and toxicity evaluation[J].Journal of Pharmaceutical Sciences,2002,91(4):1 178-1 185.
[2] 牛付阁.卵白蛋白-阿拉伯胶相互作用及其在油水界面的吸附特性[D].无锡:江南大学,2015.
[3] 董蝶.大豆蛋白/阿拉伯胶复合物形成机理及其功能性质研究[D].无锡:江南大学,2016.
[4] 闵维.大豆蛋白/多糖复合凝胶流变学及微观结构研究[D].广州:华南理工大学,2010.
[5] HUA Y F, CUI S W, WANG Q, et al. Heat induced gelling properties of soy protein isolates prepared from different defatted soybean flours[J]. Food Research International. 2005, 38 (4): 377-385.
[6] MAY C D. Industrial pectins: sources, production and applications[J]. Carbohydrate Polymers, 1990, 12(1): 79-99.
[7] El-NAWAWI S A, HEIKAL Y A. Production of a low ester pectin by de-esterification of high ester citrus pectin[J]. Carbohydrate Polymers, 1995, 27(3): 191-195.
[8] 张庆坤, 雷激, 张大凤. 果胶酯酶制备低酯果胶的研究进展[J]. 食品工业科技, 2007(8): 243-246.
[9] 王卫平. 食品品质改良剂:亲水胶体的性质及应用(之五)──果胶[J].食品与发酵工业,1996,22(4): 81-84.
[10] 陈昀赵谋明,哲浩等蛋白质与多糖类交互作用研究进展[J].食品科学,2001,22(4):90-93.
[11] 夏晓凤.大豆可溶性多糖对大豆蛋白凝胶的影响及机理初探[D].无锡:江南大学,2015.
[12] CHAISAWANG M, SUPHANTHARIKA M. Effects of guar gum and xanthan gum additions on physical and rheological properties of cationic tapioca starch[J]. Carbohydrate polymers, 2005, 61(3):288-295.
[13] COOPER C L, DUBIN P L, KAYITMAZER A B, et al. Polyelectrolyte-protein complexes[J].Current Opinion in Colloid and Interface Science, 2005,10(1/2):52-78.
[14] WANG X, LEE J, WANG Y W, et al. Composition and rheological properties of β-lactoglobulin/pectin coacervates: effects of salt concentration and initial protein/polysaccharide ratio[J].Biomacromolecules,2007,8(3):992-997.
[15] LANEUVILLE S I, TURGEON S L, SANCHEZ C, et al. Gelation of native β-lactoglobulin induced by electrostatic attractive interaction with xanthan gum[J].Langmuir, 2006,22(17):7 351-7 357.
[16] 李里特.食品物性学[M].北京:中国农业出版社,2010.
[17] YUAN Y, WAN Z L, YIN S W, et al. Formation and dynamic interfacial adsorption of glycinin/chitosan soluble complex at acidic pH: Relationship to mixed emulsion stability[J]. Food Hydrocolloids, 2013, 31(1): 85-93.
[18] CHIVERO P, GOHTANI S, IKEDA S, et al. The structure of soy soluble polysaccharide in aqueous solution[J]. Food Hydrocolloids. 2014, 5: 279-286.
[19] TAJIK S, MAGHSOUDLOU Y,KHODAIYAN F,et al. Soluble soybean polysaccharide: A new carbohydrate to make a biodegradable film for sustainable green packaging[J]. Carbohydrate Polymers, 2013, 97 (2): 817-824.
[20] LIU R, ZHAO Si-ming, XIE Bi-jun, et al. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J]. Food Hydrocolloids, 2011, 25(5): 898-906.
[21] SALARBASHI D, TAJIK S, SHOJAEE-ALIABADI S, et al. Development of new active packaging film made from a soluble soybean polysaccharide incorporatedZatariamultifloraBoiss andMenthapulegiumessential oils[J]. Food Chemistry, 2014, 146: 614-622.
[22] 詹晓北.食用胶的生产、性能与应用[M].北京:中国轻工业出版社,2003.
[23] TRAN T, ROUSSEAU D. Stabilization of acidic soy protein-based dispersions and emulsions by soy soluble polysaccharides[J]. Food Hydrocolloids, 2013, 30 (1): 382-392.
[24] LIU Z M,HO S C, CHEN Y M, et al. The effects of isoflavones combined with soy protein on lipid profiles, -reactive protein and cardiovascular risk among postmenopausal Chinese women[J]. Nutrition, Metabolism and Cardiovascular Diseases, 2012, 22 (9): 712-719.
[26] MATSUDOMI N, ISHIMURA Y, KATO A. Improvement of gelling properties of ovalbumin by heating in dry state [J]. Agricultural and Biological Chemistry, 1991,55:879-881.
[27] BOUZID H, RABILLER-BAUDRY M, PAUGAM L, et al. Impact of zeta potential and size of caseins as precursors of fouling deposit on limiting and critical fluxes in spiral ultrafiltration of modified skim milks[J]. Journal of Membrane Science, 2008,314(1/2):67-75.
[28] WONG B T, DAY L , AUGUSTIN M A . Deamidated wheat protein-dextran Maillard conjugates: effect of size and location of polysaccharide conjugated on steric stabilization of emulsions at acidic pH[J].Food Hydrocolloids, 2011, 25(6): 1 424-1 432.
