不同离子强度下罗非鱼肌球蛋白热变性聚集研究
2018-02-28李婷朱潘红齐慧红周春霞洪鹏志
李婷,朱潘红,齐慧红,周春霞,洪鹏志
(广东海洋大学 食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,广东 湛江,524088)
鱼类肌肉中最主要的蛋白是肌原纤维蛋白,约占总蛋白含量的60%~70%,而肌球蛋白又是肌原纤维蛋白“粗丝”的主要组成成分,是一类由2个球状头部和一个棒状尾部组成的不对称大分子,长约160 nm,以“Y”形状态存在,占肌原纤维蛋白的55%~60%[1]。肌球蛋白为盐溶性蛋白,在体外低离子强度(<200 mmol/L KCl)下不溶,为纤丝状聚合物,但随着盐浓度的增加,高离子强度(600 mmol/L KCl)下肌球蛋白纤丝会逐渐解离[2-3]形成单体。温度也会影响肌球蛋白单体或低聚物的自组装,肌球蛋白受热会发生变性、聚集。肌球蛋白的盐溶特性和热变性一直是国内外的研究热点。养殖暹罗鳄肌原纤维蛋白在低离子强度(0.1~0.2 mol/L NaCl)条件下溶解度差,随着离子强度的升高(0.4~1.0 mol/L NaCl),肌原纤维蛋白的溶解度增大,当NaCl浓度达到1.0 mol/L,溶解度达到最大[4];经0.3 mol/L盐溶液透析过的秘鲁鱿鱼肌球蛋白改用0.5 mol/L盐溶液进行再透析,其溶解度明显升高[5];鸡胸肉肌球蛋白在高盐浓度下溶解度较好,在0.2~0.8 mol/L KCl范围内,随着KCl浓度的上升,溶解度增大[6],由此也会影响肌球蛋白的热变性及相关特性。对鲤鱼肌球蛋白热处理研究表明,34 ℃时肌球蛋白头部开始发生聚集,形成凝胶,储能模量增加[7];兔骨骼肌肌原纤维蛋白的凝胶强度在30~50 ℃范围内随着温度升高而增强,温度继续升高,凝胶强度基本稳定[8]。这些研究对肌球蛋白的热诱导凝胶机制进行了深入的探讨,但是关于低盐条件下肌球蛋白的热聚集变性方面的研究较少。
低盐鱼糜食品是当前相关加工业的主流产品,水产蛋白的不稳定性严重制约了水产品的开发和精加工。肌球蛋白是鱼类蛋白的主要功能性蛋白质,研究低离子强度下的肌球蛋白增溶对水产蛋白的加工具有实际指导意义。因此,本文以罗非鱼肌球蛋白为研究对象,在不同离子强度(1、50、150、300、600 mmol/L KCl)下进行热处理(40、50、60、70、80 ℃),分析不同条件下肌球蛋白结构的变化,为低盐水产品的开发提供基础。
1 材料与方法
1.1 材料与试剂
新鲜罗非鱼,购于湛江市工农市场(2017.04~2017.05),迅速带回实验室处理,取其背部白肉部分,低温保存。所有操作均在4 ℃环境中进行。
KCl、(NH4)2SO4、三羟基甲基氨基甲烷、乙二胺四乙酸二钠(EDTA)等,购于广州化学试剂厂;二水合磷酸二氢钠、十二水合磷酸氢二钠、六水合氯化镁等,购于广州光华科技股份有限公司;5-腺苷三磷酸二钠盐(ATP)、马来酸和二硫苏糖醇(DTT),购于广州齐云生物技术有限公司;乙二醇双(2-氨基乙基)四乙酸(EGTA),购于上海源叶生物科技有限公司;8-苯胺基萘-1-磺酸(1,8-ANS),购于美国Sigma公司;快速Lowery法蛋白含量测定试剂盒,购于上海荔达生物科技有限公司;以上试剂均为分析纯。
1.2 仪器与设备
TU-20HT恒温水浴锅,英国Bibby Scientific有限公司;UV757紫外分光光度计,上海精科实业有限公司;RF-5301P荧光分光光度计,日本岛津公司;Chirascan圆二色谱仪,英国应用光物理公司;Nano-2s MPT-2纳米粒度分析仪,英国马尔文仪器有限公司。
1.3 实验方法
1.3.1 肌球蛋白的提取

1.3.2 不同离子强度下肌球蛋白样液的制备
将肌球蛋白原液分别用不同离子强度的溶液(20 mmol/L Tris-HCl,KCl浓度分别为1、50、100、150、300、600 mmol/L,pH 7.0),透析24 h,检测蛋白浓度,并用对应的透析液稀释到2.0 mg/mL[11],即得不同离子强度下的肌球蛋白溶液。
1.3.3 肌球蛋白样液的热处理
将蛋白溶液分别进行水浴热处理,控制升温速率约为1 ℃/min。升温过程中,当样液中心温度达到实验设置的温度(40、50、60、70、80 ℃)条件时[8],取出蛋白溶液迅速在冰水中冷却至4 ℃备用。
1.3.4 浊度的测定
取热处理后的蛋白样液稀释至0.5 mg/mL,在波长为350 nm处测定吸光度A350 nm,即为样品的浊度[12]。
1.3.5 溶解度的测定
将热处理后的蛋白溶液离心(50 000×g,15 min,4 ℃)取上清液,采用lOWRY法[10]测其蛋白含量。肌球蛋白的溶解度按离心所得上清液中蛋白浓度占未处理前溶液中总蛋白浓度的百分比计算。每个样品重复3次。
1.3.6 表面疏水性的测定
采用ANS荧光探针法[13]检测。将热处理后的蛋白溶液逐步稀释至(0.5、0.25、0.125、0.062 5 mg/mL),各取4 mL,分别加入20μL的ANS溶液(8.0 mmol/L ANS,0.01 mol/L Tris-HCl,pH 7.0),混匀后静置10 min(避光),测定样品的荧光强度(FI)。所用的激发波长和发射波长分别为374 nm和485 nm,狭缝宽为5 nm。将添加探针的样品荧光强度值减去对应样品的内源荧光强度值即为蛋白质的相对荧光强度值(RFI)。以RFI对蛋白质浓度作图,其初始段的斜率作为蛋白质的表面疏水性指标(ANS-S0)。
1.3.7 二级结构的分析
取适量肌球蛋白溶液,用对应缓冲液稀释至100 μg/mL,用仪器控温程序进行热处理,进行圆二色谱测定。波长扫描范围为190~260 nm,样品池光径为1 mm,测量温度为4 ℃,以缓冲液做空白,实验值为扫描3次的均值,α-螺旋含量的计算见公式(1)、(2)[14]:
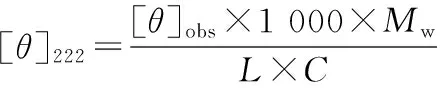
(1)

(2)
式中:[θ]obs为222 nm处的椭圆率,mdeg;[θ]222为222 nm处的摩尔椭圆率,deg·cm2/dmol;Mw为肌球蛋白的平均残基分子质量,取115 g/mol[12];C为肌球蛋白质量浓度,mg/mL;L为比色皿光程长度,cm。
1.3.8 粒径的测定
利用动态光散射技术(DLS),采用He-Ne激光在633 nm下对热处理前后的蛋白溶液(1.0 mg/mL)进行粒径的测定,用90°散射角对样品进行除尘,室温下稳定1 min后进行测试[11]。
1.4 数据分析
所有实验测定均重复操作3次,数据均用Origin 7.5处理,利用JMP 7.0分析方差,使用多重比较进行差异显著性(p<0.05)分析。
2 结果与分析
2.1 不同离子强度条件下热处理对肌球蛋白体系浊度的影响
不同离子条件下升温热处理(40、50、60、70、80 ℃)对肌球蛋白体系浊度的影响结果如图1所示。由图1可知,在实验范围内,热处理前后肌球蛋白体系的浊度随离子强度的升高而下降。当KCl浓度为1 mmol/L时,肌球蛋白分子聚集呈纤丝[2],体系浑浊,可检测的浊度值最大(p<0.05);升温处理至40 ℃时,体系浊度明显增大(p<0.05),且随着热处理的温度升高,浊度进一步增大;当温度升高到70 ℃时,体系呈现弱凝胶状态,体系热稳定性差;而随着盐浓度的增大,肌球蛋白纤丝逐渐解聚,当KCl浓度为50~150 mmol/L时,未经热处理的肌球蛋白体系浊度明显下降(p<0.05),经热处理后,解聚的蛋白分子变性聚集,体系浊度增大(p<0.05);但随着KCl浓度增大至300~600 mmol/L时,高浓度的盐离子会破坏分子间静电相互作用,肌球蛋白呈单体或二聚体状态[15],溶液澄清透亮,且经40 ℃热处理后,浊度变化不明显,但当温度升高到50~80 ℃时,解离的肌球蛋白分子变性聚集,浊度增大。因此,低盐条件(<300 mmol/L KCl)下肌球蛋白热稳定性极差,易发生聚集沉淀。
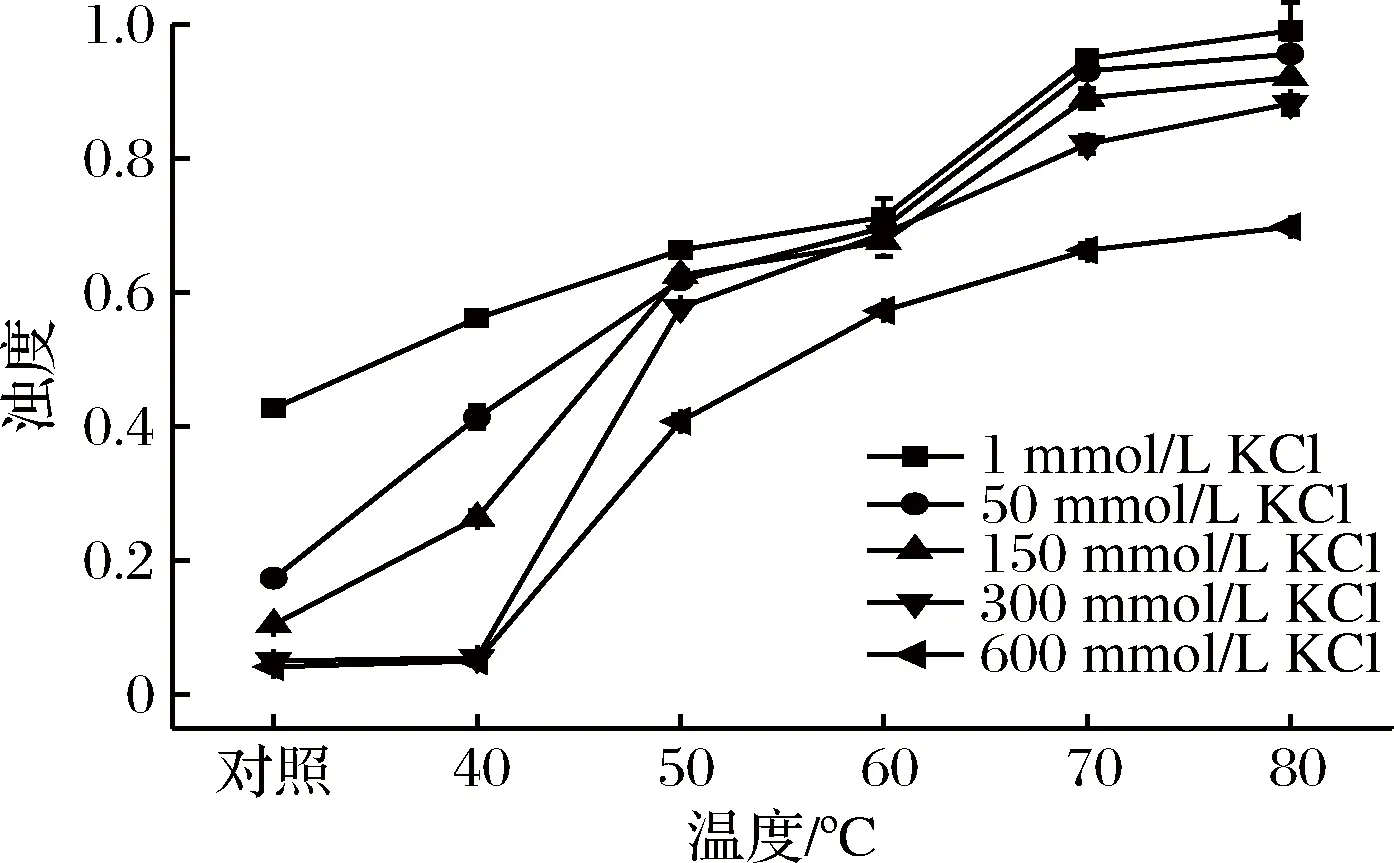
图1 不同离子强度条件下热处理过程中罗非鱼肌球蛋白体系浊度的变化Fig.1 Changes of turbidity of tilapia myosin during heating process at various ionic strengths
2.2 不同离子强度条件下热处理对肌球蛋白溶解度的影响
将热处理后的肌球蛋白体系进行高速离心,检测其可溶性蛋白含量。由图2可知,当KCl浓度为1 mmol/L时,肌球蛋白分子聚集呈纤丝[2-3],溶解性极差,未经热处理时肌球蛋白溶解度约30%,经热处理后分子运动加剧,分子间聚集沉淀[16],溶解度进一步降低至6%左右;当KCl浓度增加到50~150 mmol/L时,肌球蛋白纤丝逐渐解聚蛋白部分溶解,溶解度增加,但体系仍然浑浊;随着热处理的进行,当温度升高到50 ℃时,肌球蛋白几乎完全聚集沉淀,溶解度极低;当KCl浓度升高到300~600 mmol/L时,高浓度的盐离子破坏分子间的静电相互作用,抑制丝状体形成,分子以单体或可溶性寡聚体形式存在[15, 17],肌球蛋白溶几乎完全可溶,且经40 ℃热处理后,体系可溶性蛋白含量变化不明显(p<0.05),这与浊度的检测结果一致。由此推测高盐对肌球蛋白分子有保护作用。当温度进一步升高到50 ℃,300 mmol/L KCl下的肌球蛋白体系出现明显沉淀,溶解度下降(p<0.05),而600 mmol/L KCl下的肌球蛋白溶解度下降较小,且温度上升到80 ℃时,体系溶解度仍高于60%,表明中性盐的存在可能在一定温度范围内提高了肌球蛋白热变性温度。
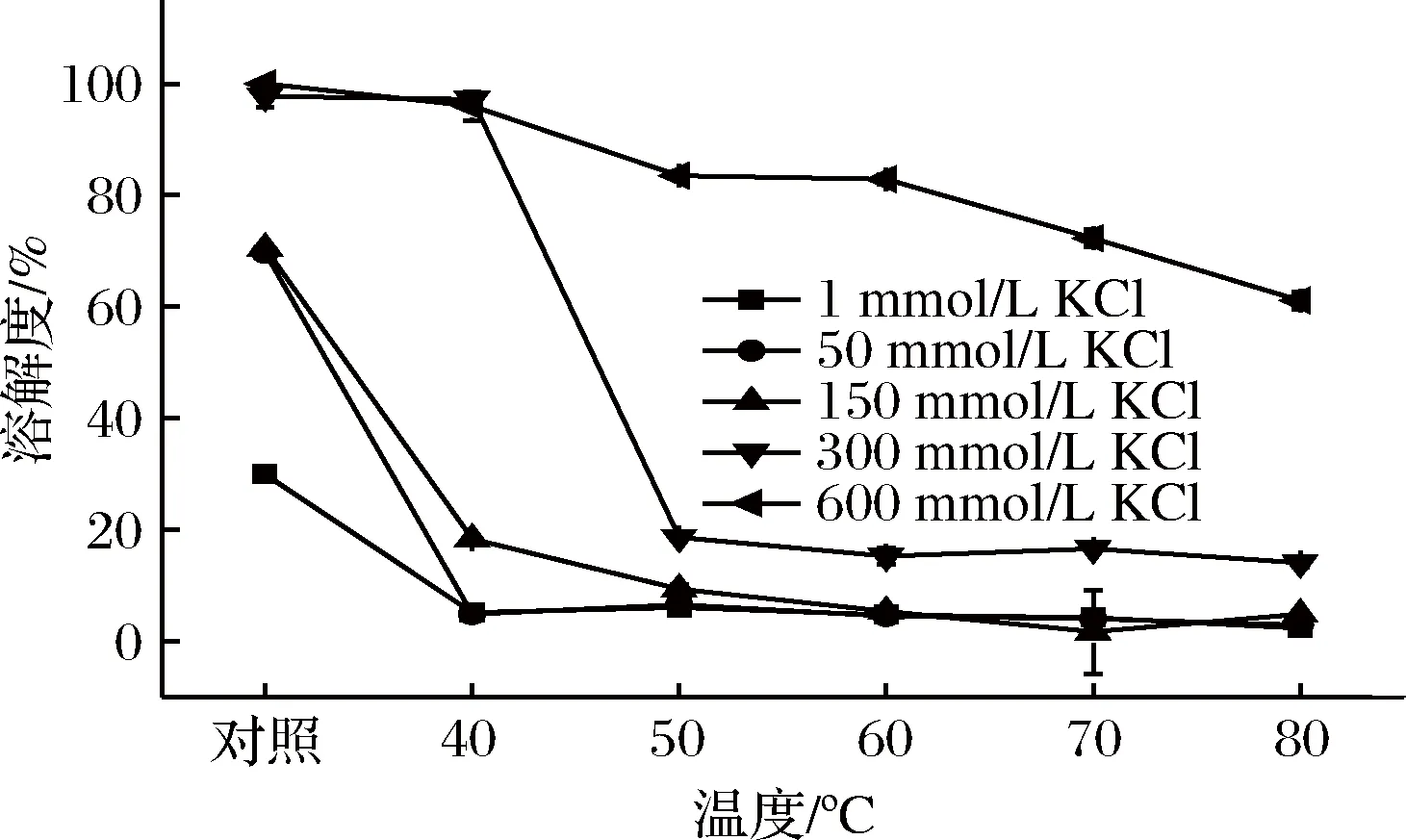
图2 不同离子强度条件下热处理过程中罗非鱼肌球蛋白溶解度的变化Fig.2 Changes of solubility of tilapia myosin during heating process at various ionic strengths
2.3 不同离子强度条件下热处理对肌球蛋白表面疏水性的影响
8-苯氨基-1-萘磺酸(ANS)是一种阴离子型荧光探针,可以通过疏水作用和静电相互作用与蛋白质分子表面的疏水基团结合[18],由此反映蛋白质分子表面疏水性的大小。如图3所示,在实验范围内,未经热处理的实验组可溶性肌球蛋白分子表面疏水性均随离子强度的增加而增大,说明随着离子强度的增加,肌球蛋白的表面疏水性增大,可能与盐离子浓度升高导致蛋白表面疏水区域暴露[18]及不同离子强度下肌球蛋白分子的聚集状态有关。随着热处理的进行,低离子强度下的肌球蛋白分子明显聚集,溶解度降低,可溶性肌球蛋白含量少,检测到的ANS-S0值较小,甚至较热处理前有降低趋势;KCl浓度为150~300 mmol/L时,肌球蛋白的表面疏水性稍有增大,但无显著差异(p>0.05);但当KCl浓度为600 mmol/L时,蛋白质分子间疏水相互作用显著增大(p<0.05)。结合肌球蛋白的溶解度变化结果分析,高盐离子可以促进肌球蛋白溶解[5],更多的可溶性蛋白可以与探针结合,表面疏水性增大;经热处理后,肌球蛋白的三级结构被破坏,分子结构更加伸展,掩藏在肌球蛋白分子内部的疏水性氨基酸残基逐渐暴露到分子表面[19],可与ANS-S0结合的疏水区域作用位点增加,因此ANS-S0增大。

图3 不同离子强度条件下热处理过程中罗非鱼肌球蛋白表面疏水性的变化Fig.3 Changes of surface hydrophobicity of tilapia myosin during heating process at various ionic strengths注:图中大写A、B、C代表同一温度下的显著性差异;小写字母a、b、c代表同一离子强度下的显著性差异。
2.4 不同离子强度条件下热处理对肌球蛋白α-螺旋含量的影响
肌球蛋白由球状头部和杆状尾部构成,其中杆状尾部是通过双股α-螺旋缠绕而成[9]。可根据圆二色谱图中α-螺旋在208 nm 和222 nm 处的特征峰进行分析(图谱未列出)。结果如图4所示,未经热处理的肌球蛋白分子α3螺旋含量随着离子强度的升高而增大。盐浓度的增加使肌球蛋白纤丝逐渐解聚,当达到高离子强度600 mmol/L KCl时,肌球蛋白已经完全解离成单体[3],肌球蛋白的α-螺旋含量达到最大。但是随着热处理的进行,蛋白分子发生剧烈热运动,蛋白分子结构伸展,螺旋结构打开,α-螺旋含量明显下降(p<0.05)。在本实验中,升温至40 ℃时,α-螺旋含量降低不显著(p>0.05);进一步升温到50 ℃时,α-螺旋含量出现显著下降趋势(p<0.05);此后,温度越高,α-螺旋含量越低。当温度逐渐达到80 ℃时,α-螺旋含量降至最低,此时蛋白质变性程度最大,这也证实了热处理是导致蛋白质结构改变,影响蛋白质稳定的重要因素。并且高离子强度下的肌球蛋白α-螺旋含量较低离子强度下的变化程度较小,可能是因为α-螺旋主要靠多肽链上的羰基(—CO)和氨基(—NH)之间的氢键所维持,此外静电相互作用对它也有影响[20],而高盐离子的存在产生了静电屏蔽效应,减弱了电荷对氢键的影响[21],二级结构变化程度较小。因此,这也进一步证实了高盐对肌球蛋白分子结构有一定保护作用。

图4 不同离子强度条件下热处理过程中罗非鱼肌球蛋白α-螺旋含量的变化Fig.4 Changes of α-helix content of tilapia myosin during heating processat various ionic strengths注:图中大写A、B、C代表同一温度下的显著性差异;小写字母a、b、c代表同一离子强度下的显著性差异。
2.5 不同离子强度条件下热处理对肌球蛋白粒径的影响
蛋白质聚集具体表现为粒径的增大,从动态光散射的结果可直观了解肌球蛋白聚集体的大小。温度是引起蛋白质聚集的主要因素,直接影响粒径。结果如图5所示,热处理前,由于在较低的离子强度下,肌球蛋白呈细长丝状,溶液中颗粒较多,聚集成团,溶解性差,粒径较大;而随着离子强度的升高,聚集的肌球蛋白经历先解聚再解离的过程,蛋白质分子以单体形式存在[17],蛋白溶解度逐渐增加,粒径显著减小(p<0.05)。热处理后,在低离子强度1 mmol/L KCl下,肌球蛋白丝状聚合物团聚明显,粒径显著增大(p<0.05),但当温度进一步升高,由于聚集体粒径太大而发生沉降,导致其对光的散射减弱,使粒径呈现微弱的下降趋势;当处理温度达到60~70 ℃时,50~150 mmol/L KCl条件下的肌球蛋白溶液呈现显著性变化(p<0.05)。而热处理对离子强度300~600 mmol/L KCl下的肌球蛋白粒径影响不明显(p>0.05)。结合热处理对肌球蛋白体系浊度和分子二级及三级结构的变化分析,低盐条件下的肌球蛋白以纤丝状存在,稳定性差,经热处理分子进一步聚集沉淀,且温度越高,形成的蛋白簇的粒径也越大;而随着盐离子浓度升高,离子间的静电吸引受到干扰,肌球蛋白纤丝解离,可溶性蛋白增多,溶解度增加,热处理后分子三级结构展开,分子间疏水作用增强,二级结构破坏,分子聚集,且高盐(300~600 mmol/L KCl)离子的存在减弱了温度对分子结构的影响,导致其热处理前后粒径变化不明显。

图5 不同离子强度条件下热处理过程中罗非鱼肌球蛋白粒径的变化Fig.5 Changes of particle size of tilapia myosin during heating process at various ionic strengths注:图中大写A、B、C……代表同一温度下的显著性差异;小写字母a、b、c……代表同一离子强度下的显著性差异。
3 结论
热处理是一项基础的加工工序,在水产食品加工中不可避免,而热变性聚集引起的肌球蛋白功能特性的变化很大程度上限制了水产蛋白的应用。肌球蛋白的高盐溶特性也与当今开发“低钠”食品的理念相悖。因此,改善肌球蛋白的溶解性和稳定性成为了各国科学家最为关注的问题之一。了解不同离子强度条件下肌球蛋白热变性聚集行为及机制有助于为罗非鱼资源的深加工提供理论依据,进而扩大水产蛋白的应用范围。实验结果表明,热处理对不同离子强度下肌球蛋白热变性聚集的影响不完全相同。在低离子强度(1 mmol/L KCl)下,未经热处理的肌球蛋白分子聚集,体系浑浊,溶解度和表面疏水性较低;热处理后的蛋白分子进一步聚集,α-螺旋含量下降,且随着热处理温度的升高聚集体粒径迅速增大,体系明显沉淀,溶解度下降,体系热稳定性极差;随着离子强度的增加,肌球蛋白开始解聚,溶解度逐渐增大,经热处理后的肌球蛋白二、三级结构发生改变,分子开始聚集,粒径增大;而在600 mmol/L KCl溶液中,肌球蛋白溶解性好,溶液澄清,热处理后溶解度下降,α-螺旋结构减少,表面疏水性显著增大,但与低离子强度下的变化相比,程度较小。综合分析,高盐条件下单体状态的肌球蛋白分子经热处理后肽链展开,疏水基团暴露,而高离子强度所产生的静电屏蔽效应一定程度上保护了肌球蛋白分子结构,其变化程度较小,体系热稳定性较好。
[1] LANIERT C, CARVAJAL P, YONGSAWATDIGUL J, et al. Surimi Gelation Chemistry[M].3rd ed. Boca Raton: CRC Press, 2013:435-489.
[2] HAYAKAWA T, ITO T, WAKAMATSU J, et al. Myosin filament depolymerizes in a low ionic strength solution containing l-histidine[J]. Meat Science, 2010, 84(4):742-746.
[3] TSUNASHIMA Y, AKUTAGAWA T. Structure transition in myosin association with the change of concentration: solubility equilibrium under specified KCl and pH condition[J]. Biopolymers, 2004, 75(3):264-277.
[4] 肖琨, 王锡昌. 养殖暹罗鳄肉肌原纤维蛋白的理化性质[J]. 食品科学, 2014, 35(23):92-98.
[5] 周茹, 倪渠峰, 林伟伟,等. 肌原纤维蛋白溶解度对盐离子浓度的依赖性[J]. 中国食品学报, 2015, 15(3):32-39.
[6] 张秋会, 周向辉, 李苗云,等. 鸡肌球蛋白凝胶保水性研究[J]. 内蒙古农业大学学报:自然科学版, 2014, 35(1):120-124.
[7] JIA D, YOU J, HU Y, et al. Effect of CaCl2on denaturation and aggregation of silver carp myosin during setting[J]. Food Chemistry, 2015, 185:212-218.
[8] HAYAKAWA T, YOSHIDA Y, YASUI M, et al. Heat-induced gelation of myosin in a low ionic strength solution containingL-histidine[J]. Meat Science, 2012, 90(1):77-80.
[9] 洪伟. pH值条件诱导鳄蛇鲻肌球蛋白分子展开/折叠行为的研究[D]. 湛江: 广东海洋大学, 2014.
[10] LOWERY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the folin phenol reagent[J]. Journal of Biological Chemistry,1951, 193(1): 265-275.
[11] 周春霞, 时娇娇, 付苇娅,等. 赖氨酸和精氨酸对三种离子强度下罗非鱼肌球蛋白溶解度及构象的影响[J]. 现代食品科技, 2016(12):99-104.
[12] VISESSANGUAN W, OGAWA M, NAKAI S, et al. Physicochemical changes and mechanism of heat-induced gelation of arrowtooth flounder myosin[J]. Journal of Agricultural and Food Chemistry, 2000, 48(4): 1 016-1 023.
[13] ALIZADEH PASDAR N, LI CHAN ECY. Comparison of protein surface hydrophobicity measured at various pH values using three different fluorescent probes[J]. Journal of Agricultural and Food Chemistry, 2000, 48(2): 328-334.
[14] OGAWA M, KANAMARU J, MIYASHITA H, et al. Alpha-helical structure of fish actomyosin: changes during setting[J]. Journal of Food Science, 1995, 60(2):297-299.
[15] 赵晓阳, 李可, 邹玉峰,等. 组氨酸与氯化钾混合液对兔肉肌球蛋白特性的影响[J]. 食品科学, 2014, 35(9):6-10.
[16] PROMEYRAT A, BAX M L, TRAORÉ S, et al. Changed dynamics in myofibrillar protein aggregation as a consequence of heating time and temperature[J]. Meat Sci, 2010, 85(4):625-631.
[17] FINER J T, SIMMONS R M, SPUDICH J A. Single myosin molecule mechanics: piconewton forces and nanometresteps[J]. Nature, 1994, 368:113-119.
[18] 余晶梅, 林东强, 童红飞, 等. 荧光探针法研究牛血清白蛋白和免疫球蛋白的表面疏水特性[J]. 高校化学工程学报, 2014, 28(4): 771-776.
[19] CAO Y, XIA T, ZHOU G, et al. The mechanism of high pressure-induced gels of rabbit myosin[J]. Innovative Food Science & Emerging Technologies, 2012, 16(39):41-46.
[20] RU L, ZHAO S M, LIU Y M, et al. Effect of pH on the gel properties and secondary structure of fish myosin[J]. Food Chemistry, 2010, 121(1):196-202.
[21] SMITH J S, SCHOLTZ J M. Energetics of polar side-chain interactions in helical peptides: salt effects on ion pairs and hydrogen bonds[J]. Biochemistry, 1998, 37(1): 33-40.
