新疆风干肉中优势乳酸菌的分离及产酶特性分析
2018-02-28李宇辉郭安民刘成江王俊钢
李宇辉,郭安民,刘成江,王俊钢*
1(新疆农垦科学院 农产品加工研究所,新疆 石河子,832000) 2(新疆农垦科学院,农产品加工重点实验室,新疆 石河子,832000)
新疆的风干肉是新疆游牧民族的特色肉制品之一,其中以塔城风干肉最为有名。风干肉又分为风干牛肉、风干马肉、风干羊肉。风干肉的制作时间多为秋季[1],现宰的牛、羊、马肉经过短时间腌制,自然发酵风干而形成,属于发酵肉制品的一种。风干肉风味独特,脂肪氧化、香辛料的添加及氨基酸的Strecker降解是新疆风干肉挥发性成分的主要来源[2],而脂肪氧化和氨基酸降解与微生物的作用息息相关。KABAN分析了土耳其Pastirma在加工过程中的微生物变化,乳酸菌和氧化氨酶阳性球菌被推荐用作发酵剂去改善Pastirma的品质特性[3]。PETIT等人对南非的Biltong中的微生物进行了调査分析,主要的优势乳酸菌鉴定为腐生葡萄球菌[4],优势的微生物产生各种酶类,分解脂肪和蛋白质,使之形成脂肪酸、小肽和氨基酸[5],进一步氧化可产生阈值低的二甲基硫化物,对风味影响较大[6]。林伟涛等从烟台中式发酵香肠中分离筛选出适合当地特色的、具有自然发酵香肠风味的微生物菌株,有德氏乳杆菌、食品乳杆菌、木糖葡萄球菌、米酒乳杆菌等,它们都具有很好的产酸和产酶特性[7]。
为了明确新疆风干肉发酵过程中乳酸菌的作用,本试验采用传统手段从新疆特色风干肉中分离获得优势乳酸菌,并对其产乳酸脱氢酶、亚硝酸还原酶和酯酶的特性进行研究,为开发新疆风干肉专用发酵剂提供理论支持。
1 材料与方法
1.1 实验原料及药品
风干牛风和风干马肉样品:采自新疆塔城、阿勒泰地区。
还原型辅酶I(NADH)(优级纯),法国生物梅里埃公司;甲基紫精(分析纯),上海美谱达仪器有限公司;α-酮戊二酸(分析纯),Biometra Tgradient;5′-磷酸吡哆醛(分析纯),苏州净化设备有限公司;对硝基苯酸酯(分析纯),上海申安医疗器械厂;NaCl(分析纯),宁波江南仪器厂;NaNO2(分析纯),德国 Eppendorf 公司。
1.2 仪器与设备
全温振荡器(HZQ-Q型),哈尔滨东联电子科技有限责任公司;紫外可见分光光度计(UV-1600),上海美谱达仪器有限公司;PCR扩增仪(050-810 Tgradient 48),Biometra Tgradient;净化工作台(SW-CJ-2FD),苏州净化设备有限公司;立式蒸汽灭菌器(LDZX-40BⅠ型),上海申安医疗器械厂;生化培养箱(XPX智能型),宁波江南仪器厂;高速冷冻离心机(5415 D),德国 Eppendorf 公司。
1.3 实验方法
1.3.1 风干牛肉中优势乳酸菌的分离纯化
将采自不同地区的风干肉样品,取10 g在无菌条件下剪碎,放入90 mL灭菌生理盐水,振荡2 min,之后分别将样品用无菌生理盐水10倍、100倍、1 000倍稀释[8],备用。将稀释液分别涂布在改良MRS固体培养基上,培养24~48 h[9],将菌落在固体MRS培养基上划线,直到镜检得到纯菌株。将纯菌株接种于固体MRS斜面培养基,4℃贮藏备用。
1.3.2 优势乳酸菌的鉴定[10]
1.3.2.1 形态观察
对纯化后的菌株接种在固体平板MRS上,观察菌落形态,并利用革兰氏染色观察菌体形态。
1.3.2.2 生理生化实验
对纯化后的菌株进行系列生理生化试验,如运动性试验、接触酶试验、葡萄糖发酵产气试验等。
1.3.2.3 菌体DNA的提取
采用CTAB法提取DNA[11]。
1.3.2.4 16S rRNA PCR扩增
采用细菌特异性引物,引物1为5′AGAGTTTGATCCTGGCTCAG-3′(E.colibase 8 to27);引物2为5′-TACCTTGTTACGACTT-3′[12],进行PCR扩增。将PCR产物纯化送至上海生工测序。测序结果在NCBI(https://blast.ncbi.nlm.nih.gov)进行BLAST比对,采用Neighbor-Joining法绘制系统发育树。
1.3.2.5 粗酶液的制备
将分离到的菌株在液体MRS培养基中活化,将种子液以2%接种量接种到MRS肉汤培养基及添加亚硝酸盐、酯、苯丙氨酸的MRS肉汤培养基中,在37 ℃培养2~3 d。依据文献[9]的方法做酶提取。
1.3.3 优势乳酸菌产酶特性分析
1.3.3.1 乳酸脱氢酶活性的分析
依据文献[13]的方法进行测定。在反应体系中加入磷酸盐缓冲液(0.1 mol/L,pH 7.4)2.8 mL,NADH(6 mmol/L)0.1 mL,丙酮酸钠(30 mmol/L)0.1 mL,酶液20 μL,25 ℃水浴5 min,测定反应体系在340 nm处的吸光值(空白用磷酸盐缓冲液)。酶活力单位定义:在本实验条件下,每分钟氧化分解1 μmol NADH所需的酶液为1个酶活力单位。
1.3.3.2 亚硝酸盐还原酶活性的分析
[9]的方法。反应体系:0.1 mol/L磷酸盐缓冲液(pH 7.4)1 mL+100 μL 0.1 mol/L NaCl+100 μL 0.1 mol/L NaNO2+100 μL 0.1 mol/L MV(甲基紫精)+0.1 mol/L Na2S2O4100 μL+20 μL酶液。37 ℃水浴10 min,反应体系为蓝色,剧烈振荡为无色后反应终止。取10μL液体,加入1 mL去离子水,加入20 μL 2 g/L盐酸奈乙二胺溶液、40μL 4 g/L对氨基苯磺酸,待显色稳定后,于538 nm 测定吸光值(以磷酸缓冲液为空白)。酶活力定义:在本实验条件下,每分钟还原1μg亚硝酸盐所需要的酶液为1个酶活力单位。
1.3.3.3 酯酶活性的分析
根据文献[14]分析酯酶活力。反应体系:100 μL酶液加入到1.9 mL的底物缓冲液中,860 μL 0.1 mol/L磷酸盐缓冲液(pH 7.4)和40 μL 25 mmol/L对硝基苯乙酸酯,37 ℃水浴1 h,加入1 mL 95%乙醇终止反应。测定反应体系在410 nm处吸光值(空白用沸水浴10 min的酶液)。酶活力定义:在本实验条件下,每分钟还原1 μmol对硝基苯酚所需要的酶液为1个酶活力单位。
1.3.4 温度对乳酸菌产酶特性的影响
将纯化后的菌株在不同产酶培养基上接种,采用不同的温度梯度(25、30、35、40、45 ℃)培养2~3 d,利用上述方法测定3种酶的活性。
1.3.5 数据统计
上述酶活力分析采用3次重复,使用SPSS18.0进行数据分析,p<0.05为显著性差异。
2 结果与分析
2.1 风干肉中优势乳酸菌的分离鉴定
从采集的样品中分离得到3株优势乳酸菌,分别是tL-4,tL-7和aL-16,其菌落形态和生理生化试验结果见表1。运动性试验、接触酶试验、葡萄糖发酵产气试验、明胶液化试验、甲基红(M-R)试验、吲哚试验、产H2S试验、乙酰甲基甲醇试验(V-P试验)均为阴性,tL-4、tL-7有较好的耐盐性。
从风干肉中分离得到的3株乳酸菌,进行16S rRNA序列分析,所建的系统发育树如图1所示,tL-7与Lactobacilluscoryniformis有100%的同源性,tL-4、aL-16在基因序列对比中与Lactobacillusplantarum和Lactobacilluspentosus的同源性都达到了99%,但综合生理生化特性分析,并结合《伯杰细菌鉴定手册》[15],可知菌株tL-7为棒状乳杆菌(Lactobacilluscoryniformis);tL-4为植物乳杆菌(Lactobacillusplantarum),而菌株aL-16为戊糖乳杆菌(Lactobacilluspentosus),虽与植物乳杆菌具有较好的同源性,但在理化性质上并不完全一致。因此对于菌种的鉴定生理生化分析与基因序列分析相结合,结果更为准确。
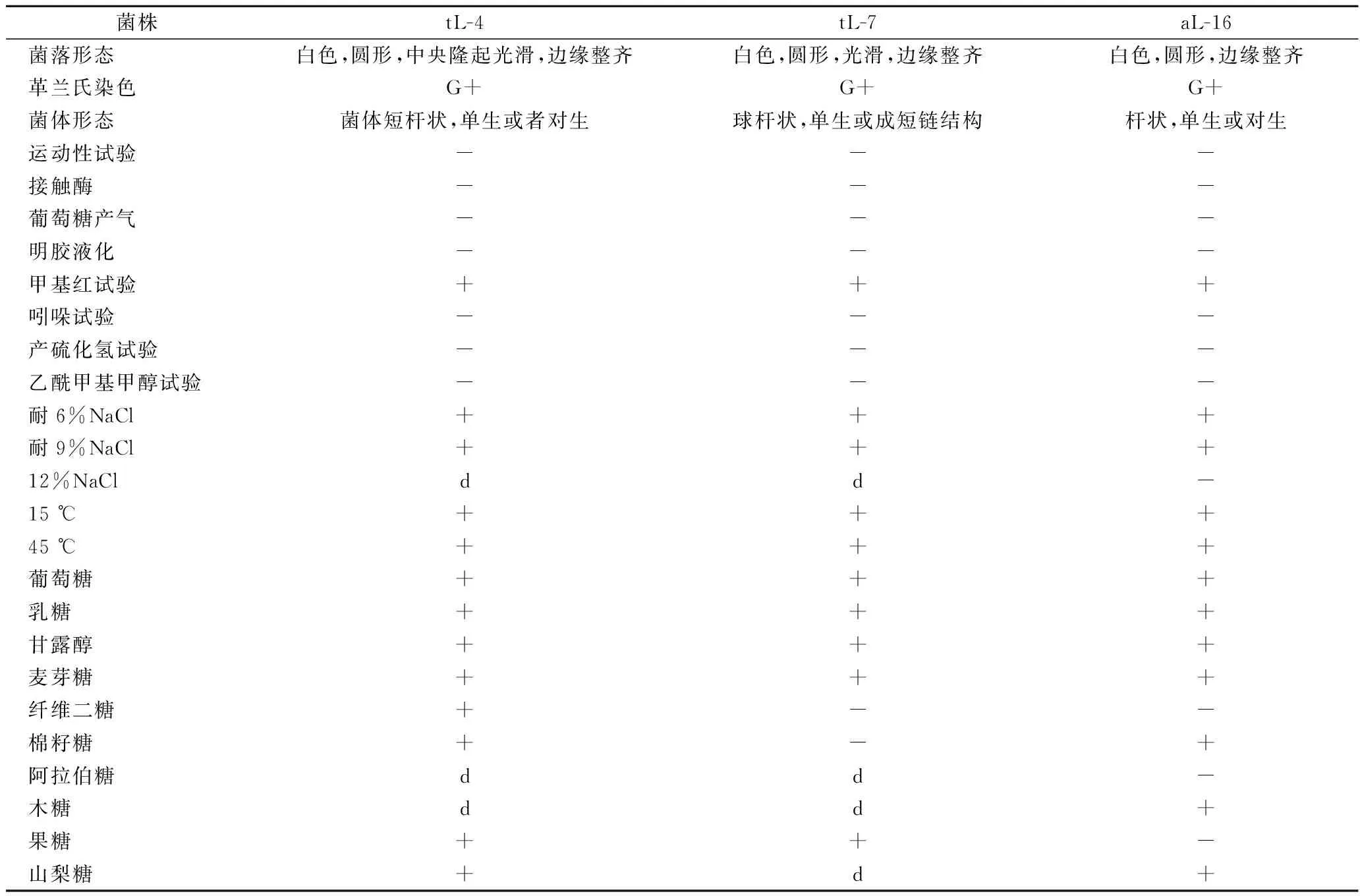
表1 菌株的形态和生理生化试验结果
注:+:90%为阳性,-:90%为阴性,d:弱阳性。

图1 风干肉中乳酸菌发育树Fig.1 Phyogenetic tree of Lactic acid bacteria strains in Xinjiang air-dried meat
2.2 菌株的产酶特性分析
2.2.1 菌株的产酶活力
表2结果显示,3 株菌的乳酸脱氢酶活性都较高,相比而言,tL-4和aL-16比tL-7有较高活性,分别为112.86 U/mL和94.62 U/mL。tL-4和aL-16的乳酸脱氢酶活性高,说明其发酵产酸能力较强,风干肉在发酵初期,需要乳酸菌产生大量乳酸,降低pH值,抑制杂菌生长。对于亚硝酸盐还原酶活力,tL-4和aL-16都较高,tL-7的亚硝酸盐还原酶活力较低,其中aL-16的亚硝酸盐还原酶活力最高,为14.72 U/mL,乳酸菌中较高的亚硝酸盐还原酶活力有利于降低风干肉在腌制和发酵过程中的亚硝酸盐含量。有研究表明,酸性环境有利于亚硝酸盐的降解[16],根据本研究,亚硝酸盐含量的降低除了与酸性环境相关,同时也与优势菌有较高的亚硝酸盐还原酶活力有关,亦或者是两者共同作用的结果[17]。酯酶与风干肉风味物质的形成息息相关,试验菌株tL-7的酯酶活力较高为13.25 U/mL,tL-4的酯酶活力为11.45 U/mL,而aL-16的酯酶活力相对较低9.67 U/mL。
表2 菌株的3种酶活力测定

单位:U/mL
注:同一栏中字母不同者表示有显著性差异(p<0.05)
2.2.2 温度与酶活的关系
试验设计3株乳酸菌在不同温度梯度(25、30、35、40、45 ℃)下的产酶特性分析,结果如图2。3株菌产乳酸脱氢酶的最适温度分别为30、35、40 ℃,其中tL-4产乳酸脱氢酶酶活力最强时温度为30 ℃,tL-7的为35 ℃、aL-16的为40 ℃。图3中3株菌产亚硝酸还原酶的最适温度分别为30、35 ℃,其中tL-4产亚硝酸还原酶的最适温度为35 ℃,tL-7的最适温度为30 ℃。三者相比,aL-16产亚硝酸还原酶活力最强,此时的温度为30 ℃,图4中3株菌产酯酶的最适温度分别为40、35、30 ℃,其中tL-4产酯酶的最适温度为40 ℃、tL-7产酯酶的酶活最强,此时温度为35 ℃、aL-16产酯酶能力相比tL-4、tL-7弱,酶活相对低,同时温度在30~35 ℃酶活无差异。

图2 温度对3株菌产乳酸脱氢酶的影响Fig.2 Effect of temperature on the lactic dehydrogenase of three strains
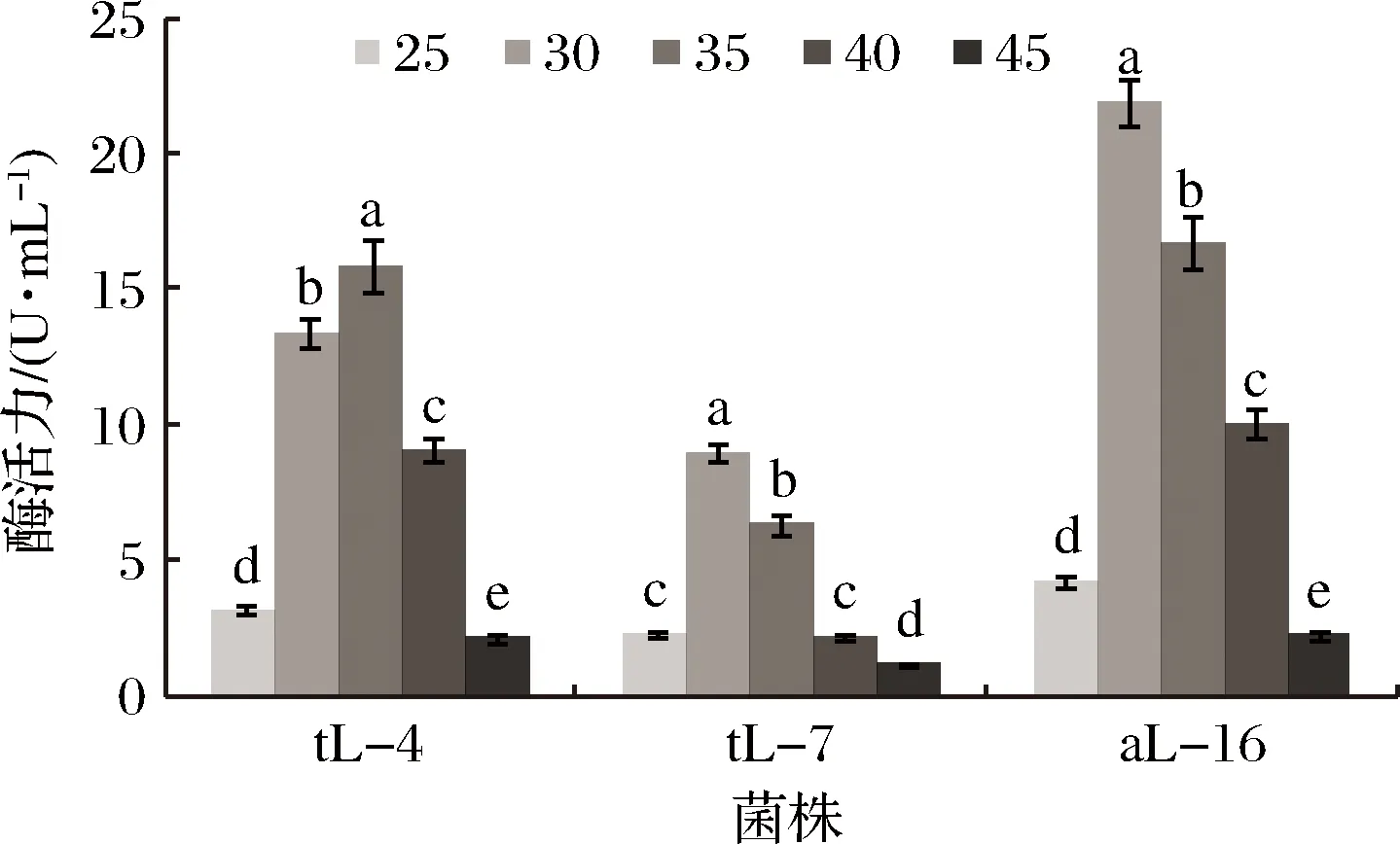
图3 温度对3株菌产亚硝酸还原酶的影响Fig.3 Effect of temperature on the nitrite reductase of three strains
综合图2、图3、图4,3株乳酸菌的最适产酶温度不同,同一菌株,产不同酶的最适产酶温度也不同;3株菌在不同温度梯度条件下的产酶特性也不同。tL-4产乳酸脱氢酶的温度是30 ℃,亚硝酸盐还原酶的最适温度在35 ℃,产酯酶的最适温度在40 ℃;tL-7的产酯酶在35 ℃出现最高值(12.53 U/mL);aL-16在30 ℃产亚硝酸还原酶达到最高值(21.93 U/mL)。3株菌在30~40 ℃时产酶能力强,酶活力高,超出这个温度范围,产酶量变少、酶活变弱。

图4 温度对3株菌产酯酶的影响Fig.4 Effect of temperature on the esterase of three strains
3 讨论
乳酸脱氢酶(lactate dehydrogenases,LDHs)是乳酸菌利用碳源转化丙酮酸为乳酸的关键酶。有研究者从枯草芽孢杆菌和酿酒酵母中分离纯化乳酸脱氢酶,并将其用于降低啤酒中高级醇的生成量[18-20]。风干肉中因为有乳酸脱氢酶,使得乳酸能够在肉中大量积累,降低肉的pH值,抑制杂菌生长,同时乳酸还可以参与酯化、聚合等反应,对于风干肉中风味物质的形成起着重要作用。
研究发现,植物乳杆菌、乳酸乳球菌、嗜酸乳杆菌、泡菜乳酸菌等许多乳酸菌都有降解亚硝酸盐的性质[21-22]。YAN等从泡菜中分离出1株乳酸菌在液体培养基中培养,对亚硝酸盐降解率高达90%[23]。国内也有研究在各种腌菜和养殖污泥中分离得到乳酸菌,具有降解亚硝酸盐的功能[24-25]。本实验中的戊糖乳杆菌和植物乳杆菌能够高产亚硝酸盐还原酶,有利于风干肉中亚硝酸盐的降解,酯酶是一类能够催化酯键断开和形成的水解酶,广泛存在于动物、植物和微生物中,能够参与水解反应、转酯反应、酯化反应等[26-29],是风味物质形成的重要环节。风干肉中酯酶的活跃,促进了风味物质中酯类物质的形成,对于高产酯酶的菌株tL-7后期研究也可以考虑经过诱变或者其他技术提高酯酶活力或者产酯酶量,来增加风干肉的产品的品质和优势风味物质含量。
3种酶在风干肉的发酵和风味物质的形成过程中起着至关重要的作用,乳酸脱氢酶是微生物发酵产生乳酸的前提,而乳酸也是风味物质的前体,酯酶影响着风干肉中风味物质的形成,在风干肉的发酵过程中3株优势乳酸菌产生的几种酶相互协调影响,对产品最终风味的形成具有重要作用。
4 结论
本研究主要针对新疆风干肉中优势乳酸菌进行了分离鉴定,通过菌株的生理生化和16S rRNA对比结果分析,新疆风干牛肉中的优势乳酸菌有植物乳杆菌(Lactobacillusplantarum)、棒状乳杆菌(Lactobacilluscoryniformis)、戊糖乳杆菌(Lactobacilluspentosus)。同时对于菌种的鉴定,生理生化分析与基因序列分析结果相结合,对于菌种的鉴定更为准确。
3株优势菌株的产酶特性,在不同温度下的产酶活力不同,同一菌株产不同酶的最适产酶温度不同,当温度在30~40 ℃范围内,菌株产各种酶的能力相对较强,3种酶活力也相对较高。
本研究只针对温度对于酶活力的影响做了简单分析,对于优势乳酸菌对风干肉品质形成和风味物质的产生并未进行系统研究,下一步可以根据本试验结果对风干肉中的微生物发酵剂制定组合配方并研究其对风干肉品质和风味物质形成的影响,同时对实验中筛选出来的产酶菌种进行应用研究,观察其在不同底物浓度不同实验条件下,产酶能力的变化,确定最适底物和最佳作用条件,使其尽快用于生产实践中。
参考文献
[1] 党欣.哈萨克风干牛肉产品特性研究及工艺优化[D].兰州:甘肃农业大学,2014.
[2] 沙坤.新疆风干牛肉质量特征及风味形成机制的研究[D].北京:中国农业科学院,2015.
[3] KABAN G. Changes in the composition of volatile compounds and in microbiological and physicochemical parameters during pastlrma processing[J]. Meat Science, 2009, 82(1):17-23.
[4] PETIT T,CARO Y, PETIT A S, et al. Physicochemical and microbiological characteristics of biltong,a traditional salted dried meat of South Africa [J] Meat Science,2014,96(3):1 313-1 317.
[5] 郭江南,蒋云升,崔繁荣,等.新疆风干牛肉贮藏期间微生物变化研究[J].食品工业科技,2016,(13):323-327.
[6] PHAM A J, SCHILLING M W, MIKEL W B. Relationships between sensory descriptors, consumer acceptability and volatile flavor compounds of american dry-cured ham[J]. Meat Science, 2008,80(3): 728-737
[7] 林伟涛,徐世明,刘蓉宏,等.中式发酵香肠菌种的分离筛选和初步鉴定[J].烟台大学学报(自然科学与工程版),2008(2):99-104.
[8] 王俊钢,李宇辉,郭安民, 等. 新疆风干牛肉成熟过程中理化及微生物特性分析[J].食品与发酵工业,2016,42(10):129-133.
[9] 张庆峰,吴祖芳,翁佩芳,等.浙东腌冬瓜优势乳酸菌的分离及产酶特性分析[J].现代食品科技,2016,32(3):119-125.
[10] 赵俊仁,程水明,洪玮娣,等.风干武昌鱼中乳酸菌的分离鉴定及发酵性能研究[J].现代食品科技,2014,30(8):100-105.
[11] 陈竞适,刘静,任海姣,等.湘西陈年腊肉微生物群落分析及高产脂肪酶细菌的筛选[J].肉类研究,2017,31(3):1-6.
[12] 马燕,倪永清,卢士玲,等.新疆特色干酪中乳酸菌的分离鉴定[J].中国酿造,2011(8):38-40.
[13] ZHAO R, ZHENG S, DUAN C C, et al. NAD-dependent lactate dehydrogenase catalyses the first step in respiratory utilization of lactate byLactococcuslactis[J]. FEBS Open Bio, 2013, 3: 379-386.
[15] DE VOS P, GARRITY GM, JONES D, et al. Bergey’s manual of systematic bacteriology[M]. 2nd ed. East Lansing:Michigan State University, 2009.
[16] 贾亚莉,贠建民,艾对元,等.甘肃浆水传统发酵过程中亚硝酸盐含量动态变化分析[J].生物技术进展,2016(1):59-66.
[17] 柳念,陈佩,高冰,等.乳酸菌降解亚硝酸盐的研究进展[J].食品科学,2017,38(7):290-295.
[18] 吴新宇.乳酸脱氢酶高产菌株的筛选及其酶的分离纯化[D].镇江:江苏大学,2010.
[19] 孟庆阳.酿酒酵母乳酸脱氢酶发酵和酶学性质及其基因序列分析[D].扬州:扬州大学,2008.
[20] 黄艳娜,许光涛,游春苹. 乳酸菌中乳酸脱氢酶的研究进展[J].食品工业科技,2016,37(8):369-373.
[21] KIM J,CHUN J ,HAN H.Leuconostockimchiisp.nov,a new species from kimchi[J].Int Syst Evol Microbiol,2000,50:1 915-1 919.
[22] CHO J, LEE D, YANG C, et al. Microbial population dynamics of kimchi, a fermented cabbage product[J]. Fems Microbiology Letters, 2006, 257(2):262-267.
[23] YAN P M, XUE W T, TAN S S, et al. Effect of inoculating lactic acid bacteria starter cultures on the nitrite concentration of fermenting Chinese paocai[J]. Food Control, 2008, 19(1):50-55.
[24] 高小朋,苏青,程同培.腌制酸菜中亚硝酸盐降解菌的筛选及其降解特性研究[J].食品工业科技,2012,33(1):198-199,203.
[25] 邓振山,张春晓.两株养殖污泥中亚硝酸盐降解菌的筛选及其降解条件[J].环境工程,2016,34(S1):176-179,234.
[26] 董娟.冰川低温酯酶产生菌的选育、基因克隆表达及在奶味香基制备中的应用[D].无锡:江南大学,2016.
[27] LEVISSON M, OOST J V D, KENGEN S W M. Carboxylic ester hydrolases from hyperthermophiles[J]. Extremophiles, 2009, 13(4):567.
[28] PATEL R N. Stereoselective Biocatalysis[M]. New York: CRC Press,2000.
[29] KHUDARY R A, VENKATACHALAM R, KATZER M, et al. A cold-adapted esterase of a novel marine isolate,Pseudoalteromonasarctica: gene cloning, enzyme purification and characterization.[J]. Extremophiles, 2010, 14(3):273-285.
[30] 王叶青.酯酶、脂肪酶的筛选、表达和性质表征[D].长春:吉林大学,2014.
