柠檬酸生产中厌氧消化液的循环回用工艺研究
2018-02-28张宏建苏先峰张建华毛忠贵
张宏建,苏先峰,张建华,毛忠贵
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
柠檬酸是一种三元有机酸,具有溶解性好、酸味温和、抗氧化、安全无毒等特点,被广泛应用在食品[1]、医药[2-3]、纺织[4]、电子[5]、化工[6]、建筑[7]等领域。随着柠檬酸应用领域的不断扩大,我国柠檬酸产量也在不断上升,而每生产1 t柠檬酸就会产生7~8 m3发酵性废水,有时甚至达到15 m3 [8-9],该废水具有高COD(约20 000 mg/L)和低pH(4.5~4.8)的特点[10],要达到国家规定的排放标准,处理要求高、难度大,因此处理后的废水仍会给环境带来严重污染,如何有效地处理柠檬酸产生的高浓有机废水,已成为制约柠檬酸行业健康发展的瓶颈。
目前柠檬酸发酵废水主要采用生化法(厌氧消化+好氧消化)来处理[11-12],生化法处理后的废水仍无法达到日益要求严格的国家排放标准,还需进一步深度处理才能达标排放[13]。同时传统的生化处理工艺投资大,运行费用高,尤其是好氧消化处理部分,占用大量的土地和消耗大量的能源,其运行成本基本占据整个废水处理过程成本的2/3以上,增加了柠檬酸的生产成本。若能革除运行费用高的废水好氧消化处理部分,保留高收益的废水厌氧消化工艺,将会有效地提升我国柠檬酸产业的竞争力。同时我国也是淡水资源较缺乏的国家之一[14],若能实现厌氧消化后废水回用到生产上,不仅能减少废水对环境的污染,还能降低对淡水资源的消耗,从而真正实现柠檬酸行业的清洁高效生产。
我国一些学者曾尝试采用柠檬酸废水回用于柠檬酸发酵的可行性,如中科院张洪勋[15]、河海大学田伟君[16]等人对柠檬酸中和废水回用的可行性进行了研究,虽可实现柠檬酸中和废水的回用,但处理过程主要采用离子交换、添加活性炭等处理方法,该法处理成本高,同时又产生了新的二次废水;另外该研究虽革除了废水的好氧消化部分,但也革除了高收益的厌氧消化工艺,导致了柠檬酸发酵废水中的大量有机物没能得到利用,也造成资源的浪费、经济效益的低下,因此无法适合工业化应用。
笔者在大量的试验基础上,提出了厌氧消化液(anaerobic digestion effluent, ADE)循环回用生产柠檬酸工艺,即柠檬酸发酵废水经过厌氧消化处理(厌氧复合菌群)将废水中的大量有机物转化为清洁能源——沼气,而沼气经过热电联产可转化为热能、电能供给生产所用;产生的液体(称为厌氧消化液)作为工艺水进行配料生产柠檬酸,从而实现循环回用。完全革除高能耗、净投入、无产出的废水好氧消化工艺,保留了高收益的废水厌氧消化工艺。此次重点研究了厌氧消化液作为柠檬酸的工艺用水对液化、发酵的影响,通过技术手段来去除厌氧消化液中影响柠檬酸发酵的关键抑制因子,为保证厌氧消化液循环回用生产柠檬酸的稳定运行,实现柠檬酸产业的清洁生产,节约宝贵的清洁水资源打下坚实的基础。
1 材料和方法
1.1 材料与试剂
用于生产柠檬酸的菌株黑曲霉(Aspergillusniger)Wml-016为本实验室自行保藏。耐高温淀粉酶(20 000 U/mL)为无锡杰能科生物工程有限公司提供;木薯和玉米原料均由河南天冠企业集团有限公司提供;中温厌氧消化污泥由宜兴协联生物化学有限公司提供;其余均为市售化学试剂。
1.2 仪器与设备
5 L自控发酵罐(LiFlus GX),韩国生物反应器有限公司;5 L上流式厌氧污泥床反应器(UASB),上海大明教育仪器有限公司;超滤膜、纳滤膜系统(PL-D3-1812),安徽普朗膜技术有限公司;SBA-40B型葡萄糖生物传感器,山东省科学院生物研究所;组合摇床(HYL-C),太仓强乐实验设备有限公司;高效液相色谱仪(Ulti Mate 3000),美国Dionex公司;分析柱(HPX-87H型离子交换柱),美国Bio-Rad公司;示差折光检测器(RI-101),日本Shodex公司。
1.3 原料预处理
1.3.1 原料粉碎
木薯和玉米均采用粉碎机粉碎后并通过60目筛所得到的木薯粉和玉米粉以备实验使用。
1.3.2 培养基液化
木薯、玉米粉按要求称取适量,用工艺配料水(分别用自来水和厌氧消化液)按比例配料调浆,搅拌均匀后用质量分数为30%的H2SO4或质量分数为10%的NaOH溶液调pH至5.8~6.0,并按照试验要求添加耐高温α-淀粉酶,沸水浴液化,用稀碘液判断液化终点。
1.4 实验方法
1.4.1 种子液制备
按1.3.1制备的木薯粉按料水质量比1∶4加入去离子水进行配料,制备成种子培养基。料液按照“1.3.2”方法进行液化,后待料液冷却至室温后,用去离子水补充液化过程中损失的水分,并加入1 g/L的(NH4)2SO4作为培养基的氮源。随后将料液调至pH 5.5,于115 ℃条件下灭菌30 min。在无菌室内,将5 mL浓度为6.0×106个/mL的孢子悬液接种到装有40 mL种子培养基的500 mL的三角瓶中,在(36±1) ℃,200 r/min的摇床中培养20 h。
1.4.2 柠檬酸发酵
按“1.3.1”制备的木薯粉和玉米粉按质量比为4∶1进行混合,然后再按料水质量比1∶4.5加入工艺用水混合配料,制备柠檬酸发酵培养基。料液的液化按照“1.3.2”进行,液化结束后用添加去离子水方式来控制最终料液的总糖质量浓度为155~160 g/L,于115 ℃条件下灭菌30 min。在无菌室内,将6 mL种子液接种到装有34 mL发酵培养基的500 mL的三角瓶中,在(37.5±1) ℃,260 r/min,培养90 h。所有摇瓶实验重复3次。
5 L发酵罐中装入2 720 mL液化后的发酵培养基,并于115 ℃条件下灭菌30 min。然后添加480 mL的种子液,在(37.5±1) ℃,600 r/min,通气量为2 L/min,发酵72 h。
1.4.3 沼气发酵条件
沼气发酵在5 L上流式厌氧污泥床反应器(UASB)中进行,污泥接种量按体积分数30%接入厌氧颗粒污泥。通过泵将外置恒温循环水送至UASB夹套来维持沼气发酵温度在(35±1) ℃。每天维持UASB进1 L的柠檬酸废水,UASB出水经过离心力为4 000×g离心20 min后所得上清液(即为厌氧消化液, ADE),以供发酵使用。
1.4.4 空气吹脱条件
在5 L的广口瓶中装入4 L ADE,放置50 ℃的水浴槽中以维持ADE的温度,通气量控制在10 L/min,吹脱60 min,然后用去离子水补充吹脱过程损失的水分,并在4 500×g条件下离心20 min,所得上清液以备实验使用。
1.4.5 超滤和纳滤膜处理条件
超滤膜处理条件:膜面积为0.08 m2,截留分子量为20 000 Da;ADE注入贮罐中,经循环泵输入超滤膜内,操作压力控制在0.6 MPa,操作温度通过外置冷却装置控制进料温度为45 ℃,所得透过液收集以备实验和纳滤膜使用,而浓缩液循环回至贮罐中继续进入超滤膜处理,直至浓缩液为原厌氧消化液体积分数的20%时停止时操作。
纳滤膜处理条件:膜面积为0.27 m2,截留分子量为150 Da;收集的超滤透过液注入纳滤膜系统的贮罐中,经循环泵输入纳滤膜内,操作压力控制在1.5 MPa,操作温度通过外置冷却装置控制进料温度为45 ℃,所得透过液收集以备实验使用,而浓缩液循环回至贮罐中继续进入超滤膜处理,直至浓缩液为原厌氧消化液体积分数的30%时停止操作。
1.5 分析方法
总糖和残总糖测定:样品采用质量分数为4%的HCl在沸水浴中水解2 h,然后用SBA-40B葡萄糖生物传感器测定。
柠檬酸浓度测定:采用高效液相色谱(U-3000,Dionex,Sunnyvale CA)测定,液相系统配备离子交换柱(Aminex HPX-87H,300 mm×7.8 mm,Hercules,CA)紫外检测器(Dionex,USA)和示差检测器(Shodex RI-101,Tokyo,Japan)。操作条件为柱温60 ℃,流动相5 mmol/L H2SO4,流速0.6 mL/min,进样量20 μL。
金属离子测定:采用火焰原子吸收光谱仪(VARIAN,SpectrAA-220,Australia)测定。
柠檬酸发酵废水和ADE中的COD、挥发性脂肪酸(Volatile Fatty Acids,VFAs)、乙酸、丙酸、碱度、电导率、氨氮浓度均采用标准方法[17]测定。
数据处理:试验结果用平均值±标准差表示,采用spss19.0软件对试验数据进行方差分析,采用ANOVA法进行组间多重比较,显著性水平设为0.05。
2 结果与讨论
2.1 ADE循环回用对液化的影响
在柠檬酸生产工艺中,原料液化完全后,才能进入下一步发酵阶段,而液化时间的长短和液化酶的使用量也直接影响了柠檬酸的生产强度和生产成本。分别用去离子水(对照组)和ADE作为工艺水与物料按料水质量比为1∶4.5进行配料,然后在沸水浴的条件下,加入不同量的液化酶进行液化实验,分析厌氧消化液对液化酶的添加量、液化时间和DE值的影响,结果如图1所示。
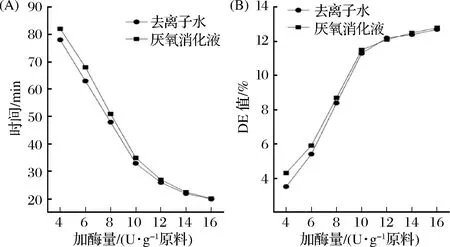
图1 不同配料水对液化时间和DE值的影响Fig.1 Effects of different kinds of mixing water on liquefaction time and DE value
从图1(A)可看出,随着液化酶用量的增加,液化时间均缩短呈现下降趋势;且在液化酶用量小于12 U/g时,ADE液化时间比对照组略高,当液化酶添加量达到12 U/g时,液化时间与对照组基本一致。同时在液化时,常利用液化液中DE值的高低来判别液化效果[18]。从图1(B)可看出,当液化酶添加量达到8 U/g时,液化液的DE值与对照组基本一致。
在柠檬酸的工业生产中,木薯原料液化时液化酶用量一般为10~14 U/g,而从图1可看出,液化酶用量在这个范围内时,ADE作为配料水在液化时间和液化效果与对照组是一致的,因而从液化时间和液化效果上来看,厌氧消化液作为工艺配料水回用对液化时间和液化效果均没有影响。后面原料的液化处理中液化酶添加量均采用12 U/g。
2.2 ADE循环回用对柠檬酸发酵的影响
为考察ADE循环回用对柠檬酸发酵是否有影响,则采用去离子水作为配料水发酵生产柠檬酸作为第1批的发酵实验(对照组实验),发酵废水经过厌氧消化后产生的ADE作为第2批的配料水进行发酵实验,以后各批次实验均采用前一批的ADE进行配料,依次共进行4批循环发酵实验,实验结果如图2所示,随着循环批次的增加,其柠檬酸产量依次下降,残总糖上升,此现象表明在ADE中存在抑制因子对柠檬酸发酵产生了抑制,且抑制因子还存在积累现象,因此ADE不能直接进行循环回用。
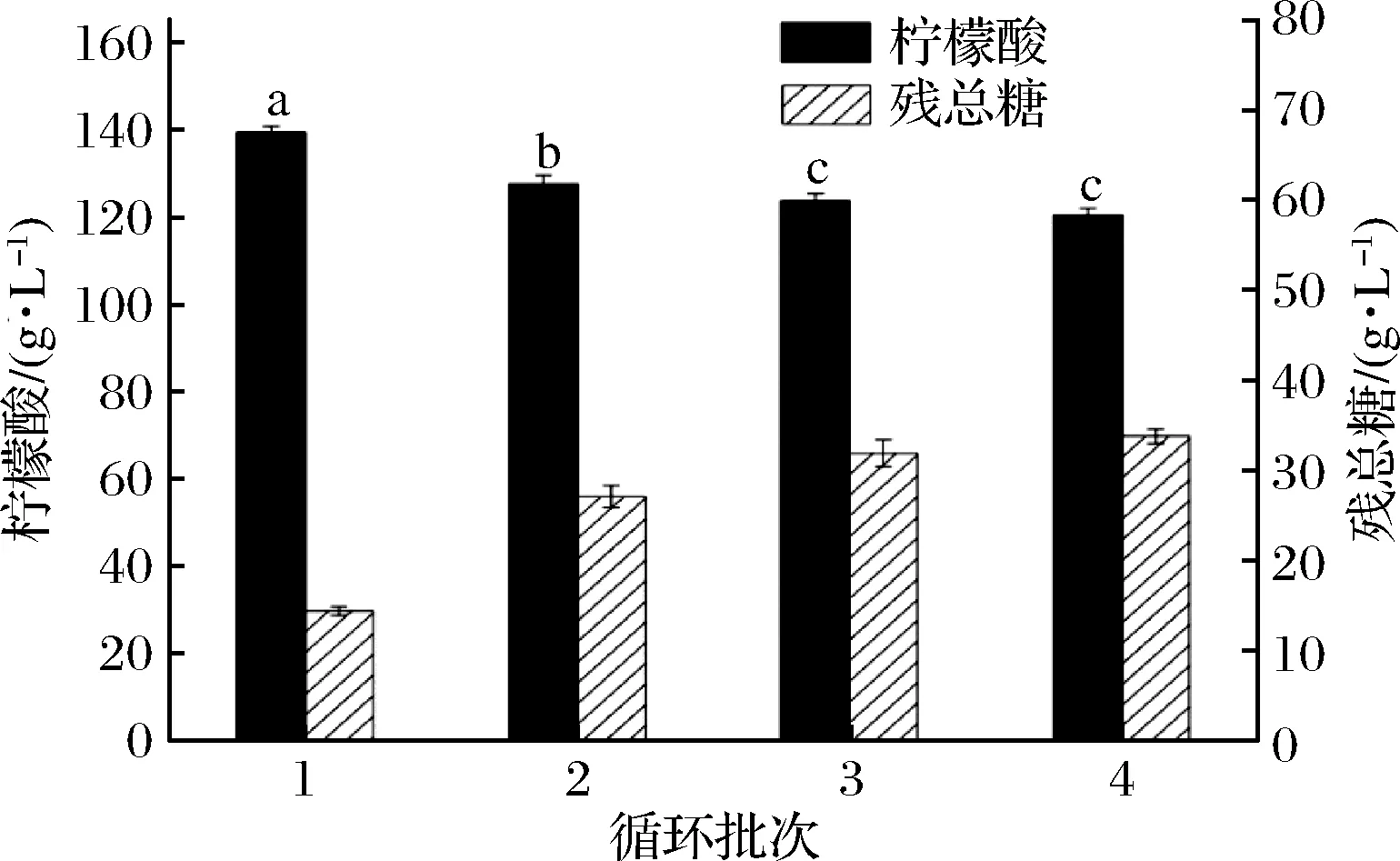
图2 不同循环批对柠檬酸产量和残总糖质量浓度的影响(不同字母表示具有显著性,p<0.05)Fig.2 Effects of citric acid production and residual total sugar concentration in successive fermentation batches
每批的ADE液作为下批柠檬酸发酵的配料水,这将黑曲霉的柠檬酸好氧发酵与甲烷菌系的沼气厌氧发酵实现了耦联并形成环形工艺,双发酵工艺互为影响,尤其是甲烷菌系的沼气发酵将柠檬酸发酵废水中的有机物进行降解,会产生小分子的氨氮、VFAs等物质,这些物质存在ADE中,将ADE直接循环回用会影响着柠檬酸发酵稳定性,为消除ADE对柠檬酸发酵的影响,则对ADE中主要成分进行分析。分析结果如表1所示,随着循环的进行,ADE的COD质量浓度基本维持在1 200 mg/L上下,VFAs在300~340 mg/L之间,并没有明显增加,氨氮也维持在较低水平(170~190 mg/L),虽然电导率随着循环的进行出现显著升高,由第一批3 940 μS/cm升至5 680 μS/cm,但并没影响到ADE的COD、VFAs和氨氮浓度,这表明沼气发酵是比较稳定的。
2.3 氨氮对柠檬酸发酵的影响
氮源是构成微生物合成蛋白质和核酸类物质的基本元素,对微生物生长和发酵均有重要的作用。有学者报导[19]适宜浓度的氮源有利用于微生物的生长和代谢,从而促进产物的合成,但过高浓度的氮源会加速微生物的快速生长,而过高的菌体量会增加培养基的黏度和较高的吸氧量,从而也加速了菌体的衰亡,并影响柠檬酸产量。表1数据显示厌氧消化液中氨氮浓度虽比较稳定,但在该浓度下的氨氮是否影响柠檬酸发酵需要进一步研究确定。因此以去离子水为配料水的柠檬酸发酵过程中,采用外源添加氨氮的方式来考察对柠檬酸发酵的影响。

表1 连续循环过程中的厌氧消化液化学成分分析
从图3可看出,当添加氨氮浓度小于100 mg/L时,柠檬酸发酵不受影响,当超过这一浓度时,导致了柠檬酸产量的快速下降,残总糖质量浓度上升。
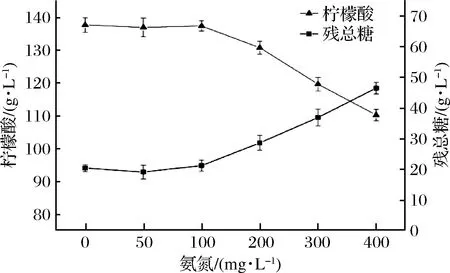
图3 氨氮对柠檬酸产量和残总糖的影响Fig.3 Effects of ammonia nitrogen on citric acid production and residual total sugar concentration
有文献报道,空气吹脱是去除溶液中氨氮的有效方式[20],于是对厌氧消化液进行吹脱处理,从表2可看出,经过吹脱处理后的厌氧出水中的氨氮由178 mg/L下降至61 mg/L,去除率达到65.7%,COD、电导率、VFAs也有轻微的下降。经过吹脱处理的ADE回用后柠檬酸产量比未处理的ADE柠檬酸产量高10%,但仍比以去离子水为对照组的柠檬酸产量低(如图4所示)。这表明ADE中的氨氮浓度抑制了柠檬酸发酵,虽经过吹脱处理后柠檬酸产量有所提高,但仍比对照组低,因此在ADE中仍有其他的抑制因子存在,影响了柠檬酸发酵。
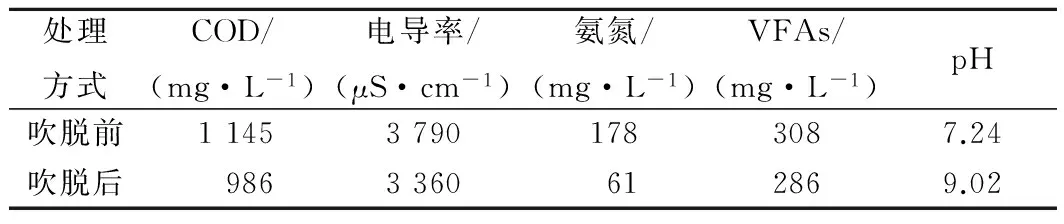
表2 空气吹脱处理前后厌氧消化液化学成分变化

图4 不同工艺水对柠檬酸产量和残总糖的影响Fig.4 Effects of different process water on citric acid production and residual total sugar concentration
2.4 VFAs对柠檬酸发酵的影响
正常情况下,在厌氧消化过程中产甲烷和产酸速率是相匹配的,VFAs不会出现大量的累积。但厌氧消化过程中,产甲烷菌比产酸菌对于有机溶剂负荷波动更加敏感,在有机溶剂负荷变动时会造成一定量的VFAs累积,积累的有机酸并随着ADE排出反应体系[21]。对本实验ADE中VFAs的成分进行了检测,发现ADE中VFAs主要是乙酸和丙酸(表3),分别达到213 mg/L和102 mg/L。虽然在柠檬酸发酵过程中,VFAs对柠檬酸影响的报导文献较鲜见,但在酵母乙醇发酵过程中,VFAs对乙醇发酵的影响有了大量的研究,并发现较高浓度的乙酸会抑制酵母的生长[22],也有研究报道[23]中显示,在丙酸达到45 mmol/L时,酒精发酵时间显著延长,乙醇产率也大幅下降。因此有必要研究乙酸和丙酸对柠檬酸发酵的影响。
表3 厌氧消化液中挥发性脂肪酸组成

单位:mg/L
在发酵培养基中分别添加一定浓度的乙酸和丙酸,通过摇瓶发酵实验,从图4(A)可看出,当添加的乙酸浓度超过400 mg/L时,才开始对柠檬酸发酵产生影响,造成柠檬酸产量下降和残总糖的上升,同样在图4(B)中也发现,在添加丙酸浓度超过400 mg/L时,也造成柠檬酸产量下降和残总糖的上升。当添加的乙酸、丙酸浓度分别达到1 000、600 mg/L时,其对应柠檬酸浓度分别为116.3、108.6 g/L,这也说明丙酸比乙酸对柠檬酸发酵抑制作用更强。在正常情况下ADE中的乙酸和丙酸的浓度远低于对应的抑制浓度400 mg/L,只要控制好沼气厌氧发酵,就可稳定VFAs在安全水平,ADE中的VFAs不会对柠檬酸发酵产生不利影响。

图4 乙酸与丙酸对柠檬酸产量和残总糖的影响Fig.4 Effects of acetic acid and propionic acid on citric acid production and residual total sugar concentration
2.5 金属离子对柠檬酸发酵的影响
柠檬酸发酵过程中,黑曲霉的生长、代谢均需要一定量的微量元素。例如,Mg2+、Zn2+和Cu2+是细胞中很多生化反应的辅酶;Mn2+是细胞内关键酶的重要调节因子[24]。但是,过高浓度的金属离子又会影响菌体生长代谢从而影响柠檬酸的产量,因而必须对培养基中的金属离子进行限制[25-26]。本研究以木薯、玉米粉为原料来生产柠檬酸,原料为黑曲霉提供适宜浓度的金属离子以维持微生物的生产代谢。从表1中可看出,第1批ADE中电导率为3 940 μS/cm,当循环到第4批时其ADE电导率高达5 680 μS/cm,表明在ADE中含有一定量的金属离子,且随着循环批次的进行,金属离子也发生了累积,并进入下批次的柠檬酸发酵体系中,从而造成培养基中的金属离子过剩,可能会影响到柠檬酸发酵。因此需要进一步确认金属离子是否对柠檬酸发酵有抑制作用。
对ADE中的金属离子进行了分析,结果见表4。Na+、K+、Ca2+和Mg2+等4种金属离子含量相对较高,Zn2+、Fe3+、Cu2+和Mn2+等4种离子含量相对较低。由于ADE碱度高,pH值在7.0~7.5之间,部分高价离子易以碳酸盐形式形成沉淀随污泥排出,而一价离子Na+、K+则更容易积累,因此以一价离子作为研究对象,在以去离子水为配料水,采用添加Na2SO4、K2SO4的形式来研究Na+、K+对柠檬酸的影响,结果如图5所示。发现当添加的Na+、K+质量浓度分别高于200、300 mg/L时均抑制柠檬酸发酵,造成柠檬酸产量的下降,残总糖上升。这说明ADE中所携带的金属离子会影响柠檬酸的发酵,从表4中可看出,ADE中Na+质量浓度已高于其抑制浓度,且随着循环的进行,K+很可能积累到其临界抑制浓度从而影响着柠檬酸发酵,因此需要对ADE进行资源化处理以消除金属离子对柠檬酸发酵的影响。当然多价金属离子在低浓度下也可能会影响柠檬酸的发酵,但本研究中没有对多价金属离子作进一步研究。
表4 厌氧消化液中金属离子组成

单位:mg/L
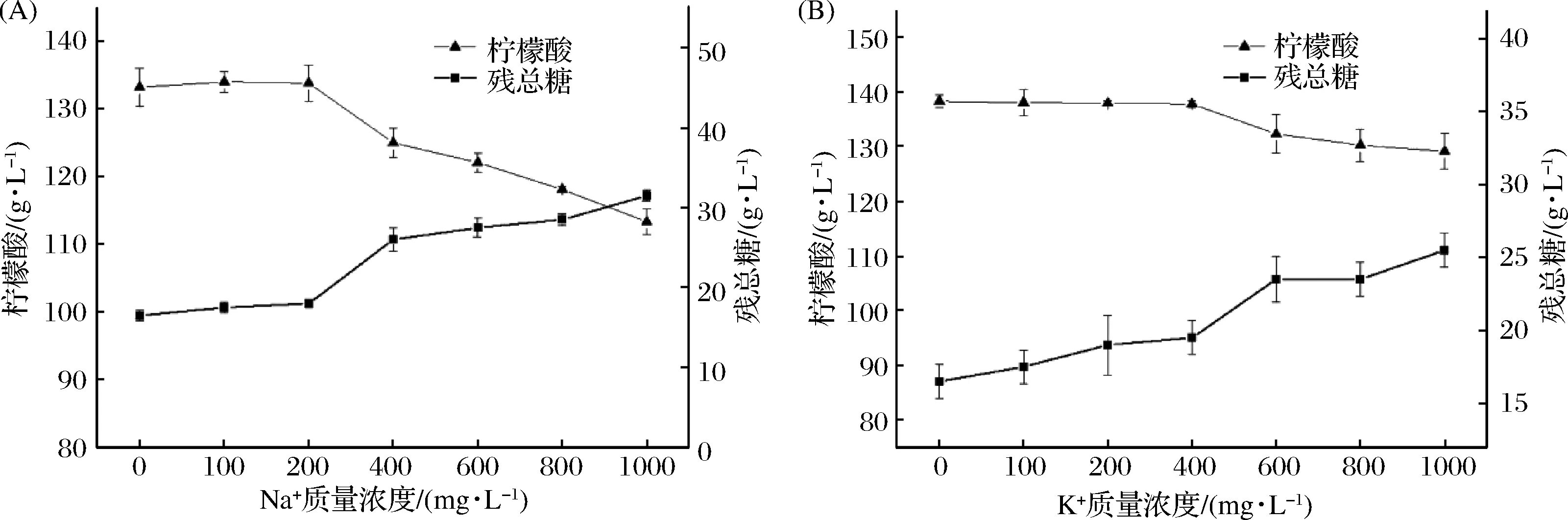
图5 Na+、K+对柠檬酸产量和残总糖的影响Fig.5 Effects of Na+ and K+ on citric acid production and residual total sugar concentration
2.6 ADE资源化处理
采用超滤膜对ADE进行预处理,随后再采用纳滤膜对超滤透过液进一步资源化处理,处理前后主要离子质量浓度如表5所示。ADE经过超滤膜处理后其主要离子去除率很低,但经过纳滤膜处理后主要的离子去除率均较高。多价离子质量浓度很低甚至无法检出,而K+、Na+质量浓度分别为18.40和32.20 mg/L,K+、Na+的去除率均达到90%以上,氨氮质量浓度只有22.10 mg/L,其去除率也达到80%以上。ADE经过超滤和纳滤处理后主要的抑制物均低于其临界的抑制质量浓度。

表5 不同水质中的离子组成分析
以去离子水为对照组与超滤、纳滤膜处理前后的ADE进行发酵实验(图6),发现单纯经过超滤处理后的ADE与未经过处理的ADE的柠檬酸产量基本相同,均低于对照组。而经过超滤及纳滤共同处理后的ADE与去离子水(对照组)柠檬酸产量相一致,说明组合膜技术(超滤+纳滤)能够有效地去除厌氧消化液中对柠檬酸发酵的抑制物。说明经过超滤和纳滤的组合膜技术处理后的ADE循环回用是可行的,该工艺的建立减少柠檬酸的废水污染和新鲜水的消耗,实现了柠檬酸工业的无废制造和节能减排,对该行业的健康可持续发展均具有重要的意义。

a)经过超滤膜处理后的厌氧消化液;b)经过超滤膜和纳滤膜处理后的厌氧消化液图6 不同处理方式对柠檬酸发酵的影响Fig.6 Effects of different processing methods on the citric acid fermentation 不同字母表示具有显著性,p<0.05
3 结论
为解决柠檬酸发酵行业的废水污染问题,提出采用ADE作为配料水循环回用生产柠檬酸的新工艺。研究发现ADE直接循环回用对原料的液化没有任何影响,但对柠檬酸发酵产生抑制作用。进一步研究表明,在ADE中的氨氮、VFAs、金属离子(Na+、K+)在不同程度上抑制柠檬酸的发酵,导致柠檬酸产量的下降和残总糖的上升。采用超滤膜、纳滤膜对ADE资源化处理后,几个关键的抑制物浓度均低于其临界的抑制浓度,解除了对柠檬酸发酵的抑制。从而建立了ADE循环回用生产柠檬酸的新工艺,对实现柠檬酸行业的无废制造和节能减排具有重要的意义。
[1] 陈效兰,雷钢铁. 柠檬酸在食品工业中的应用[J]. 食品研究与开发, 2000,21(3): 6-7.
[2] ABD-ALGADIR I M, IHAIMER M M, ELKHIER K S M, et al. Effect of benzoic acid and combination of benzoic with citric acid as food additives on the renal function of experimental rats[J]. Asian Journal of Clinical Nutrition, 2009, 1(2): 83-87.
[3] 张鹏飞,吕琼霞,刘玉梅,等. 柠檬酸对小鼠睾丸组织抗氧化酶活性的影响[J].动物医学进展, 2012, 33(8): 115-118.
[4] DONG Yong-chun, WANG Ji-jun, LIU Peng-fei. Dyeing and finishing of cotton babric in a single batch with reactive dyes and citric acid[J]. Coloration Technology, 2001, 117(5):262-265.
[5] DADVAND N, DADVAND M. Pulse electrodeposition of nanostructured silver-tungsten-cobalt oxide composite from a non-cyanide plating bath [J]. Journal of the Electrochemical Society, 2014, 161(14): 730-735.
[6] JIANG Xiu-ping, LIU You-zhi, DU Cai-li, et al. Flue gas desulfurization by sodium citrate in high gravity rotating packed bed [J]. Environmental Protection of Chemical Industry, 2011(5):1-10.
[7] 彭家惠,陈明凤,瞿金东,等. 柠檬酸对建筑石膏水化的影响及其机理研究[J]. 建筑材料学报, 2005, 8(1): 94-99.
[8] 王建辉,王璐. 柠檬酸废水的厌氧处理[J]. 长春工程学院学报(自然科学版), 2017, 18(1): 99-103.
[9] 朱世琴,朱为宏. 柠檬酸废水处理的研究进展[J]. 工业水处理, 2002, 22(3): 1-5.
[10] CONTRERAS E M, GIANNUZZI L, ZARITZKY N E. Growth kinetics of the filamentous microorganismSphaerotilusnatansin a model system of a food industry wastewater[J]. Water Research, 2000, 34(18):4 455-4 463.
[11] COLLERAN E, PENDER S, PHILPOTT U, et al. Full-scale and laboratory-scale anaerobic treatment of citric acid production wastewater[J]. Biodegradation, 1998, 9(3-4): 233-245.
[12] SVARDAL K, GÖTZENDORFER K, NOWAK O, et al. Treatment of citric acid wastewater for high quality effluent on the anaerobic-aerobic route[J]. Water Science and Technology, 1993, 28(2): 177-186.
[13] BAI Jun-yue, XU Hao-long, ZHANG Yi-dan, et al. Combined industrial and domesic wastewater treatment by periodic allocating water hybrid hydrolysis acidification reactor followed by SBR[J].Biochemical Engineering Journal, 2013,70(15):115-119.
[14] 林珍铭,韩增林. 海水淡化对我国缓解沿海地区水资源短缺的作用分析[J]. 辽宁师范大学学报(自然科学版), 2003, 26(3): 297-301.
[15] 张洪勋,程芳,齐鸿雁. 柠檬酸中和废水回用技术研究[J]. 环境科学进展, 1999, 7(2): 103-109.
[16] 田伟君,王超,翟金波,等. 柠檬酸中和废水回用过程中色素物质脱的研究[J]. 河海大学学报(自然科学版), 2004, 32(6): 652-654.
[17] ASSOCIATION A P H, ASSOCIATION A W W. Standard methods for the examination of water and wastewater[M]. 17th ed. New York: American Public Health Association (APHA), 1989.
[18] 郑美娟,郭金玲,余华顺,等. 耐酸性高温α-淀粉酶液化工艺条件的研究[J].农产品加工,2015(19): 29-31.
[19] PIETKIEWICZ J, JANCZAR M. The effect of nitrogen concentration in the fermentation broth on citric acid production byAspergillusniger[J]. Progress in Biotechnology, 2000,17:241-245.
[20] 黄海明,肖贤明,晏波. 氨吹脱处理稀土分离厂中氨氮废水试验研究[J]. 环境工程学报, 2008, 2(8): 1 062-1 065.
[21] ALKAYA E, KAPTAN S, OZKAN L, et al. Recovery of acids from anaerobic acidification broth by liquid-liquid extraction[J]. Chemosphere, 2009, 77(8): 1 137-1 142.
[22] THOMAS K, HYNES S, INGLEDEW W. Influence of medium buffering capacity on inhibition ofSaccharomycescerevisiaegrowth by acetic and lactic acids[J]. Applied Environmental Microbiology, 2002, 68(4): 1 616-1 623.
[23] ZHANG Cheng-ming, DUFeng-guang, WANG Xing, et al. Effect of propanoic acid on ethanol fermentation bySaccharomycescerevisiaein an ethanol-methane coupled fermentation process[J]. Chinese Journal of Chemical Engineering, 2012, 20(5): 942-949.
[24] BERG J M, TYMOCZKO J L, STRYER L. Biochemistry[M]. 5th ed. New York: WH Freeman, 2002.
[25] PAPAGIANNI M. Advances in citric acid fermentation byAspergillusniger: Biochemical aspects, membrane transport and modeling[J]. Biotechnology Advances, 2007, 25(3): 244-263.
[26] GREWAL H, KALRA K. Fungal production of citric acid[J]. Biotechnology Advances, 1995, 13(2): 209-234.
