棘胸蛙抗菌肽Spinosan-C的串联表达与活性检测
2018-02-28刘悦詹忠根朱兵郑荣泉程宏毅聂作明
刘悦,詹忠根,朱兵,郑荣泉,程宏毅,聂作明
1 浙江经贸职业技术学院,浙江 杭州 310018
2 浙江理工大学 生命科学学院,浙江 杭州 310018
3 浙江师范大学 生态研究所,浙江 金华 321004
棘胸蛙Paa spinosa,又名石蛙,在长江以南地区广泛分布,其肉质细嫩,味道鲜美,具有清凉滋补、健肝胃、防癌抗癌等多种功效,兼具美食和药用价值,素有“百蛙之王”的美名。为满足人民生活的需要,20世纪 80年代福建、江西等地开始尝试驯养棘胸蛙,之后安徽、江苏、湖北、浙江、云南、贵州、广西等省陆续有人工养殖棘胸蛙的报道。近年来,在科技人员的帮助下,有的企业实现了人工育种、育苗,尝试工厂化养殖,逐渐走上规模化、科技化的道路,取得了不错的效益。但因野生棘胸蛙常年栖息于水质清澈的山涧、溪流中,活动范围较大,而人工养殖时饲养密度变大,加上水质变化等影响,常受水霉病、红腿病、烂皮等多种疾病的困扰,给棘胸蛙养殖业带来巨大的经济损失,严重影响着棘胸蛙养殖的可持续性发展。
为预防和控制病害的发生,养殖户不得不大量使用抗生素药物。尽管抗生素的主导地位短期内不会动摇,但随着病原菌抗药性问题的日趋严重,越来越多的科学家把目光转移到抗菌肽新药的研发上。抗菌肽 (Antimicrobial peptides) 广泛分布于动、植物体内[1],通常在μmol/L级即具有抗菌能力[2-3],是最有前途的传统抗生素替代品,已成为国际学术研究的活跃领域之一[4-5]。
而蛙类是生物活性肽的巨大储备库,其皮肤分泌物中即含有多种抗菌肽,自1970年从欧洲铃蟾皮肤分泌物中分离到第一个具有溶血功能的抗菌肽后,目前已从铃蟾属Bombina、肛褶蛙属Kassina、雨滨蛙属Litoria、叶泡蛙属Phyllomedusa、多指节蟾属Pseudis、蛙属Rana、耳腺蟾属Uperoleia、爪蟾属Xenopus和棘蛙属Quasipaa等蛙类的皮肤分泌物中分离到分别属于Brevinin-1、Esculentin-1、Esculentin-2、Temporin、Ranalexin、Ranatuerin-1、Ranatuerin-2、Plaustrin、Brevinin-2、Tigerinin、Japonicin、Nigrocin 和Melittin等13个家族的抗菌肽[6-7]。
为提高棘胸蛙的疾病防治能力,前期已从棘胸蛙皮肤中克隆得到 4条抗菌肽序列[8],本研究为克服抗菌肽易被蛋白酶降解及对宿主大肠杆菌的杀伤作用,进一步提高大肠杆菌系统的表达能力,以棘胸蛙抗菌肽Spinosan-C为研究对象,探讨利用大肠杆菌系统高效表达 8倍串联的8×Spinosan-C重组蛋白,经甲酸切割后得到具有抑菌活性的Spinosan-C抗菌肽单体,以期为抗菌肽的规模化制备和产业化应用提供技术参考。
1 材料与方法
1.1 材料和主要试剂
棘胸蛙采集于浙江省兰溪市,约 1.5龄,体重约40−60 g。将采集的棘胸蛙用双毁髓法处死后取新鲜蛙皮立即至液氮冻存,于−70 ℃超低温冰箱保存备用。大肠杆菌感受态细胞Rosetta为北京康为世纪生物科技有限公司产品。原核表达载体pET-28a、大肠杆菌 TG1菌株和枯草芽孢杆菌由本实验室保存。dNTPs和 rTaq等 PCR试剂为TaKaRa公司产品;琼脂糖、甲酸、十二烷基磺酸钠购自德国 Boehringer Mannheim公司;卡那霉素、N,Nʹ-甲叉双丙烯酰胺、异丙基-1-硫代-β-D-半乳糖苷 (IPTG) 为美国Promega公司产品;蛋白胨和酵母提取物购自英国Oxoid公司;质粒提取试剂盒、PCR回收试剂盒购自 Axygen公司;棘胸蛙Spinosan-C抗菌肽标准品由上海吉尔生化有限公司合成。
1.2 棘胸蛙抗菌肽Spinosan-C的序列分析
应用 DNASTAR 软件对抗菌肽基因Spinosan-C进行开放阅读框和编码氨基酸序列分析,确定抗菌肽的氨基酸序列。将得到的抗菌肽序列通过BLAST在线分析程序 (https://blast.ncbi.nlm.nih.gov/Blast.cgi) 查找 GenBank中的其他相似性序列,确定棘胸蛙Spinosan-C抗菌肽的同源序列。应用 BioEdit软件中的 ClusterW 程序对Spinosan-C及其同源序列进行多序列比较。通过CD-Search检索保守结构域数据库 CDD (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),确定Spinosan-C含有的保守结构域和成熟肽。
1.3 抗菌肽 Spinosan-C基因的串联表达与串联重组蛋白的切割
1.3.1 串联抗菌肽基因的设计与合成
根据抗菌肽Spinosan-C基因编码框和大肠杆菌密码子偏好性设计 8倍串联的抗菌肽基因8×Spinosan-C,为方便融合蛋白切割和表达载体构建,在每个抗菌肽基因单体之间插入编码蛋白甲酸切割位点,在5'和3'末端引入EcoR Ⅰ和Hind Ⅲ两个限制性内切酶位点,并加入了导肽 pho A。序列由苏州金维智生物有限公司合成,装入到pUC-18载体上。
1.3.2 串联抗菌肽重组表达载体的构建
利用EcoRⅠ/HindⅢ双酶切含有 8×Spinosan-C基因的重组载体和 pET-28a原核表达载体,纯化回收8×Spinosan-C基因片段和pET-28a双酶切片段,连接酶连接后转化大肠杆菌Rosetta感受态细胞,涂布于含有卡那霉素的 LB培养基平板,挑选阳性菌落进行液体培养,PCR和双酶切鉴定重组菌,鉴定为阳性的重组菌送上海生工生物有限公司进一步测序鉴定。
1.3.3 串联抗菌肽融合蛋白的原核表达、纯化和切割
将测序鉴定和理论序列相符的阳性重组菌按1%的接种量接种LB液态培养基,37 ℃条件下培养6 h,然后加入IPTG诱导剂 (终浓度为2 nmol/L),37 ℃诱导表达过夜。4 500 r/min离心30 min收集菌体,用超纯水清洗,12 000 r/min离心10 min收集菌体,重复3 次。将所得菌体用裂解液重悬后冰浴条件下超声波破碎,12 000 r/min离心10 min,分别取沉淀 (包涵体) 和上清液留样。包涵体用PBS清洗3次,用8 mol/L的尿素溶液重悬,30 ℃、200 r/min振荡至悬液澄清。离心后取上清液用镍柱进行融合蛋白的纯化 (如重组蛋白不挂镍柱则采用蛋白割胶纯化),用 50–250 mmol/L的咪唑浓度梯度进行洗脱,SDS-PAGE检测各个阶段蛋白样品。将纯化后的蛋白进行透析,然后冷冻干燥,最后利用甲酸进行化学切割。切割甲酸浓度为40%,切割温度37 ℃,切割时间36 h。切割后的样品直接冻干,随后加无菌水溶解后再次冻干,重复3次,尽可能去除样品中的甲酸。最后一次样品用PBS溶解,溶解后的抗菌肽单体采用Trisin-SDS-PAGE检测。
1.4 抗菌肽切割单体抑菌效果的鉴定
1.4.1 培养平板的制备
在灭菌后的平板中倒入1%琼脂作为下层培养基,待下层培养基凝固后,将灭菌后的LB 培养基冷却至65 ℃左右,加入1 mL培养过夜的大肠杆菌TG1菌液混匀,然后加至预先准备的下层培养基上,待培养基凝固后,即制成革兰氏阴性菌抑菌试验培养平板。以同样的方法,用枯草芽孢杆菌制得革兰式阳性菌抑菌平板。
1.4.2 杯碟法检测抗菌肽单体的抑菌效果
抗菌肽的抑菌效果采用杯碟法进行检测。在每个培养平板上摆放5个牛津杯,并标记数字1、2、3、4、5。1 号牛津杯加入 10 mg/mL 氨苄青霉素,2号牛津杯加入阳性对照抗菌肽moricin样品 (定量至1 mmol/L),3号牛津杯加入人工合成的本研究目标抗菌肽标准品 (浓度为1 mmol/L),4号牛津杯加入制备的抗菌肽样品,5号加入PBS作为阴性对照。样品加满整个牛津杯,以不外溢为准,37 ℃培养12 h。根据抑菌圈的直径,判断样品的抗菌活性。
2 结果与分析
2.1 棘胸蛙抗菌肽 Spinosan-C基因的序列分析
Spinosan-C基因的 ORF框及其编码的氨基酸序列如图 1A所示,该基因编码的抗菌肽前体肽长度为 72 aa。经 Blast分析发现,Spinosan-C前体肽和高山倭蛙Nanorana parkeri的多个抗菌肽前体如Temporin-H (GenBank登录号:XP_018423642.1)、Parkerin (GenBank登录号:ACX47914.1)、Japonicin-1NPa (GenBank登录号:ACX47912.1)和Japonicin-1NPb (GenBank登录号:ACX47913.1)具有较高同源性,其相似性分别为 60%、61%、58%和70%;同时和倭蛙Nanoranapleskei抗菌肽Pleskein-1 (GenBank登录号:AIU99932.1)、Pleskein-2 (GenBank登录号:AIU99931.1)和Pleskein-3 (GenBank登录号:AIU99930.1) 的前体肽也具有较高同源性,其相似性分别为76%、55%和73%。进一步分析表明,这些抗菌肽N端具有较高保守性,如图 1B所示,经保守结构域分析表明,这些抗菌肽N端结构域为蛙类皮肤活性肽结构域 FSAP_sig_propep。蛙类皮肤活性肽(Frog skin active peptide,FSAP) 家族成员在N端存在结构域FSAP_sig_propep (pfam03032),该结构域位于FSAP前体的N末端,包含信号肽和前肽,但不包含肽的活性部分,该结构域 N末端较为保守,1−8位一致性氨基酸保守序列为MFTLKKSL。去除抗菌肽前体序列的 FSAP_sig_propep结构域片段,即可获得抗菌肽的成熟活性抗菌肽片段,如图 2B所示,Spinosan-C抗菌肽的成熟肽为SGEKRDLSMMRKAGSNIVCGLNGLC,长度为25 aa。

图1 棘胸蛙抗菌肽Spinosan-C基因的序列分析Fig. 1 Sequence analysis of Spinosan-C gene from Paaspinosa. (A) Open reading frame and deduced amino acid sequence of Spinosan-C gene. (B) Multi-alignment of Spinosan-C precursor and its homologs. Temporin-H, Parkerin,Japonicin-1Npa and Japonicin-1NPb are from Nanoranaparkeri, and Pleskein-1, Pleskein-2 and Pleskein-3 are from Nanoranapleskei. The N terminal region is the frog active peptide conserved domain FSAP_sig_propep, containing Signal peptide domain and Propeptide domain. The C terminal region contains the mature antimicrobial peptide.
2.2 棘胸蛙抗菌肽 Spinosan-C的串联表达与纯化
2.2.1 Spinosan-C基因8倍串联片段的设计
根据上述分析获得的Spinosan-C成熟肽氨基酸序列,采用串联表达的方法进行抗菌肽的原核表达。去掉信号肽和前肽序列后,编码Spinosan-C成熟肽的核酸序列为:5ʹ-AGCGGAGAGAAA AGAGACTTGTCGATGATGAGGAAAGCGGGATC AAATATAGTGTGTGGACTAAATGGGTTGTGT)-3ʹ。为了提高原核表达效率,根据大肠杆菌密码子偏好性设计的编码序列变为:(5ʹ-AGCGGAGAGAA ACGUGACTTGTCAATGATGCGUAAAGCGGGA TCAAATATCGTGTGTGGACTGAATGGGTTGTG T-3ʹ)。设计框架为:EcoR Ⅰ+phoA+8×(甲酸位点+抗菌肽)+Hind Ⅲ位点,即在5ʹ和3ʹ末端分别引入EcoRⅠ酶切位点 (5ʹ-GAATTC-3ʹ) 和Hind Ⅲ酶切位点 (5ʹ-AAGCTT-3ʹ),串联的抗菌肽单体之间插入蛋白甲酸切割位点 (5ʹ-GACCG-3ʹ),同时还加入了导肽 phoA(5ʹ-ATGAAACAAAGCACTATTGC ACTGGCACTCTTATCGTTACTGTTTACCCCTG TGACAAAAGCC-3ʹ)。
2.2.2 Spinosan-C抗菌肽的串联表达与纯化
将设计的8×Spinosan-C基因合成后克隆至大肠杆菌原核表达载体 pET-28a,构建抗菌肽的重组串联表达载体 pET-28a-8×Spinosan-C。构建的重组质粒经过EcoR Ⅰ和Hind Ⅲ双酶切获得一条大小为750 bp左右的条带 (图2),和理论大小一致 (726 bp),双酶切鉴定的重组载体进一步测序鉴定,序列也和理论一致。表明已成功构建了表达8×Spinosan-C串联基因的原核表达载体,可用于后续表达实验。
测序鉴定正确的重组菌通过 IPTG诱导表达(图 3),与阴性对照进行对比,IPTG诱导的重组菌在28 kDa左右有明显的特异性条带,与理论分子量一致(phoA+8倍串联抗菌肽分子量大小为25.2 kDa,HIS标签约3 kDa,共28.2 kDa),表明融合蛋白已经得到高效表达,并且8×Spinosan-C在包涵体中的含量比上清液中高 (图 3A)。利用镍柱亲和层析对包涵体中目的蛋白进行纯化失败后改用割胶方法纯化目的蛋白获得成功 (图3B)。

图 2 重组串联表达载体 pET-28a-8×Spinosan-C 的PCR鉴定和酶切鉴定Fig. 2 Identification of the recombinant expression vector pET-28a-8×Spinosan-C by PCR and double restriction enzyme. M: DL2000 marker; 1: identification by PCR; 2: identification by double restriction enzyme.

图3 抗菌肽串联重组蛋白8×Spinosan-C的表达与纯化Fig. 3 Expression and purification of tandem recombinant protein 8×Spinosan-C. (A) Expression of 8×Spinosan-C. M: protein molecular marker; 1:Escherichia coli Rosetta before inducing; 2: Escherichia coli Rosetta after inducing; 3: recombinant bacteria after inducing; 4: recombinant bacteria before induced; 5:precipitation of recombinant bacteria after ultrasonic disruption; 6: the washing solution of recombinant inclusion body. (B) Purification of tandem recombinant protein 8×Spinosan-C.
2.2.3 串联抗菌肽8×Spinosan-C的甲酸切割
纯化后的重组蛋白采用 40%的甲酸切割获得Spinosan-C抗菌肽单体,经Trisin-SDS-PAGE分析(图4),切割出的抗菌肽单体大小在10 kDa左右,与理论分子量相比偏大 (理论分子量大小为3.3 kDa),这可能与该抗菌肽的偏碱性 (pI 8.88)有关,但切割的抗菌肽单体和对照标准品相比,分子量大小一致,表明已成功切割获得Spinosan-C抗菌肽单体。
2.2.4 Spinosan-C切割单体样品的抑菌效果检测
利用杯蝶法检测切割Spinosan-C单体的抑菌效果,以氨苄青霉素作为阳性对照,结果显示,根据抑菌圈的透明程度和抑菌圈大小来看,不论是化学合成的Spinosan-C单体,还是本实验制备的Spinosan-C单体,均对枯草芽孢杆菌和大肠标杆菌的生长具有一定的抑制作用 (图 5A,5B),可见,通过串联表达后切割获得Spinosan-C抗菌肽的方法是可行的。
3 讨论
抗菌肽是两栖类动物抵御有害病原体入侵的第一道防线[9-11],两栖类动物皮肤抗菌肽大多是碱性多肽,容易与酸性生物膜的层状排列脂类双分子层相结合,依靠两亲的α-螺旋结构的特点形成跨膜的离子通道,在不损伤正常细胞的前提下对细菌、真菌、病毒和癌细胞有抑杀作用[12-13],而且在低浓度条件下仍具有较强的活性,具备很大的开发利用潜力[14]。由于天然抗菌肽资源有限,分离纯化工艺复杂且具有细胞毒性、半衰期短、抗菌谱过宽和对蛋白酶敏感等方面的缺陷[15],难以满足进一步研究和应用的需要,而采用化学方法合成多肽的步骤复杂,一时难以有效降低成本,致使目前可应用于生产实践的产品比较少。但随着抗菌肽结构与功能的破译以及基因工程等批量生产手段的出现,因其操作简便、生产成本较低等特点,非常适用于未来的规模化生产,有望使抗菌肽成为防治水产养殖主要病害的新型药物[16-17]。

图 4 Tricine-SDS-PAGE检测 8×Spinosan-C 的化学切割Fig. 4 Chemical cleavage of 8×Spinosan-C tandem recombinant proteindetected by Tricine-SDS-PAGE. M:protein molecular marker; 1: Spinosan-C monomer; 2:Spinosan-C standard sample by chemical synthesis.
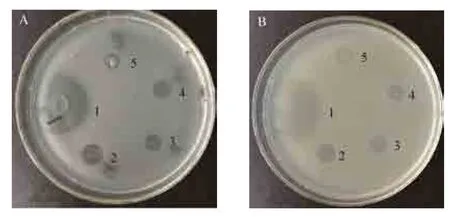
图5 Spinosan-C单体的抑菌效果检测Fig. 5 The bacteriostatic efficacy of Spinosan-C monomer. (A) Bacteriostatic test on Bacillus subtilis. (B)Bacteriostatic test on Escherichia coli. 1: ampicillin; 2: positive controlmoricin; 3: Spinosan-C standard sample by chemical synthesis; 4: prepared Spinosan-C monomer; 5: negative control PBS.
利用基因工程方法表达抗菌肽已在酵母、昆虫、大肠杆菌等多种异源宿主中获得成功[18]。目前,大肠杆菌是应用最为广泛的表达系统,虽然该系统的翻译后加工修饰体系、表达产物的生物活性不及酵母表达系统和昆虫表达系统,但对于抗菌肽这种小分子量的短肽,通常不需要过多的翻译后加工修饰,非常适合能在短时间内高水平表达、发酵条件易于掌控和表达成本低的大肠杆菌系统中进行表达[19-21]。本研究以前期从棘胸蛙皮肤中克隆到的抗菌肽 Spinosan-C为研究对象[8],在大肠杆菌表达系统中通过串联方式获得了抗菌肽的高效表达,对纯化的串联重组蛋白8×Spinosan-C进行甲酸切割后得到纯度较高的Spinosan-C抗菌肽单体。该方法成功解决抗菌肽易被蛋白酶降解及对宿主大肠杆菌的杀伤作用[22],进一步提高了大肠杆菌系统的表达能力,且在家蚕moricin抗菌肽的表达中也得到验证[23],可靠性强,有望为抗菌肽的规模化制备和应用提供可能。
抑菌试验结果表明,所制备的抗菌肽Spinosan-C对革兰氏阳性菌枯草芽孢杆菌和革兰氏阴性菌大肠杆菌的生长均具有一定的抑制作用,但其抑菌能力离应用于生产实践还有一定差距,需要在后续的研究中进一步通过改变氨基酸序列、变换辅助基团等方法对该抗菌肽进行分子设计和结构改造,以提高其抗菌能力[24-28]。
[1]Zasloff M. Antimicrobial peptides of multicellular organisms. Nature, 2002, 415(6870): 389–395.
[2]Reddy KVR, Yedery RD, Aranha C. Antimicrobial peptides: premises and promises. Int J Antimicrob Agents, 2004, 24(6): 536–547.
[3]Mookherjee N, Hancock REW. Cationic host defence peptides: innate immune regulatory peptides as a novel approach for treating infections. Cell Mol Life Sci, 2007, 64(7/8): 922–933.
[4]Gordon YJ, Romanowski EG, Mcdermott AM. A review of antimicrobial peptides and their therapeutic potential as anti-infective drugs. Curr Eye Res, 2005,30(7): 505–515.
[5]Hu MH, Wang YJ. Review on the application of antibacterial peptides as antibiotics replacer in aquaculture. J Beijing Fish, 2007, 6(11): 47–49(in Chinese).胡梦红, 王有基. 传统抗生素替代物抗菌肽在水产养殖中的应用前景. 北京水产, 2007, 6(11): 47–49.
[6]Yang X, Lee WH, Zhang Y. Extremely abundant antimicrobial peptides existed in the skins of nine kinds ofChinese odorous frogs. J Proteome Res,2012, 11(1): 306–319.
[7]Conlon JM, Kolodziejek J, Nowotny N.Antimicrobial peptides from ranid frogs: taxonomic and phylogenetic markers and a potential source of new therapeutic agents. Biochim Biophys Acta, 2004,1696(1): 1–14.
[8]Dong BJ, Zhan ZG, Zheng RQ, et al. cDNA cloning and functional characterisation of four antimicrobial peptides fromPaa spinosaZ. Naturforsch, 2015,70(9/10): 251–256.
[9]Simmaco M, Mignogna G, Barr A. Antimicrobial peptides from amphibian skin: what do they tell us?Biopolymers, 1998, 47(6): 435–450.
[10]Hancock REW, Chapple DS. Peptide antibiotics.Antimicrob Agents Chemother, 1999, 43(6):1317–1323.
[11]Zasloff M. Magainins, A class of antimicrobial peptides fromXenopusskin: isolation,characterization of two active forms, and partial cDNA sequence of a precursor. Proc Natl Acad Sci USA, 1987, 84(15): 5449–5453.
[12]Rozek T, Wegener KL, Bowie JH, et al. The antibiotic and anticancer active aurein peptides from the Australian Bell FrogsLitoria aureaandLitoriaraniformis. Eur J Biochem, 2000, 267(17):5330−5331.
[13]Vanhoye D, Bruston F, Nicolas P, et al.Antimicrobial peptides from hylid and ranin frogs originated from a 150-million-year-old ancestral precursor with a conserved signal peptide but a hypermutable antimicrobial domain. Eur J Biochem,2003, 270(9): 2068−2081.
[14]Pan PP, Feng LW, Li JP, et al. Isolation and biological activityin vitroof skin-antibacterial peptides inXenopuslaevis. J Vet Sci China, 2011,31(8): 1162–1165(in Chinese).潘朋朋, 冯立文, 李吉平, 等. 光滑爪蟾皮肤抗菌肽的分离纯化及活性检测. 中国兽医学报, 2011,31(8): 1162–1165.
[15]Vaara M. New approaches in peptide antibiotics. Curr Opin Pharmacol, 2009, 9(5): 571–576.
[16]Chen B, Cao JM, Chen PJ, etal. Effects of antibacterial peptides ofMusca domesticaon growth performance and immunerelated indicators inLitopenaeus vannamei. J Fish Sci China, 2010, 17(2):258–266(in Chinese).陈冰, 曹俊明, 陈平洁, 等. 家蝇抗菌肽对凡纳滨对虾生长性能及免疫相关指标的影响. 中国水产科学, 2010, 17(2): 258–266.
[17]Lin X, Mao SH, Yang Y, etal. Effects of antimicrobial peptides supplementation on growth,nonspecific immunity and disease resistance of koi(Cyprinus carpio koi). Chin J Anim Nutr, 2013,25(8): 1860–1865(in Chinese).林鑫, 毛述宏, 杨阳, 等. 饲料中添加抗菌肽对锦鲤生长、非特异性免疫力和抗病力的影响. 动物营养学报, 2013, 25(8): 1860–1865.
[18]Ingham AB, Moore RJ. Recombinant production of antimicrobial peptides in heterologous microbial systems. Biotechnol Appl Biochem, 2007, 47(1): 1–9.
[19]Fu DF, Hu JH, Liu XY. Research progress in genetic engineering expression of antimicrobial peptides.China Anim Husb Vet Med, 2010, 37(9): 124–126 (in Chinese).付登峰, 胡建和, 刘兴友. 抗菌肽基因工程表达技术研究进展. 中国畜牧兽医, 2010, 37(9): 124–126.
[20]Tang Y. Research progress in antimicrobial peptides gene expression systems. China Feed, 2013, 23(6):7–9 (in Chinese).唐勇. 抗菌肽基因表达系统的研究进展. 中国饲料, 2013, 23(6): 7–9.
[21]Liu XM, Jiang N, Zhang AZ, et al. Expression of hybrid antimicrobial peptides inPichiayeast and identification of its biological activity.China Biotechnol, 2016, 36(2): 81–89(in Chinese).刘晓明, 姜宁, 张爱忠, 等. 杂合抗菌肽在毕赤酵母中的表达及其活性测定. 中国生物工程杂志,2016, 36(2): 81–89.
[22]Kozlov SA, Vassilevski AA, Grishin EV.Antimicrobial peptide precursor structures suggest effective production strategies. Recent Pat Inflamm Allergy Drug Discov, 2008, 2(1): 58–63.
[23]Zhou Y, Wu CC, Si HQ, et al. Tandem expression ofBom byxmoriantibacterial peptide moricin gene and activity determination of its cleavage product. Sci Sericult, 2015, 41(5): 864–869(in Chinese).周雍, 吴程程, 斯洪强, 等. 家蚕抗菌肽moricin基因的串联表达与切割产物的活性检测. 蚕业科学,2015, 41(5): 864–869.
[24]Hilpert K, Volkmer-Engert R, Walter T, et al.High-throughput generation of small antibacterial peptides with improved activity. Nat Biotechnol,2005, 23(8): 1008–1012.
[25]Hicks RP, Abercrombie JJ, Wong RK, et al.Antimicrobial peptides containing unnatural amino acid exhibit potent bactericidal activity against ESKAPE pathogens. Bioorg Med Chem, 2013, 21(1):205–214.
[26]Albada HB, Chiriac AI, Wenzel M, et al. Modulating the activity of short arginine-tryptophan containing antibacterial peptides with N-terminal metallocenoyl groups. Beilstein J Org Chem, 2012, 8: 1753–1764.
[27]Kim SM, Kim JM, Cho H, et al. Synthesis of antibacterial pseudopeptides with less hemolytic activity from a cytotoxic peptide and their pH-dependent activity. Bioorg Med Chem Lett, 2009,19(19): 5627–5631.
[28]Wieczorek M, Jenssen H, Kindrachuk J, et al.Structural studies of a peptide with immune modulating and direct antimicrobial activity. Chem Biol, 2010, 17(9): 970–980.
