柠檬酸钠对脱氮假单胞杆菌发酵产维生素B12代谢过程的影响
2018-02-28吴志明李昆太
杨 勇,龙 悦,吴志明,夏 薇,李昆太*
(1.江西农业大学 生物科学与工程学院,江西 南昌 330045;2.江西派尼生物药业有限公司,江西 安义 330500)
维生素B12(Vitamin B12)又称钴胺素,通常用来表示含钴离子的类咕啉(corrinoid)化合物,最早作为“抗恶性贫血因子”在1926年发现。作为一种重要的生理活性物质,维生素B12是许多重要生物化学反应所必需的辅酶,如分子内重排作用、由三磷酸核糖核苷酸生成2′-三磷酸脱氧核糖核苷酸的还原反应、分子间甲基转移反应等[1]。
由于维生素B12的分子结构极为复杂,其全化学合成需要多达70余个的反应步骤[2],且成本昂贵,故目前几乎都是通过微生物发酵的方式来生产维生素B12。而具备维生素B12合成能力的微生物有很多种,但目前成功应用于工业化发酵生产维生素B12的菌株主要有费氏丙酸杆菌(Propionibacteriumfreudenreichii)、谢氏丙酸杆菌(Propionibacteriumshermanii)和脱氮假单胞杆菌(Pseudomonasdenitrificans)等[3]。其中,脱氮假单胞杆菌更是因为其维生素B12产率高,而成为当前应用最广的维生素B12生产菌株。尤其是通过一系列发酵工艺的优化,脱氮假单胞杆菌的维生素B12工业化发酵水平近年来得到了大幅度的提高,稳定在200 mg/L以上[4]。
并且经过几十年研究,脱氮假单胞杆菌中维生素B12生物合成途径已经得到阐明[5-7]。Wang等[8]利用13C同位素标记代谢流分析的方法考察了维生素B12产生菌脱氮假单胞杆菌的中心代谢网络,发现糖酵解途径(EMP途径)的代谢活性很低,主要利用ED途径分解代谢葡萄糖,并且存在较大通量的磷酸戊糖途径(HMP途径)。有文献[9-10]报道柠檬酸钠结合葡萄糖代谢能阻止微生物发酵过程中副产物的合成,柠檬酸钠作用于微生物发酵的探究也逐渐深入。刘新星等[11]和陈双喜等[12]发现柠檬酸钠能减弱丙酮酸激酶和磷酸果糖激酶的活性,并能抑制EMP途径和TCA循环之间的“碳源溢流”,增加HMP途径的通量,大幅度提高肌苷产量。随后,大量的文献[13-16]报道,添加柠檬酸钠能在不影响菌体正常生长的情况下,减少发酵副产物的生成,改变目标产物合成途径关键点的代谢流分布,提高目标产物合成途径的代谢流量,提高胞内NADPH、NADH和ATP的水平,促进目标产物的合成和积累。
因此,本文通过摇瓶培养的方式,结合酶学方法,从发酵液pH、菌体生长量、维生素B12产量、有机酸含量和糖代谢途径的关键酶活力等角度出发,考察了不同浓度的柠檬酸钠对脱氮假单胞杆菌发酵过程的影响,并总结出添加浓度为0.3%的柠檬酸钠最有利于脱氮假单胞杆菌发酵产维生素B12。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种 脱氮假单胞杆菌(Pseudomonasdenitrificans),由本实验室保存。
1.1.2 药品和仪器 乙酰辅酶A、葡萄糖-6-磷酸脱氢酶、醛缩酶、磷酸丙糖异构酶、甘油醛-3-磷酸脱氢酶和L-乳酸脱氢酶均为Sigma产品,DNA酶、草酰乙酸、磷酸烯醇丙酮酸、ATP、ADP、NADP、NADH、NADPH均为进口分装生化试剂,其他试剂均为国产分析纯。
UV765型紫外-可见分光光度计(上海精科);ZHWY-2112型大振幅恒温双层摇床(上海智诚);高效液相色谱仪SPD-20A(MODEL);雷磁pHS-3C pH计(上海精科)。
1.2 培养基
1.2.1 斜面培养基 蔗糖30 g,蛋白胨10 g,玉米浆10 g,(NH4)2SO40.25 g,(NH4)2HPO41.5 g,MnSO4·H2O 0.1 g,ZnSO4·7H2O 0.1 g,琼脂20 g,去离子水1 000 mL。灭菌前调pH 至7.0~7.2。
1.2.2 种子培养基 蔗糖35 g,蛋白胨20 g,KH2PO45 g,(NH4)2SO42.0 g,(NH4)2HPO40.8 g,MgSO41.5 g,ZnSO4·7H2O 0.02 g,MnSO4·H2O 0.2 g,去离子水1 000 mL。灭菌前调pH至 7.2~7.4。
1.2.3 发酵培养基 蔗糖50 g,蛋白胨25 g,(NH4)2SO41 g,ZnSO4·7H2O 0.08 g,MgSO42 g,KH2PO40.8 g,甜菜碱10 g,5,6-二甲基苯并咪唑(DMBI)0.08 g,CoCl2·6H2O 0.15 g,CaCO32 g,去离子水1 000 mL。灭菌前调pH至 7.2~7.4。
1.3 摇瓶发酵方法
种子液的制备:每支培养好的脱氮假单胞杆菌新鲜斜面(18 mm×180 mm)加入10 mL无菌水,刮洗制备成菌悬液。以无菌吸管吸取2 mL菌悬液至装有种子培养基的三角瓶(装量为50 mL/250 mL三角瓶)中,在摇床上进行种子液的培养,培养条件为:温度30 ℃;转速180 r/min;培养至OD700为9~10(周期大概24 h)。
摇瓶发酵:培养好的种子液按10%接种量接种到装有发酵培养基的摇瓶(装量为40 mL/250 mL三角瓶)中,在30 ℃的温度和180 r/min的转速下培养。
将柠檬酸钠按照相应的浓度梯度(浓度梯度为0%、0.05%、0.1%、0.2%、0.3%、0.4%)添加到发酵培养基中,进行摇瓶发酵培养。
1.4 酶液的制备
取5 mL发酵液于4 ℃,4 000 r/min离心20 min,沉淀用5 mL磷酸盐缓冲液(PBS,pH 7.0) 充分混匀后在上述相同条件下离心,弃上清继续用PBS清洗再离心。上述处理后的沉淀中加入5 mL PBS,DNA酶(2.5 mg/mL) 25 μL,溶菌酶(25 mg/mL) 300 μL,充分混匀在30 ℃水浴振荡30 min,于4 ℃ 8 000 r/min离心20 min,上清即为细胞裂解液[11]。
1.5 测定方法
1.5.1 菌体生物量的测定 将取样的发酵液进行适当的稀释后,于700 nm处测定吸光值,用蒸馏水作为对照,试验设3次重复。菌体的光密度(OD700)=OD读数×稀释倍数。
1.5.2 维生素B12含量的测定 取30 mL充分摇匀的发酵液于4 000 r/min离心10 min,去上清后加30 mL蒸馏水搅匀在上述相同条件下离心,倒去上清液后加入10 mL蒸馏水将菌体搅匀,加入8%(质量比)亚硝酸钠溶液和冰乙酸各3 mL,摇匀,于95~100 ℃水浴30 min;水浴后冷却至室温,加蒸馏水定容至50 mL,过滤。所得滤液适当稀释后,在波长为361 nm处进行紫外光谱分析,根据所绘制的标准曲线算出维生素B12含量[3],试验设3次重复。
1.5.3 酶液中蛋白的测定 酶液中蛋白的测定采用考马斯亮蓝法[17]。
1.5.4 酶活的测定 (1)葡萄糖激酶:采用6-磷酸葡萄糖脱氢酶偶联比色法[18],1 mL反应体积中含有50 mmol/L Tris-HCl(pH 7.5),1 mmol/L ATP,0.5 mmol/L NADP,10 mmol/L MgCl2,10 mmol/L葡萄糖和0.7U 葡萄糖-6-磷酸脱氢酶。
(2)丙酮酸激酶:参照文献[19]并做了部分修改,1 mL反应体积中含有2 mmol/L磷酸烯醇式丙酮酸,5 mmol/L ADP,2 mmol/L果糖-1,6-二磷酸,0.15 mmol/L NADH,80 mmol/L KCl,10 mmol/L MgCl2和2.85 U L-乳酸脱氢酶。
(3)葡萄糖-6-磷酸脱氢酶:参照文献[20]并做了部分修改,1 mL反应体积中含有2 mmol/L葡萄糖-6-磷酸,1 mmol/L NADP和10 mmol/L MgCl2。
(4)磷酸果糖激酶:采用酶偶联法[21],1 mL反应体积中含有2 mmol/L果糖-6-磷酸,1 mmol/L ATP,0.3 mmol/L NADH,10 mmol/L MgCl2,1 U醛缩酶,3.5 U磷酸丙糖异构酶和1 U甘油醛-3-磷酸脱氢酶。
(5)柠檬酸合成酶:参照文献[22]并做了部分修改,1 mL反应体积中含有1 mmol/L 2-硝基苯甲酸(DTNB),0.5 mmol/L乙酰辅酶A,10 mmol/L草酰乙酸和10 mmol/L MgCl2。
葡萄糖激酶和葡萄糖-6-磷酸脱氢酶的酶活测定时,1 mL反应体系和50 μL细胞裂解液分别在30 ℃水浴锅中预热5 min,混合后立即连续测定340 nm处吸光值10 min,△A值=反应10 minA340值-反应0 minA340值,根据所绘制的NADPH标准曲线算出酶量。
丙酮酸激酶和磷酸果糖激酶的酶活测定时,1 mL反应体系和50 μL细胞裂解液分别在30 ℃水浴锅中预热5 min,混合后立即连续测定340 nm处吸光值10 min,△A值=反应0 minA340值-反应10 minA340值,根据所绘制的NADH标准曲线算出酶量。
柠檬酸合成酶的酶活测定时,1 mL反应体系和50 μL细胞裂解液分别在30 ℃水浴锅中预热5 min,混合后立即连续测定412 nm处吸光值10 min,△A值=反应10 minA340值-反应0 minA340值,根据公式A=εbc算出酶量,摩尔吸光系数ε=1 485 L/(mol·cm)。
一个酶活力单位(U)定义为在30 ℃下,1分钟催化1 μmol的底物反应所需的酶量。根据各样品的蛋白质含量,计算出酶的比活力(比活力代表的是添加柠檬酸钠与不添加柠檬酸钠对照酶活下的比值)。
1.5.5 有机酸的测定 采用HPLC法,色谱条件:色谱柱 Hi-Plex H(8 μm,300 mm×7.8 mm),流动相0.01 M H2SO4,流速 0.4 mL/min,样品量 10 μL,温度 50 ℃,检测器 UV 210 nm。标准品为柠檬酸、延胡索酸、乙酸、丙酮酸、苹果酸、琥珀酸、草酰乙酸、α-酮戊二酸和丙酸。
2 结果与分析
2.1 柠檬酸钠对脱氮假单胞杆菌发酵过程基本参数的影响
不同浓度的柠檬酸钠对菌体发酵过程基本参数的影响如图1所示。其中A、B、C 3图分别表示菌浓、pH以及维生素B12变化曲线。从图中可以看出,发酵前72 h的菌体生长速度随着柠檬酸钠添加浓度的增大而明显增加,这表明柠檬酸钠的添加有助于P.denitrificans的菌体生长;另外,当发酵培养基中的柠檬酸钠添加浓度为0.3%和0.4%时,其维生素B12发酵产量明显高于未添加柠檬酸钠的发酵处理,产量分别高达45.73 μg/mL和50.44 μg/mL,这表明柠檬酸钠对产物合成具有一定的促进作用;进一步测定了发酵过程的pH变化情况,结果显示柠檬酸钠有助于维系发酵液的pH保持在合理水平,尽管0.3%和0.4%柠檬酸钠添加方案下的菌体生长较为迅速,但是其整个发酵过程的pH却一直稳定在6.5~7.0,而其他发酵方案的pH出现了明显的下降趋势。
综合以上结果可以得出结论,发酵培养基中添加质量浓度为0.3%~0.4%的柠檬酸钠不仅有利于P.denitrificans的菌体生长和维生素B12合成,而且还对发酵液的pH具有较强的缓冲作用,使得整个发酵过程的pH一值保持在较合理的水平。

图1 柠檬酸钠脱氮假单胞杆菌发酵过程基本参数的影响Fig.1 The effects of sodium citrate on basic parameters of Pseudomonas denitrificans fermentation
2.2 柠檬酸钠对有机酸代谢的影响
为了进一步研究柠檬酸钠对脱氮假单胞杆菌代谢过程的影响,在发酵培养基中分别加入质量浓度为0%和0.3%的柠檬酸钠,测定这2种发酵方案下有机酸动态变化情况。
由图2可知在脱氮假单胞杆菌发酵过程中,柠檬酸、延胡索酸、琥珀酸和苹果酸是主要的有机酸代谢物。柠檬酸钠的添加明显促进了发酵前期柠檬酸浓度积累。而随着发酵的进行,这2种发酵处理的柠檬酸浓度均呈明显的下降趋势。然而,当培养基中未添加柠檬酸钠时,其柠檬酸浓度反而显著高于0.3%柠檬酸钠添加量下的处理。这说明柠檬酸钠的添加会抑制柠檬酸的生成。在发酵前中期添加柠檬酸钠后,延胡索酸浓度升高,而发酵后期未添加柠檬酸钠的发酵处理略高。因此,柠檬酸钠的添加会促进延胡索酸的生成。但无论是否添加柠檬酸钠,苹果酸浓度在前36 h相差不大,但是此后未添加柠檬酸钠的发酵过程的苹果酸浓度则显著高于0.3%柠檬酸钠添加量的发酵处理,二者含量在72 h时相差达60 mmol/L。这说明柠檬酸钠的添加会促进苹果酸的消耗。在发酵前48 h,未添加柠檬酸钠处理下的琥珀酸浓度明显更高,在发酵后期这2种发酵处理的琥珀酸浓度相差不大。因此,柠檬酸钠的添加会抑制琥珀酸的生成。
2.3 柠檬酸钠对糖代谢途径中关键酶活力的影响
以不添加柠檬酸钠的发酵处理为对照,考察了添加0.1%和0.3% 2种质量浓度下菌体糖代谢途径中关键酶的相对比酶活力。其结果如图3所示,其中a、b、c、d和e图分别表示葡萄糖激酶、丙酮酸激酶、葡萄糖-6-磷酸脱氢酶、磷酸果糖激酶和柠檬酸合酶相对比活力。
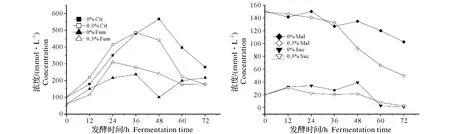
图2 柠檬酸钠对有机酸代谢的影响Fig.2 The effects of sodium citrate on the metabolism of organic acids

*The ratio between the enzyme activity with sodium citrate addition and the enzyme activity without sodium citrate addition图3 糖代谢途径关键酶相对比活的时序变化Fig.3 Relative specific activity of key enzymes in glucose metabolism pathway
从图3可以看出,在整个发酵过程中,添加了柠檬酸钠后葡萄糖激酶的活力没有明显的变化,且添加与未添加柠檬酸钠这两者的酶活力相近,比值都在1上下略微波动,始终保持着较大的酶活力,说明柠檬酸钠对葡萄糖激酶的影响不大。在整个发酵过程中,添加了柠檬酸钠后丙酮酸激酶的活力变化很明显。在发酵初期,添加柠檬酸钠后丙酮酸激酶的活力较大,比未添加时增加了35%。随着发酵的进行,其酶活力开始下降,且低于未添加柠檬酸钠时的相对比活力,最低的仅有接近70%,同比发酵初期降低了接近60%。随着葡萄糖的浓度增加,柠檬酸钠开始降低丙酮酸激酶的活力,且较高浓度的柠檬酸钠对丙酮酸激酶的抑制作用更强。
c为0.1%和0.3% 2种柠檬酸钠添加质量浓度下,其发酵过程中葡萄糖-6-磷酸脱氢酶的相对比酶活力时序变化。从图中可看出,添加柠檬酸钠后对葡萄糖-6-磷酸脱氢酶的活力有一定的影响,并从图中可以看出,在菌体生长和维生素B12合成的开始阶段,柠檬酸钠提高了葡萄糖-6-磷酸脱氢酶的活力。从d图不同时间相对酶活数据分析,添加柠檬酸钠后明显降低了磷酸果糖激酶的活性。除此之外,在整个发酵过程中,柠檬酸钠浓度为0.3%的酶活力低于浓度为0.1%的处理,说明柠檬酸钠对磷酸果糖激酶有强烈的抑制作用,且柠檬酸钠的浓度越大,抑制作用越强。与磷酸果糖激酶的酶活力变化趋势相类似,添加柠檬酸钠的柠檬酸合成酶酶活力出现了明显的下降,相对比活最大减少了70%。而且柠檬酸钠的添加浓度越高,其柠檬酸合成酶酶活力越低。由此可见,柠檬酸钠对柠檬酸合成酶的酶活力具有一定的抑制作用,这与前面添加柠檬酸钠会抑制柠檬酸的生成相一致。
3 结论与讨论
由于维生素B12的化学结构非常复杂,合成过程高度繁琐。使得应用化学方法来工业化生产维生素B12在技术上存在很大的难度,成本十分昂贵。而在脱氮假单胞杆菌发酵产维生素B12过程中,添加一些维生素B12合成所必需的化合物是非常必要的。例如钴离子和5,6-二甲基苯并咪唑[23]。另外,在发酵培养基中添加甘氨酸、苏氨酸、5-氨基乙酰丙酸、甜菜碱和胆碱等甲基供体,也能促进维生素B12的合成[24],特别是胆碱能增加膜透性[3]。除此之外,不同的无机氮源对P.denitrificans代谢产维生素B12的影响也是不一样的,彭卫福等[25]通过研究发现,硫酸铵是维生素B12发酵较为适宜的无机氮源,高浓度的NH4+能明显促进菌体的生长,但是会对维生素B12的合成产生一定的负作用。
为了进一步阐明柠檬酸钠添加对P.denitrificans代谢途径所产生的影响,研究发酵过程有机酸和糖代谢途径关键酶酶活力的时序性动态变化发现:在TCA循环中,琥珀酸是由琥珀酰CoA水解生成,而琥珀酰CoA是脱氮假单胞杆菌合成维生素B12的重要前体物质。由此可见,柠檬酸钠抑制琥珀酸的生成,可能会使得大量的琥珀酰CoA得以流向维生素B12合成途径。另外,柠檬酸钠促进苹果酸的快速利用,产生大量的还原力NADH,更好地满足了维生素B12合成所需。本文所测定的5个酶均为代谢网络中的关键酶,根据Wang等[8]的研究结果,并结合前文中维生素B12合成量分析推测,在脱氮假单胞杆菌中心代谢途径中存在较大通量的HMP途径,这可能是HMP途径为菌体生长提供大量的前体代谢物,而较高浓度的柠檬酸钠提高了葡萄糖-6-磷酸脱氢酶的活力,从而提高了HMP途径的通量,为维生素B12的合成提供了大量的NADPH,故维生素B12产量大幅度增加。此外,由于柠檬酸钠与葡萄糖的联合作用增加了细胞内磷酸烯醇式丙酮酸(PEP)的浓度,而PEP是磷酸果糖激酶的强烈抑制剂[26],而磷酸果糖激酶的活力受高浓度ATP的抑制[6],柠檬酸钠增强了ATP对磷酸果糖激酶的抑制作用,因此减缓了糖酵解途径的速率。TCA循环中,柠檬酸合成酶的活力也受到了一定的限制作用。由此可见,柠檬酸钠的添加可增加P.denitrificans中HMP途径的代谢通量,而这可为维生素B12的合成提供充足的还原力NADPH,从而有利于维生素B12发酵产量的提高。
综上所述,柠檬酸钠的添加提高了胞内ATP的含量,增加了HMP途径的代谢通量,降低了EMP和TCA循环的代谢流量,为维生素B12的合成提供充足的还原力NADPH,有利于维生素B12产量的提高。
[1] Randaccio L,Geremia S,Demitri N,et al.Vitamin B12:unique metalorganic compounds and the most complex vitamins[J].Molecules,2010,15(5):3228-3259.
[2] Eschenmoser A.Organic natural-product synthesis today.vitamin B12as an example[J].Naturwissenschaften,1974,61:513-525.
[3] Martens H,Barg H,Warren M J,et al.Microbial production of vitamin B12[J].Appl Microbiol Biotechnol,2002,58(3):275-285.
[4] Kang Z,Zhang J,Zhou J,et al.Recent advances in microbial production of δ-aminolevulinic acid and vitamin B12[J].Biotechnol Adv,2012,30(6):1533-1542.
[5] Debussehe L,Thibaut D,Cameron B,et al.Biosynthesis of the corrin macrocycle of coenzyme B12inPseudomonasdenitrificans[J].Baeteriol,1993,175(22):7430-7440.
[6] Warren M J,Raux E,Sehubert H L,et al.The biosynthesis of Adenosylcobalamin(vitamin B12)[J].Nat Prod Rep,2002,19(4):390-412.
[7]Moore S J,Lawrence A D,Biedendieck R,et al.Elucidation of the anaerobic pathway for the corrin component of cobalamin(vitamin B12)[J].Proceedings of the National Academy of Sciences,2013,110(37):14906-14911.
[8] Wang Z J,Wang P,Liu Y W,et al.Metabolic flux analysis of the central carbon metabolism of the industrial vitamin B12producing strainPseudomonasdenitrificansusing 13C-labeled glucose[J].Taiwan Inst Chem Eng,2012,43(2):181-187.
[9] Goel A,Jinwoon L,Domach M M,et al.Metabolic fluxes,pool and enzyme measurements suggest a tighter coupling of energetics and biosynthetic reactions associated with reduced pyruvate kinase flux[J].Biotechnol Bioeng,1999,64(2):129-134.
[10] 唐军,蔡水洪,叶勤.克鲁斯假丝酵母分批发酵生产甘油的代谢流分布[J].高校化学工程学报,2002,16(1):58-63.
Tang J,Cai S H,Ye Q.Metabolic flux distribution in batch cultivation ofCandidakruseifor glycerol production[J].Journal of Chemical Engineering of Chinese Universities,2002,16(1):58-63.
[11] 刘新星,陈双喜,储炬,等.柠檬酸钠对枯草杆菌生长代谢及肌苷积累的影响[J].微生物学报,2004,44(5):627-630.
Liu X X,Chen S X,Chu J,et al.Effect of sodium citrate on the growth metabolism and inosine accumulation byBacillussubtilis[J].Acta Microbiologica Sinica,2004,44(5):627-630.
[12] 陈双喜,黄明志,储炬,等.柠檬酸钠对肌苷发酵过程代谢流分布的调节[J].化工学报,2005,56(9):1731-1737.
Chen S X,Huang M Z,Chu J,et al.Regulation of sodium citrate on metabolic flux distribution of inosine fermentation process[J].Journal of Chemical Industry and Engineering(China),2005,56(9):1731-1737.
[13] 秦永锋,徐庆阳,谢希贤,等.柠檬酸钠对L-缬氨酸发酵及代谢流量分布的影响[J].天津科技大学学报,2010,25(2):9-12.
Qin Y F,Xu Q Y,Xie X X,et al.Effects of sodium citrate on metabolic flux distributions of L-Valine fermentation[J].Journal of Tianjin University of Science & Technology,2010,25(2):9-12.
[14] 马雷,程立坤,徐庆阳,等.柠檬酸钠对L-异亮氨酸发酵及代谢流量分布的影响[J].天津科技大学学报,2010,25(3):14-18.
Ma L,Cheng L K,Xu Q Y,et al.Effects of sodium citrate on metabolic flux distributions of L-isoleucine fermentation[J].Journal of Tianjin University of Science & Technology,2010,25(3):14-18.
[15] 王凤,石侃,潘涛,等.柠檬酸钠和生物素对白色链霉菌发酵产ε-聚赖氨酸的影响[J].现代食品科技,2013,29(6):1230-1233.
Wang F,Shi K,Pan T,et al.Effect of sodium citrate and biotin on ε-poly-lysine fermentation ofStreptomycesalbulus[J].Modern Food Science and Technology,2013,29(6):1230-1233.
[16] 王玉磊,朱健,卫功元,等.柠檬酸钠促进S-腺苷蛋氨酸和谷胱甘肽联合高产[J].中国生物工程杂志,2013,33(8):49-54.
Wang Y L,Zhu J,Wei G Y,et al.Increased Co-production of S-adenosylmethionine and glutathione by sodium citrate addition[J].China Biotechnology,2013,33(8):49-54.
[17] Bradford M M.A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(1/2):248-254.
[18] Pestma E,Sehefiers W A,vall Dijken J P.Adaptation of the kinetics of glucose transport to envirmental conditions in the yeast Candida utilis CBS 621 continuous culture study[J].Gen Microbiol,1988,134(5):1109-1116.
[19] Collins L B,Thomas T D.Pyruvate Kinase ofStreptococcuslactis[J].Journa of Bacteriology,1974,120(1):52-58.
[20] Avigad G.Inhibition of glucose 6-phosphate dehydrogenase by adenosine 5’-triphosphate[J].Proceedings of the National Academy of Sciences,1966,56(5):1543-1547.
[21] Phong W Y,Lin W,Rao S P S,et al.Characterization of phosphofructokinase activity inMycobacteriumtuberculosisreveals that a functional glycolytic carbon flow is necessary to limit the accumulation of toxic metabolic intermediates under hypoxia[J].Plos One,2013,(8)2:1-11.
[22] Fortnagel P,Freese E.Analysis of sporulation mutants.Ⅱ.Mutants blocked in the citric acid cycle[J].Bacteriof,1969,95(4):1434-1438.
[23] Akshay G,Jinwoon L,Michale M,et al.Metabolic fluxes,pool and enzyme measurements suggest a tighter coupling of energeties and biosynthetie reactions associated with reduced pyruvate kinase flux[J].Biotechnol and Bioeng,1999,64(2):129-134.
[24] 周佳,程新,彭志远,等.典型性甲基供体对脱氮假单胞杆菌代谢过程的氧调控作用[J].食品工业科技,2013,34(7):162-164.
Zhou J,Chen X,Peng Z Y,et al.Regulatory effect of the typical methyl-group donors on the oxygen metabolism inPseudomonasdenitrificans[J].Science and Technology of Food Industry,2013,34(7):162-164.
[25] 彭卫福,陈未,周佳,等.无机氮源对脱氮假单胞杆菌产维生素B12代谢过程的影响[J].食品工业科技,2013,34(18):178-181.
Peng W F,Chen W,Zhou J,et al.Effect of inorganic nitrogen sources on the metabolic process of vitamin B12producing byPseudomonasdenitrificans[J].Science and Technology of Food Industry,2013,34(18):178-181.
[26] Zhou J,Liu L,Chen J.Improved ATP supply enhances acid tolerance of Candida glabrata during pyruvic acid production[J].Applied Microbiology,2011,110(1):44-53.
