假单胞杆菌BS1培养条件的研究
2013-08-06刘铜毕思宁史洁侯巨梅崔素萍王彦杰左豫虎于裴芝
刘铜,毕思宁,2,史洁,侯巨梅,崔素萍,王彦杰,左豫虎,于裴芝
(1.黑龙江八一农垦大学,大庆 163319;2.黑龙江生态工程职业学院)
生物表面活性剂是一类由微生物代谢产生的两性化合物,具有化学合成表面活性剂所无法比拟的环境兼容性和广阔的应用前景。由于生物表面活性剂可生物降解、对有机体无毒害,因此在医药、洗涤剂、原油开采和食品工业以及植物病原菌生物防治方面具有潜在的应用价值[1-2]。假单胞杆菌BS1 是从大庆 石油污染土样中分离的一株可以产生生物表面活性剂的菌株[3-4],同时发现假单胞杆菌BS1 的菌体、去菌体发酵滤液对植物病原菌有一定的抑制作用,这表明了假单胞杆菌BS1 具有一定的生防潜力[5]。由此可见,假单胞杆菌BS1 具有很好的工业开发前景和应用价值。将对假单胞杆菌BS1 培养条件进行优化,为以后开发利用假单胞杆菌BS1 提供了更加可靠的理论依据。
1 材料与方法
1.1 供试菌株
假单胞杆菌BS1[3],由黑龙江八一农垦大学农学院植物病理与应用微生物所提供。
1.2 供试培养基
无机盐培养基:硝酸钠1.5 g,硫酸铵1.5 g,磷酸氢二钾1.31 g,硫酸镁0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,氯化钙0.002 g,蒸馏水1 000 mL,pH 7.0。
发酵培养基:硝酸钠1.5 g,硫酸铵1.5 g,磷酸氢二钾1.0 g,硫酸镁0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,氯化钙0.002 g,蒸馏水1 000 mL,液体石蜡5%,pH 7.0。
固体LB 培养基:胰化蛋白胨10 g,酵母提取物5 g,氯化钠10 g,琼脂15 g,定容至1 000 mL。以上培养基均经过121 ℃高压蒸汽灭菌20 min 后,保存备用。
1.3 碳源对假单胞杆菌BS1 生长的影响
将供试假单胞杆菌BS1 在固体LB 培养基上活化24 h 后,用无菌水配制成菌悬液(107cfu·mL-1)。向100 mL 的无机盐培养基中分别加入5 mL 的液体石蜡、正己烷、正辛烷、正庚烷作为碳源,每处理重复3 次,灭菌后,按1%的比例分别接种菌悬液,置于37 ℃、180 r·min-1振荡培养箱中培养9 d,每隔24 h取一次样,通过紫外分光光度计测定各处理菌悬液的光吸收值(OD640)。
1.4 接种量对假单胞杆菌BS1 生长的影响
在100 mL 灭菌后的发酵培养基中分别以1%、2%、3%、5%、7.5%、10%的比例接种菌悬液,每处理3 次重复,置于37 ℃、180 r·min-1振荡培养箱中培养9 d,每隔24 h 取一次样,通过紫外分光光度计测定各处理菌悬液的光吸收值(OD640),每处理重复3 次。
1.5 温度对假单胞杆菌BS1 生长的影响
将菌悬液按3%比例的接种量接种于灭菌后的发酵培养基中,然后分别置于25、30、35、37、40 ℃,180 r·min-1的振荡培养箱中培养9 d,每隔24 h 取一次样,每处理重复3 次,通过紫外分光光度计测定各处理菌悬液的光吸收值(OD640)。
1.6 pH 对假单胞杆菌BS1 生长的影响
用0.1 mol·L-1的HCl 或NaOH 将发酵培养基的pH 值分别调至5.0、6.0、7.0、8.0 和9.0,每处理3 次重复,灭菌后按3%比例的接种量接入菌悬液,置于30 ℃、180 r·min-1振荡培养箱中培养9 d,每隔24 h取样一次,通过紫外分光光度计测定各处理菌悬液的光吸收值(OD640),每处理重复3 次。
1.7 NaCl 浓度对假单胞杆菌BS1 生长的影响
在发酵培养基其他成分不变的情况下,分别以0%、1%、3%、5%、10%、15%的比例添加NaCl,每处理3 次重复,然后按3%比例的接种量接入菌悬液,置于30 ℃、180 r·min-1振荡培养箱中培养9 d,每隔24 h取一次样,通过紫外分光光度计测定各处理菌悬液的光吸收值(OD640),每处理重复3 次。
1.8 装液量对假单胞杆菌BS1 生长的影响
将250 mL 的三角瓶中分别装入70、100、130、160、190 mL 的发酵培养基,每处理3 次重复,灭菌后,按3%比例的接种量接入菌悬液,置于30 ℃、180 r·min-1振荡培养箱中培养9 d,每隔24 h 取一次样,通过紫外分光光度计测定各处理菌悬液的光吸收值(OD640),每处理重复3 次。
1.9 最适培养条件下假单胞杆菌BS1 生长曲线的测定
将发酵培养基按130 mL 的装液量装入三角瓶中(250 mL 的三角瓶),灭菌后以3%比例的接种量接入菌悬液,置于30 ℃、180 r·min-1振荡培养箱中培养,每处理重复3 次,定时取样,通过紫外分光光度计测定各处理菌悬液的光吸收值(OD640)。
2 结果与分析
2.1 碳源对假单胞杆菌BS1 生长的影响

图1 碳源对假单孢杆菌BS1 生长的影响Fig.1 The effect of carbon source on Pseudomonas bacillus BS1
结果如图1 所示,从图中可以看出,以液体石蜡为碳源的无机盐培养基中,假单胞杆菌BS1 菌体的生长状况良好,培养第7 d 时菌悬液的OD640值为2.10。当以正辛烷、正庚烷、正己烷为碳源时,随着碳链长度的减小,菌体的生长状况逐渐下降,培养第7 d 时菌悬液的OD640值分别为1.31、0.46、0.14;当以正己烷为碳源时,菌体几乎没有生长,培养9 d 内菌悬液的OD640值基本处于同一水平;这可能是由于假单胞杆菌BS1 不能利用正己烷、正庚烷为碳源进行生长代谢,或是由于正己烷、正庚烷对菌体细胞产生的毒性,使其生长受到抑制。
2.2 接种量对假单胞杆菌BS1 生长的影响
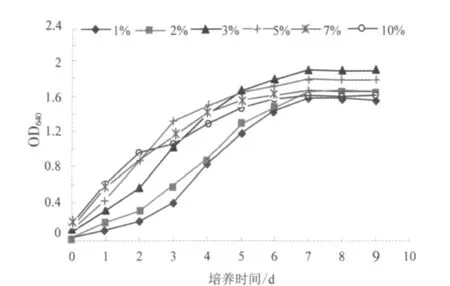
图2 接种量对菌株生长的影响Fig.2 The effect of inoculum size on Pseudomonas bacillus BS1
图2 为接种量对假单胞杆菌BS1 生长的影响试验结果,从图中可以看出:接种量分别为1%、2%时,菌体生长的延滞期较长(0~3 d),菌体的生长状况较差,培养第7 d 时菌悬液的OD640值分别为1.63、1.70。当接种量分别为5%、7%、10%时,培养前期(0~4 d)菌体生长较快,但培养后期(4~9 d)菌体的生长状况不如接种量为3%时,培养第7 d 时菌悬液的OD640值分别为1.82、1.71、1.66 和1.91。
2.3 温度对假单胞杆菌BS1 生长的影响
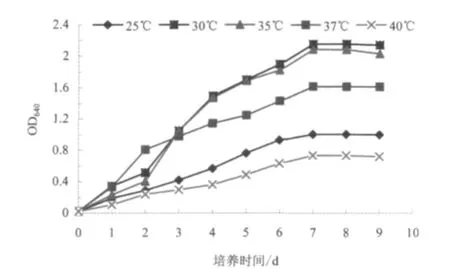
图3 温度对菌株生长的影响Fig.3 The effect of temperture on Pseudomonas bacillus BS1
试验结果图3 表明,温度对假单胞杆菌BS1 的生长有一定的影响,在25~40 ℃温度范围内,菌体均可以生长。温度为30 ℃时,菌体的生长状况最好,培养第7 d 时菌悬液的OD640值为2.16。其次是温度为35 ℃、37 ℃时,培养第7 天时菌悬液的OD640值分别为2.09 和1.62。当温度为25 ℃和40 ℃时,菌体的生长状况较差,培养第7 d 时菌悬液的OD640值分别为1.01、0.74。
2.4 pH 对假单胞杆菌BS1 生长的影响

图4 pH 对假单胞杆菌BS1 生长的影响Fig.4 The effect of pH on Pseudomonas bacillus BS1
2.5 NaCl 浓度对假单胞杆菌BS1 生长的影响

图5 NaCl 浓度对假单胞杆菌BS1 生长的影响Fig.5 The effect of NaCl concentration on Pseudomonas bacillus BS1
NaCl 浓度对假单胞杆菌BS1 生长的影响试验结果如图5 所示。结果表明,假单胞杆菌BS1 的生长随NaCl 浓度的增加而逐渐受到抑制。当培养基中不添加NaCl(浓度为0)时,菌体的生长状况最好,其次是NaCl 浓度为1%和3%时,培养第7 d 时菌悬液的OD640值分别为2.16、2.04 和1.74。当NaCl 浓度为5%时,菌体的生长明显受到抑制,培养第7 d 时菌悬液的OD640值为1.20;当NaCl 浓度为10%和15%时,菌体几乎不再生长,这表明过高的盐浓度不利于假单胞杆菌BS1 的生长繁殖。
2.6 装液量对假单胞杆菌BS1 生长的影响
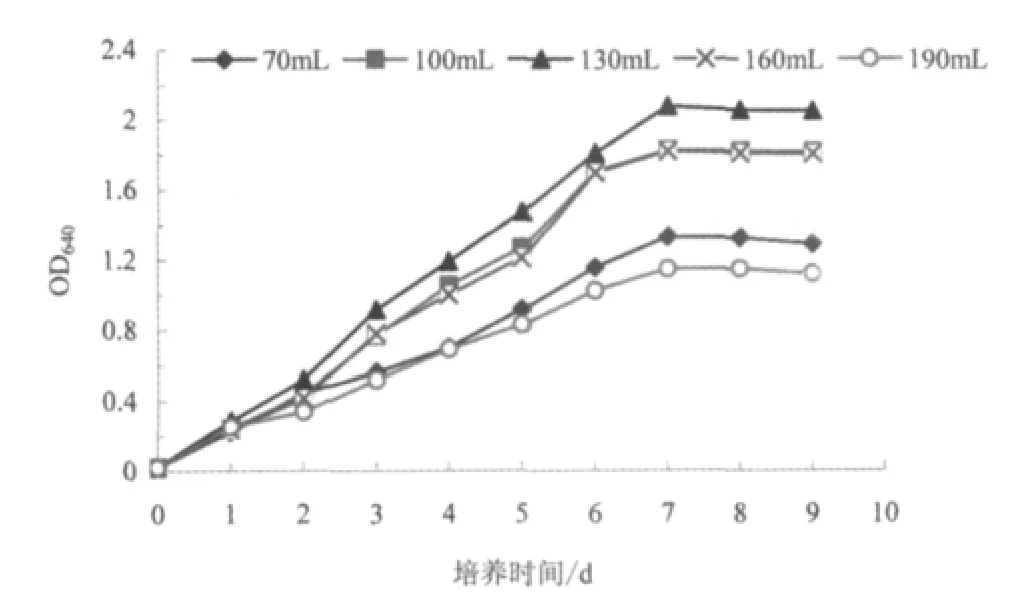
图6 装液量对菌株生长的影响Fig.6 The effect of broth concent on Pseudomonas bacillus BS1
装液量对假单胞杆菌BS1 生长的影响如图6 所示,试验结果表明:在250 mL 的三角瓶中,装液量为130 mL 时菌体的生长状况最好,其次是装液量为100 mL 和160 mL 时,培养第7 d 时菌悬液的OD640值分别为2.08、1.82 和1.81;当装液量为70 mL 时,菌体的生长状况较差,培养第7 d 时菌悬液的OD640值为1.33;当装液量为190 mL 时,菌体的生长状况最差,培养第7 d 时菌悬液的OD640值为1.15。
2.7 适宜培养条件下假单胞杆菌BS1 的生长曲线

图7 适宜培养条件下假单胞杆菌BS1 的生长曲线Fig.7 The growth curve of Pseudomonas bacillus BS1 on the optimal culture conditions
图7 表示假单胞杆菌BS1 在适宜培养条件下的生长曲线。从图中可以看出:0~48 h 为菌体生长延滞期,菌体生长比较缓慢,菌体的数量只有少量增加,是菌体适应新环境和积累能量的阶段;48~156 h 为菌体快速生长繁殖期,培养液中菌体的数量急剧增加;156~240 h 为菌体生长稳定期,菌体细胞的分裂速度减慢,菌体的生长和死亡速率基本相等;由于培养液中营养物质的消耗、营养比例失调以及代谢废物的大量积累,菌体细胞的死亡速度大于分裂产生新细胞的速度,240 h 后为菌体衰亡期。
3 讨论
碳源是供给菌株各种生命活动所需能量和构成菌株细胞及代谢产物的物质基础,因此选择合适的碳源对菌株的生长有很大的影响[6]。在水性基质中,长链烷烃的溶解度太小(10-5~10-10g·L-1),不足以维持微生物的生长;但当碳链小于C8时,烷烃会对细胞膜的结构造成破坏而产生毒性[7]。试验中,当以正辛烷、正庚烷、正己烷为碳源时,随着碳链长度的减小,假单胞杆菌BS1 菌体的生长逐渐受到抑制,分析这可能是由于假单胞杆菌BS1 不能利用正己烷、正庚烷为碳源进行生长代谢,或是由于正己烷、正庚烷对菌体细胞产生的毒性,使其生长受到抑制,彭新榜等[8]和李习武等[9]的研究结果与此一致。同时,试验考虑到该假单胞杆菌BS1 是从被石油长年污染的土壤中分离而得,而石油中含有蜡质成分,故设置处理以液体石蜡为碳源,结果表明液体石蜡(主要成分为C16~C20正构烷烃)为适宜假单胞杆菌BS1 生长的碳源。因此,可用假单胞杆菌BS1 来分解植物叶片表面的蜡质层,该结果进一步拓宽了假单胞杆菌BS1 的应用领域。
接种量的大小对微生物生长延滞期和生长速度有一定的影响,是微生物生长过程中的一个重要控制参数。试验结果表明,接种量为1%和2%时,假单胞杆菌BS1 菌体的生长延滞期较长(0~3 d),菌体的生长状况较差,原因可能是接种量太少影响其生长代谢。当接种量分别为5%、7%、10%时,培养前期(0~4 d)菌体生长较快,但培养后期(4~9 d)菌体的生长状况不如接种量为3%时,这可能是因为接种量过大会使营养物质在短间内消耗过多,同时菌体产生大量的代谢物,从而抑制菌体的进一步生长,吴智诚[10]的研究结果证明本结论。
试验结果表明温度对假单胞杆菌BS1 菌体的生长有一定的影响,当温度为25 ℃和40 ℃时,菌体的生长状况较差,这可能就是由于25 ℃和40 ℃的环境温度影响细胞的新陈代谢活动,使菌体的生长受到抑制,已报道文献[11-12]的结论进一步证明试验结果。
不同微生物对pH 值条件的要求各不相同,它们只能在一定的pH 值范围内生长,这个范围有宽有窄,而其生长最适pH 值常限于一个较窄的范围,对pH 值条件的不同要求,在一定程度上反映出微生物对环境的适应能力[13-14]。试验结果表明,假单胞杆菌BS1 菌体生长的适宜pH 值为7.0,周群英等[15]报道的较适宜细菌生长的pH 值在7.5 左右与研究结论基本吻合。
试验结果表明,培养基中不添加NaCl(浓度为0%)时,适宜假单胞杆菌BS1 菌体的生长,而叶和松[12]对产生物表面活性剂J3、T4 假单胞菌株的研究表明,其最佳生长的NaCl 浓度为2%、3%,这可能是由于不同的菌株对盐浓度的适应能力有差异所致。同时,试验结果还表明,过高的盐浓度(NaCl 浓度在5%~15%)对假单胞杆菌BS1 菌体的生长有明显的抑制作用,这可能是由于高盐环境中外渗透压过高而导致菌体细胞严重失水收缩,质壁分离而死亡,李湛江等[16]的报道与此结论一致。试验在明确适宜假单胞杆菌BS1 生长的碳源为液体石蜡的基础上,进一步摸索出假单胞杆菌BS1 液体培养的优化条件,为今后生产应用假单胞杆菌BS1 提供了基础。
[1]Healym G.Microbial production of biosurfactarts[J].Study Environment Science,1997,6(6):179-195.
[2]左晶,王学川.生物表面活性剂的应用[J].化学工业与工程技术,2005,26(2):23-26.
[3]Tong Liu,Jeimei Hou,Sining Bi,et al.Isolation and characterization of a biosurfactant -producing bacterium from Daqing oil-contaminated sites[J].African journal of microbiology research,2011,21(5):3509-3514.
[4]毕思宁,王彦杰,左豫虎.生物表面活性剂排油圈检测方法的改进和应用[J].黑龙江八一农垦大学学报,2009,21(6):58-60.
[5]Jumei Hou,Sining Bi,Lei Yan,et al.Biological potential of Pseudomonas sp.BS1 in the control of Phytophthora root rot in soybean [J].African Journal of Microbiology Research,2012,15(6):3589-3593.
[6]曹永梅.海藻酸钙固定化细胞及其在食品工业中的应用[J].中国乳品工业,2001,29(6):15.
[7]钱新平,阳永荣,孟琴.利用不同碳源合成生物表面活性剂的研究[J].日用化学工业,2002,32(1):15-17.
[8]彭新榜,马歌丽,卫军,等.微生物生产生物表面活性剂发酵条件的研究[J].食品技术,2004(10):9.
[9]李习武,刘志培.石油烃类的微生物降解[J].微生物学报,2002,42(6):764-767.
[10]吴智诚.机油降解菌的分离、筛选、鉴定及降解机油性能研究[D].福州:福建师范大学,2007.
[11]叶和松.生物表面活性剂产生菌株的筛选及提高植物吸收土壤铅镉效应的研究[D].南京:南京农业大学,2006.
[12]卢国满.产表面活性剂菌株的筛选、发酵条件优化及定量分析[D].长沙:湖南大学,2006.
[13]方云,夏咏梅.生物表面活性剂[M].北京:中国轻工业出版社,1992.
[14]袁玉荪.生物化学实验[M].北京:高等教育出版社,1988.
[15]周群英,高廷耀.环境工程微生物学[M].2 版.北京:高等教育出版社,2000.
[16]李湛江,韦朝海,任源,等.硝基苯降解菌生长特性及其降解活性[J].环境科学,1999,20(5):20-24.
