湿地松×加勒比松杂种木材密度QTL定位分析
2018-02-28黄少伟毛积鹏何紫迪蒋开彬
林 艳,黄少伟,毛积鹏,何紫迪,蒋开彬
(华南农业大学 广东省森林植物种质资源创新与利用重点实验室/林学与风景园林院,广东 广州 510462)
在以锯材为生产目的的人工林培育中,材性性状作为重要的经济性状已受广泛重视。对木材材性的重视,一方面源于它们对出材率,对最终产品的质量和市场价格影响重大[1],另一方面也因为它们受中度至高度的遗传控制[2-3],对这些性状的改良能获得较大的遗传增益。已经开展定位数量性状基因位点定位(quantitative trait locus,QTL)的性状包括:生长与活力[4]、木材性状[5]、油成分[6]、无性繁殖特性[7]、分枝习性和生理性状等[8-9]。
林木生长周期长,世代周转慢,杂合性强,绝大多数重要的经济性状为数量性状,受环境影响大,多数性状的遗传控制,如基因的数目、基因位点和作用效果等,都还不清楚[10],而分子生物学技术为解决这些问题提供了一个有力的工具。通过构建高密度遗传图谱,建立性状与分子标记的连锁,进而确定控制性状的基因数目、效应值以及基因间的相互作用,可大大提高林木育种的研究水平,因此,构建林木遗传图谱和定位数量性状基因位点具有重要的理论和实践意义[11]。
50年代澳大利亚昆士兰林业研究所首次开展了湿地松与加勒比松杂交育种,取得了举世瞩目的成就。我国于60年代初开展湿地松、加勒比松杂交育种工作,取得了显著的经济、社会效益[12]。传统的林木遗传改良方法是通过杂交育种试验,育种周期长,具有一定局限性,分子标记辅助育种的出现大大缩短了育种周期,目前已有研究人员通过RAPD[13]、SSR[14]等分子标记技术构建湿加松遗传图谱,但利用遗传图谱进行QTL定位分析的较少。对湿加松材性性状的QTL定位研究,有助于确定该性状受遗传控制的程度,促进杂种松的遗传改良进展。
本研究采用的亲本树种加勒比松(Pinuscaribaea)具有速生性和优良的分枝习性的特性,湿地松(Pinuselliottii)具有干形的通直性和较高的木材密度的特性,湿地松×加勒比松杂种多个重要经济性状的表现具有明显的树种效应[15]。此外,松树的生殖生物学具有独特之处,其种子具有比较大的单倍体胚乳,可以利用一个单株的大配子体群体构建单株树遗传图谱,这一策略已在多种松树上得到应用[16]。
1 材料与方法
1.1 材 料
以湿地松(Pinuselliottiivar.elliottii,PEE)为母本,加勒比松(Pinuscaribaeavar.hondurensis,PCH)为父本,将PEE的一个无性系(2ee1-102)和PCH的一个无性系(1ch1-063)人工控制授粉。杂交种子全部播种育苗,营造试验林,地点在澳大利亚昆士兰(Queensland)东南部的Beerburrum(26°09′S,152°53′E)和Tuan(25°22′S,152°30′E)。选择杂交F1代共86株用于本试验作图群体及木材密度QTL定位群体。
1.2 方 法
1.2.1 DNA提取与浓度检测 从上述两个试验点的86株树上采集松针,采用Graham等人[17]的方法提取DNA,经琼脂糖凝胶电泳检测,并用紫外分光光度计测其浓度和纯度,将DNA浓度调整至30~40g/g[18],-20 ℃低温保存。
1.2.2 SSR、AFLP、ESTP和PAL1标记与遗传图谱的构建 参照Shepherd等[19]成功转移到PEE和PCH的201个SSR标记,选择扩增效果较好的137对引物用于多态性检测。连同单核苷酸多态性(SNP)技术标定的一个苯丙氨酸脱氨酶(PAL1)基因和Shepherd等[20]发表的297个AFLP标记,最后采用JoinMap®3.0[21]作图软件构建连锁遗传图谱。
1.2.3 木材密度的测量 在6 a生湿加松86个单株树干胸高位置以下的轮枝间(约1.2 m)钻取直径12 mm的木芯备用。将木芯置于索氏抽提器中,分别用酒精和水各抽提6 h和8 h去除松脂,然后置于103 ℃烘箱烘干,在槽形支架上粘牢,沿径向锯成(2.00±0.05)mm厚的薄片,将薄片放置在室内使其含水率与空气湿度达到平衡,以便进行X光照射。
对所有个体进行木材密度分析,采用间接的X射线光密度法扫描,产生数码图像,用WindendroTM软件[22]进行分析。通过对X射线密度的原始数据进行检验,发现最外一个年轮的晚材在处理过程中受损或在WinDendro软件分析过程中判读不准确,另外由于每个样本髓心与木芯取样位置的距离都不完全相等,导致第一个年轮数据不准确,因此第一年和第六年年轮数据舍弃,采用QTL定位法对4年的年轮密度:全木芯木材基本密度(BD)(单位:mg/c3),年轮木材密度(RD),早材基本密度(EWD),晚材基本密度(LWD)进行测量并求平均值。
1.2.4 QTL定位方法 用作图软件MapQTL 4.0®[23]进行木材密度QTL定位,采用单标记作图法(MT),和区间作图法(IM)进行QTL分析,以LOD值的大小来判断是否存在QTL效应。

图1 加勒比松父本的遗传图谱Fig.1 Genetic map of male parent of Pinus caribaea
2 结果与分析
2.1 遗传连锁图谱的构建
加勒比松图谱共包含199个标记:70个SSR,125个AFLP,3个ESTP和PAL1,分成32个连锁群(Pc1~Pc32,其中Pc3和Pc6因无法确定连锁相,各分成两个片段,实际上是34个连锁群),总长度为1 734 cM,标记平均间距(10.6±7.8)cM(图1)。
2.2 分子标记与木材密度QTL的连锁
全木芯木材基本密度(BD)和年轮平均木材密度(AVRD)上都有数量较大的QTL位点,如BD,在Kruskal-Willas检验和区间作图中显著性水平都高于0.05的位点有8个,分布在连锁群H1_Pc16,H2_Pc7和H14_Pc21上(表1)。AVRD上效应较高的位点,也主要分布在3个连锁群,分别是H2_Pc7,H2_Pc10和H14_Pc21(表2)。
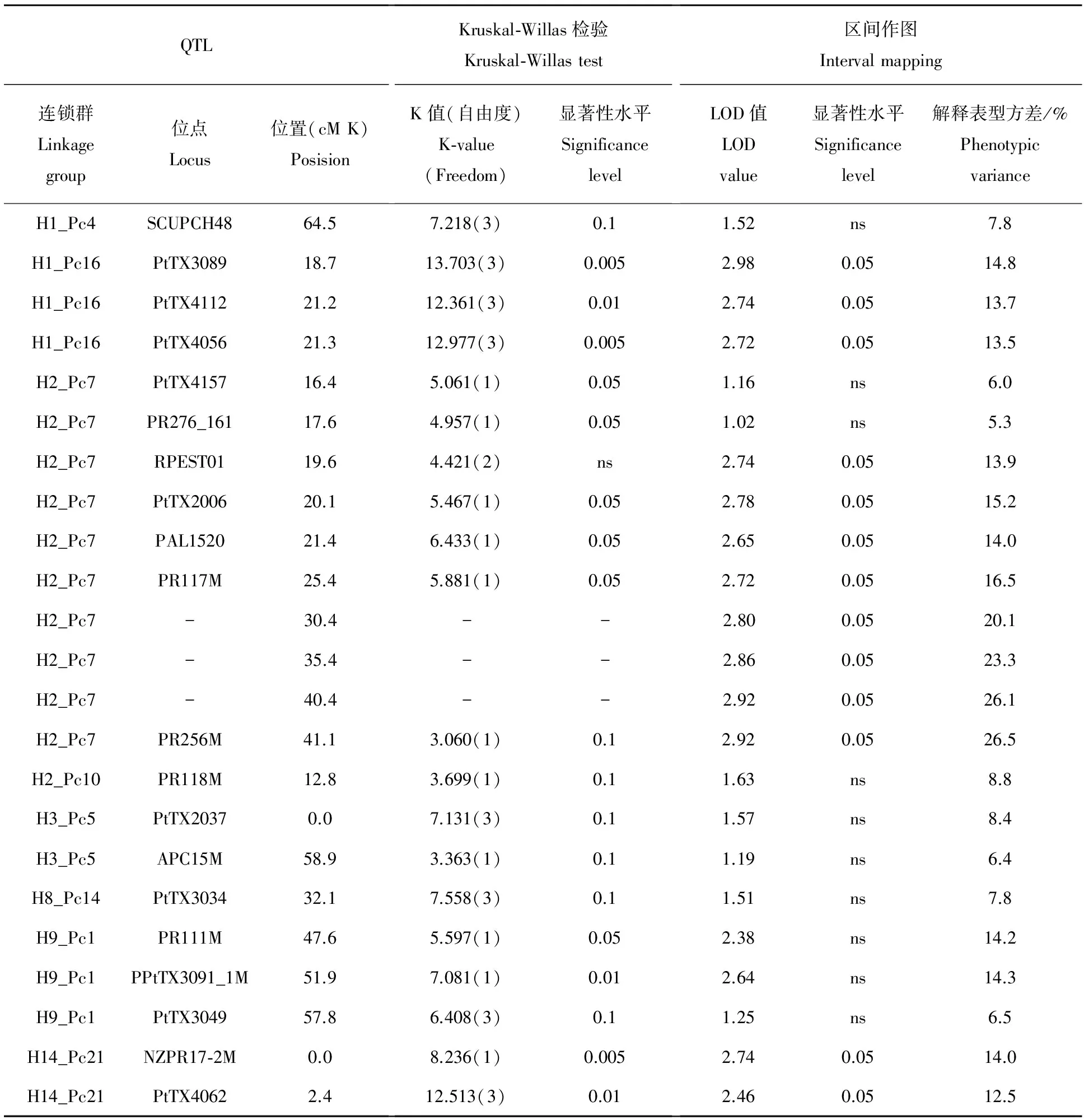
表1 分子标记与全木芯木材基本密度(BD)QTL的连锁
结果显示,全木芯木材基本密度(BD)和年轮平均木材基本密度(AVRD)都存在解释表型方差在20%以上的点,并且多数分布在连锁群H2_Pc7上的PR117M和PR256M之间的区段上(表1,表2),这些结果显示出连锁群H2_Pc7在木材密度遗传控制上具有特殊重要性。
ESTP标记在木材密度的遗传控制上也发挥了作用,其中H2_Pc7上的PAL1基因(位点PAL1520),对全木芯木材基本密度(BD)的效应达到0.05以上的显著性水平,解释了该性状表型方差的14.0%(表1)。
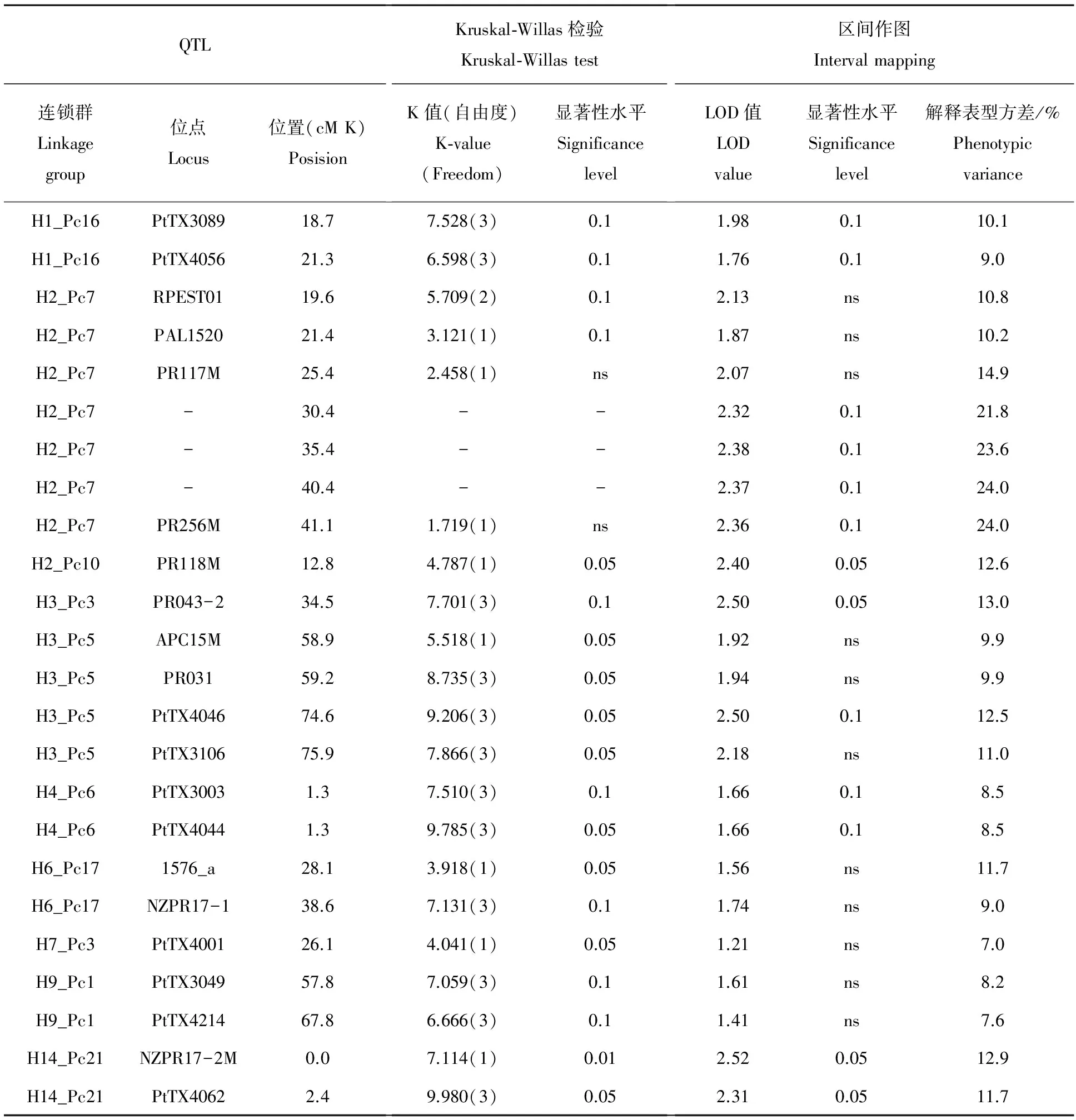
表2 分子标记与年轮木材基本密度(RD)QTL的连锁
晚材密度的QTL分布有别于年轮木材密度和早材密度,主要分布在H3_Pc5和H4_Pc6(表4),其中H4_Pc6在年轮密度和早材密度某些性状上也起比较重要的作用,而在年轮密度和早材密度的遗传控制中起重要作用的连锁群,如H2_Pc7和H14_Pc21上面的标记,在这里或者不出现,或者效应较小(表3,表4)。
晚材密度的QTL效应也低于年轮和早材密度,解释表型方差的比例超过10%的位点较少。可能是因为晚材密度受遗传控制的程度低于年轮木材密度和早材密度,这有待进一步的检验。
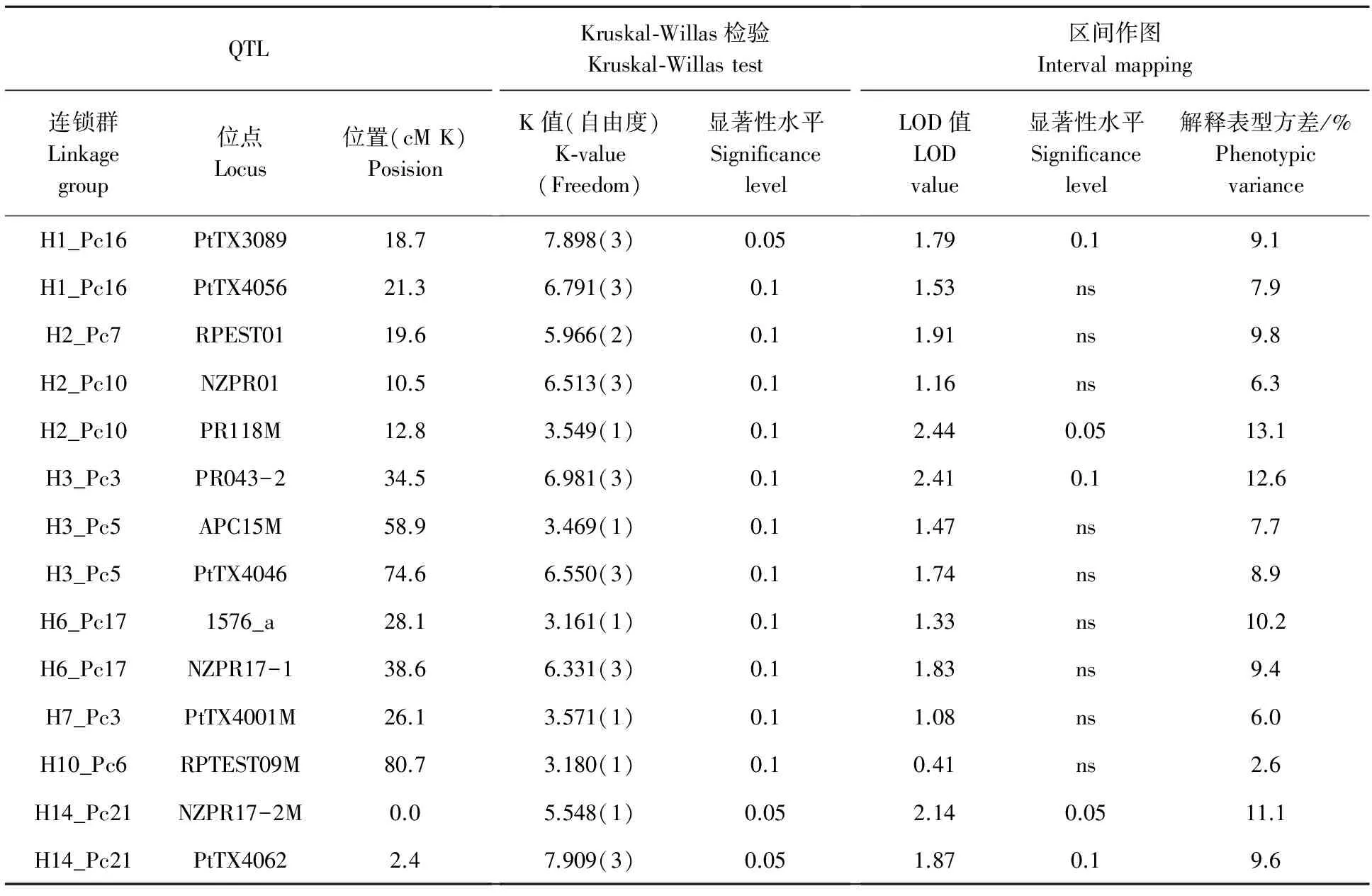
表3 分子标记与早材基本密度(EWD)QTL的连锁
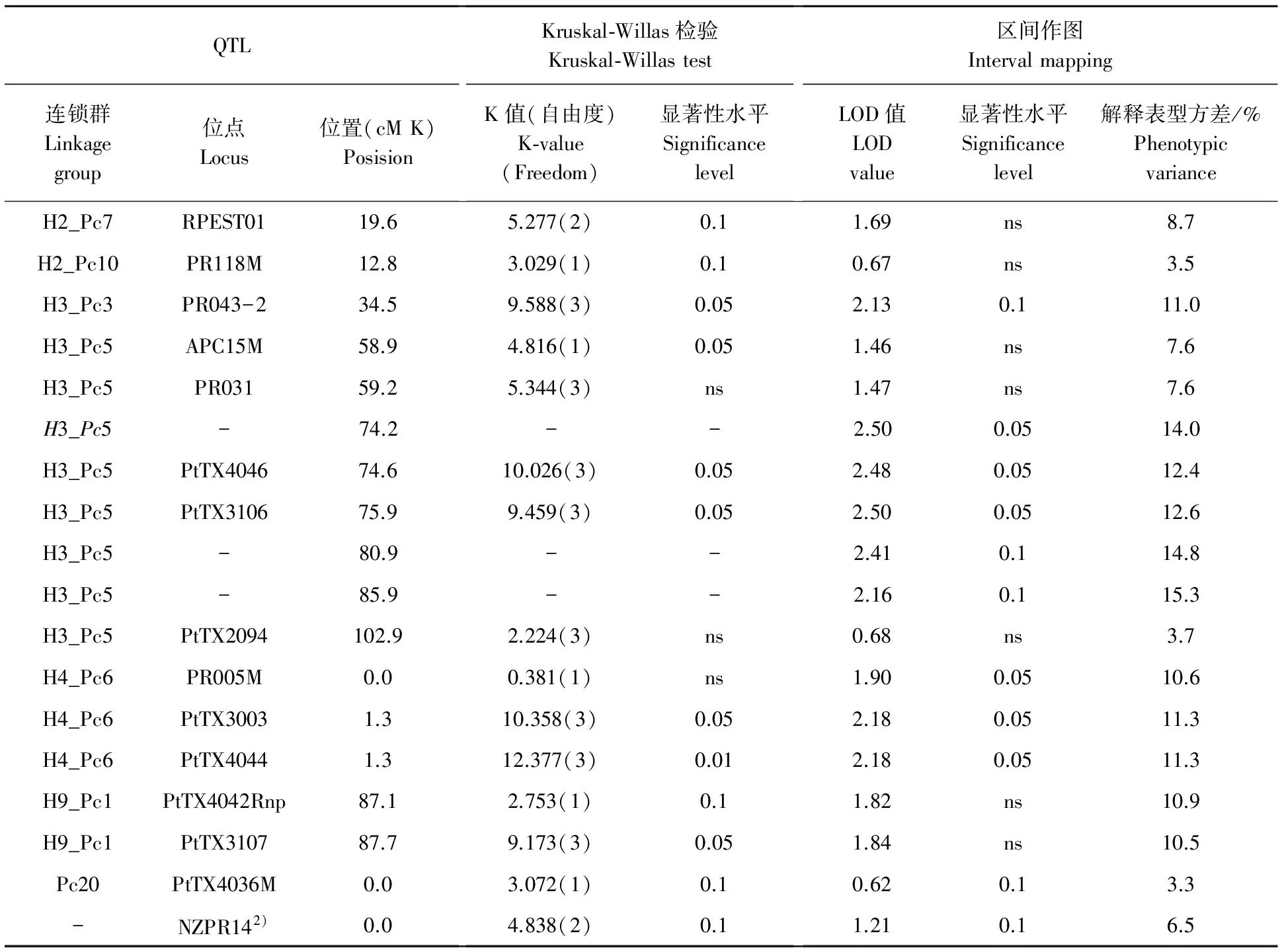
表4 分子标记与晚材基本密度(LWD)QTL的连锁
3 讨论与结论
传统的数量遗传学多以Nilsson[24]的微效多基因假说为基础。Nilsson假说提出数量性状是由数以百计的基因控制,且各基因的效应微小而且相等。至今几乎所有在作物和林木上进行的QTL定位研究,均揭示了寡基因模型,即控制数量性状的基因间效应是不等的,且常常存在着少数主效基因,解释了大部分的表型变异[25]。重要经济性状的遗传控制中普遍存在着主效基因[26]。田宝华[27]通过对不同环境下的玉米穗部进行QTL定位,发掘与玉米产量性状密切相关的穗行数主效QTL位点;沈新莲[28]利用1个棉属野生种异常棉(Ganomalum )基因渐渗的优质纤维种质系,获得高强纤维的主效QTL。本研究建立的杂种松木材密度的QTL连锁群,也存在寡基因模型和主效基因现象,这类基因可单独解释10%~20%的表型方差。控制木材密度的QTL位点相对集中分布在4个连锁群:H2_Pc7,H2_Pc10,H4_Pc6和H14_Pc21,其中H4_Pc6和H14_Pc21两个连锁群在木材密度的遗传控制上起着重要的作用,并且在相对狭窄的范围内连锁或重叠,呈一因多效模式。
采用SSR和ESTP标记,检测效率较高。检测效率的差异与标记类型有关,也与分析软件有关。AFLP为显性标记,只有3种位点分离信息(PI,MI和BI)[29],采用Map Manager QTX v0.24和QTL Cartographer v1.14作图软件,比较适合于近交物种,它们只能按测交模式进行QTL检测;SSR和ESTP标记为共分离标记,位点分离信息共有4种(PI,MI,BI和FI)[29],不少位点上存在复等位基因,Map QTL v4.0能够按异交模式检测QTL,对包含复等位基因的位点的检测效率较高,并在一定程度上弥补了群体较小的缺陷。
在小群体内没有检测到显著性水平较高的QTL,原因可能有3个,其一,群体规模偏小;其二,本研究构建的图谱未能覆盖全基因组,控制木材密度性状的部分QTL位于本图谱以外的区段;其三,控制木材密度的QTL位点在该群体内没有发生分离。另外,年度间、季节间的差异也会影响,如晚材密度(LWD)上的QTL从数量和效应上都不如早材密(EWD),这可能是受到年度和季节气候差异的影响。Sewell等[30]就木材物理性状QTL表现受季节性气候的影响做过研究,认为气候因素可能导致与木材形成有关的细胞产生生物化学变化。比如,在早材和晚材形成过程中植物生长素水平的变化。此外,本研究的研究范围仍较窄,只对单一密度性状作出研究,下一步将结合生长、形质性状的QTL位点进行比较分析。
本研究通过对杂种松木材密度的QTL定位,获得了控制木材密度的高效QTL连锁群及主效基因,为进一步对生长、形质等性状进行QTL定位和发掘更多在各个性状间共同作用的QTL位点奠定基础。了解木材相关性状的遗传模式,有助于开展分子遗传学研究,并为分子标记辅助选择提供参考,以期最终实现培育出材性优良的湿加松杂种的目的,在提高木材商业价值及木材生产加工品质方面具有重要作用。
[1] Dixon R K,Meldahl R S,Ruark G A,et al.Process modeling of forest growth responses to environmental stress[J].Biometrics,Process modeling of forest growth responses to environmental stress.Portland Oregen:Timber Press,1990,47(4):21-32.
[2] Zobel B J,Buijtenen J P V.Wood variation:its causes and control[J].Wood Variation Its Causes & Control,1989.
[3] Zobel B J,Jett J B.Genetics of Wood Production[M].Springer,Berlin,Heidelbery,1995.
[4] 李金华,王丰,廖亦龙,等.水稻种子活力的生理生化及遗传研究[J].分子植物育种,2009,7(04):772-777.
Li J H,Wang F,Liao Y L,et al.Biochemical and genetic studies on seed of vigor rice[J].Molecular Plant Breeding,2009,7(04):772-777.
[5] 于晓丽.桉树高密度遗传图谱构建及生长和材性相关QTL解析[D].北京:中国林业科学研究院,2015.
Yu X L.Construction ofEucalyptusgenetic map with high density and QTL analysis of its correlation with growth and wood properties[D].Beijing:Chinese Academy of Forestry,2015.
[6] 吕秀清.玉米籽粒油分QTL定位及其效应分析[D].北京:中国农业大学,2005.
Lü X Q.QTL location and effect analysis of corn kernel oil[D].Beijing:China Agricultural University,2005.
[7] 武喆,李蕾,张婷,等.黄瓜单性结实性状的QTL定位[J].中国农业科学,2015,48(1):112-119.
Wu Z,Li L,Zhang T,et al.QTL positioning of cucumber parthenocarpic character[J].Chinese Agricultural Science,2015,48(1):112-119.
[8] 成良强,唐梅,任小平,等.栽培种花生遗传图谱的构建及主茎高和总分枝数QTL分析[J].作物学报,2015,41(6):979-987.
Cheng L Q,Tang M,Ren X P,et al.Genetic map construction of cultivated peanut and QTL analysis of main stem height and branch number[J].Journal of Crop Science,2015,41(6):979-987.
[9] 马爱芬,王雯,李加纳,等.甘蓝型油菜种子发芽率QTL定位及相关生理性状[J].遗传,2009,31(2):206-212.
Ma A F,Wang W,Li J N,et al.Seed germination rate,QTL mapping and related physiological characters ofBrassicanapus[J].2009,31(2):206-212.
[10] 王明庥.林木遗传育种学[M].北京:中国林业出版社,2001.
Wang M X.Forest genetics and breeding[M].Beijing:China Forestry Publishing House,2001.
[11] 高用明,朱军.植物QTL定位方法的研究进展[J].遗传,2000,22(3):175-179.
Gao Y M,Zhu J.Advances in plant QTL mapping methods[J].Genetics,2000,22(3):175-179.
[12] 黄少伟.松树分子标记辅助育种研究进展[J].林业科学研究,2006,19(6):799-806.
Huang S W.Advances in molecular marker assisted breeding of pine trees[J].Forestry Science Research,2006,19(6):799-806.
[13] Nelson C D,Nance W L,Doud rick R L.Apartial genetic link age map of slash pine(PinuselliottiiEngelmann var.elliottii) based on random amlified polymorphic DNAs[J].Theor App Genet,1993,87(1/2):145-151.
[14] Yi-Liang L I,Zhao F C,Hui-Shan W U,et al.Relationship between growth traits heterosis and genetic distance among parents ofPinuselliottii×P.caribaeabased on SSR molecular markers[J].Forest Research,2012,25(2):138-143.
[15] 赵奋成,李宪政,张应中,等.湿地松与洪都拉斯加勒比松的杂交效果分析[J].林业科学研究,2006,19(4):409-415.
Zhao F C,Li X Z,Zhang Y Z,et al.Hybridization analysis ofPinuselliottiiand Honduras Caribbean pine[J].Forestry Science Research,2006,19(4):409-415.
[16] Johnston A J,Dieters M J,Dungey H S,et al.Intraspecific hybridization inPinuscaribaea,var.hondurensis,II.Genetic parameters[J].Euphytica,2003,129(2):159-168.
[17] Graham G C,Mayers P,Henry R J.A simplified method for the preparation of fungal genomic DNA for PCR and RAPD analysis.[J].Biotechniques,1994,16(1):48-50.
[18] Komulainen P,Brown G R,Mikkonen M,et al.Comparing EST-based genetic maps betweenPinussylvestrisandPinustaeda[J].Theoretical & Applied Genetics,2003,107(4):667-678.
[19] Shepherd M,Cross M,Maguire T,et al.Transpecific microsatellites for hard pines[J].Theoretical & Applied Genetics,2002,104(5):819.
[20] Shepherd M,Huang S,Eggler P,et al.Congruence in QTL for adventitious rooting inPinuselliottiixPinuscaribaeahybrids resolves between and within-species effects[J].Molecular Breeding,2006,18(1):11-28.
[21] Van Ooijen J W,Voorrips R E.JoinMap3.0,software for the calculation of genetic linkage maps[J].Plant Research International,Wageninggen,the Netherlands,2001.
[22] Dungey H S,Dieters M J,Nikles D G,et al.Symposium on hybrid breeding and genetics of forest trees.QFRI/CRC-SPF Symposium,Noosa,Australia,9-14 April 2000.[C]// Symposium on hybrid breeding and genetics of forest trees.QFRI/CRC-SPF Symposium,Noosa,Australia,2000.
[23] Van Ooijen J W,Boer M P,Jansen R C,et al.MapQTL4.0,Software for the calculation of QTL positions on genetic mpas[J].Plant Research International,Wageninggen,the Netherlands,2002.
[24] Nilsson-Ehle H.Kreuzungsuntersuchungen an Hafer und Weizen[J].Heredity,1909,252(1):290-291.
[25] Bradshaw H.Case history in genetics of long-lived plants:molecular approaches to domestication of a fast-growing forest tree[M].Molecular Dissection of Complex Traits,1997.
[26] Yan W H,Wang P,Chen H X,et al.A Major QTL,Ghd8,plays pleiotropic roles in regulating grain productivity,plant height,and heading date in rice[J].Molecular Plant,2011,4(2):319.
[27] 田宝华.不同环境条件下玉米穗部和籽粒性状的QTL定位及玉米穗行数主效QTL的验证[D].北京:中国农业大学,2013.
Tian B H.QTL location and kernel number of maize ears and validation of main QTL in different environmental conditions[D].Beijing:China Agricultural University,2013.
[28] 沈新莲,袁有禄,郭旺珍,等.棉花高强纤维主效QTL的遗传稳定性及它的分子标记辅助选择效果[J].高技术通讯,2001,11(10):13-16.
Shen X L,Yuan Y L,Guo W Z,et al.Genetic stability of cotton high strength fiber dominant QTL and its molecular marker assisted selection effect[J].High Tech Communication,2001,11(10):13-16.
[29] QTL Mapping in Outbred Pedigrees[M]//Statistical genetics of quantitative traits.Springer New York,2007:303-329.
[30] Sewell M M,Bassoni D L,Megraw R A,et al.Identification of QTLs influencing wood property traits in loblolly pine(PinustaedaL.).I.Physical wood properties[J].Theoretical & Applied Genetics,2000,101(8):1273-1281.
