茉莉酸甲酯诱导桉树对焦枯病的抗性研究
2018-02-28郭朦朦陈慧洁冯丽贞杨泽慧
郭朦朦,陈慧洁,冯丽贞,杨泽慧,陆 芝,唐 芬
(福建农林大学 林学院,福建 福州 350002)
桉树(Eucalyptusspp.)是世界三大速生造林树种之一[1]。桉树焦枯病(Cylindrodadiumleaf blight)是一种世界性病害,严重危胁桉树生产[2]。如今生产上对桉树焦枯病的防治主要采取化学防治,但因森林面积大,森林病害具有长时性和隐蔽性,采用化学防治不符合社会经济的实际情况,不仅收效甚微,而且导致农药残留、污染环境[3]。同时药物的重复使用使病菌产生抗药性,其防治效果大大下降[4]。因此,为促进林业的可持续发展,从植物的抗病防御机制入手,提高寄主抗病性是桉树焦枯病防治切实可行的重要途径。
茉莉酸甲酯(MeJA)是新确认的一种植物体的植物生长物质,其生理功能与植物体的抗病防御系统有关,在病虫害防御等信号转导中起信使作用[5-11],且MeJA具有高效、对环境无毒害、操作简单等特点。课题组前期研究发现不同抗病种系桉树的SOD活性、PPO活性及其同工酶谱均可作为早期鉴定桉树对焦枯病抗病性的重要生理生化指标[12];在构建抗病种系“巨赤桉9224”(Eucalyptusgrandis×E.tereticornisM1)在焦枯病菌(C.quinqueseptatumMorgan)侵染下的cDNA正向差减文库上调表达基因中发现茉莉酸结构域mRNA[13];用桉树焦枯病菌Ca.pseudoreteaudii侵染抗病种系“尾细桉M1”后,其蛋白组和表达谱分析也表明茉莉酸(JAs)生物合成相关基因上调表达[12]。前期的这些研究都暗示了JAs信号途径参与了桉树对焦枯病菌的响应。由于桉树焦枯病主要为害桉树幼苗和4 a生以下桉树幼林。因此,本试验以前期研究的11个桉树主栽种系中感病品种“巨桉3号”和中抗品种“巨尾桉广9”的组培苗为试验材料,通过检测MeJA诱导抗病性弱的桉树后体内抗病防御酶应答,筛选出MeJA诱导桉树对焦枯病抗性的最佳浓度及抗性的持效期,为桉树焦枯病防治工作提供理论和实践指导。
1 材料与方法
1.1 试验材料
感病种系“巨桉3号”(Eucalyptusgrandis3) 和中抗种系“巨尾桉广9”(E.grandis3×E.urohyllaguang 9)组培苗为材料[14],于2012年5月取发育正常、无病害症状、苗高20 cm左右的组培苗移植于福建农林大学森林保护研究所试验地,株行距为30 cm×40 cm,确保苗木生长健康,2个月后用于试验。
1.2 供试病原菌
强致病力焦枯病菌Ca.pseudoreteaudii[15]由福建农林大学森林保护研究所提供。
1.3 试验方法
1.3.1 茉莉酸甲酯对焦枯病菌的毒性检测 采用抑菌圈法[16]。取0.1 mL浓度为106个/mL的焦枯病菌悬浮液于PDA培养基上(d=9 cm),均匀涂抹。待表面无液滴后,将浸有不同浓度MeJA(0.05,0.1,0.5,1 mmol/L)的圆形滤纸片(d=6 mm)放入培养皿中,以浸有无菌水的滤纸片为对照,每个培养皿同时放入同一浓度的圆形滤纸片3片,每浓度重复3次。在25 ℃下培养72 h后观察记录滤纸片圆片周围抑菌圈的有无及大小。
1.3.2 茉莉酸甲酯处理及接菌 接菌前3 d,用0(Control),0.05,0.1,0.5,1 mmol/L的MeJA(内含0.1%的Tween20)进行叶面喷施处理,植株下面的土壤用聚乙烯塑料覆盖,每天喷雾1次,以看到液滴从叶面滴落为止,连续3次后,用浓度为5×104个/mL的孢子悬浮液进行无伤接种,同时用无菌水湿棉球保湿,外面覆盖透明塑料薄膜。接种后24 h[14]取成熟度一致的植株顶部第一完全展开叶片用于SOD和PPO活性的测定。
1.3.3 茉莉酸甲酯对焦枯病抗性的测定 用1.3.2中筛选出的最适MeJA诱导浓度对“巨桉3号”和“巨尾桉广9”进行叶面喷施处理,在处理后的1,3,5,7,10和15 d,用浓度为5×104个/mL的孢子悬浮液进行无伤接种,每次接种24 h后,取成熟度一致的植株顶部第一完全展开叶片用于SOD和PPO活性测定。
1.3.4 多酚氧化酶和超氧化物歧化酶活性的测定 多酚氧化酶(PPO)采用三氯乙酸比色法[17]。超氧化物歧化酶(SOD)采用氮蓝四唑(NBT)光还原法[18]。
1.4 数据处理
采用Excel2003软件处理数据并作图,用SPSS18.0统计软件对数据进行分析。
2 结果与分析
2.1 茉莉酸甲酯对焦枯病菌菌落生长情况的影响
在浸有0.05,0.1,0.5,1 mmol/L MeJA浓度的滤纸片圆片周围无明显抑菌圈形成(图1),可以得出,不同浓度的MeJA对桉树焦枯病菌的生长无明显的直接毒性。

a,b,c,d和e分别代表对照组,0.05 mmol/L,0.1 mmol/L,0.5 mmol/L和1 mmol/L MeJA浓度a,b,c,d and e stand for control,0.05 mmol/L,0.1 mmol/L,0.5 mmol/L and 1 mmol/L of MeJA respectively图1 茉莉酸甲酯对焦枯病菌菌落生长情况的影响Fig.1 Toxicity assay of different concentrations of MeJA to Ca. pseudoreteaudii
2.2 茉莉酸甲酯诱导后接种焦枯病菌对PPO活性的影响
图2显示,不同浓度MeJA诱导不同抗病类型桉树后,其叶片的PPO活性均随MeJA浓度的增加呈现先上升后下降的变化趋势,当浓度为0.1 mmol/L时,PPO活性最高。从图2还可看出,感病种系“巨桉3号”诱导前PPO活性比中抗种系“巨尾桉广9”低,这与课题组前期研究结果一致[19],但低浓度MeJA诱导后PPO活性增幅“巨桉3号”均高于“巨尾桉广9”,“巨桉3号”分别比对照高出35.1%、90.3%和47.4%,而“巨尾桉广9”才高出21.9%、45.5%和13.4%;高浓度(1 mmol/L)的MeJA使PPO活性下降,并低于诱导前,分别比对照降低了18.2%和4.8%。可见,不同浓度MeJA对桉树抗病性诱导的效果不同,低浓度MeJA感病种系“巨桉3号” 诱导效果比中抗种系“巨尾桉广9”好。

图2 不同浓度MeJA处理后接种焦枯病菌时桉树叶片的PPO活性变化Fig.2 The PPO activity change in eucalyptus leaves after inducing with different concentrations of MeJA for 3 days and then inoculating Ca. pseudoreteaudii
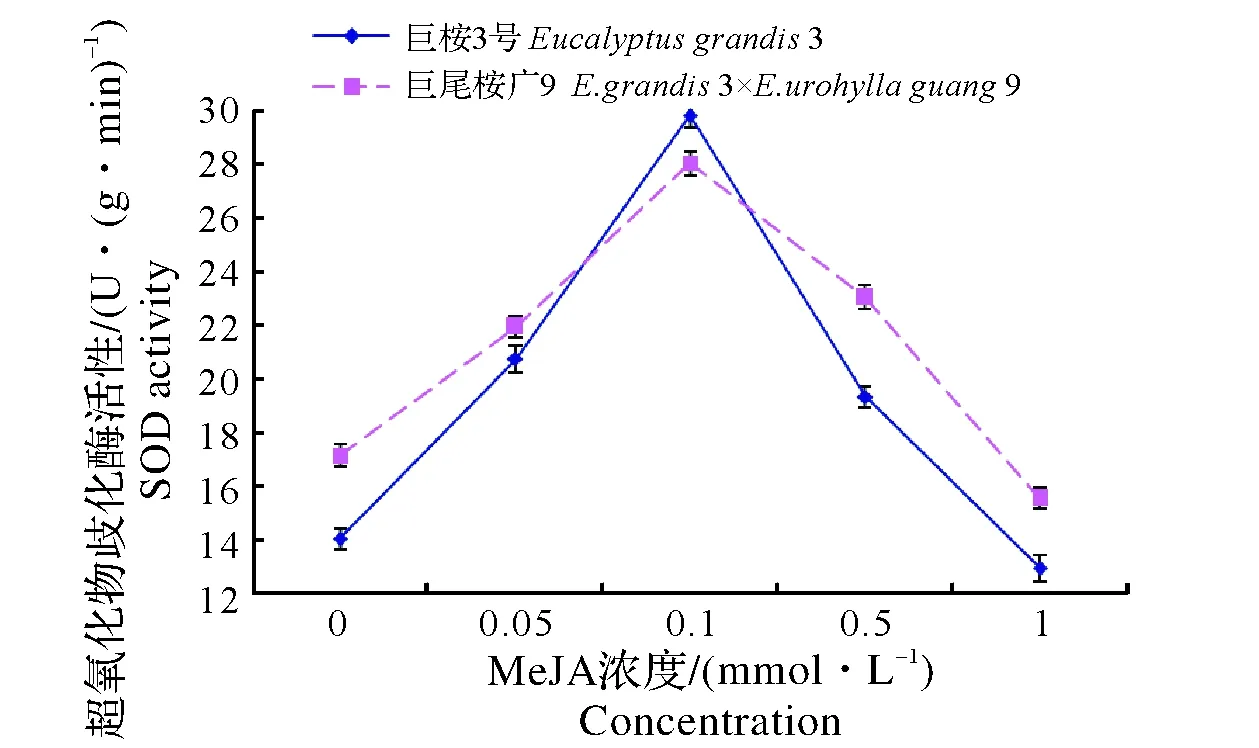
图3 不同浓度MeJA处理后接种焦枯病菌时桉树叶片的SOD活性变化Fig.3 The SOD activity change in eucalyptus leaves when induced with different concentrations of MeJA for 3 days and then inoculated Ca. pseudoreteaudii
2.3 茉莉酸甲酯诱导后接种焦枯病菌对SOD活性的影响
不同浓度MeJA诱导并接种焦枯病菌后,“巨桉3号”和 “巨尾桉广9”叶片SOD活性变化趋势与PPO活性变化趋势基本一致,如图3所示。只是酶活性增幅更高。MeJA从低到高各浓度诱导,“巨桉3号” SOD活性比对照相分别为增长了47.9%、112.9%和37.9%,而“巨尾桉广9”为28.1%、63.7%和34.5%,当浓度为1 mmol/L时,“巨桉3号” 和“巨尾桉广9”的SOD活性最低,分别比对照下降了7.9%和9.4%。进一步验证了低浓度MeJA能诱导桉树对焦枯病的抗性,且最佳浓度为0.1 mmol/L,同时感病种系“巨桉3号” 诱导效果强于中抗种系“巨尾桉广9”。
2.4 0.1 mmol/L MeJA诱导后不同时间接种对桉叶PPO活性的影响
从图4中可以看出,“巨桉3号”和 “巨尾桉广9” 经最适浓度0.1 mmol/L MeJA诱导后在1、3、5、7、10和15 d不同时间接种叶片的PPO活性都有提高,到第5天时达到最大值,与第1天相比分别高出76%和67.5%。随后两品种的酶活性逐渐下降,但均高于第1天。“巨桉3号”第7~10天略有回升,随后又开始下降,到第15天时,酶活性略高于第1天。总之,“巨桉3号”诱导后的PPO活性高于“巨尾桉广9”。
2.5 0.1 mmol/L MeJA诱导后不同时间接种对桉叶SOD活性的影响
经最适浓度诱导后不同时间接种“巨桉3号”和 “巨尾桉广9”叶片SOD活性变化趋势与PPO活性变化趋势基本一致(图5),呈先上升后下降的趋势,并都于第5天时酶活性达到最大值,与第1天相比分别高出98.6%和70.5%,均达到显著水平;而后,两者的酶活性开始下降,至第15天时,“巨桉3号”和 “巨尾桉广9”的酶活性分别降至20.2 U/(g·min)和16.9 U/(g·min),但仍高于第1天。这进一步验证了MeJA诱导桉树对焦枯病抗性的最佳表达为诱导后第5天,且其对感病种系“巨桉3号” 的诱导效果较中抗种系“巨尾桉广9”的好。

图4 最适浓度MeJA诱导后不同时间接种焦枯病菌下桉树叶片的PPO酶活性变化Fig.4 The PPO activity change in eucalyptus leaves when induced with the optimal concentration of MeJA for 1,3,5,7,10 and 15 d respectively then inoculated Ca. pseudoreteaudii

图5 最适浓度MeJA诱导后不同时间接种焦枯病菌下桉树叶片的SOD酶活性变化Fig.5 The SOD activity change in eucalyptus leaves when induced with the optimal concentration of MeJA for 1,3,5,7,10 and 15 d respectively then inoculated Ca. pseudoreteaudii
3 结论与讨论
茉莉酸类化合物是存在植物体中的一类内源的植物生长物质[10-11]。茉莉酸甲酯能调节植物体抗氧化酶系统,诱导蛋白质及次生物质合成,提高植物的抗病虫害性[20]。冯丽贞等[19,21]对福建省11个不同抗病类型桉树主栽种系研究发现,无论健康叶还是接种后的病叶,多酚类物质含量、黄酮类化合物含量、多酚氧化酶活性、过氧化物酶、超氧化物歧化酶活性的水平可作为桉树对焦枯病抗病性的早期鉴定的生化指标。本研究对感病种系“巨桉3号”和中抗种系“巨尾桉广9”叶片喷施不同浓度的MeJA诱导后接种焦枯病菌,发现除高浓度MeJA(1 mmol/L)外,其余各浓度处理的桉树叶片中超氧化物歧化酶、多酚氧化酶活性均随MeJA浓度的增加呈现出先上升后下降的变化趋势,且都在浓度为0.1 mmol/L处达到最大值;用该浓度处理不同抗病类型的桉叶并间隔不同时间接种后发现,桉叶的防御反应变化与接种时间间隔有关,且在第5天时多酚氧化酶和超氧化物歧化酶的酶活性最高,随后呈现出下降的变化趋势,表明诱导桉树对焦枯病抗性的最佳表达为诱导后第5天。该结果显示低浓度MeJA能够诱导桉树抗病保护酶活性的表达,有效地抑制焦枯病菌对桉树的侵害,从而提高桉树对焦枯病抗性。
植物抗性分为基础抗性和诱导抗性,基础抗性是由遗传决定的。因此,诱导系统性抗性是植物的一种重要防病机制,对于生长性状优良但感病的桉树无性系来说,利用诱导抗性大幅度地提高其对于焦枯病的抗性、降低发病程度、减少死亡或生长损失无疑是一条强有力的控制病害途径。本研究结果显示,茉莉酸甲酯对桉树焦枯病菌没有直接毒性,MeJA在植物抗病中的主要作用不是直接的抑菌作用,而是诱导刺激植物防御系统表达,以防止焦枯病菌对桉树的侵害,且诱导的最佳浓度为0.1 mmol/L,最佳表达为诱导后第5天。更可喜的是感病种系“巨桉3号”所表现出的诱导效果比中感种系“巨尾桉广9”更佳,这无疑给生产实践带来福音。
[1] Grobbelaar J W,De Beer Z W,Bloomer P,et al.Discovery ofOphiostomatsotsionEucalyptuswood chips in China[J].Mycoscience,2011,52(2):111-118.
[2] Chen S,Lombard L,Roux J,et al.Novel species ofCalonectriaassociated withEucalyptusleaf blight in Southeast China[J].Persoonia:Molecular Phylogeny and Evolution of Fungi,2011,26(1):1-12.
[3] 朱建华,郭文硕,吴建勤,等.桉树焦枯病防治技术研究[J].福建林业科技,2011,38(3):41-47.
Zhu J H,Guo W S,Wu J Q,et al.Study on the control technology ofClindrocladiumquinqueseptatum[J].Jour of Fujian Forestry Sci and Tech,2011,38(3):41-47.
[4] 纪兆林,童蕴慧,张建军,等.灰葡萄孢对速克灵抗性的研究[J].扬州大学学报(农业与生命科学版),2003,24(3):60-63.
Ji Z L,Tong Y H,Zhang J J,et al.Resistance ofBotrytiscinereato Procymidone[J].Journal of Yangzhou University(Agricultural and Life Sciences Edition),2003,24(3):60-63.
[5] 将科技,皮妍,侯嵘,等.植物内源茉莉酸类物质的生物合成途径及其生物学意义[J].植物学报,2010,45(2):137-148.
Jiang K J,Pi Y,Hou R,et al.Jasmonate biosynthetic pathway:its physiological role and potential application in plant secondary Metabolic engineering[J].Chinese Bulletin of Botary,2010,45(2):137-148.
[6] Li C Y,Williams M M,Loh Y T,et al.Resistance of cultivated tomato to cell content-feeding herbivores is regulated by the octadecanoid-signaling pathway[J].Plant Physiology,2002,130(1):494-503.
[7] Howe G A.Jasmonates as signals in the wound response[J].Plant Growth Regul,2004,23(3):223-237.
[8] Wasternack C,Stenzel I,Hause B,et al.The wound response in tomato-role of jasmonic acid[J].Plant Physiology,2006,163(3):297-306.
[9] 张智慧,何磊,王振中,等.外源茉莉酸甲酯诱导水稻抗瘟性相关防御酶和内源水杨酸的变化[J].植物病理学报,2010,40(5):395-403.
Zhang Z H,He L,Wang Z Z,et al.Resistance-related defense enzymes and endogenous salicylic acid induced by exo-genous methyl jasmonate in rice against blast disease[J].Acta Phytopathologica Sinica,2010,40(5):395-403.
[10] 冯远娇,王建武,骆世明.叶片涂施茉莉酸对玉米幼苗防御反应的时间和浓度效应[J].植物生态学报,2009,33(4):812-823.
Feng Y J,Wang J W,Luo S M.Timing and concentration effects on the defense response ofZeaMaysseedlings after application of jasomnic aicd to leavers[J].Chinese Journal of Plant Ecology,2009,33(4):812-823.
[11] Naidoo R,Ferreira L,Berger D,et al.The identification and differential expression ofEucalyptusgrandispathogenesis-related genes in response to salicylic acid and methyl jasmonate[J].Frontiers in Plant Science,2013,4(43):1-9.
[12] Booth T H,Jovanovic T,Old K M,et al.Climatic mapping to identify high-risk areas forCylindrocladiumquinqueseptatumleaf blight on eucalypts in mainland South East Asia and around the world[J].Environmental Pollution,2000,108(3):365-372.
[13] Feng Li-zhen,Guo Wen-shou,Xie Wan-feng,et al.Construction and analysis of a SSH cDNA library ofEucalyptusgrandis×Eucalyptusurophylla9224 induced byCylindrocladiumquinqueseptatum[J].Botany,2012,90(12):1277-1283.
[14] 陈全助.桉树种系对焦枯病抗性的初步测定[J].福建林学院学报,2010,30(4):297-299.
Chen Q Z.Measurement on the resistance of Eucalyptus cultivar toCylindrocladiumquinqueseptatum[J].Journal of Fujian College of Foresry,2010,30(4):297-299.
[15] 陈全助,郭文硕,叶小真,等.福建省桉树焦枯病菌分类鉴定[J].福建林学院学报,2013,33(2):176-182.
Chen Q Z,Guo W S,Ye X Z,et al.Identification ofCalonectriaassociatedwithEucalypusleaf blight in Fujian province[J].Journal fo Fujian College of Forestry,2013,33(2):176-182.
[16] 王伟英.水杨酸对甘薯抗薯瘟病诱导效果及其生理生化机制的研究[D].福州:福建农林大学,2007.
Wang W Y.Studies on the Salicylic-acid(SA)-induced effect of disease-resistance toRalstoniasolanacearumand physiological and biochemical mechanisms[D].Fuzhou:Fujian Agriculture and Forestry University,2007.
[17] 赫再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:116-117.
He Z B,Cang J,Xu Z.Plant physiology experiment[M].Harbin:Press of Harbin Institute of Technology,2004:116-117.
[18] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2003:167-169.
Li H S.Experimental principle and technology of plant physiology and biochemistry[M].Beijing:Higher Education Press,2003:167-169.
[19] 冯丽贞,陈全助,郭文硕,等.桉树的次生代谢及其对焦枯病抗性的关系[J].中国生态农业学报,2008,11(2):426-430.
Feng L Z,Chen Q Z,Guo W S,et al.Relationship between eucalyptus resistance to dieback and secondary metabolism[J].Chinese Journal of Eco-Agirculture,2008,11(2):426-430.
[20] 李劲,萧浪涛,蔺万煌.植物内源茉莉酸类生长物质研究进展[J].湖南农业大学学报(自然科学版),2002,28(1):78-84.
Li J,Xiao L T,Lin W H.Endogenous jasmonic acid and jasmonates in plants[J].Journal of Hunan Agricultural University(Natural Sciences Edition),2002,28(1):78-84.
[21] 冯丽贞,陈全助,郭文硕,等.植物防御酶与桉树对焦枯病抗性的关系[J].中国生态农业学报,2008,11(5):1188-1191.
Feng L Z,Chen Q Z,Guo W S,et al.Relationship between eucalyptus resistance to eucalyptus dieback defense enzyme system[J].Chinese Journal of Eco-Agriculture,2008,11(5):1188-1191.
