臭氧氧化法对颜料废水中苯胺的深度降解研究
2018-02-28李桂菊孟攀攀
李桂菊,夏 欣,姚 悦,孟攀攀,李 丽
(天津科技大学海洋与环境学院,天津 300457)
颜料废水由母液和冲洗液组成,其特点是高色度、高 CODCr、含苯胺类等物质、难生物降解、水质变化大,故该废水是工业废水处理的一大难题[1–4].某生产酸性颜料的公司准备搬迁到新的工业园区,废水处理规模预计达 2,000,t/d,且出水水质要求达到 CJ 343—2010《污水排入城镇下水道水质标准》.目前经“物理、微电解及生物”组合工艺处理后,出水色度和苯胺浓度都无法达到这一水质标准.由于苯胺类化合物具有“三致”作用,如不进行有效处理,会对环境和人体产生严重影响,故需对该废水进行深度处理.
臭氧的氧化还原电位是 2.07,V[5],具有强氧化性,并能产生大量的羟基自由基,能将有机物氧化成为小分子有机酸、醛及酮等[6],故其能降解大部分生化出水中残留的难降解的有机物.Turhan等[7]用臭氧处理模拟水溶性碱性染料亚甲基蓝,结果表明16,min后亚甲基蓝降解完全.李昊等[8]利用臭氧处理印染生化出水,在臭氧投加量为 15.625,mg/L时,废水 COD去除率约为 40%,,色度去除率大于95%,.由于臭氧的氧化和脱色作用在印染废水中的良好应用,可将其用于颜料废水的深度处理工艺,保障出水水质.
本研究采用臭氧氧化法深度处理经“物理、微电解及生物”组合工艺处理后的颜料废水,以期处理后的出水水质达到 CJ 343—2010《污水排入城镇下水道水质标准》的要求,同时探讨臭氧氧化处理的影响因素及臭氧降解苯胺的动力学,旨在为工程实践提供理论依据.
1 材料与方法
1.1 废水水质及排放标准
废水经“物理、微电解及生物”组合工艺处理后的出水水质及 CJ 343—2010《污水排入城镇下水道水质标准》中的C等级排放标准见表1.公司组合工艺处理后出水水质具有波动性,CODCr为 150~250,mg/L,色度为 50~150,苯胺质量浓度为 10~30,mg/L.表 1中的数据为厂家的某一批水样的水质数据.
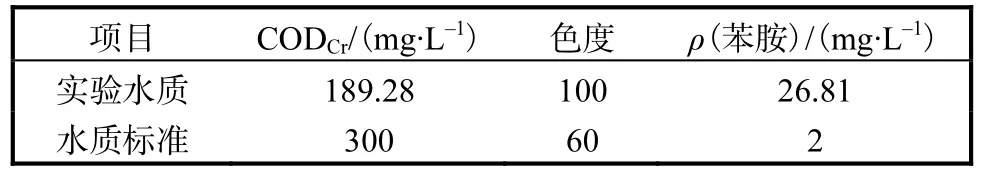
表1 主要废水水质及排放标准Tab. 1 The main quality of wastewater and its discharge standards
1.2 实验装置
臭氧反应装置如图1所示.主要包括NOP 10P–3–2型臭氧发生器(东绿邦光光电设备有限公司)、臭氧反应器、转子流量计、臭氧浓度计以及臭氧尾气吸收瓶.
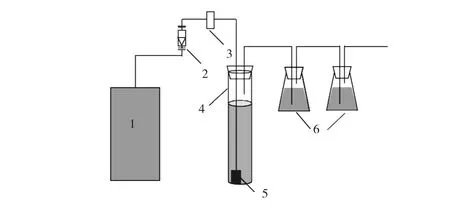
图1 臭氧反应装置图Fig. 1 Diagram of ozonation system
1.3 分析方法[9]
COD测定采用重铬酸钾法;苯胺测定采用 N–(1–萘基)–乙二胺偶氮分光光度法;色度测定采用稀释倍数法.
1.4 臭氧投加速率的计算
臭氧投加速率为每分钟通入装置内的臭氧总量与臭氧利用率之积,而臭氧总量为产生气体中臭氧的浓度与臭氧流量之积.反应后的剩余臭氧通过 KI吸收法测定,臭氧的利用率为通入的臭氧总量与剩余臭氧量之差与臭氧总通入量的比值,所以臭氧的实际投放速率可通过式(1)求得.

式中:v为臭氧投加速率,mg/(L·min);ρ为产生混合气体中的臭氧质量浓度,mg/L;Q为气体流量,L/min;η为臭氧利用率;V为废水体积,L.
2 结果与讨论
2.1 臭氧氧化的影响因素
废水中含有苯胺,且其质量浓度为 25,mg/L左右,为保证其排放达标,进行臭氧氧化处理,考察了废水 pH、温度、臭氧投加速率及进水苯胺质量浓度对臭氧降解效率的影响.
2.1.1 pH
在臭氧投加速率 0.45,mg/(L·min)、反应温度298.15,K、进水苯胺质量浓度 26.81,mg/L时,在不同的 pH下对废水进行臭氧氧化,pH对臭氧降解苯胺的影响如图2所示.
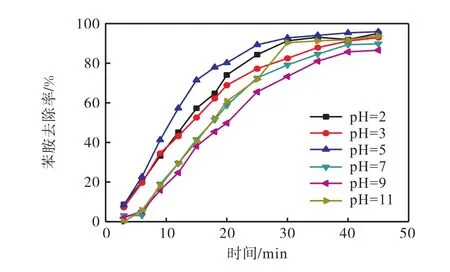
图2 pH对臭氧降解苯胺的影响Fig. 2 Effect of pH on the degradation of aniline by ozone
因为臭氧降解目标物质过程分为直接反应和间接反应,直接反应即臭氧分子直接和目标污染物发生反应,间接反应是诱发臭氧产生羟基自由基,羟基自由基氧化降解目标污染物[10],OH-是羟基自由基的诱发剂,所以 pH对臭氧反应有很大的影响.由图 2可知,整体来看苯胺的降解效率在酸性条件下较碱性条件下要高.分析原因:在酸性(pH<4)条件下,臭氧分子直接氧化机理占主导;在碱性(pH>10)条件下,臭氧分解形成羟基自由基的间接反应机理占主导[11].由图2可以推测,臭氧对于该水样中的苯胺降解机理不符合羟基自由基机理,而是以臭氧直接氧化为主.这可能是由于公司生产偶氮类颜料的重氮化过程中,调节酸性反应条件时用的是盐酸,所以引入大量的 Cl-(废水中 Cl-质量浓度为 2,014,mg/L),而 Cl-是羟基自由基的猝灭剂,因此本实验废水中大量的Cl-使得碱性条件下产生的·OH发生无效的反应.故在本实验中降解苯胺机理主要是臭氧直接反应,臭氧在酸性条件下比碱性条件下降解效率高.为了进一步验证此推测,以异丙醇为羟基自由基的捕获剂,当pH=5时,在 500,mL废水中加入 2,mL的异丙醇进行臭氧深度处理,与相同条件下不加异丙醇的出水苯胺含量进行对比,结果见图 3.由图 3可知:在废水中加入异丙醇后并没有明显降低苯胺的降解效率,由此也可以证明臭氧氧化此颜料废水的过程中以臭氧直接氧化机理为主.
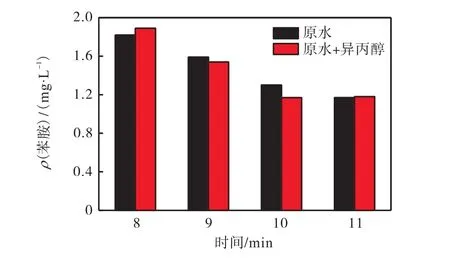
图3 pH=5时水样加与不加异丙醇的处理效果对比Fig. 3 Comparison of the water sample with and without isopropyl alcohol with pH=5
在酸性条件下,pH为2和3时苯胺的去除率小于 pH=5时苯胺的去除率.这是因为偶氮染料合成过程中加入了亚硝酸钠,在 pH=2左右苯胺和废水中残留亚硝酸盐生成重氮盐,导致一部分臭氧先与重氮盐发生反应,臭氧的利用率降低,故pH=5时处理效果最佳,去除率稳定在 95%,以上.在高 pH 下(如pH=11),臭氧分子的分解速率加快,使得臭氧的有效利用率减小,该情况下的处理效果还不及 pH=9时的处理效果.
2.1.2 臭氧投加速率
在反应 pH=5、反应温度为 298.15,K、苯胺质量浓度为 26.81,mg/L时,设定臭氧投加速率分别为0.45、0.74、0.92、1.08,mg/(L·min),考察臭氧投加速率对苯胺降解的影响,结果如图 4所示.由图 4可知:随着臭氧投加速率的增加,苯胺的降解速率也随之增加,在臭氧投加速率从 0.45,mg/(L·min)升高到1.08,mg/(L·min)时,苯胺由 26.81,mg/L 降到 2,mg/L以下需要的降解时间从50,min缩短到10,min. 投加速率在 0.92,mg/(L·min)和 1.08,mg/(L·min)情况下,降解效果相当.当臭氧投加速率为0.45、0.74,mg/(L·min)时,反应速率较小,这是由在低的臭氧投加速率下,气相中臭氧分子在废水中与苯胺接触的概率小,传质效率低所造成的.臭氧投加速率由 0.92,mg/(L·min)增加到 1.08,mg/(L·min),苯胺的降解速率没有很大提高,这是因为在较大的臭氧投加速率下,越来越多的臭氧来不及传质到液相中就随尾气排出,导致臭氧的利用率降低,故后续实验中选择 0.92,mg/(L·min)为最优臭氧投加速率.
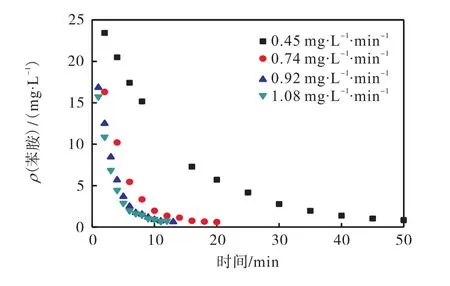
图4 臭氧投加速率对苯胺降解的影响Fig. 4 Effect of ozone acceleration rate on the degradation aniline
2.1.3 温度
在 pH=5、进水苯胺质量浓度为 26.81,mg/L、臭氧投加速率为 0.92,mg/(L·min)时,设定反应温度分别为 279.25、285.65、298.15、315.25,K,考察温度对苯胺降解的影响,结果如图5所示.
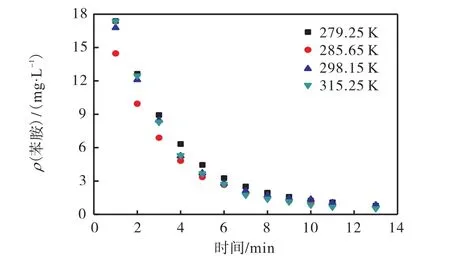
图5 温度对苯胺降解的影响Fig. 5 Effect of temperature on aniline degradation
由图 5可知:随着温度的升高,臭氧降解苯胺的反应速率也随之增加,故升温有利于苯胺的降解.温度会影响臭氧氧化的速率常数,根据范特霍夫近似规则,温度升高,化学反应的反应速率常数也会增加.而另一方面,温度升高会加速水中臭氧的自分解,同时降低臭氧在水中的溶解度,在一定程度上限制苯胺的降解.这两方面的共同作用导致温度对苯胺降解速率的影响不是很大.可见臭氧降解苯胺时对温度变化的抗冲击性较稳定,故实验采用298.15,K.
2.1.4 苯胺初始质量浓度
目标污染物的初始浓度将直接影响有机污染物的去除效率及所需的反应时间.在 pH=5、反应温度为 298.15,K、臭氧投加速率为 0.92,mg/(L·min)的情况下,分别对不同初始质量浓度的苯胺废水进行降解,考察苯胺初始质量浓度对臭氧降解效果的影响,结果如图6所示.
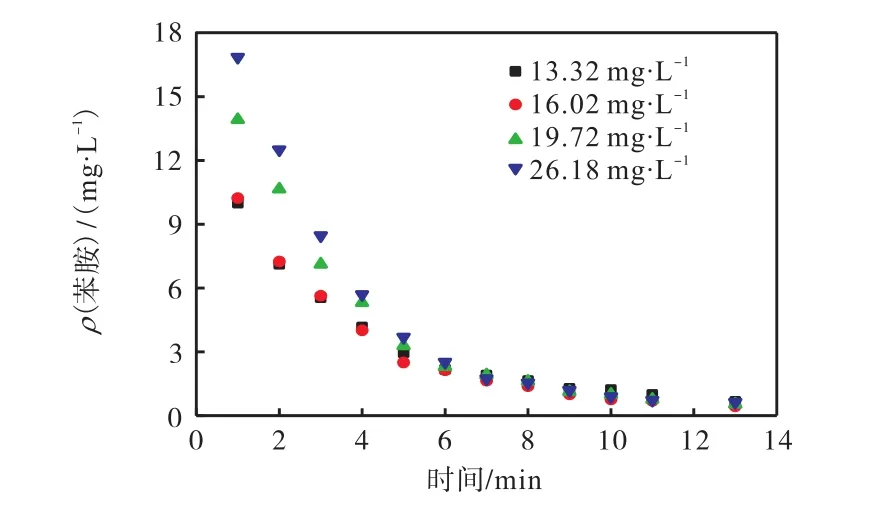
图6 苯胺初始浓度对臭氧降解效果的影响Fig. 6 Influence of concentration of aniline on ozone degradation
由图 6可知:反应 6,min后,苯胺质量浓度分别由 13.32、16.02、19.72、26.18,mg/L 降为 2.18、2.14、2.31、2.51,mg/L,去除率分别为 83.63%,、86.64%,、88.29%,、90.41%,,苯胺的降解率随其质量浓度的增加而增大.反应13,min后,上述4种浓度降解率都能达到 94%,以上.故苯胺初始质量浓度在 13.32~26.18,mg/L时,臭氧氧化反应都可以在 13,min时使出水苯胺质量浓度小于 2,mg/L,且色度降至 40.臭氧投加速率一定时,废水中的苯胺初始质量浓度增加,反应消耗的臭氧量随之增加,溶液中臭氧的浓度减小,臭氧在气液两相间的传质推动力增加,臭氧传质量增加,从而提高了苯胺的降解率.
综上所述,臭氧处理的最佳工艺条件为:pH=5(原水 pH)、臭氧投加速率为 0.92,mg/(L·min)、反应温度 298.15,K,在该条件下反应 13,min处理组合工艺出水,色度降至40,苯胺质量浓度降到0.63,mg/L.
2.2 臭氧降解苯胺动力学方程的确定
通过对反应动力学的研究,可加深了解臭氧氧化过程中各主要影响因素在氧化过程中的贡献[12].臭氧降解苯胺的反应动力学可由式(2)表示.

式中:ρ为反应时间t时的苯胺质量浓度;ρO3为反应时间t时溶液中臭氧质量浓度;k为反应速率常数;m和n分别为苯胺的反应级数和臭氧的反应级数.
反应过程中,臭氧处于连续曝气状态,水中臭氧供给与消耗达到一个平衡,可认定水中臭氧浓度恒定,则式(2)可简化为

由上述 ln(ρ/ρ0)对 t的拟合曲线为直线,可知臭氧降解苯胺符合一级反应动力学,即 m=1,则臭氧降解苯胺的动力学方程为

根据上述实验可知臭氧的投加速率、反应温度以及溶液中苯胺的初始质量浓度,对苯胺的降解都会有影响.其对苯胺降解的影响可由 kobs与各参数之间的幂指数拟合经验模型式(5)表示.
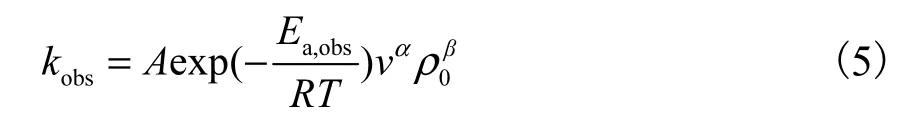
两边取对数得
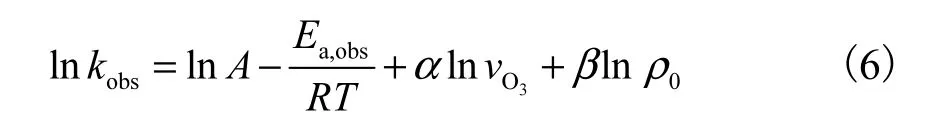
式中:v是臭氧投加速率,mg/(L·min);ρ0是苯胺的初始质量浓度,mg/L;kobs是苯胺与臭氧反应的表观速率常数,min-1;A为指前因子;Ea,obs为表观反应活化能,J/mol;R 为气体常数,8.314,J/(mol·K);T 为反应温度,K;α、β为指数.
(1)kobs与不同反应温度的拟合
对臭氧在不同温度下降解苯胺进行动力学拟合,将得到的不同反应温度下的 kobs,对 ln,kobs–T,-1作线性回归,结果如图7(a)所示.分析得到回归方程
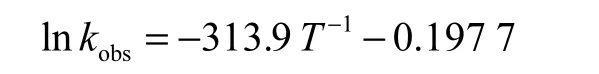
直线斜率为-313.9,故表观活化能 Ea,obs=2,609.76,J/mol,通常氧化反应活化能为 70~170,kJ/mol[13],说明臭氧氧化降解苯胺过程较容易进行,基本属于快速反应[14].
(2)kobs与臭氧投加速率的拟合
臭氧投加速率对苯胺降解效果一级动力学拟合,得到各臭氧投加速率下的 kobs,并对 ln,kobs–ln,v作线性回归,结果见图7(b).其直线斜率为 2.004,3,可决系数 R2=0.964,8.
(3)kobs与不同苯胺初始质量浓度的拟合
苯胺初始质量浓度对苯胺降解效果的一级动力学拟合,拟合得到各臭氧投加速率下的 kobs,并对ln,kobs–ln,ρ0作线性回归,结果见图 7(c).直线斜率为0.422,9,可决系数 R2=0.975,3.
将各条件下实验数据代入式(5),计算出 A的平均值为0.256.则臭氧降解苯胺的动力学方程参数为
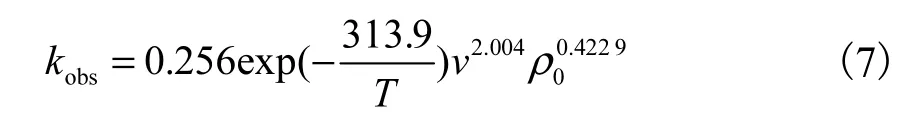
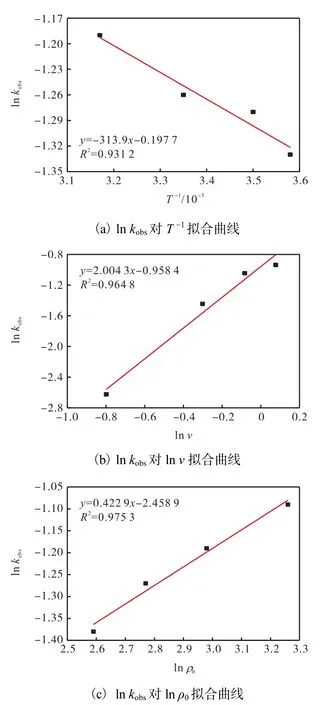
图7 ln k对 T,-1、ln v、ln ρ 的拟合曲线obs,0Fig. 7 Plots of ln kobs vs T-1,ln v and ln ρ0
根据图 7中的实验数据,对各实验条件下的 kobs进行计算,结果见表 2.臭氧投加速率、反应温度和苯胺初始质量浓度对苯胺的降解效果都有影响,在臭氧投加速率为 0.45~1.08,mg/(L·min)、反应温度为279.25~315.25,K 和苯胺初始质量浓度为 13.32~26.18,mg/L条件下,臭氧氧化苯胺均符合一级动力学降解规律,且臭氧投加速率的增加、反应温度的增大和苯胺初始质量浓度的增大都有利于一级动力学常数的提高.
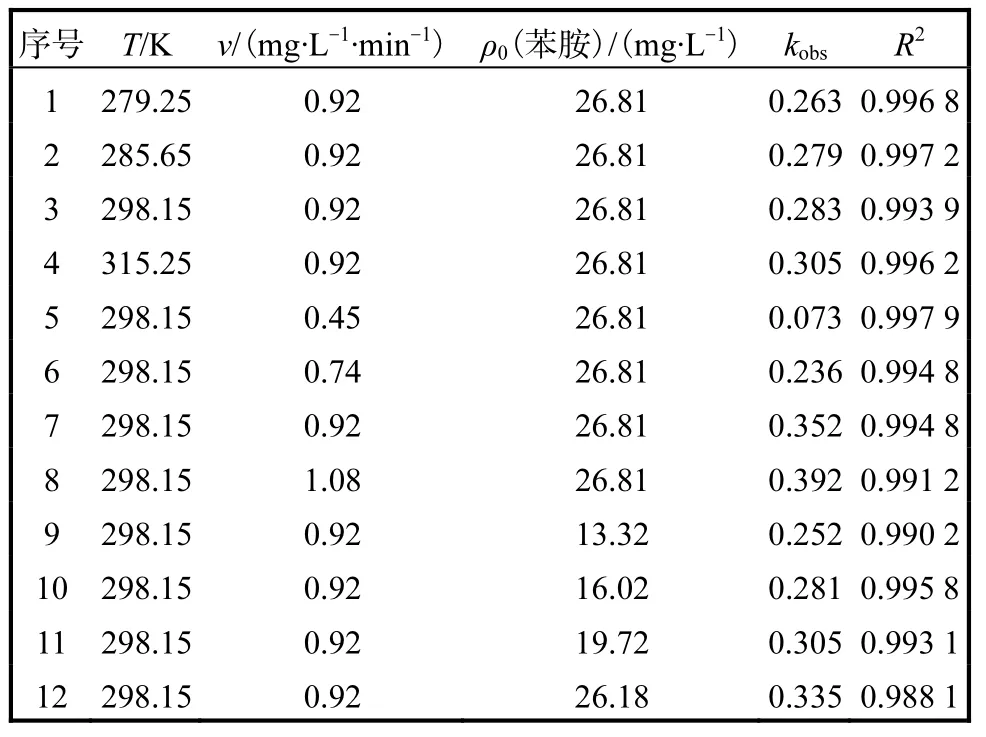
表2 动力学拟合结果Tab. 2 Fitted rate constants of the experimental results
3 结 论
臭氧氧化反应深度处理苯胺废水,最佳工艺条件为 pH=5、反应温度为 298.15,K、臭氧投加速率为0.92,mg/(L·min),反应 13,min后色度降至 40,苯胺去除率达到 94%,以上,出水能稳定降到 2,mg/L以下.对臭氧降解苯胺进行动力学拟合,其结果符合一级动力学方程,动力学方程参数为
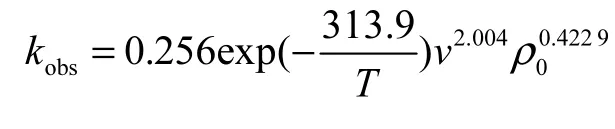
[1] 张萍. 大孔吸附树脂处理颜料废水的实验研究[D]. 济南:山东师范大学,2009.
[2] 曲艺. 云母珠光颜料工业废水处理方法及机理研究[D]. 武汉:武汉理工大学,2005.
[3] 梁吉艳,崔春玲,崔丽,等. Fenton 法预处理颜料企业生产废水[J]. 沈阳工业大学学报,2014,36(4):476–480.
[4] 周欣平,杨常凤,孔峰. TiO2光催化降解颜料废水实验研究[J]. 河北化工,2008,31(4):62–63.
[5] Chu W,Ma C W. Quantitative prediction of direct and indirect dye ozonation kinetics[J]. Water Research,2000,34(12):3153–3160.
[6] Huang H L,Huang H B,Zhan Y J,et al. Efficient degradation of gaseous benzene by VUV photolysis combined with ozone-assisted catalytic oxidation:Performance and mechanism[J]. Applied Catalysis B:Environmental,2016,186:62–68.
[7] Turhan K,Durukan I,Ozturkcan S A,et al. Decolorization of textile basic dye in aqueous solution by ozone[J].Dyes and Pigments,2012,92(3):897–901.
[8] 李昊,周律,李涛,等. 臭氧氧化法深度处理印染废水生化处理出水[J]. 化工环保,2012,32(1):30–34.
[9] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京:中国环境科学出版社,2002:35–106.
[10] 侯甲才. 臭氧化降解水中双酚 A的效能及动力学[D].泰安:山东农业大学,2014.
[11] 张晓慧. 催化臭氧氧化法处理有机废水的研究[D]. 天津:天津大学,2006.
[12] 蔡少卿,何月峰,戴启洲,等. 臭氧氧化对甲基苯磺酸的动力学模型[J]. 化工学报,2011,62(5):1414–1420.
[13] 张凌,陶莹,常志显,等. 臭氧法降解水中对甲基苯磺酸的动力学研究[J]. 环境科学学报,2011,31(10):2185–2191.
[14] 张林生. 水的深度处理与回用技术[M]. 北京:化学工业出版社,2001:78–79.
