大孔树脂纯化黑豆异黄酮的工艺优化
2018-02-27刘振春邹基豪崔晶蕾李泽鸿
张 星,董 欣,刘振春,郑 丽,邹基豪,崔晶蕾,李泽鸿
(1长春工业大学 人文信息学院,吉林 长春 130118;2吉林农业大学 a食品科学与工程学院,b生命科学学院,吉林 长春 130118)
黑豆(Glycinemax(L.)merr)为被子植物门(Ngiospermae)双子叶植物纲(Dicotyledons) 豆科(Leguminosaesp)大豆属(GlycineWild) 植物,又被称为橹豆、料豆、零乌豆。其外形呈卵圆形或球形,表皮呈黑色或深绿色,全国多地均有产出,其中东北产量居全国首位[1]。黑豆中含有丰富的人体必需营养物质,如脂肪、蛋白质、纤维素等,同时也含有多种生物活性物质,如异黄酮、多糖等。所以黑豆也被誉为可被大力开发的食药兼用型健康食品[2]。黑豆中的异黄酮是一种能够很好地抑制结肠癌、前列腺癌、乳腺癌等癌症的植物性雌激素,同时异黄酮还可以防治中老年骨质疏松症,预防多种心血管疾病,对于改善妇女更年期综合症及增加雌激素活性也有明显的作用[3-5]。但黑豆中的异黄酮遇高温易氧化,因此在提取过程中要避免温度过高[6-7]。
目前应用较为广泛的异黄酮分离方法有萃取法、沉淀法、柱层析法等[8-9]。大孔树脂吸附法是近年来针对有机高聚吸附剂发展起来的新型异黄酮分离法,与传统方法相比,这种方法具有使用周期长、成本低、毒性小等诸多优点[10-12]。黑豆异黄酮主要是指以3-苯并吡喃酮为母核的化合物,其骨架结构与大孔树脂分子相近,因此将大孔吸附树脂的吸附性能与分子筛相结合,可以从黑豆粗提物中有选择地吸附其中的有效成分,去除杂质。但目前有关利用大孔树脂分离纯化黑豆异黄酮的研究尚未见报道。为此,本研究利用响应面优化和回归分析方法确定利用大孔树脂分离纯化黑豆粗黄酮的最优工艺条件,并通过超高效液相色谱分析法,准确测定纯化黑豆异黄酮的成分,以期为黑豆的开发利用提供参考。
1 材料与方法
1.1 材 料
东北青仁黑豆,市售。染料木素标准品、大豆苷元标准品、大豆苷标准品、染料木苷标准品,纯度≥98%,上海雅吉生物科技有限公司;无水乙醇、HCl、NaOH、磷酸钠等为分析纯;甲醇色谱纯,天津市东丽区天大化学试剂厂;大孔吸附树脂NKA-9、AB-8、D101、HPD100、DM301,北京索宝生物科技有限公司。
1.2 仪器与设备
AR1502CN电子天平,奥豪斯仪器(上海)有限公司;Q-250A3高速多功能粉碎机,上海冰都电器有限公司;NJL07-3型实验用微波炉,南京杰全微波设备有限公司;TU-1901紫外分光光度计,北京普希通用仪器有限责任公司;JY99-2D超声波细胞粉碎机,宁波新芝生物科技股份有限公司;LXJ-B离心机,上海安亭科学仪器厂;超高效液相色谱系统,美国沃特斯公司。
1.3 试验方法
1.3.1 黑豆异黄酮的提取及含量测定 (1)异黄酮提取。根据张星等[13]的方法,将脱脂黑豆粉末放入体积分数为60%的乙醇溶液中提取,经多次试验,确定提取条件为料(g)液(mL)比1∶20、超声波功率310 W,微波功率420 W,微波辐射时间120 s,经离心处理后得黑豆异黄酮粗品备用。
(2)标准曲线的绘制。精确称取染料木素标准品1 mg,用体积分数为95%的乙醇溶液定容至10 mL,配制成0.1 mg/mL的染料木素标准溶液;量取1 mL体积分数为95%的乙醇,加蒸馏水定容至10 mL,作为空白对照组;再分别准确量取0.1,0.3,0.5,0.7,0.9 mL染料木素标准溶液置于10 mL容量瓶中,用体积分数为95%的乙醇定容至1 mL后再加蒸馏水定容至10 mL。以空白组为对照,在波长200~600 nm内扫描染料木素标准溶液,最终确定黑豆异黄酮的最大吸收波长为260 nm。利用紫外分光光度计,在波长260 nm处测定其吸光度;并将测定出的吸光度作为纵坐标(Y),黑豆异黄酮质量浓度(μg/mL)作为横坐标(X)绘制标准曲线[14],根据标准曲线计算黑豆异黄酮的含量。
1.3.2 黑豆异黄酮的纯化 (1)大孔吸附树脂预处理。将NKA-9、AB-8、D101、HPD100、DM301 5种树脂,分别浸泡于体积分数为95%的乙醇溶液中24 h,然后用蒸馏水洗涤至中性;再分别用体积分数为5%的NaOH溶液浸泡12 h,洗涤至中性;最后用体积分数为5%的HCl浸泡12 h,洗涤至中性,静置待用[15-16]。
(2)静态吸附试验及相关指标的计算。准确称取预处理后的5种湿树脂各1 g,分别装入100 mL的具塞锥形瓶中,各加入50 mL黑豆粗黄酮溶液,置于摇床上振荡24 h,使树脂吸附充分。振荡过程中每隔0.5 h吸取0.1 mL上清液,测定其中的黑豆异黄酮质量浓度,据此计算吸附量[17-18]。取最终吸附的树脂,滤去上清液,加入50 mL体积分数为75%的乙醇,摇床振荡24 h,测定其中黑豆异黄酮质量浓度,最后计算吸附率、解吸率、洗脱率、回收率和纯度,计算公式如下:
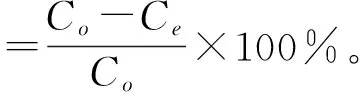
(1)

(2)
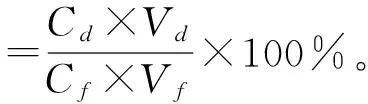
(3)
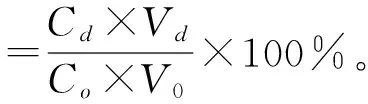
(4)
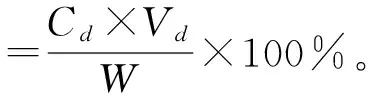
(5)
式中:Co为吸附前溶液中黑豆异黄酮质量浓度,mg/mL;Ce为吸附后溶液中黑豆异黄酮质量浓度,mg/mL;Cd为解吸溶液中黑豆异黄酮质量浓度,mg/mL;Vd为解吸溶液体积,mL;Cf为吸附溶液中黑豆异黄酮质量浓度,mg/mL;Vf为吸附溶液的体积,mL;Vo为吸附前溶液的体积,mL;W为干膏质量,mg。
1.4 大孔树脂吸附的单因素试验
1.4.1 上样液质量浓度 用静态吸附试验中吸附能力最强的AB-8大孔吸附树脂,分别饱和吸附质量浓度为3,5,7,9,11 mg/mL、体积为60 mL、pH值为2的黑豆异黄酮提取液,根据其吸附量计算树脂对黑豆异黄酮的吸附率,确定上样液的最佳质量浓度。
1.4.2 上样液pH值 取7 mg/mL黑豆异黄酮提取液60 mL,以2 mL/min的上样流速通过AB-8大孔吸附树脂,通过柱体时pH分别为1,2,3,4,5,根据吸附率选择最佳的上样液pH值。
1.4.3 上样液流速 将7 mg/mL的黑豆异黄酮提取液分别以1.5,2.0,2.5,3.0,3.5 mL/min的流速通过AB-8大孔吸附树脂,准确测定黑豆异黄酮质量浓度,根据泄漏点出现时间选择最佳上样流速[19]。
1.5 大孔树脂吸附黑豆异黄酮工艺的Box-Behnken响应面优化
根据单因素试验结果,分别选择上样液质量浓度、pH值、上样液流速3个变量,采用响应面分析法对其进行优化,以吸附率为参照值,设计三因素三水平的响应面优化试验[20-21]。试验因素与水平设计方案见表1。

表1 大孔树脂吸附黑豆异黄酮工艺条件优化的响应面试验方案Table 1 Factors and levels for response surface analysis affecting the adsorption of black soybean isoflavone by macroporous resin
1.6 大孔吸附树脂解吸的单因素试验
1.6.1 乙醇体积分数 从经济、适用角度考虑,本研究选取乙醇作为黑豆异黄酮洗脱剂,由于洗脱剂体积分数是影响AB-8大孔树脂洗脱效果的重要因素,所以将饱和吸附后的AB-8大孔吸附树脂分别用体积分数为0,20%,40%,60%,80%的乙醇溶液洗脱,根据黑豆异黄酮洗脱率确定乙醇的最佳体积分数[22]。
1.6.2 乙醇用量 黑豆异黄酮的解吸效果由多个因素综合决定,其中洗脱剂的用量除了要考虑其对解吸效果的影响外,还要综合考虑成本因素。所以本试验将饱和吸附后的AB-8大孔吸附树脂分别用20,40,60,80,100,120,140,160,180 mL体积分数为50%的乙醇溶液进行洗脱,根据黑豆异黄酮洗脱率来确定乙醇的最适用量。
1.7 黑豆异黄酮的二次纯化试验
在上述优化的吸附和解吸条件下,将黑豆粗黄酮经过AB-8型大孔吸附树脂进行一次纯化,记录结果后再以相同条件进行二次纯化,获得最终纯化的黑豆异黄酮。
1.8 黑豆异黄酮组分的超高效液相色谱分析
1.8.1 样品的制备 将大豆苷、大豆苷元、染料木苷、染料木素4种标准品分别溶于体积分数80%甲醇中,然后将标准品溶液和黑豆异黄酮粗提物经AB-8型大孔吸附树脂纯化,所得液体分别经0.45 nm滤膜过滤备测。
1.8.2 色谱条件 色谱柱为BEH C18柱(1.7 μm,2.1 mm×100 mm);柱温40 ℃;进样量1 μL;流动相为体积分数10%甲醇(A)和体积分数0.3%乙酸(B);流速0.3 mL/min;检测波长260 nm。
2 结果与分析
2.1 黑豆异黄酮的提取
黑豆异黄酮质量浓度与吸光度的标准曲线回归方程为Y=0.112 65X-0.058 85,R2=0.999 25(图1)。在波长260 nm下测定其吸光度,按照回归方程算出待测样品中的黑豆异黄酮含量为(4.73±0.2) mg/g。
2.2 黑豆异黄酮吸附树脂的筛选
由图2可知,5种大孔树脂对黑豆异黄酮均有一定的吸附作用,且以AB-8对黑豆异黄酮的吸附能力最强,7 h时其吸附量可达14.01 mg/g。这可能是由于异黄酮类物质的分子结构由极性糖基和非极性黄酮母核结构组成,总体显示弱极性;而AB-8型树脂也为弱极性,且其所具有的酚羟基结构可以作为较好的羟基供体,所以可以很好地吸附黑豆异黄酮。吸附时间小于7 h时,AB-8树脂的吸附量增幅和吸附速率快速增加;超过7 h后,吸附曲线则趋于平缓,吸附量增加缓慢。因此从生产周期以及成本角度考虑,将AB-8作为吸附黑豆异黄酮的大孔树脂,最佳吸附时间为7 h。

图1 黑豆异黄酮含量测定的标准曲线Fig.1 Standard curve for determination of black soybean isoflavone
2.3 大孔树脂吸附黑豆异黄酮的单因素试验结果
2.3.1 上样液质量浓度对吸附效果的影响 图3为黑豆异黄酮粗提物质量浓度对AB-8大孔树脂吸附效果的影响。从图3可以看出,随着上样液质量浓度的增加,AB-8大孔树脂对黑豆异黄酮的吸附率呈现明显上升趋势,当上样液质量浓度达到7 mg/mL时,吸附效果最好,吸附率达到87.92%;之后,当上样液质量浓度增加时,吸附率反而有所下降。因此,确定AB-8大孔树脂吸附黑豆异黄酮时的上样液质量浓度为7 mg/mL。
2.3.2 上样液pH对吸附效果的影响 从图4可以看出,在pH值不断增大的过程中,AB-8大孔树脂对黑豆异黄酮的吸附率表现为先增加后降低。且当pH值为2时,其吸附率最高达到87.31%。因此,选择pH值为2进行AB-8大孔树脂吸附黑豆异黄酮试验。究其原因,可能是由于异黄酮类化合物多数为多羟基酚类,其弱酸性特质导致其溶解度在酸性条件下降低,因此利于被树脂吸附。但当pH降至1时,因酸性过强导致沉淀析出,所以吸附率也不高。
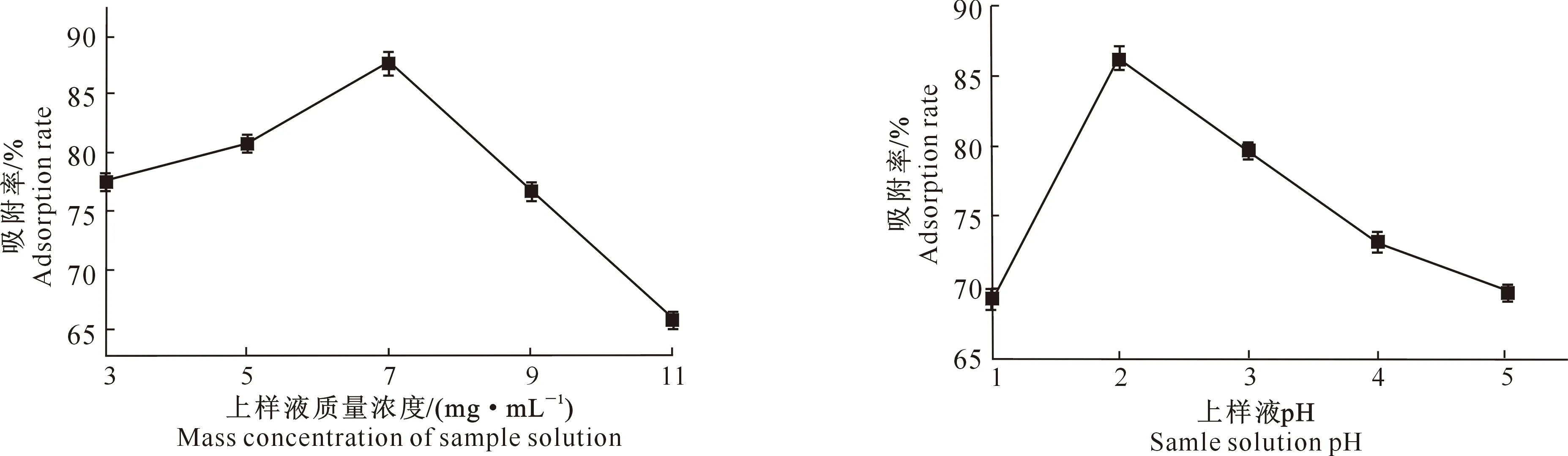
图3 上样液质量浓度对AB-8大孔树脂吸附黑豆异黄酮效果的影响Fig.3 Effect of solution concentration on adsorption of black soybean isoflavone by AB-8
2.3.3 上样液流速对吸附效果的影响 图5为将黑豆异黄酮粗提物以不同流速通过AB-8大孔树脂时的吸附效果。图5显示,当流速为1.5,2 mL/min时,吸附率较高,当流速大于2 mL/min时吸附率呈现下降态势,证明在此流速下黑豆异黄酮不能较好地被吸附。这可能是由于过快的流速导致溶质分子不能全面扩散到树脂表层,因而减少了吸附量。综合考虑试验用时和泄漏效果双重因素,最终选择2 mL/min为最佳流速。
2.4 大孔树脂吸附黑豆异黄酮工艺条件的响应面优化
2.4.1 响应面试验结果 由单因素试验结果可知,上样液质量浓度、pH值和流速3种因素对黑豆异黄酮的吸附率均有一定影响,所以以上样液质量浓
度(X1)、pH值(X2)、流速(X3)进行三因素三水平Box-Behnken中心组合试验,结果见表2。
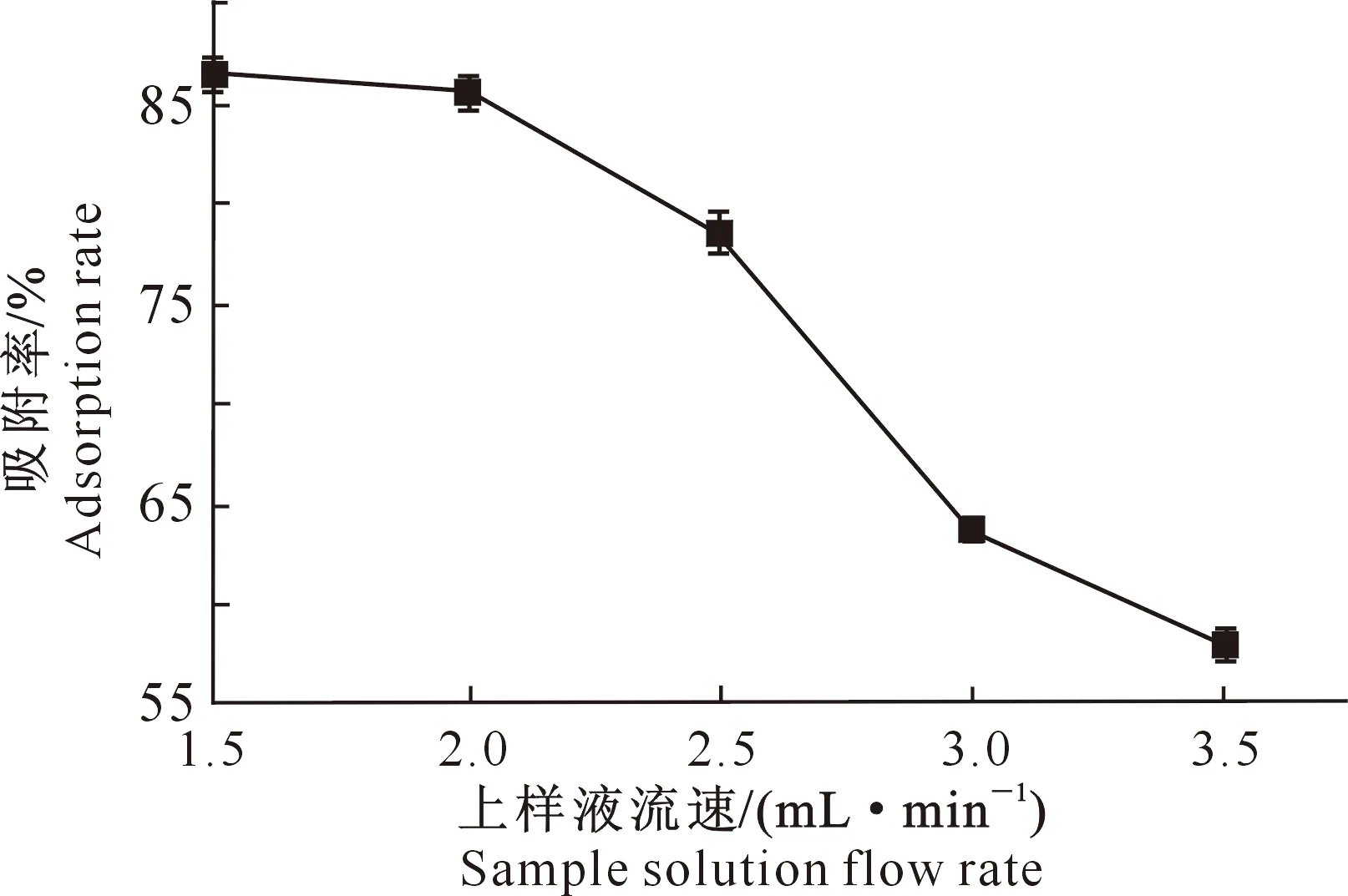
图5 上样液流速对AB-8大孔树脂吸附黑豆异黄酮效果的影响Fig.5 Effect of solution velocity on adsorption of black soybean isoflavone by AB-8

试验号No.上样液质量浓度(X1)MassconcentrationofsamplesolutionpH(X2)上样液流速(X3)Sampleliquidflowrate吸附率/%Adsorptionrate100087.9621-1068.3230-1161.214-1-1057.475-11071.69601178.497-10-178.42800087.929-10166.261010-186.08110-1-174.361201-185.921311080.541400088.561500086.471610179.311700087.08
2.4.2 回归方程的建立 利用Design-expert 8.0.6 对试验数据进行分析处理,回归分析结果见表3。黑豆异黄酮吸附率(Y)对上样液质量浓度(X1)、pH值(X2)、上样液流速(X3)的二次多项回归方程为:

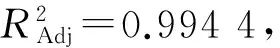

表3 大孔树脂吸附黑豆异黄酮工艺优化回归方程的方差分析Table 3 Variance analysis of optimal regression equations for adsorption of black soybean isoflavone by macroporous resin
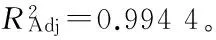

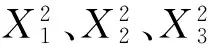
(1)上样液质量浓度与pH值之间的交互作用。在上样液流速为2 mL/min时,上样液质量浓度与pH值交互作用的等高线和响应面图见图6。

图6 pH值与上样液质量浓度交互作用对黑豆异黄酮吸附率的影响Fig.6 Effect of pH and concentration of sample solution interaction on adsorption rate of soybean isoflavones
由图6可以看出,在对黑豆异黄酮吸附率的交互作用中,pH值曲面较上样液质量浓度曲面较平缓,说明pH值对吸附率的影响较为明显。等高线图呈椭圆形,说明两者之间有显著的交互作用。
(2)上样液质量浓度与上样液流速的交互作用。在pH值为2时,上样液质量浓度与上样液流速交互作用的等高线及响应面图见图7。从图7可以看出,在对黑豆异黄酮吸附率的交互作用中,上样液质量浓度曲面较上样液流速曲面变化平缓,说明上样液质量浓度对吸附率的影响大于上样液流速。等高线为椭圆形,说明两者之间的交互作用显著。
(3)pH值与上样液流速的交互作用。在上样液质量浓度为7 mg/mL时,pH值与上样液流速的交互作用等高线和响应面图见图8。由图8可以看出,在对黑豆异黄酮吸附率的交互作用中,pH值曲面缓于上样液流速曲面,说明pH值对黑豆异黄酮吸附率的影响大于上样液流速。椭圆形等高线说明pH值与上样液流速的交互作用对黑豆异黄酮吸附率有明显影响。
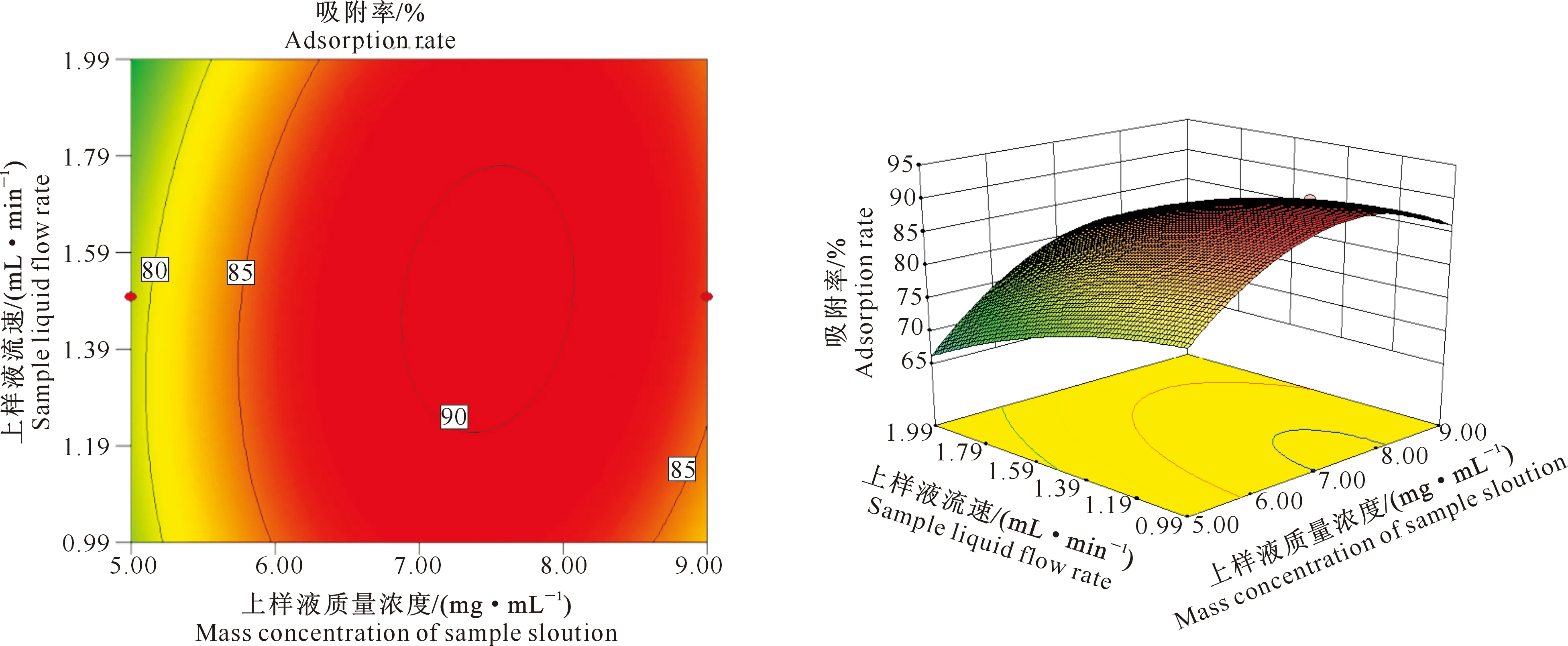
图7 上样液流速与上样液质量浓度交互作用对黑豆异黄酮吸附率的影响Fig.7 Effect of velocity and concentration of sample solution interaction on adsorption rate of soybean isoflavones
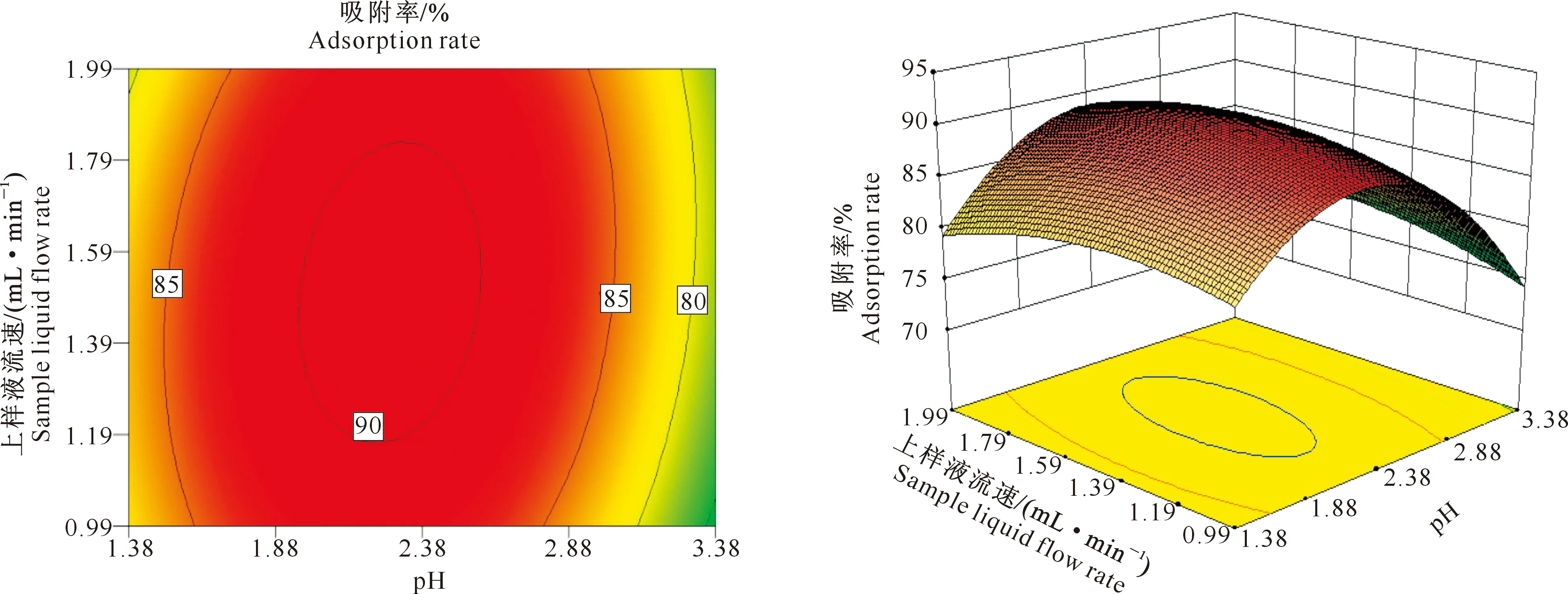
图8 上样液流速与pH值交互作用对黑豆异黄酮吸附率的影响Fig.8 Effect of sample liquid velocity and pH on adsorption rate of soybean isoflavones
2.4.4 最佳工艺条件的确定及验证 用Design expert 8.0.6对2.4.2中回归方程进行分析,得出AB-8大孔树脂吸附黑豆异黄酮的最佳条件为:上样液质量浓度7.47 mg/mL,pH值2.27,上样液流速1.54 mL/min,预测在此条件下的吸附率为91.392%。考虑到实际操作的可行性,将上述条件校正为:上样液质量浓度7.47 mg/mL,pH值2.27,上样液流速2 mL/min,在此条件下进行3次重复验证试验,得到的吸附率分别为91.053%,90.966%,91.069%,平均吸附率为91.029%,与预测值接近,表明所建立的回归模型可以较好地反映AB-8大孔树脂吸附黑豆异黄酮的效果。
2.5 大孔树脂解吸影响的单因素试验结果
2.5.1 洗脱剂体积分数对解吸效果的影响 图9为不同体积分数乙醇作为洗脱剂对黑豆异黄酮洗脱率的影响。由图9可以看出,随着乙醇体积分数逐渐增大,洗脱率呈现先上升后下降的趋势。当洗脱剂体积分数为60%时,黑豆异黄酮能被有效洗脱出来,洗脱率达到78.32%;而当洗脱剂体积分数升高至80%时,洗脱率降至62.71%。从洗脱液的颜色也可以明显看出,用体积分数60%乙醇时洗脱液颜色更接近于深棕色,且颜色保持时间较长。综上所述,选择体积分数60%乙醇作为最适条件。
2.5.2 洗脱剂用量对解吸效果的影响 图10为不同体积乙醇洗脱AB-8大孔树脂后所得的黑豆异黄酮洗脱率。从图10可知,随着洗脱剂体积增加,黑豆异黄酮洗脱率逐渐上升。当乙醇体积为80 mL时,黑豆异黄酮洗脱率达到68.89%;体积大于80 mL时,洗脱率增幅减小至5%以下,所以从经济适用角度考虑,选取洗脱剂体积为80 mL。
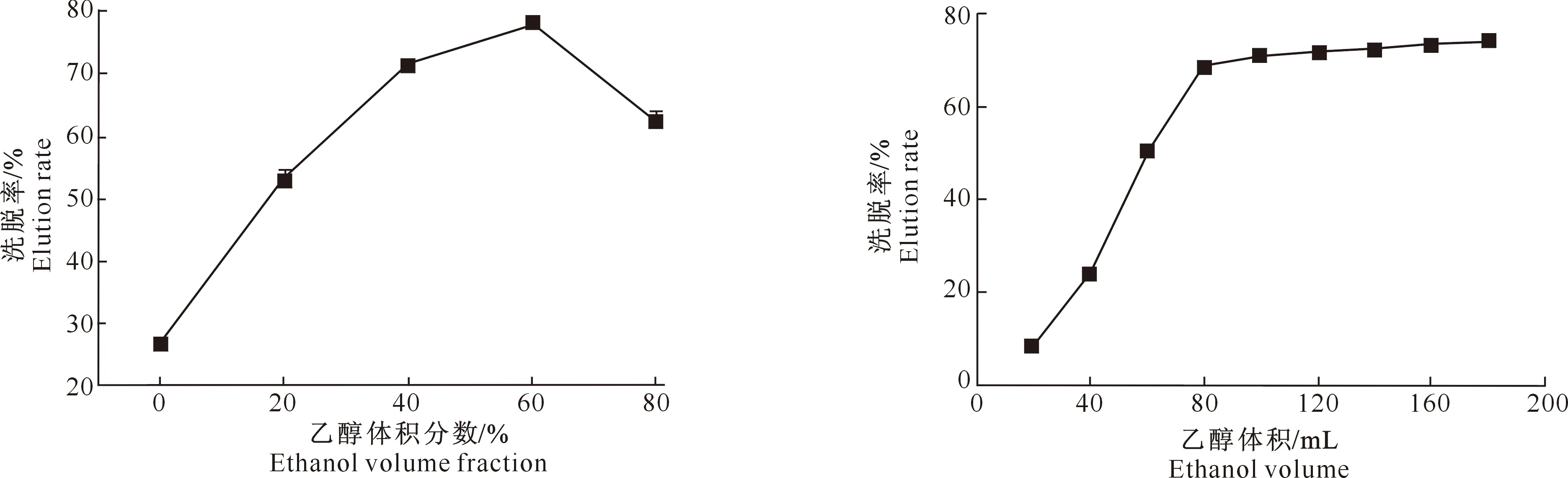
图9 乙醇体积分数对黑豆异黄酮解吸效果的影响Fig.9 Effect of ethanol concentration on the adsorption by AB-8
2.6 黑豆异黄酮的二次纯化
在优化的最佳工艺下,将黑豆粗黄酮第一次通过AB-8型大孔吸附树脂,获得的黑豆异黄酮纯度达到72.42%,比未纯化前(纯度21.36%)提高了近3倍,回收率为81.34%。将一次纯化后的黑豆异黄酮在相同条件下再次过柱,所得黑豆异黄酮纯度为78.56%,较一次纯化提高了8.48%,回收率为81.66%。
2.7 黑豆异黄酮组分的超高效液相色谱分析
图11为黑豆异黄酮4种标准品所得的超高效液相色谱(UPLC)图。
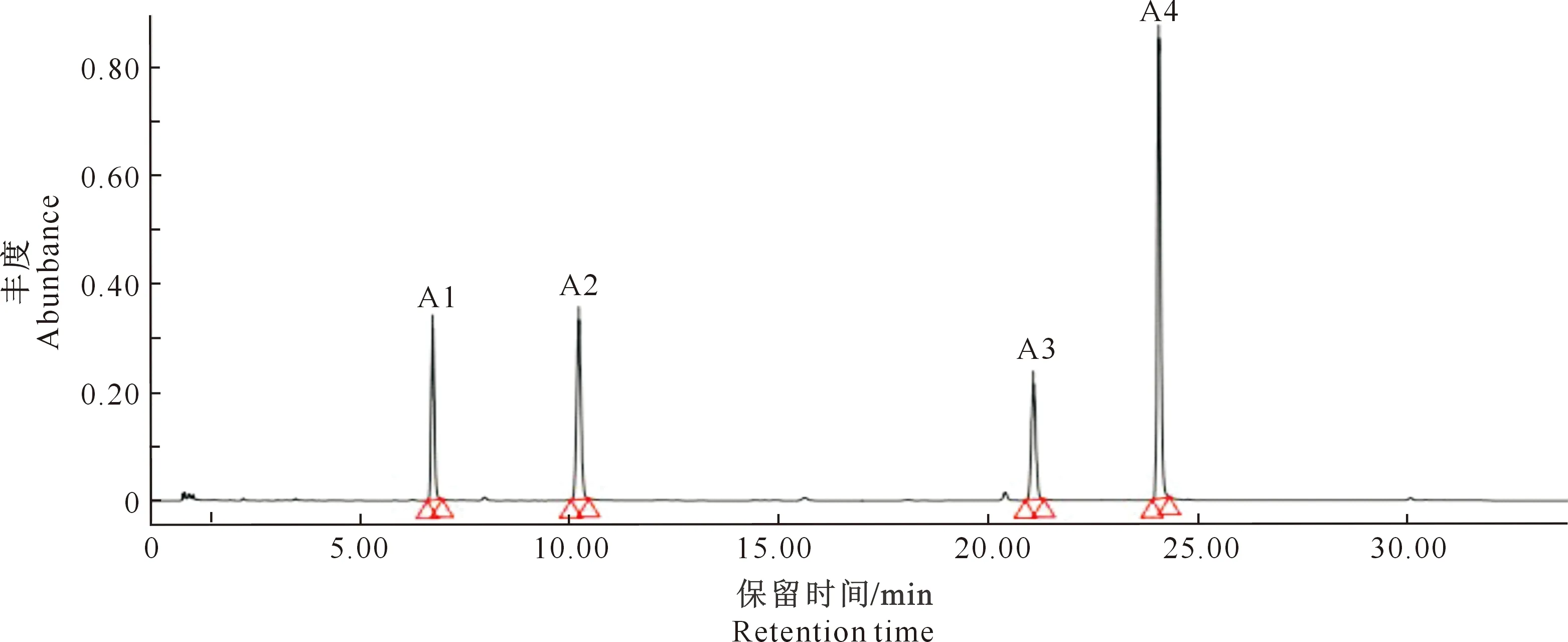
A1峰为大豆苷,A2峰为染料木苷,A3峰为大豆苷元,A4峰为染料木素A1.Daidzin;A2.Genistin;A3.Isoflavoues aglycone;A4.Genistein图11 黑豆异黄酮4种单体的UPLC结果Fig.11 UPLC chromatograms of four components of single black soybean isoflavone
图12为选用上样液质量浓度7.47 mg/mL、上样液pH 2.27、上样液流速2 mL/min、洗脱剂体积分数60%、洗脱剂用量80 mL下,一次纯化得到的黑豆异黄酮提取物。图13为二次纯化后的黑豆异黄酮,与图11中各峰的出峰时间相比可以推断,图12与图13中所对应峰依次可能为大豆苷、染料木苷、大豆苷元和染料木素[23]。但图12中明显可见较多杂峰,推测应该是黑豆异黄酮提取液中的其他异黄酮类单体以及经大孔树脂吸附后未被完全吸附掉的一些杂质[24]。经过二次纯化之后,部分杂峰已经去除,剩余峰值推测为异黄酮类其他单体(图13)。通过2次大孔吸附树脂纯化,使得黑豆异黄酮在提取液中的纯度较吸附前有了很大提升。
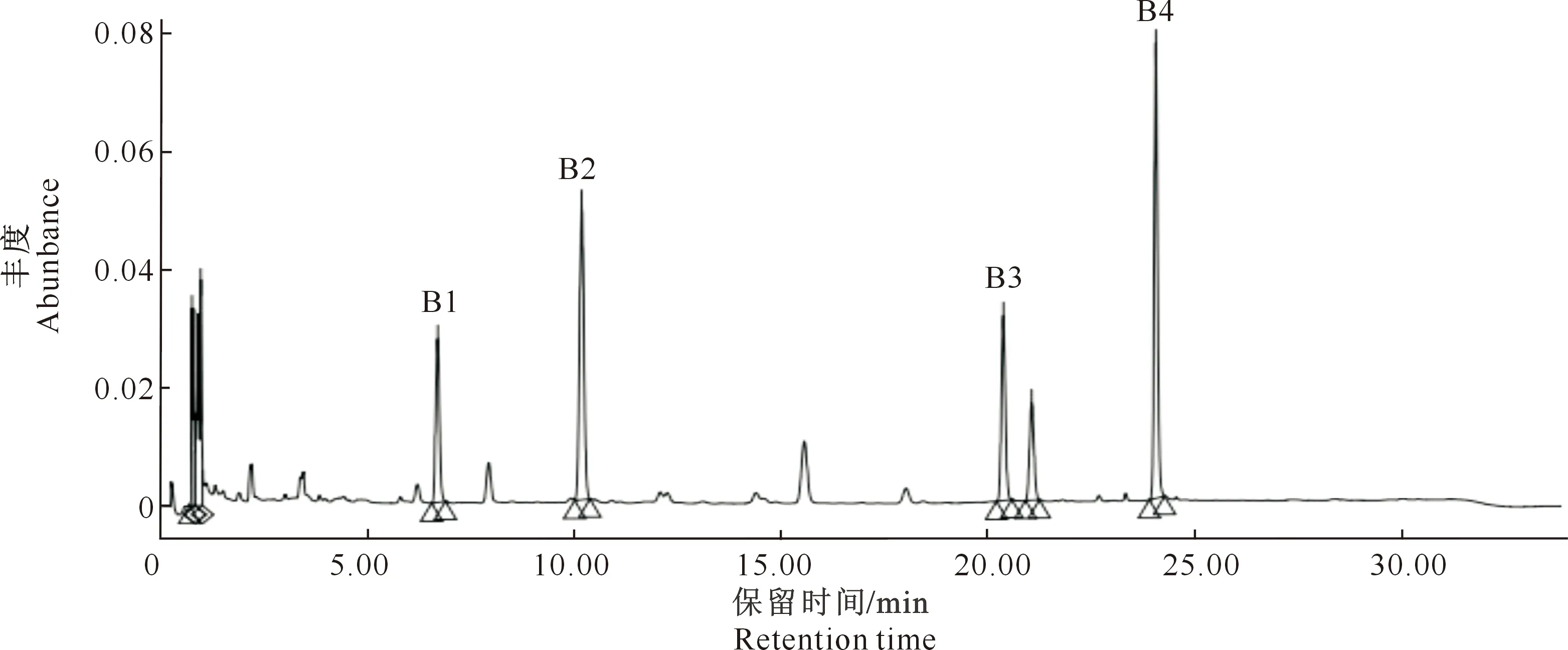
B1峰为大豆苷,B2峰为染料木苷,B3峰为大豆苷元,B4峰为染料木素B1.Daidzin;B2.Genistin;B3.Isoflavoues aglycone;B4.Genistein图12 一次纯化后黑豆异黄酮提取液的UPLC结果Fig.12 UPLC chromatograms of black soybean isoflavone after one time purification
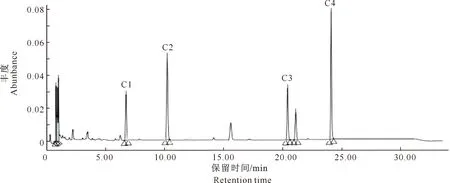
C1峰为大豆苷,C2峰为染料木苷,C3峰为大豆苷元,C4峰为染料木素C1.Daidzin;C2.Genistin;C3.Isoflavoues aglycone;C4.Genistein图13 二次纯化后黑豆异黄酮提取液的UPLC结果Fig.13 UPLC chromatograms of black soybean isoflavone after second time purification
3 结 论
本研究将超声波微波辅助提取得到的黑豆异黄酮粗提物,分别经NKA-9、AB-8、D101、HPD100、DM301 5种大孔树脂进行静态吸附试验,结果表明AB-8树脂对黑豆异黄酮的吸附效果最佳,且最佳吸附时间为7 h。经AB-8大孔树脂动态吸附试验可知,上样液质量浓度、pH值以及上样液流速对黑豆粗黄酮的吸附率均有显著影响。通过Box-Behnken响应面法对试验条件进行进一步优化,经过修正得到最佳吸附条件为7.47 mg/mL,pH值为2.27,上样液流速2 mL/min,通过3次重复试验得到最终吸附率为91.029%。AB-8大孔树脂的动态解吸试验表明,洗脱剂体积分数为60%,用量为80 mL时,黑豆异黄酮的解吸效果最佳。本研究运用UPLC方法对黑豆异黄酮的4种标准品以及经AB-8大孔树脂纯化的提取物进行鉴定分析,结果显示,纯化后黑豆异黄酮在提取物中得到了最大限度保留,纯度可达78.56%,回收率为81.66%。表明AB-8大孔吸附树脂不仅能够有效吸附杂质,获得高纯度黑豆异黄酮,而且经济适用,因此可应用于黑豆异黄酮的纯化研究。
[1] 丛建民.黑豆的营养成分分析研究 [J].食品工业科技,2008(4):262-268.
Cong J M.Analysis of nutritional components of black beans [J].Science and Technology of Food Industry,2008(4):262-268.
[2] 李文斌.黑豆营养保健功能的研究与产品开发 [J].食品工程,2010(4):19-28.
Li W B.Study and development of nutrition and health function of black beans [J].Food Engineering,2010(4):19-28.
[3] Wu A H,Spicer D V,Pike M C.Soy isoflavones for breast cancer risk reduction-letter [J].Cancer Prevention Research,2012,5(7):984-985.DOI:10.1158/1940-6207.CAPR-12-0189.
[4] Jiao C F,Run Q Y,Yu L Z,et al.Nitric oxide mediates isoflavone accumulation and the antioxidant system enhancement in soybean sprouts [J].Food Chemistry,2016,204:1-21.
[5] 刘 葵,张恩娟.大豆异黄酮的开发及市场前景 [J].中国药房,2006,7(2):92-94.
Liu K,Zhang E J.Development and market prospects of soybean isoflavone [J].Chinese Pharmacy,2006,7(2):92-94.
[6] 李万林,钟娇娇,刘方平.大豆异黄酮的提取及其抗氧化稳定性的研究 [J].西部皮革,2014,36(6):16-21.
Li W L,Zhong J J,Liu F P.Extraction technology and antioxidation stability of soybean isoflavones [J].Westlea Ther,2014,36(6):16-21.
[7] 汪玉秀.大豆异黄酮的研究及应用 [J].西北农林科技大学学报(自然科学版),2003,31(1):113-116.
Wang Y X .The research and application of soybean isoflavones [J].Journal of Northwest A&F University(Nat Sci Ed),2003,31(1):113-116.
[8] 增祥群.葛根总黄酮提取工艺 [J].食品工业科技,2000,21(3):32-33.
Zeng X Q.Extraction technology of total flavonoids from puerarin [J].Science and Technology of Food Industry,2000,21(3):32-33.
[9] 张玉超,李 娜,乔东东,等.D-101大孔树脂分离纯化葛根异黄酮的工艺探讨 [J].西北农林科技大学学报(自然科学版),2009,37(11):161-167.
Zhang Y C,Li N,Qiao D D,et al.Study on separation and purification technology of puerarin isoflavone by D-101 macroporous resin [J].Journal of Northwest A&F University(Nat Sci Ed),2009,37(11):161-167.
[10] Ming J Y,Song C Q.A dvances of application of macroporous resin in study of tranditional Chinese herbs [J].Chin Tradit Pat Med,2001,23(12):914-917.
[11] Xiang H Y,Zhou C S,Du S L.Separation and purification of resveratrol fromPolygonumcuspidatumby macroporous adsorption resin [J].Chin Tradit Pat Med,2005,36(2):207-210.
[12] 施淑琴,施 群,钟宇森,等.筋骨草总黄酮大孔树脂吸附热力学研究 [J].中成药,2013,35(2):401-403.
Shi S Q,Shi Q,Zhong Y S,et al.Study of ajuga flavonoids by macroporous resin adsorption thermodynamics [J].Chinese Patent Medicine,2013,35(2):401-403.
[13] 张 星,刘振春,董 欣,等.黑豆异黄酮超声波微波辅助提取工艺的响应面优化 [J].西北农林科技大学学报(自然科学版),2017,45(6):185-192.
Zhang X,Liu Z C,Dong X,et al.Optimization of ultrasonic/microwave-assisted extraction of black soybean isoflavone from black soybeans by response surface methodology [J].Journal of Northwest A&F University(Nat Sci Ed),2017,45(6):185-192.
[14] 史宣明,岳 琳,武丽荣.大豆异黄酮的提取及精制 [J].中国油脂,2001,26(2):3-5.
Shi X M,Yue L,Wu L R.Extraction and purification of soybean isoflavones [J].China Oils and Fats,2001,26(2):3-5.
[15] 董玲燕,李 琳,赵 雷,等.酱油渣中大豆异黄酮的提取及纯化工艺 [J].食品科学,2012,33(14):30-35.
Dong L Y,Li L,Zhao L,et al.Extraction and purification technology of soybean isoflavone from soy sauce residue [J].Food Science,2012,33(14):30-35.
[16] 刘 莹,郁建平.大孔吸附树脂纯化葛根总黄酮的工艺条件研究 [J].山地农业生物学报,2010,29(1):56-60.
Liu Y,Yu J P.Study on the purification process of total flavonoids from puerarin by macroporous adsorption resin [J].Journal of Mountain Agriculture and Biology,2010,29(1):56-60.
[17] 袁怀波,赵国华,李洪军,等.利用大孔吸附树脂纯化葛根异黄酮的研究 [J].食品与发酵工程,2003,29(2):62-65.
Yuan H B,Zhao G H,Li H J,et al.Study on the purification of puerarin isoflavones by macroporous adsorption resin [J].Food and Fermentation Engineering,2003,29(2):62-65.
[18] 李淑珍,李 进.大孔树脂分离纯化黑果枸杞总黄酮的研究 [J].食品科学,2009,30(1):19-24.
Li S Z,Li J.Study on separation and purification of total flavonoids from Chinese wolfberry fruit with macroporous resin [J].Food Science,2009,30(1):19-24.
[19] 胡志军,郝利君,王南溪,等.D-101大孔吸附树脂分离纯化橘皮中的黄酮类物质 [J].食品科学,2010,31(8):65-69.
Hu Z J,Hao L J,Wang N X,et al.Separation and purification of flavonoids in citrus peel by macroporous resin D-101 [J].Food Science,2010,31(8):65-69.
[20] 杨 喆,万 山,张乔会,等.大孔树脂纯化山杏核壳总黄酮的工艺优化 [J].食品科学,2015,36(10):38-42.
Yang Z,Wan S,Zhang Q H,et al.Process optimization and purification of total flavonoids from apricot shell by macroporous resin [J].Food Science,2015,36(10):38-42.
[21] 贺金娜,曹 栋,史苏佳.大孔树脂纯化苹果多酚的工艺优化 [J].生产与科研经验,2014,40(5):135-141.
He J N,Cao D,Shi S J.Process optimization of macroporous resin for purification of apple polyphenols [J].Experience in Production and Scientific Research,2014,40(5):135-141.
[22] 何隽婷,梁 勇,梁 斯,等.酱油渣中大豆异黄酮的动态逆流提取及分离纯化研究 [J].华南师范大学学报(自然科学版),2010,11(4):80-86.
He J T,Liang Y,Liang S,et al.Study on dynamic countercurrent extraction and separation and purification of soybean isoflavone from soy sauce residue [J].Journal of South China Normal University(Natural Science Edition),2010,11(4):80-86.
[23] 汪海波,刘大川,佘珠花,等.大豆异黄酮类物质的提取、抗氧化性及稳定性研究 [J].食品科学,2004,25(1):111-114.
Wang H B,Liu D C,She Z H,et al.Extraction,antioxidation and stability of soybean isoflavones [J].Food Science,2004,25(1):111-114.
[24] Sun J,Sun B,Han F,et al.Rapid HPLC method for determination of 12 isoflavone components in soybean seed [J].Agricultural Sciences in China,2011,10(1):70-77.
