运动训练对大鼠脑缺血再灌注后神经细胞内质网应激的影响
2018-02-27古丽玲罗昌禄
古丽玲 王 连 罗昌禄 付 钰 陶 陶
(贵州省人民医院康复医学科,贵州 贵阳 550002)
在脑血管疾病中,缺血性脑血管病占60%~80%〔1〕。研究显示,有相当部分患者脑缺血后血管能自然再通或溶栓治疗再通,但是脑缺血再灌注损伤(CIRI)可导致缺血组织发生较血供恢复前更为严重的损伤,严重影响患者预后〔2〕。内质网应激(ERS)是一种新发现的细胞凋亡途径,在脑缺血再灌注损伤中具有重要作用,是诱导脑细胞凋亡的重要途径之一〔3〕。本研究通过建立脑缺血再灌注损伤大鼠模型,探讨运动训练对神经细胞凋亡及ERS相关信号分子葡萄糖调节蛋白(GRP)78、C/EBP同源蛋白(CHOP)和Tribbles相关蛋白(TRB)3的表达的影响。
1 材料与方法
1.1实验动物及分组 清洁级SD大鼠100只,体重180~220 g,购于贵州医科大学实验动物中心。采用随机数字表法分为正常对照组、假手术组、模型组和实验组,每组25只。
1.2主要试剂 TUNEL 细胞凋亡检测试剂盒(武汉博士德生物工程有限公司);RT-PCR试剂盒(大连宝生物公司);全蛋白提取试剂盒、Western一抗及二抗稀释液,碧云天生物技术研究所;GRP78多克隆抗体(武汉博士德生物工程有限公司);TRB3一抗(北京博奥森生物技术有限公司);CHOPⅠ抗和β-actin一抗(Santa Cruz公司);BCA蛋白定量试剂盒(北京鼎国昌盛生物技术有限责任公司);其他试剂均为分析纯国产试剂。
1.3主要仪器 超净工作台(AIRTECH,苏州净化设备有限公司),精密电子天平(Adventurer 公司,美国),紫外分光光度计(上海第三分析仪器厂),酶标仪(上海安亭科学仪器厂),RT-PCR仪(美国BIO-RAD公司),双垂直蛋白电泳仪(北京市六一仪器厂)。
1.4动物模型的构建 参考文献〔4〕,采用改良Longa线栓法制作大鼠局灶性大脑中动脉缺血再灌注损伤模型。手术前12 h禁食不禁水,麻醉(10%水合氯醛),大鼠取仰卧位,分离左侧颈总动脉及其分支颈外动脉和颈内动脉,在分支颈外动脉剪一小口经颈总动脉分叉部将鱼线插入颈内动脉至颅内,插入深度为17~18 mm,扎紧备线,完全阻断血供。30 min后轻轻提拉所留线头,使血流再通,将栓线尾部埋在皮下。术后缝合皮肤,再灌注3 d后用同样方法进行缺血及再灌注。假手术组除不插鱼线外,其余步骤同模型组。对照组不做任何处理。模型成功的标志为大鼠麻醉药醒后出现右眼Horner征和左侧以前肢为重的偏瘫。
1.5运动训练 实验组大鼠造模成功后24 h开始进行跑台训练,12 m/min,每天10 min,对照组、假手术组和手术组大鼠不做任何训练。
1.6观察指标
1.6.1TUNEL检测 造模后1、3、7、14、28 d,分别取每组5只大鼠,麻醉后处死,断头取脑,脑组织于4%多聚甲醛溶液中固定过夜,石蜡包埋,冰冻切片采用TUNEL进行细胞凋亡检测,严格按TUNEL检测试剂盒说明书操作。显微镜下红色荧光为TUNEL阳性细胞,随机选取6个不重复高倍视野(×200),计算阳性细胞凋亡指数(AI),AI=(凋亡细胞数/总细胞数)×100%。
1.6.2RT-PCR检测脑组织GRP78、CHOP和TRB3 mRNA表达水平 造模后1、3、7、14、28 d,分别取每组5只大鼠,麻醉后处死,断头取脑,Trizol法分别提取各组大鼠总RNA。总RNA采用纯化柱纯化。逆转录得cDNA,引物设计:β-actin(239 bp)上游引物:5′-GGAAGCTTGTCATCAATGG-3′,下游引物:5′-CTGTGGTCATGAGTCCTTC-3′;GRP78(499 bp)上游引物:5′-TGGAATCTTCACCTCAGAGTG-3′,下游引物:5′-ATATCCAAGGTGAACACACAC-3′;CHOP上游引物:5′-CCTCGCTCTCCAGATTCCA-3′,下游引物:5′-CTCATTCTCCTGCTCCTTCTCC-3′;TRB3上游引物:5′-TCAAGTTGCGTCGATTTGTCTTC-3′,下游引物:5′-CAGTCATCACACAGGCATCCTC-3′。应用RT-PCR检测GRP78、CHOP和TRB3 mRNA转录水平。以β-actin作为内参照,同一标本的β-actin产物表达水平校正各自目的基因的表达水平,相对表达水平=目的基因表达水平/β-actin表达水平。
1.6.3Western印迹检测脑组织GRP78、CHOP和TRB3蛋白表达水平 造模后1、3、7、14、28 d,分别取每组5只大鼠,麻醉后处死,断头取脑,切碎,用预冷的组织裂解液提取大鼠脑组织总蛋白,Bradford法测定样品的蛋白含量,12%的凝胶分离蛋白质,利用转膜仪(湿转)在100 V 1.5 h的条件下将凝胶上的蛋白转移到PVDF膜上,脱脂奶粉封闭2 h,洗膜后与稀释的GRP78、CHOP和TRB3单克隆抗体(1∶1 000)过夜结合,洗模后加入稀释的二抗,室温孵育60 min,BeyoECL Plus显色,凝胶成像和化学发光分析系统收集显色条带,运用 Quantity One 软件进行蛋白条带数据分析。
1.7统计学方法 应用SPSS18.0软件行χ2、t检验。
2 结 果
2.1运动训练对神经细胞凋亡的影响 缺血再灌注后1、3、7、14、28 d,实验组凋亡细胞数明显少于模型组(P<0.05),见图1。

与假手术组比较:1)P<0.05;与模型组比较:2)P<0.05图1 造模后1~28 d内各组大鼠神经细胞凋亡检测结果
2.2GRP78、CHOP和TRB3 mRNA表达水平 缺血再灌注后1、3、7、14、28 d,实验组和模型组GRP78、CHOP和TRB3 mRNA表达水平均显著高于假手术组(P<0.05)。缺血再灌注后3、7、14、28 d,实验组大鼠脑组织GRP78、CHOP和TRB3 mRNA表达水平显著低于模型组(P<0.05)。见表1。
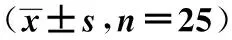
表1 造模后1~28 d内各组大鼠脑组织GRP78、CHOP和TRB3 mRNA表达水平
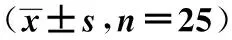
续表1 造模后1~28 d内各组大鼠脑组织GRP78、CHOP和TRB3 mRNA表达水平
与假手术组比较:1)P<0.05;与正常对照组比较:2)P<0.05;与模型组比较:3)P<0.05;下表同
2.3GRP78、CHOP和TRB3 蛋白表达水平 缺血再灌注后1、3、7、14、28 d,实验组和模型组脑组织GRP78、CHOP和TRB3 蛋白表达水平均显著高于假手术组(P<0.05)。缺血再灌注后3、7、14、28 d,实验组大鼠脑组织GRP78、CHOP和TRB3 蛋白表达水平显著低于模型组(P<0.05)。见表2。

表2 造模后1~28 d内各组大鼠脑组织GRP78、CHOP和TRB3 蛋白表达水平
3 讨 论
脑血管疾病多发于中老年人群,具有病情重、发病急、病程进展迅速及致残率、死亡率高等特点。据统计,全世界每年约有500多万人死于脑血管疾病,已经成为导致人类死亡的三大原因之一〔5〕。随着我国人口老龄化进程的加快、生活条件及饮食具有显著改善,导致脑血管疾病的发病率逐年上升,给我国医疗资源带来沉重的负担。脑血管疾病患者可表现为失语、偏瘫、共济失调,严重者会出现深度昏迷,如果得不到及时救治,会导致各种并发症发生,甚至导致患者死亡〔6〕,尤其是缺血性脑血管病缺血后血流恢复导致的脑缺血再灌注损伤对患者危害更为严重。
本研究显示,运动训练能明显抑制神经细胞凋亡。研究表明,适量的运动训练有助于恢复脑损伤的运动功能,帮助重建非损伤区功能环路,加速建立脑侧支循环,这主要是由于运动训练可改善脑血流量,促进多种神经再生相关神经生长营养因子的表达,从而起到保护神经元的作用,同时提高突触素活性,促进树突和轴突形成新的突触连接,提高神经再生能力〔7〕。廖杨平等〔8〕报道称,运动训练参与了中枢神经再生调节过程,有助于建立脑侧支循环,提高神经再生能力,最终促进中枢神经功能恢复,与本研究结果一致。
内质网是重要的细胞器之一,是蛋白质的合成、加工和运输的主要场所,同时在类固醇激素合成和脂质代谢过程中具有重要作用。在多种因素刺激下,可导致内质网生理功能紊乱,发生ERS〔9〕。长期的ERS则启动细胞凋亡。研究表明,细胞凋亡在脑缺血再灌注过程中扮有重要角色,而这一细胞凋亡过也被证实与ERS有关。GRP78是第一个被发现内质网分子伴侣,是ERS的标志性蛋白,其表达上调可减轻内质网蛋白负荷,对脑细胞具有一定的保护作用〔10〕。CHOP也是ERS经典标志物之一,其表达上调则激活细胞死亡途径,可介导细胞凋亡加重脑损伤〔11〕。TRB3蛋白是一种激酶类似蛋白,可与丝/苏氨酸蛋白激酶AKT结合,从而参与细胞凋亡过程,当发生ERS时,CHOP表达上调促进TRB3基因的表达〔12〕。本研究表明运动训练可能有助于下调脑组织GRP78、CHOP和TRB3表达水平,从而促进脑缺血再灌注后神经功能恢复。
1李锦程,武晓宁,赵海苹,等.大脑中动脉内促红细胞生成素或联合tPA注射对大鼠脑缺血再灌注的作用及机制〔J〕.首都医科大学学报,2015;36(5):699-704.
2Wu C,Liu R,Gao M,etal.Pinocembrin protects brain against ischemia/reperfusion injury by attenuating endoplasmic reticulum stress induced apoptosis〔J〕.Neurosc Lett,2013;546:57-62.
3闵鹤鸣,鲁璐清,王文娟,等.GRP78、CHOP、caspase-3和caspase-9蛋白在缺血预处理大鼠脑组织中的表达及意义〔J〕.中风与神经疾病,2012;29(8):703-6.
4赵 杰,陈怀龙,马福国,等.浅低温时脑缺血再灌注小鼠海马蛋白激酶R样内皮网激酶活性的影响〔J〕.中华麻醉学,2016;36(2):250-2.
5王 伟,孔 维,陈 萌,等.丁苯酞预处理对脑缺血再灌注大鼠内质网应激的影响〔J〕.临床神经病学杂志,2013;26(2):122-4.
6毛森林,马翊竑,张海东,等.芍药苷预处理对脑缺血再灌注损伤大鼠脑组织细胞凋亡及 CHOP 蛋白表达的影响〔J〕.山东医药,2014;54(32):14-6.
7孙竹梅,赵雅宁,陈长香,等.力竭运动预处理对全脑缺血再灌注大鼠海马区 GAP-43 与 Nogo-A 的影响〔J〕.中华行为医学与脑科学杂志,2016;25(8):682-6.
8廖杨平,程道宾,苏 丽,等.运动训练对大鼠脑缺血再灌注后神经修复及 GAP-43 和 Neurocan 表达的影响〔J〕.中风与神经疾病杂志,2011;28(4):303-6.
9黄 澈.原花青素对脑缺血再灌注后大鼠海马内质网应激相关因子GRP78,CHOP和Caspase-12表达的影响〔D〕.锦州:辽宁医学院,2012.
10Gu LL,Yang Q,Tao T,etal.Role of GRP78,CHOP and TRB3 in cerebral ischemia-reperfusion injury in rats〔J〕.Int J Clin Exp Pathol,2017;10(1):789-94.
11Ye Z,Wang N,Xia P,etal.Parecoxib suppresses CHOP and Foxo1 nuclear translocation,but increases GRP78 levels in a rat model of focal ischemia〔J〕.Neurochem Res,2013;38(4):686-93.
12Yu H,Zhang H,Zhao W,etal.Gypenoside protects against myocardial ischemia-reperfusion injury by inhibiting cardiomyocytes apoptosis via inhibition of CHOP pathway and activation of PI3K/Akt pathway in vivo and in vitro〔J〕.Cell Physiol Biochem,2016;39(1):123-36.
