Toll样受体4激活Wnt/β-catenin信号通路促进骨髓间充质干细胞增殖
2018-02-27陈文明龙仙萍赵然尊
陈文明 龙仙萍 赵然尊 石 蓓
(遵义医学院附属医院心血管内科,贵州 遵义 563000)
Toll样受体(TLR)主要在单核巨噬细胞和树突细胞等免疫细胞中表达。间充质干细胞(MSCs)表面有多种TLR表达,且TLR4配体可通过信号转导通路调控MSCs的增殖和分化〔1,2〕。TLR4通过Wnt/β-Catenin信号促进乙型肝炎病毒(HBV)相关肝癌细胞的增殖和迁移〔3〕。本研究通过内毒素脂多糖(LPS)作用骨髓间充质干细胞(BMSCs),观察TLR4能否通过调控Wnt/β-catenin信号通路促进BMSCs增殖。
1 材料与方法
1.1一般材料 6周龄SD大鼠,体重50~100 g,购自第三军医大学实验动物中心。实验试剂与仪器:LPS(购自美国Sigma-Aldrich公司);TLR4阻断剂(购自美国Abcam公司);甘油醛-3-磷酸脱氢酶(GAPDH)、β-actin、β-catenin、细胞周期蛋白(cyclin)D1和c-myc抗体及山羊抗兔二抗(均购自博奥森科技有限公司);TRIzol和PCR试剂盒(均购自日本TaKaRa公司);倒置荧光显微镜(购自日本OLYMPUS公司);凝胶成像系统和电泳仪(均购自美国BIO-RAD公司)。分为对照组 〔磷酸盐缓冲液(PBS)〕、LPS组(1.0 μg/ml)、TLR4阻断剂+LPS组(TLR4阻断剂0.5 μg/ml与细胞共同作用4 h后加入LPS 1.0 μg/ml)、Wnt信号通路抑制因子(DKK-1)+LPS组(加入DKK-1 0.1 mg/ml后,即刻加入LPS 1.0 μg/ml)各3只。
1.2方法
1.2.1BMSCs的培养和鉴定 大鼠用手术剪刀快速断颈处死,用酒精浸泡消毒,在超净工作台分离股骨和胫骨,冲出骨髓,经离心后弃上清,之后制成单细胞悬液,转移到细胞培养瓶,将细胞培养瓶置于37℃,5% CO2无菌细胞培养箱中培养,细胞培养至第3代,利用流式仪检测BMSCs表面标志物的表达〔4〕。
1.2.2CCK-8 检测 BMSCs 的增殖 根据CCK-8试剂盒检测BMSCs 的增殖能力。
1.2.3Western印迹检测BMSCs中TLR4蛋白表达 对照组和LPS组细胞培养至3 d后收集细胞,将细胞裂解,提取细胞总蛋白,然后用聚氰基丙烯酸正丁酯(BCA)法检测总蛋白浓度。配胶上样,恒压电泳后转膜(湿转),聚偏氟乙烯(PVDF)膜封闭2 h,与一抗结合(TLR4 1∶200)、4℃过夜,二抗孵育2 h,用凝胶成像系统曝光扫描,采用Quantity One定量分析软件系统对图像进行灰度测定,以目的条带和β-actin比值作为半定量依据。
1.2.4实时荧光定量(RT)-PCR检测BMSCs中β-catenin、c-myc及cyclinD1 mRNA表达 细胞放置于37℃,5% CO2无菌细胞养培箱中培养3 d,用Trizol法提取总RNA,将RNA逆转录,然后根据试剂盒说明书,进行PCR反应扩增。基因引物序列为β-catenin上游:5′-TGGTGACAGGGAAGACATCA-3′,下游:5′-CCATAGTGAAGGCGAACTGC-3′,108 bp;c-Myc上游:5′-GAGACAGATCAGCAACAACCGA-3′,下游:5′-CTGCTTGGACGGACAGGATG-3′,227 bp;Cyclind1上游:5′-TTCGTTGCCCTCTGTGCCA-3′,下游:5′-GAAGCGTGTGAGGCGGTAGTAG-3′,196 bp;β-actin上游:5′-CCACGAACTACCTTCAACTCC-3′,下游:5′-GTGATCT CCTTCTGCATCCTGT-3′,132 bp。
1.2.5Western印迹检测BMSCs中β-catenin、c-myc和cyclinD1蛋白表达 一抗浓度分别为β-catenin 1∶200、c-myc 1∶300、cyclinD1 1∶200。
1.3统计学方法 应用SPSS17.0软件进行t检验。
2 结 果
2.1BMSCs的培养与鉴定 在显微镜下见原代BMSCs呈圆形亮点状分布于培养瓶底部,P1代BMSCs呈多角形、短棒或短梭形;P2代BMSCs形态呈长梭状均匀分布;P3代BMSCs细胞体积较大,与P2代BMSCs细胞形态相似。流式细胞仪检测结果显示,BMSCs表面标志物CD29为98.6%,CD90为99.7%,CD45为2.7%。见图1。
2.2BMSCs的增殖情况 如图2所示,LPS剌激后,细胞的增殖能力得到了增强,第3天增殖最为明显,且LPS组(1.370±0.143)显著高于对照组(1.210±0.101,P<0.01)。
2.3BMSCs中β-catenin、c-myc及cyclinD1 mRNA表达情况 与对照组相比,LPS组细胞核内β-catenin mRNA、c-myc和cyclinD1 mRNA表达显著增加(P<0.01);与LPS组相比,加入TLR4阻断剂和抑制剂DDK-1后,β-catenin、c-myc、cyclinD1 mRNA表达,均显著下降(P<0.01)。见图5。
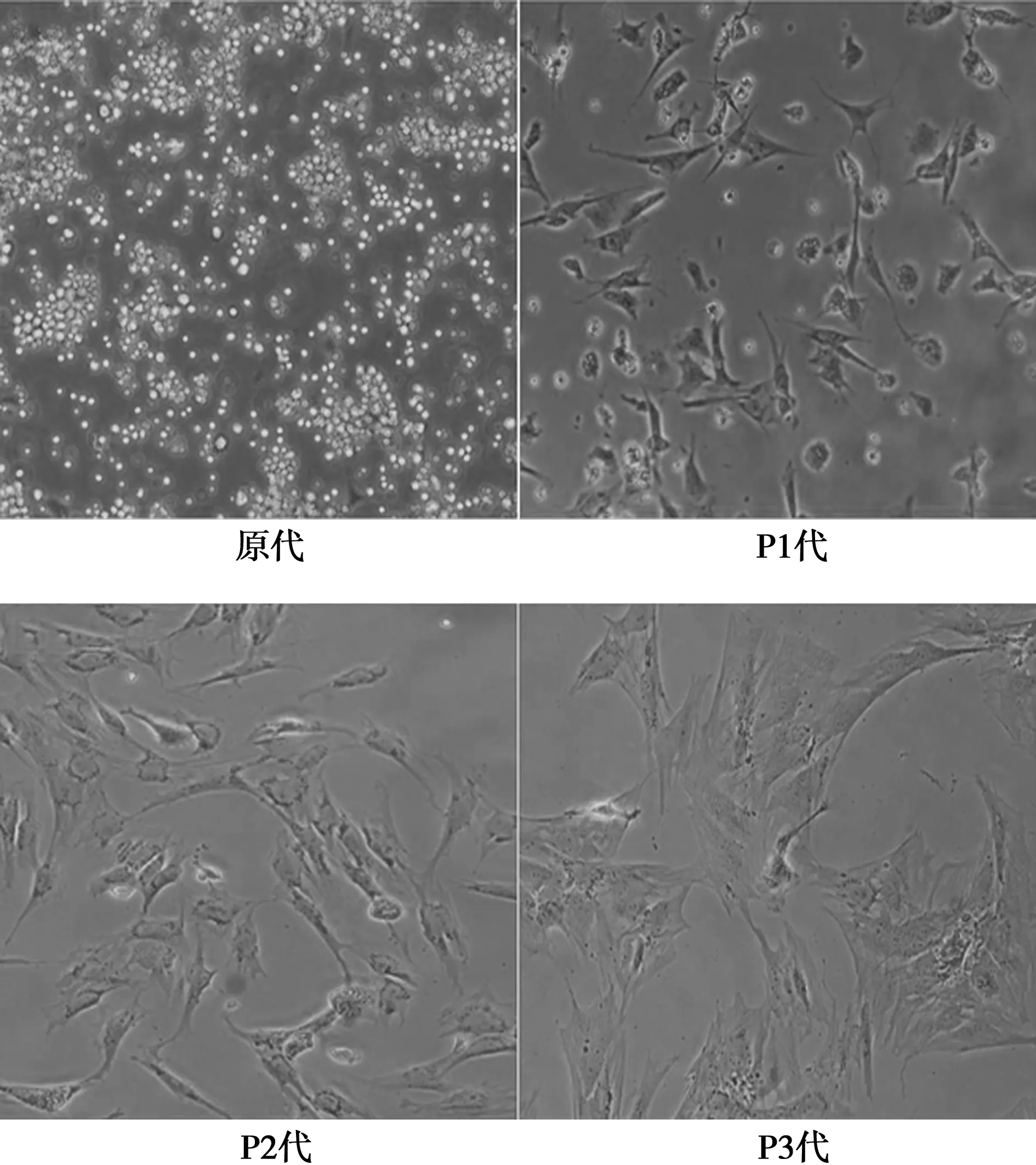
图1 BMSCs的生长情况(×100)
2.4BMSCs中cyclinD1、c-myc及β-catenin蛋白表达情况 与对照组相比,LPS组BMSCs细胞核内β-catenin蛋白表达、c-myc和cyclinD1表达明显增强(P<0.01);与LPS组相比,加入TLR4阻断剂和抑制剂DDK-1后,β-catenin、c-myc和cyclinD1表达均明显下降(P<0.01)。见图4。

图2 BMSCs增殖曲线
2.5BMSCs中TLR4蛋白表达情况 Western印迹检测结果发现,与对照组(0.445±0.031)比较,LPS组TLR4(1.088±0.097)呈现高表达(P<0.01)。见图5。

与对照组比较:1)P<0.01;与LPS组比较:2)P<0.01;下图同图3 BMSCs中β-catenin、c-myc、cyclinD mRNA表达情况
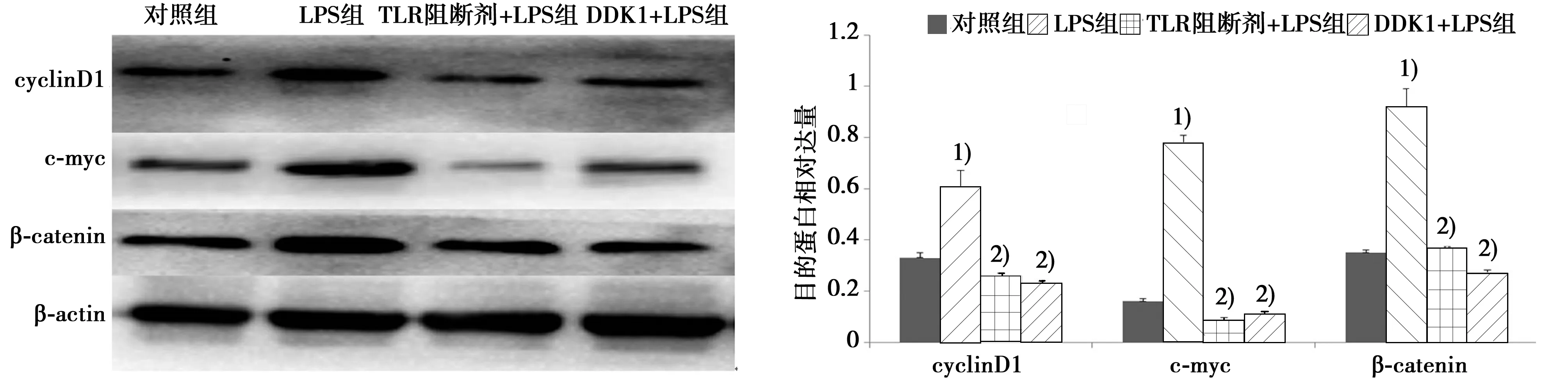
图4 BMSCs中 β-catenin、c-myc、cyclinD1蛋白表达
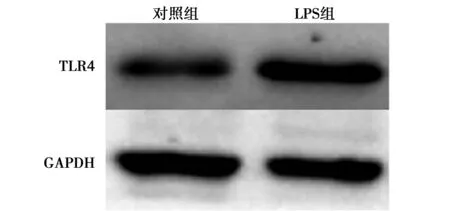
图5 BMSCs中TLR4的表达
3 讨 论
经典的 Wnt/β-catenin信号传导通路,最初由Wnt蛋白与细胞表面的Wnt蛋白受体(Frizzled proteins和LRP5/6)相结合,信号传递入胞内,稳定β-catenin,然后将稳定的β-catenin转移至细胞核中,进入细胞核后的β-catenin与淋巴增强子结合因子(Lef))或T细胞因子(Tcf))等转录因子构成转录复合物,启动增殖相关目标基因的表达,如cyclinD1、轴蛋白(axin)2、c-Myc等〔5〕。本研究结果表明,TLR4能通过Wnt/β-catenin
信号通路促进BMSCs增殖,为BMSCs临床治疗心肌梗死疾病提供了新的理论依据。
1Hua-Cho H,Bae YC,Jung JS.Role of toll-like receptors on human adipose derivedstromal cells〔J〕.Stem Cells,2006;24(12):2744-52.
2Pevsner-Fischer M,Morad V,Cohen-Sfady M,etal.Toll-like receptors and their ligands control mesenchymal stem cell functions〔J〕.Blood,2007;109(4):1422-32.
3Yin Y,Li F,Li S,etal.TLR4 influences hepatitis B virus related hepatocellular carcinoma by regulating the Wnt/β-catenin pathway〔J〕.Cell Physiol Biochem,2017;42(2):469.
4龙仙萍,邓文文,赵然尊,等.干扰Nrf2基因后骨髓间充质干细胞移植对大鼠心肌梗死后心肌凋亡的影响〔J〕.第三军医大学学报,2015;37(13):1319-24.
5Kim JH,Liu X,Wang J,etal.Wnt signaling in bone formation and its therapeutic potential for bone diseases〔J〕.Ther Adv Musculoskelet Dis,2013;5(1):13-31.
