C肽治疗对糖尿病肾病GK大鼠模型氧化应激的影响
2018-02-27罗维芸王丽娟何扬芳许世清蔡寒青
罗维芸 王丽娟 何扬芳 许世清 蔡寒青
(吉林大学第二医院内分泌科,吉林 长春 130041)
糖尿病肾病是常见的糖尿病微血管病变之一,早期表现为尿白蛋白排泄增加,最终可导致患者出现慢性肾功能不全。糖尿病肾病的发生机制十分复杂,胰岛素降糖治疗不能真正阻断其病变进展。C肽是与胰岛素等分子量合成与分泌的多肽类物质,既往认为其无明显生物学活性〔1〕。然而,早期临床观察显示,同时给予C肽和胰岛素治疗1型糖尿病患者,可降低肾小球高滤过,从而改善肾小球功能及代谢控制,而单独应用胰岛素治疗则无此作用〔2〕。在胰岛移植治疗的1型糖尿病患者中,也观察到尿蛋白排泄减少和肾功能改善〔3〕,推测与C肽有关。本文拟分析C肽治疗对糖尿病肾病GK大鼠模型氧化应激的影响。
1 材料及方法
1.1材料 8周龄SPF级GK大鼠〔上海斯莱克实验动物有限公司,合格证号:SCXK(沪)2007-0005〕及同龄雄性Wistar大鼠〔北京维通利华实验动物有限公司,合格证号:SCXK(京)2006-0009〕。主要试剂:高脂饲料(中国科学院实验动物中心);微量渗透压泵(Alzet公司,美国);大鼠C肽(Sigma公司,美国);大鼠白蛋白酶联免疫吸附(ELISA)检测试剂盒(Assaypro公司,美国);二喹啉甲酸(BCA)法蛋白测定试剂盒(碧云天公司);RNeasy总RNA提取试剂盒(Qiagen公司,德国);SYBR green PCR试剂盒(Toyobo公司,日本);电化学发光(ECL)试剂(Millipore公司,美国)。
1.2方法
1.2.1糖尿病肾病大鼠动物模型的制备 采用高脂饲料喂养GK大鼠并监测血糖,当连续3 d血糖≥16.7 mmol/L时判断为糖尿病模型建立成功。成模后的糖尿病GK大鼠继续给予正常饲料喂养持续10 w,直至测定尿蛋白≥300 mg/24 h时,判断为糖尿病肾病模型。
1.2.2实验动物分组 将15只糖尿病肾病GK大鼠随机分为3组(n=5)。C肽治疗组:在大鼠腹腔手术植入含2 ml C肽溶液的微量渗透压泵,设置50 pmol·kg-1·min-1的恒速缓慢腹腔释放,每28 d后更换1次;对照组:同样步骤植入含等量生理盐水的微量渗透压泵;胰岛素治疗组:予甘精胰岛素2.5 IU,皮下注射1次/d。正常组(n=5)为同龄正常饲养Wistar大鼠;各组均治疗16 w。
1.2.3功能评价
1.2.3.1血糖、24 h尿蛋白及24 h尿白蛋白定量 治疗前及治疗后1次/4 w分别测定大鼠尾静脉空腹血糖;治疗前及治疗后每4 w将大鼠置于代谢笼收集24 h尿,分别用ELISA法测定24 h尿蛋白(BCA法蛋白测定试剂盒)及24 h尿白蛋白(大鼠白蛋白ELISA检测试剂盒)。
1.2.3.2肾脏病理改变 治疗结束后处死动物,生理盐水灌洗后获取肾脏,其中部分肾组织置于10%中性甲醛固定,石蜡包埋并制备病理切片;部分肾组织以2.5%戊二醛固定,制作透射电镜标本;其余肾组织取肾皮质部分物理研磨,收集经100目金属筛网滤过的细胞悬液,4℃低温离心,再经M199溶液重悬沉淀后过300目金属筛网,收集获得肾小球。
1.2.3.3免疫组化 石蜡切片经常规脱蜡、脱水、热修复后,先以3%H2O2封闭,再分别与一抗羊抗人超氧化物歧化酶(SOD)-1抗体(1∶800)、兔抗小鼠诱导型一氧化氮合酶(iNOS)抗体(1∶800),4℃孵育过夜。次日分别加入二抗辣根过氧化物酶标记的兔抗羊IgG或羊抗兔IgG抗体,于37℃条件下孵育反应30 min。最后再以二氨基联苯胺(DAB)显色,苏木素复染后封片镜检。
1.2.3.4实时定量(RT)-PCR 应用RNeasy总RNA提取试剂盒和逆转录试剂盒分别进行各组肾小球总RNA的提取和逆转录。采用SYBR green PCR试剂盒,应用ABI PRISM 7300序列检测系统经两步法进行目的基因的PCR扩增,PCR引物序列详。SOD :上游:5′-GGTTCACCGCTTGCCTTCT-3′,下游:5′-TTGCACCTTCGTTTCCTG-3′,长度176 bp;iNOS:上游:5′-CACCTTGGAGTTCACCCAGT-3′,下游:5′-ACCACTCGTACTTGGGATGC-3′,长度170 bp;β-actin:上游:5′-GACATCCGTAAAGACCTCTATGCC-3′,下游:5′-ATAGAGCCACCAATCCACACAGAG-3′,长度173 bp。以2-ΔΔCt法半定量分析各组肾小球组织SOD基因及iNOS基因在mRNA水平表达的差异。
1.2.3.5Wester印迹 提取各组糖尿病肾病大鼠肾小球总蛋白,分别取各组30 μg总蛋白行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜后封闭、洗膜,分别加入羊抗人SOD-1抗体(1∶200)、兔抗小鼠iNOS抗体(1∶800)及小鼠抗大鼠β-actin单克隆抗体(0.5 μg/ml),4℃下杂交反应过夜。次日洗膜后用辣根过氧化物酶标记的兔抗羊IgG(1∶15 000)、羊抗兔lgG(1∶15 000)或羊抗小鼠IgG(0.25 μg/ml)分别进行二抗杂交。最后使用ECL试剂显色,暗室曝光成像。
1.3统计学方法 应用SPSS13.0软件进行单因素方差分析。
2 结 果
2.1各组血糖、24 h尿蛋白定量及24 h尿白蛋白定量比较 治疗后胰岛素治疗组血糖显著下降(P<0.05),与对照组相比差异有统计学意义(P<0.01),C肽治疗组血糖无显著下降,与对照组相比差异无统计学意义(P>0.05);C肽治疗组24 h尿蛋白及24 h尿白蛋白均显著减少(P<0.01),胰岛素治疗组无明显降低,C肽治疗组明显优于胰岛素治疗组(P<0.01)。见图1。
2.2各组肾小球PAS染色及投射电子显微镜下肾小球形态学改变 光镜下肾脏PAS染色显示:正常组大鼠肾小球毛细血管袢薄而清晰;对照组肾小球系膜细胞增生,基底膜明显增厚,毛细血管袢有大量不规则、结节状PAS阳性物质沉积,肾小球球囊间隙明显变窄,部分几乎消失;C肽治疗组肾小球毛细血管袢则较规则、清晰,PAS阳性物质沉积较少,肾小球囊间隙存在;胰岛素治疗组的肾小球硬化与对照组相近。电镜下,与正常大鼠肾脏相比,对照组大鼠基底膜明显增厚,系膜区基质增多,足细胞排列不规则,部分足突缺失或融合;C肽治疗组基底膜增厚改变较轻,足细胞的形态和排列紊乱也较轻,均明显优于胰岛素治疗组。见图2。
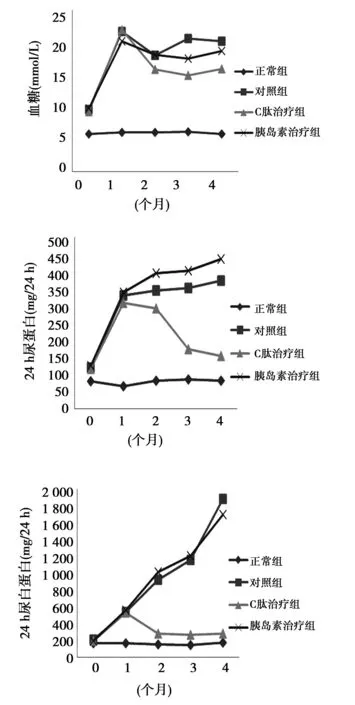
图1 各组血糖、24 h尿蛋白及24 h尿白蛋白比较
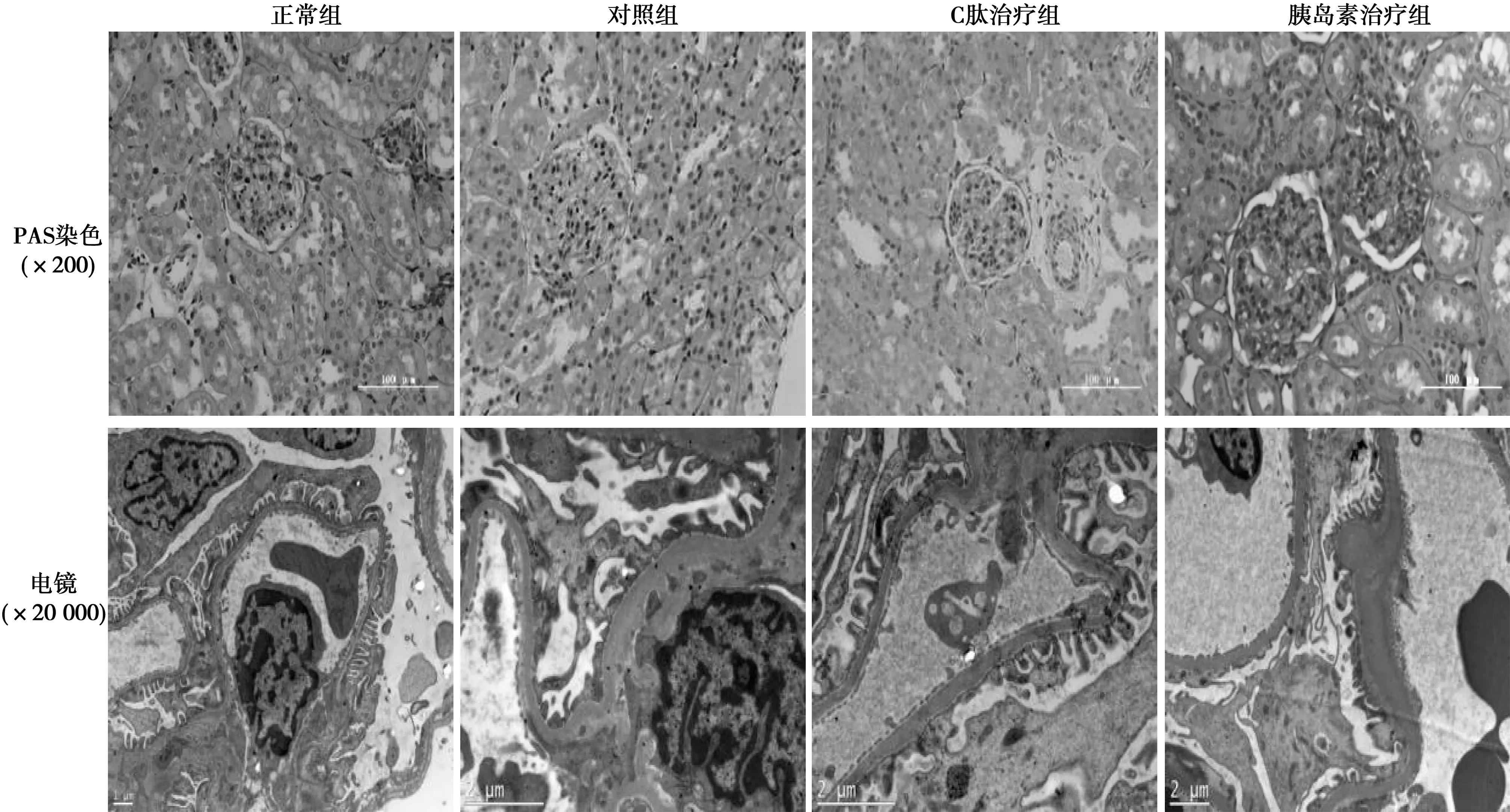
图2 各治疗组肾小球基底膜的病理改变

图3 各组肾小球SOD与iNOS表达的差异(×400)
2.3免疫组化染色结果 如图3针对SOD的免疫组化染色显示,正常组大鼠肾脏染色浓集,肾小球系膜细胞可见棕黄色阳性染色;对照组大鼠肾小球阳性染色明显减少,而C肽治疗组肾小球系膜细胞的阳性染色较胰岛素治疗组及对照组明显增多。针对iNOS的免疫组化染色显示,相对于正常组大鼠肾小球,对照组肾小球与活性氧(ROS)产生过多相关的iNOS表达上调,C肽治疗显著下调糖尿病肾病大鼠肾小球iNOS的表达;胰岛素治疗也可以部分降低iNOS在肾小球的表达。
2.4RT-PCR和Wester印迹方法检测肾小球SOD及iNOS mRNA、蛋白表达 RT-PCR结果显示,正常组设为1,对照组肾小球iNOS mRNA表达上调5.09倍,SOD表达降低65%(P<0.05);C肽治疗组显著下调iNOS mRNA表达至正常大鼠的1.57倍,升高SOD
mRNA表达至正常大鼠的82%(P<0.05);胰岛素治疗组也可以部分降低iNOS mRNA在肾小球的表达至正常大鼠的3.5倍(P<0.05),但对SOD mRNA在肾小球的表达(0.76)无明显影响(P>0.05)。Western 印迹检测各组蛋白水平见图4。
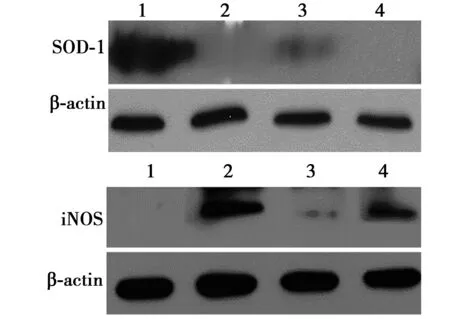
1~4:正常组,对照组,C肽治疗组,胰岛素治疗组图4 各组SOD及iNOS在mRNA与蛋白水平的表达差异
3 讨 论
近年来研究显示,C肽可能具有防治糖尿病微血管病变的作用和应用价值〔3〕,其中在防治糖尿病肾病方面,有动物实验发现C肽治疗1型糖尿病大鼠可降低肾小球高滤过和尿蛋白漏出〔4〕。C肽治疗还能抑制糖尿病大鼠的Ⅳ型胶原合成,从而减缓细胞外基质增生并抑制肾小球增生〔5〕。在体外培养的肾脏微血管内皮细胞,C肽可阻断高糖诱导的ROS产生〔6〕。本研究提示C肽治疗降低尿蛋白排泄的作用独立于降糖作用之外。
氧化应激被认为是糖尿病肾病发生的重要环节,也是糖尿病肾损伤的诱发因素。氧化应激是由ROS和高血糖的氮元素产生,可以引起基因表达的异常、信号转导的改变及诱导糖尿病肾病发展途径的激活〔7〕。研究显示多种分子途径参与糖尿病肾病的发生和发展〔8〕。这些途径包括蛋白激(PK)C、多元醇和己糖胺通路的激活及转化生长因子(TGF)β的增加,其他途径还包括MAPK通路的活化,晚期糖基化终产物(AGEs)的增加,内皮素受体的激活及信号通路和表观遗传学机制。此外,大量的研究数据表明抗氧化剂对于糖尿病并发症(包括糖尿病肾病)的进展有潜在的预防作用,如维生素E、α-硫辛酸、N-乙酰半胱氨酸等〔9~12〕。本研究结果提示C肽治疗可能通过抑制氧化应激而减缓糖尿病肾病病变进展,改善肾小球基底膜增厚等结构异常,并减少尿蛋白排泄,达到防治糖尿病肾病的作用。
1Johansson BL,Kernell A,Sjoberg S,etal.Influence of combined C-peptide and insulin administration on renal function and metabolic control in diabetes type 1〔J〕.J Clin Endocrinol Metab,1993;77(4):976-81.
2Boggi U,Vistoli F,Amorese G,etal.Results of pancreas transplantation alone with special attention to native kidney function and proteinuria in type 1 diabetes patients〔J〕.Rev Diabet Stud,2011;8(2):259-67.
3Cantarovich D,Perrone V.Pancreas transplant as treatment to arrest renal function decline in patients with type 1 diabetes and proteinuria〔J〕.Semin Nephrol,2012;32(5):432-6.
4Nakamoto H,Kajiya F.In vivo quantitative visualization analysis of the effect of C-peptide on glomerular hyperfiltration in diabetic rats by using multiphoton microscopy〔J〕.Microcirculation,2013;20(5):425-33.
5Sun W,Gao X,Zhao X,etal.Beneficial effects of C-peptide on renal morphology in diabetic rats〔J〕.Acta Biochim Biophys Sin,2010;42(12):893-9.
6Vejandla H,Hollander JM,Kothur A,etal.C-peptide reduces mitochondrial superoxide generation by restoring complex I activity in high glucose-exposed renal microvascular endothelial cells〔J〕.ISRN Endocrinol,2012;2012:162802.
7Arora MK,Singh UK.Oxidative stress:meeting multiple targets in pathogenesis of diabetic nephropathy〔J〕.Curr Drug Targets,2014;15(5):531-8.
8Usuelli V,La Rocca E.Novel therapeutic approaches for diabetic nephropathy and retinopathy〔J〕.Pharmacol Res,2015;98:39-44.
9Evans JL,Goldfine ID,Maddux BA,etal.Oxidative stress and stress-activated signaling pathways:a unifying hypothesis of type 2 diabetes〔J〕.Endocr Rev,2002;23(5):599-622.
10King GL,Loeken MR.Hyperglycemia-induced oxidative stress in diabetic complications〔J〕.Histochem Cell Biol,2004;122(4):333-8.
11Pennathur S,Heinecke JW.Mechanisms for oxidative stress in diabetic cardiovascular disease〔J〕.Antioxid Redox Signal,2007;9(7):955-69.
12Giacco F,Brownlee M.Oxidative stress and diabetic complications〔J〕.Circ Res,2010;107(9):1058-70.
