不同剂量右美托咪定对大鼠脑缺血再灌注损伤脑组织TNF-α、IL-1β及ICAM-1表达的影响
2018-02-27方洁
方 洁
(河南中医药大学第一附属医院麻醉科,河南 郑州 450000)
脑部对缺血缺氧敏感性高,缺血后再灌注导致脑部出现严重的不可逆损伤,同时多种高危风险手术潜在发生脑缺血的风险,脑部病变位置易发生炎症、神经元变性和氧化应激等,这是导致患者死亡的重要原因〔1〕。目前临床上常采用再灌注疗法,通过血液再灌注使脑组织的缺血缺氧部位代谢恢复正常,同时加速代谢产物的清除速度,但是治疗窗窄,仅有一小部分患者适用此法〔2〕。近几年研究发现〔3,4〕,右美托咪定(DEX)对于脑缺血再灌注损伤的脑组织具有保护作用,不仅能够降低儿茶酚胺的生成量,而且能够下调兴奋性神经递质谷氨酸的释放量。临床上对于DEX治疗脑缺血再灌注损伤的作用机制研究较多,但是具体的用药剂量及是否存在剂量依赖性尚未明确。本研究通过不同剂量的DEX干预脑缺血再灌注大鼠血清及脑组织中相关因子水平变化。
1 材料与方法
1.1实验动物及分组 SPF级健康SD大鼠60只,雌雄各半,周龄7~10 w,体重220~250 g,由郑州大学实验动物中心提供,饲养于洁净级环境中,自由饮食,饲养室温度(23±2)℃,相对湿度55%~60%,换气8~12次/h,保持光线每隔12 h交替,实验前适应性饲养7 d。按照随机数字表法。将大鼠分为假手术组(Sham组)、缺血再灌注组(I/R组)、低剂量DEX组、中剂量DEX组和高剂量DEX组,每组12只。
1.2造模及给药方法 造模方法参考Longa等〔5〕记载的大鼠大脑中动脉阻塞缺血再灌注模型。试验前用3.6%水合氯醛腹腔注射10 ml/kg进行麻醉,将大鼠仰卧位固定四肢,切开颈部右侧正中皮肤,做一2~3 cm的切口,使得右侧颈总动脉充分暴露,钝性分离颈内动脉和颈外动脉至分叉处,并用眼科剪子细分离周边组织,同时避免损伤迷走神经和气管,使用3号线结扎颈总动脉和颈外动脉,在颈总动脉处用2 ml注射器扎一小孔,使用3-0尼龙线从小孔插入颈内动脉约18 mm,轻微感到阻力后,将颈内静脉结扎并固定尼龙线,在颈中动脉外置留0.5 cm尼龙线,从而阻断右大脑中动脉入口,使得大脑右侧中动脉供血区形成缺血区域,阻断2 h后拔出线栓进行再灌注,逐层缝合皮下组织和皮肤,脑缺血再灌注模型造模完毕。造模成功的标志为阻断血流成功1 min后,大鼠瞳孔扩大,颜色苍白,呼吸速度加快,恢复血流灌注后,瞳孔颜色恢复为鲜红色。Sham组大鼠只进行分离血管,并不插线栓,术中持续静脉泵入生理盐水2 h,速度2 ml/h;I/R组大鼠造模完毕后持续静脉泵入生理盐水2 h,速度2 ml/h;DEX组中DEX均使用生理盐水稀释,低剂量DEX组大鼠造模完毕后,首次静脉输注6 μg/kg DEX,10 min内完成,同时剩余的DEX以0.05 μg·kg-1· min-1速度持续静脉泵注2 h,输注速度为2 ml/h;中剂量DEX组大鼠造模完毕后,首次静脉输注60 μg/kg DEX,10 min内完成,同时剩余的DEX以0.5 μg·kg-1· min-1速度持续静脉泵注2 h,输注速度为2 ml/h;高剂量DEX组大鼠造模完毕后,首次静脉输注600 μg/kg DEX,10 min内完成,同时剩余的DEX以5.00 μg·kg-1· min-1速度持续静脉泵注2 h,输注速度为2 ml/h。
1.3观察指标 造模结束后,评估各组大鼠神经功能缺损程度。各组大鼠在脑缺血再灌注24 h后进行麻醉,从右心室采血3 ml,置于未涂肝素钠的离心管中,立即离心,3 500 r/min离心10 min,取上清液,置于-20℃冰箱中待测,采用酶联免疫吸附法(ELISA)检测血清中肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β及细胞间黏附分子(ICAM)-1的表达水平,试剂盒由美国R&D公司提供,严格按照说明书进行操作。另外,麻醉后断头去脑,置于-80℃冰箱中,除去小脑及脑干等位置,剩余部分采用冠状位切片,从额极向后切片,厚度为2 μm,应用双氧水处理10 min,然后使用非免疫血清封闭15 min,加入兔抗鼠一抗(购自武汉博士德生物工程有限公司),在室温下过夜反应,接着使用PBS洗脱,避光条件下,采用DAB(北京中杉金桥生物技术有限公司)进行显色,使用光镜观察。放大200倍,应用MAS2图像分析系统对脑组织中TNF-α、IL-1β及ICAM-1在单位视野中表达阳性的积分光密度。另外将部分脑片置于2% 2,3,5-三苯基氯化四氮唑(TTC)溶液中,37℃避光孵育30 min,孵化结束后照相,使用AutoCAD软件计算染色结果,统计梗死区域面积。
1.4神经功能评分标准〔6〕在大鼠清醒后,对神经功能缺损程度进行评估,共分为五个等级:0分,神经功能无缺损;1分,左前爪不能伸直;2分,行动过程中向左侧旋转;3分,行动过程中身体向左侧倾斜;4分,自主行动能力和意识丧失。
1.5统计学方法 应用SPSS19.0软件行t检验。
2 结 果
2.1各组神经功能评分和梗死区域面积比较 造模大鼠均出现了一定程度的神经功能缺损和梗死面积。与Sham组相比,其他各组大鼠神经功能评分及梗死面积均明显更高,同时高、中、低剂量DEX组大鼠神经功能评分及梗死面积均显著低于I/R组(P<0.05),不同剂量DEX组大鼠神经功能评分及梗死面积之间的差异无统计学意义(P>0.05)。见表1。

表1 各组神经功能评分和梗死区域面积比较
与Sham组相比:1)P<0.05;与I/R组相比:2)P<0.05,下表同
2.2各组血清中TNF-α、IL-1β及ICAM-1表达水平比较 与Sham组相比,其他各组大鼠血清中TNF-α、IL-1β及ICAM-1表达水平均明显升高(P<0.05);与I/R组相比,高、中、低剂量DEX组大鼠血清中TNF-α、IL-1β及ICAM-1表达水平显著降低(P<0.05),不同剂量DEX组大鼠血清中各检测指标之间差异无统计学意义(P>0.05)。见表2。
2.3各组脑组织中TNF-α、IL-1β及ICAM-1表达水平比较 其他各组大鼠脑组织中TNF-α、IL-1β及ICAM-1表达水平均明显高于Sham组,同时高、中、低剂量DEX组大鼠血清中TNF-α、IL-1β及ICAM-1表达水平显均著低于I/R组(P<0.05),但是不同剂量DEX组大鼠血清中各检测指标之间差异无统计学意义(P>0.05)。见表3。
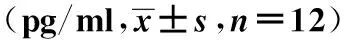
表2 各组大鼠血清中TNF-α、IL-1β及ICAM-1表达水平对比
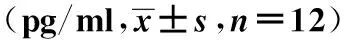
表3 各组脑组织中TNF-α、IL-1β及ICAM-1表达水平比较
3 讨 论
临床脑缺血再灌注损伤患者发生危急症状时,即使得到有效的治疗后,患者依然存在意识障碍,可导致患者心肺衰竭,甚至成为植物人,这些均是由脑缺血再灌注损伤所致。脑缺血再灌注损伤作为一个十分复杂的病理过程,其中多种因素参与其中,包括炎症反应、兴奋性神经毒性、自由基损伤、Ca2+超载及膜脂质过氧化等,其中炎症反应是造成脑缺血再灌注损伤的重要原因〔7〕。炎症反应是机体对抗外界危险因素和维持内环境稳定的保护机制,同时又可能导致机体损伤,血脑屏障通透性增加后,大量的炎性因子通过血脑屏障加重脑缺血程度〔8〕。另外有研究证实,患者一旦出现脑缺血,体内的炎性反应能够导致脑组织发生继发性损伤,在此基础上,多种因素的相互作用,诱发缺血再灌注损伤〔9〕。本研究说明脑缺血再灌注大鼠血清和脑组织中炎性反应增强,TNF-α作为重要的炎性因子,具有多种生物活性物质,如炎症反应及免疫反应,机体在正常状态时,TNF-α具有抗感染和加速组织修复的功能,但是机体处理病理状态时会促进组织损伤,TNF-α能够上调一氧化氮合酶的表达量,从而产生大量的一氧化氮,促进氧自由基生成,同时还能促进兴奋性氨基酸的释放,另外能破坏血脑屏障,加速炎性因子进入血液中,导致脑细胞损伤〔10〕。IL-1β是触发炎性反应的重要介质之一,能够通过促进白细胞和内皮细胞发生黏附而诱发炎症反应,而且还可以协同细胞因子激活淋巴细胞,另外能诱导其他炎性因子的释放,最终致使神经元损伤〔11〕。ICAM-1是黏附分子免疫球蛋白超家族成员之一,主要分布在内皮细胞、淋巴细胞及中性粒细胞表面,机体处于正常状态时,ICAM-1表达水平低,但是血管内皮细胞出现损伤后,分泌大量的ICAM-1,其能够加速中性粒细胞和内皮细胞聚集,并释放氧自由基〔12〕。DEX作为这一种高选择性α2-肾上腺素能受体激动剂,对α2受体的敏感性是α1的1 620倍,同时也是可乐定的8倍,半衰期比可乐定短,药代动力学的预测性强于可乐定,2009年我国食品药品监督管理总局批准应用于临床麻醉诱导、镇静及抗焦虑等,广泛应用于临床,但是并未对DEX的具体用量进行严格规定。本研究提示DEX能够有效改善脑缺血再灌注损伤大鼠血清及脑组织中的相关指标。DEX发挥药理作用主要有以下三个机制:①抑制中枢交感神经活性,提高脑部供血量和供氧量,改善脑部缺血区域血流灌注状态,抑制神经细胞凋亡,发挥神经保护的功能;②升高血管内Ca2+浓度,降低谷氨酸水平,避免神经中毒;③降低儿茶酚胺的释放量,降低炎症损伤程度,保护神经元。本研究结果提示不同剂量的DEX治疗脑缺血再灌注损伤并无显著的剂量关系,临床上可以选择较低的剂量进行治疗,从而降低药物不良反应。
1毕江江,王金韬,罗爱林,等.右美托咪定改善大鼠脑缺血再灌注后认知功能障碍〔J〕.神经损伤与功能重建,2016;11(3):189-91.
2Yuan W,Chen Q,Zeng J,etal.3′-Daidzein sulfonate sodium improves mitochondrial functions after cerebral ischemia/reperfusion injury〔J〕.Neural Regen Res,2017;12(2):235-41.
3赵丽佳,岳子勇,公维东,等.右美托咪定的临床麻醉应用进展〔J〕.现代生物医学进展,2015;15(6):1178-81.
4郭培培,吴会生,严 虹,等.右美托咪定对大鼠全脑缺血再灌注时氧化应激反应的影响〔J〕.中华麻醉学杂志,2015;35(3):377-9.
5Longa EZ,Weinstein PR,Carlson S,etal.Reversible middle cerebral artery occlusion without craniectomy in rats〔J〕.Stroke,1989;20(1):84-91.
6刘付宁,纪风涛,何惠燕,等.右美托咪定对大鼠脑缺血再灌注损伤后星形胶质细胞的影响〔J〕.中国病理生理杂志,2012;28(10):1751-5.
7陈兴泳,张 旭,雷惠新,等.RNA干扰免疫蛋白酶体对大鼠脑缺血再灌注神经炎症反应的影响〔J〕.中国临床药理学杂志,2015;31(19):1943-5,1967.
8支中文,杨 龙,杜 波,等.Necrostatin-1对大鼠脑缺血再灌注损伤后小胶质细胞和炎症因子的影响〔J〕.中华神经医学杂志,2015;14(8):757-63.
9Li X,Su L,Zhang X,etal.Ulinastatin downregulates TLR4 and NF-kB expression and protects mouse brains against ischemia/reperfusion injury〔J〕.Neurol Res,2017;39(4):367-73.
10井 欢,于 丹,高 原,等.眼针与体针对急性脑缺血再灌注损伤大鼠脑组织TNF-α表达的差异研究〔J〕.中国生化药物杂志,2014;35(1):22-5.
11Nia AM,Kalantaripour TP,Basiri M,etal.Nepeta dschuparensis bornm extract moderates COX-2 and IL-1β proteins in a rat model of cerebral ischemia〔J〕.Iran J Med Sci,2017;42(2):179-86.
12曾晶晶,任 迪,陆俊福,等.右美托咪定联合乌司他丁治疗大鼠缺血再灌注所致急性肺损伤〔J〕.实用医学杂志,2016;32(13):2112-5.
