下调雄激素受体表达对不同类型老年宫颈癌患者癌细胞活性的影响
2018-02-27杨文冯文
杨 文 冯 文
(徐州医科大学附属连云港医院 连云港市第一人民医院妇产科,江苏 连云港 222000)
宫颈癌多发于绝经后的老年女性,高危型人乳头瘤病毒(HPV)长期感染是宫颈癌发生的必要因素〔1〕。相关研究显示,高危型HPV诱发宫颈癌上皮细胞恶性转变中雄激素可能发挥协同、促进作用〔2〕,而G蛋白耦联受体(Cpr)30可参与介导雄激素的快速基因组转录反应,其作用机制可能与Cpr30/Tlr3信号通路有关〔3〕。雌激素在宫颈癌发病机制中的作用已得到证实,但其中非激素依赖性的发生无法通过雌激素/雌激素受体通路加以解释〔4〕。相关研究显示,前列腺癌、乳腺癌等恶性肿瘤中,雄激素受体(AR)高表达与病情进展有明显关联〔5〕。本研究选取C33a细胞为宫颈腺癌体外模型,Caski细胞为Ⅱ型宫颈鳞癌体外模型,以AR为靶点构建小干扰RNA(siRNA),慢病毒为载体转染细胞株,检测细胞凋亡情况,并探讨其可能作用机制。
1 资料与方法
1.1材料与试剂 人宫颈腺癌细胞系C33a、宫颈鳞癌细胞系Caski均购于上海素尔生物科技有限公司,主要试剂:DMEM细胞培养基、胰蛋白酶、Trizol试剂盒购于无锡市赛尔百灵生物技术有限公司;逆转录试剂盒、荧光定量PCR试剂盒购于北京瑞尔欣德科技有限公司;AR抗体、带荧光蛋白的慢病毒AR siRNA载体购于杭州华安生物技术有限公司。
1.2细胞培养与转染 C33a、Caski细胞分布置于含10%胎牛血清、100 U/ml青霉素及链霉素的DMEM培养基中,放入37℃ 5%CO2浓度的培养箱中孵育。用慢病毒AR siRNA载体转染上述细胞株进行预实验,选取最佳培养条件和感染复数(MOI)值,转染72 h后荧光显微镜下评定转染效率,荧光率>80%者可进行正式实验,分为3组:AR干扰组(转染AR基因慢病毒干扰载体),阴性对照组(转染AR基因阴性慢病毒载体),空白对照组(仅加入正常培养基)。转染后均按原培养方案继续培养,每组均分为两份,分别用于RNA、蛋白提取。
1.3荧光定量PCR检测AR mRNA表达情况 Trizol试剂盒提取细胞总RNA,测定浓度和纯度,逆转录得到cDNA,使用SYBR GreenⅠMaster试剂进行荧光定量PCR检测,引物序列如下:AR上游:5′-TGGCRCRCRAACAACAAC-3′,下游:5′-GTAGGTGTGCGAGACGTC-3′;三磷酸甘油醛脱氢酶(GAPDH)上游:5′-CGTGGCAGTTCCGACTCT-3′,下游:5′-ACCACT TCGCGGT CAGCC-3′。反应条件:95℃ 5 s,95℃ 10 s,60℃ 5 s,72℃ 10 s,共40个循环。在每次延伸阶段测吸光度值,双标准曲线法得出目的基因相对表达量。
1.4Western印迹检测AR蛋白表达情况 蛋白裂解液提取细胞总蛋白,取上清测定蛋白浓度。取50 μg总蛋白,行10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,湿法转移到聚偏氟乙烯(PVDF)膜,脱脂奶粉封闭后,加入兔抗人AR抗体(1∶500),鼠源性β-actin单抗(1∶1 000)为内参,4℃培养过夜,加入辣根过氧化物酶(HRP)标记的二抗,培养4 h,电化学发光法(ECL)显色,避光环境下显影、定影,分析各条带灰度值。
1.5细胞凋亡情况检测 Annexin染色法检测各组细胞凋亡情况,收集AR干扰组和阴性对照组细胞,磷酸缓冲液洗涤后,加缓冲液制成密度为1×105的细胞悬液;向流式细胞仪上样管中加入100 μl细胞悬液,滴加染料混合均匀,室温下暗室中静置30 min,分别滴加500 μl缓冲液,60 min内使用流式细胞仪进行检测。
1.6Cpr30 mRNA和蛋白表达情况检查 RT-PCR检测Cpr30 mRNA表达情况:提取3组细胞总RNA,逆转录得到cDNA,进行PCR扩增。反应体系30 μl。扩增条件同1.3,共40个循环;取扩增产物行琼脂糖凝胶电泳,成像系统分析条带灰度值,计算相对表达量。Western印迹检测Cpr30蛋白表达情况:蛋白裂解液提取3组细胞总蛋白,行10% SDS-PAGE电泳,蛋白质湿法转移,免疫检测,电化学显影,软件分析各条带灰度值。
1.7统计学方法 应用SPSS20.0软件进行t检验。
2 结 果
2.1各组AR mRNA及其蛋白表达情况 AR干扰组C33a、Caski AR mRNA及其蛋白的相对表达量较阴性对照组、空白对照组明显降低(P<0.05);阴性对照组与空白对照组C33a、Caski AR mRNA及其蛋白的相对表达量差异无统计学意义(P>0.05)。见表1,图1。

表1 各组宫颈癌细胞AR mRNA及其蛋白相对表达量
与AR干扰组比较:1)P<0.05

1为空白对照组;2 为AR干扰组;3为阴性对照组;下图同图1 各组宫颈癌细胞AR蛋白表达水平
2.2下调AR表达对各组宫颈癌细胞凋亡的影响 AR干扰组C33a、Caski凋亡率较阴性对照组和空白对照组明显增加(P<0.05);而阴性对照组与空白对照组C33a、Caski凋亡率差异无统计学意义(P>0.05)。AR干扰组内比较显示,C33a凋亡率明显大于Caski凋亡率(P<0.05)。见表2。

表2 各组宫颈癌细胞凋亡情况
与AR干扰组比较:1)P<0.05;与同组Caski细胞比较:2)P<0.05
2.3各组细胞中Cpr30 mRNA及其蛋白表达情况 AR干扰组Cpr30 mRNA及其蛋白相对表达量均明显高于阴性对照组和空白对照组(P<0.05);而阴性对照组与空白对照组Cpr30 mRNA及其蛋白相对表达量差异无统计学意义(P>0.05)。见表3,图2。

表3 各组细胞中Cpr30 mRNA及其蛋白相对表达量
与AR干扰组比较:1)P<0.05
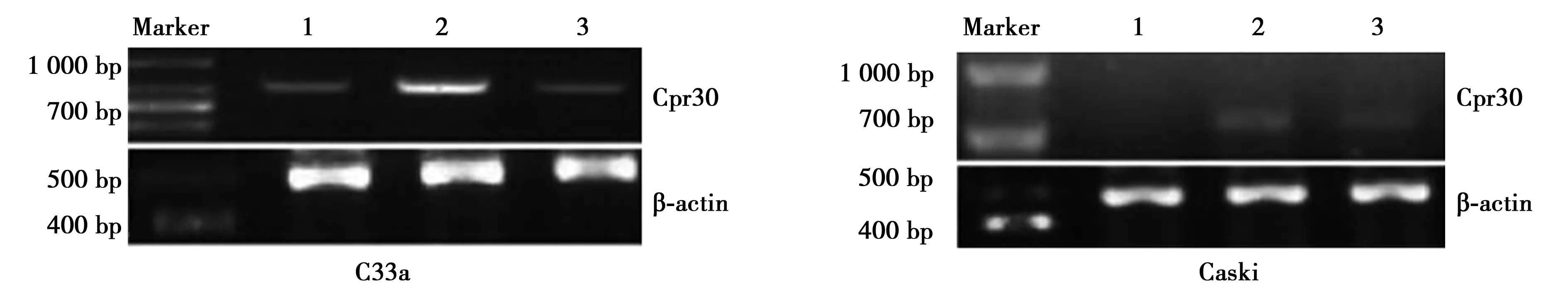
图2 各组C33a细胞、Caski细胞中Cpr30 mRNA表达情况
3 讨 论
宫颈癌的发生与发展是一个多因素调控的复杂过程,涉及抑癌基因、促癌基因、转录信号等多种信号通路途径〔6〕。在前列腺癌、乳腺癌、卵巢癌、胃癌等多种恶性肿瘤中AR基因的高表达与病情进展和预后存在明显关联,AR基因已受到肿瘤基础研究领域的广泛关注,有望成为生殖道恶性肿瘤治疗的新靶点。Cpr30与相应配体相互结合后可有效活化表皮生长因子受体(EGFR)、细胞外信号调节蛋白激酶(ERK)、丝裂原活化蛋白激酶(MAPK)等信号激酶,提升环磷酸腺苷(cAMP)、钙离子浓度,激活相应的信号传导通路,使雌激素敏感器官出现增殖反应〔7〕。Cpr30水平提升与卵巢癌、乳腺癌的发生发展有明显关联〔8〕。而AR表达改变对Cpr30水平的影响目前仍未见系统研究报道。本研究结果提示下调AR表达可提升Cpr30表达水平,进而激活Cpr30/Tlr3信号通路,促进宫颈癌细胞凋亡。
1Hariri-Tabrizi S,Aghamiri SM,Farzaneh F,etal.The use of optical spectro scopy for in vivo detection of cervical pre-cancer〔J〕.Lasers Med Sci,2014;29(2):831-45.
2葛 瑜,张 林,徐敬云,等.血清TSGF、CA125、CA19-9联合SCC检测在老年宫颈癌诊断中的价值〔J〕.中国老年学杂志,2016;36(21):5358-60.
3张晓丽.LKB1对宫颈癌细胞转录谱的影响及抑癌机制〔D〕.济南:山东大学,2014.
4崔 洁,宋丽萍,赵 红,等.周剂量顺铂和奈达铂同步放疗治疗中晚期宫颈癌72例临床分析〔J〕.北华大学学报(自然科学版),2014;15(3):358-61.
5Balleyguier C,Fournet C,BenHassen W,etal.Management of cervical cancer detected during pregnancy:role of magnetic resonance imaging〔J〕.Clin Imag,2013;37(1):70-6.
6王素琴,安红军,徐胜东,等.老年宫颈癌患者首次治疗的预后及危险因素〔J〕.中国老年学杂志,2016;36(6):1363-4.
7刘 晨.宫颈癌放射抗拒细胞株的建立及其抗拒机制的初步研究〔D〕.重庆:第三军医大学,2013.
8Uezono H,Tsujino K,Ota Y,etal.Pelvic insufficiency fracture after definitive radiotherapy for uterine cervical cancer:retrospective analysis of risk factors〔J〕.J Radiat Res,2013;54(6):1102-9.
