微波消融联合经肝动脉化疗栓塞术对肝癌患者免疫功能、AFP水平及生存时间的影响
2018-02-27刘建平范耀刚刘德钦汪俊州王义刚孙昌勤周建平
刘建平 熊 勇 范耀刚 刘德钦 汪俊州 王义刚 栗 粟 孙昌勤 周建平
(攀枝花市中心医院肝胆外科,四川 攀枝花 617067)
肝癌发病年龄40~50岁,且男性发病率高于女性〔1〕。肝癌的死亡率在消化系统恶性肿瘤中仅次于胃癌和食管癌〔2〕。临床行肿瘤手术切除是肝癌主要的治疗方法,但由于早期肝癌临床症状缺乏特异性,确诊时患者大多数已处于肝癌晚期,从而错失了最佳手术时期〔3〕。相关研究显示,目前肝癌患者中能承受外科手术切除治疗的仅占10%~20%,而且术后复发率较高、预后差,所以介入微创治疗已成为中晚期肝癌患者的最佳治疗选择〔4〕。经肝动脉化疗栓塞术(TACE)和微波消融术(MWA)是目前针对无法进行手术的肝癌患者的主要介入治疗手段,但两种介入治疗手段都存在局限性,临床效果也不佳,如TACE无法完全杀死肿瘤细胞,肿瘤细胞易复发及转移;MWA在面对较大瘤体时容易出现治疗漏洞导致治疗不彻底,降低疗效〔5~7〕。本研究将同期接受TACE和接受MWA、TACE联合治疗的患者各项临床指标进行对比,旨在探讨MWA联合TACE对肝癌患者免疫功能、甲胎蛋白(AFP)水平及生存时间的影响。
1 资料与方法
1.1一般资料 2011年1月至2013年7月接受治疗的中晚期肝癌患者90例。纳入标准:(1)经影像学检查、AFP或穿刺病理学结果确诊为肝癌的患者,且TNM分期为Ⅲ~Ⅳ期;(2)肿瘤最大直径均≥5.0 cm患者;(3)无法行手术切除治疗患者;(4)肝功能 Child A 或 B 级,无肝性脑病及利尿、保肝治疗病史患者;(5)病例及随访资料完整,治疗依从性高。排除标准:(1)合并有其他肿瘤疾病;(2)弥漫性肝癌及发生转移者;(3)严重凝血功能障碍者;(4)有门静脉高压导致上消化道出血既往病史者;(5)败血症、胆系感染、肝脓肿病史患者;(6)混有粒子植入、射频消融等其他介入治疗方式者。采用随机数字表法将所有患者分为观察组和对照组各45例,对照组男21例,女24例,年龄25~70岁,平均(53.12±7.65)岁;其中单个病灶20例,多个病灶25例;肝硬化19例,非肝硬化26例。观察组男23例,女22例,年龄25~72岁,平均(52.26 ±6.99)岁,其中单个病灶22例,多个病灶23例;肝硬化20例,非肝硬化25例。两组患者年龄、性别、病灶个数及肝硬化情况等一般资料差异无统计学意义(P>0.05),具有可比性。
1.2术前准备 两组患者术前均进行血常规、生化常规、乙型肝炎五项、凝血功能及传染病三项等常规检查,检测AFP指标;经胸片、CT、腹部彩超或MRI检查确定肿瘤位置及情况。
1.3治疗方法 对照组行TACE术,在数字减影血管造影(DSA)下,经股动脉穿刺插管,常规消毒,采用1%利多卡因麻醉,然后经右股动脉进行穿刺,选择性插入腹腔动脉干及肠系膜上动脉行DSA,在造影后可以观察肿瘤病灶染色情况和血液供应情况。采用5FRH导管选择性插入至肿瘤供血动脉,将表阿霉素(60 mg/m2)、5-氟尿嘧啶(15 mg/kg)、奥沙利铂(85 mg/m2)及碘化油10~20 ml先后注入,混合成乳剂进行肿瘤病灶栓塞,直到肿瘤病灶内碘化油均匀沉淀、再次造影确定肿瘤供血血管是否完全栓塞,确定后将各导管和股动脉鞘管拔出,对穿刺点进行压迫止血,行加压包扎。根据患者病情变化,TACE可适当重复2~3次,每次间隔时间需4~6 w。观察组行TACE及 MWA联合术,在患者TACE 治疗1~2 w后,根据肿瘤体缩小程度及时制定MWA治疗方案。依照患者肿瘤病灶位置选择超声或CT进行定位,定位后常规消毒、铺巾、局部麻醉,在超声或CT的引导下穿刺针进入肿块中心位置,根据患者耐受程度以及肿块的大小、形态确定射频时间、次数、功率及进针方向,治疗过程中持续监测患者生命体征,消融范围应超过肿瘤边缘1 cm左右,选择功率50~70 W,消融时间5~10 min,以达到可能浸润部分肿瘤充分杀灭的目的。术后给予止血、抗感染及保肝等对症治疗。
1.4观察指标 所有患者在治疗前和治疗1个月后抽取空腹静脉血2 ml,将血液与2 ml淋巴细胞分离液混合,采用1 500 r/min离心10 min,采集淋巴细胞层,采用流式细胞仪检测两组患者各个时间段CD4+、CD8+淋巴细胞、自然杀伤(NK)细胞等免疫指标水平变化情况;比较两组患者的AFP水平;治疗后每1~3个月随访一次,随访主要终点为死亡,随访时间为期3年,主要通过电话、上门、门诊复查等方式进行随访,记录两组患者生存时间、不良反应和复发率。
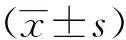
2 结 果
2.1两组治疗前、治疗1个月后免疫指标比较 对照组治疗前后CD4+、CD8+淋巴细胞、NK细胞水平差异无统计学意义(P>0.05)。治疗1个月后观察组NK细胞和CD4+淋巴细胞水平显著升高,CD8+淋巴细胞水平显著降低(P<0.05),且观察组NK细胞和CD4+淋巴细胞水平显著高于对照组,CD8+淋巴细胞水平显著低于对照组(P<0.05)。见表1。
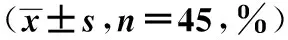
表1 两组治疗前、治疗1个月后免疫指标比较
与治疗前比较:1)P<0.05
2.2两组AFP水平对比 治疗前,观察组AFP水平为(498.55±421.32)ng/L,对照组为(482.15±421.09)ng/L,治疗1个月后,观察组AFP水平为(186.57±158.93)ng/L,对照组为(312.35±278.23)ng/L,治疗前,两组AFP水平比较差异无统计学意义(t=0.185,P=0.854);治疗1个月后,两组AFP水平较治疗前均显著降低(t=4.648、2.257,P=0.000、0.026),且观察组AFP水平显著低于对照组(t=4.825,P=0.000)。
2.3两组生存率对比 观察组1、2、3年生存率均显著高于对照组(P<0.05)。见表2。
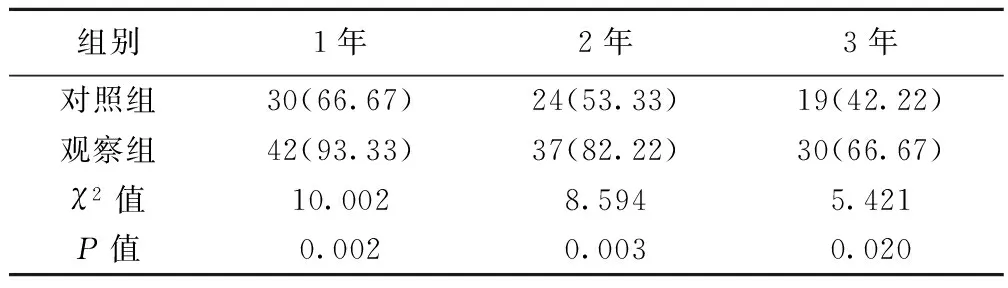
表2 两组患者生存率对比〔n(%),n=45〕
2.4两组不良反应发生率比较 两组血小板减少、上消化道出血、白细胞减少、咳血等不良反应发生率比较差异无统计学意义(P>0.05)。见表3。
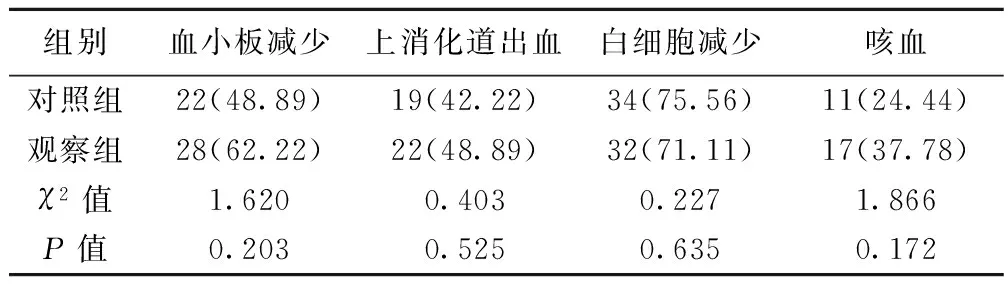
表3 两组患者不良反应发生率比较〔n(%),n=45〕
2.5两组复发率比较 3年内,观察组15例复发,复发率为33.33%(15/45),对照组25例复发,复发率为55.56%(25/45),两组复发率比较差异有统计学意义(χ2=4.500,P=0.034)。
3 讨 论
肝癌因发病隐匿,恶性程度高,多数患者发现时已处于中晚期而无法接受手术治疗,因此研究治疗肝癌的非手术方案极为重要〔8〕。TACE是近年来治疗肝癌中晚期患者的首选方法,具有较好的近期疗效,但由于肝脏肿瘤供血相对复杂,TACE治疗多次穿刺容易引起肝动脉、肠系膜动脉狭窄,建立侧支循环易促使肿瘤生长,肿瘤周边及包膜下的癌细胞无法彻底杀死,增加肿瘤转移和复发率,远期预后效果差〔9〕。本文研究结果显示,TACE联合MWA治疗能明显延长患者治疗后的生存时间,减少复发率。相关研究显示〔10,11〕,肝癌是恶性程度较高的肿瘤,术后易复发,死亡率较高,如患者不接受治疗,生存周期仅2~6 w,而由此可见两种手术方法均能提高患者生存时间。TACE通过肿瘤供血动脉直接注射化疗药物,有效浓度高,效果好、疗效快,而MWA治疗能有效消除TACE治疗后残留的病灶,MWA联合TACE治疗能结合两种方法的优势,进而更好的改善预后,减少复发率。
MWA是一种在影像引导下通过微波辐射使得病灶组织受到高温凝固坏死,从而达到治疗目的的热消融技术,但是对于瘤体较大者,在三维空间上易存在治疗漏洞导致治疗不彻底,降低了疗效〔12〕。相关研究显示,肝癌患者均有不同程度的免疫功能紊乱或障碍。本文研究结果说明TACE联合MWA治疗肝癌中晚期能有效纠正患者免疫功能紊乱,提高患者免疫功能。其原因主要是TACE治疗虽然能有效抑制肿瘤对免疫功能的影响,但反复TACE治疗对患者正常肝组织损害较大,所以单纯TACE治疗对免疫功能纠正效果不佳。TACE联合MWA治疗,MWA灭活肿瘤组织后,机体免疫系统受到肿瘤组织抑制较小,抗原呈递细胞数量增加,导致抗原提呈效率得到提升,且MWA治疗创伤较小,对机体免疫功能的影响也较小〔13〕。TACE联合MWA治疗通常是通过微波热毁损作用清除局部残留的肿瘤病灶,热凝掉肝癌侧支血管网,从而达到抑制肿瘤转移及继续生长的目的。本文结果还显示TACE联合MWA治疗能有效降低肝癌患者AFP水平,延长患者生存期。分析原因AFP是一种糖蛋白,主要来自胚胎的肝细胞,并在胎儿出生2 w左右消失,所以正常成年人血清中AFP的水平极低,当肝细胞出现癌变时,肝细胞恢复产生AFP的功能,随着癌变的进展血清中AFP也含量也急剧增加〔14〕,通过TACE联合MWA治疗后,AFP水平随着患者病情的恢复而逐渐下降。并且两种治疗方法具有相似的安全性。
综上所述,相对TACE,TACE联合MWA治疗肝癌更能有效提高患者免疫功能,降低患者AFP水平及复发率,改善预后,提高患者生存时间。
1唐海峰,乔 敏,袁翠云,等.肝动脉灌注化疗栓塞联合微波消融对肝癌患者AFP水平、复发率及生存时间的影响〔J〕.癌症进展,2016;14(10):1019-21.
2Yan SY,Zhang Y,Sun C,etal.Comparison of real-time contrast-enhanced ultrasonography and standard ultrasonography in liver cancer microwave ablation〔J〕.Exp Ther Med,2016;12(3):1345-8.
3张金梁,翟 博,方泰石,等.晚期肝癌和复发性肝癌治疗的研究进展〔J〕.现代生物医学进展,2016;16(2):358-61.
4赵 鹏,郑加生,张洪海,等.肝动脉导管化疗栓塞联合 CT 引导精准微波消融治疗原发性肝癌的疗效及影响因素〔J〕.中华肿瘤杂志,2016;38(2):138-45.
5Chetboun M,Kianmanesh R,Sommacale D,etal.Complete necrosis after microwave thermosphere ablation of liver metastases from colorectal cancer,histological proof of efficacy〔J〕.J Surg Oncol,2016;113(7):843-4.
6李 梅,姚 乐,程 媛,等.肝动脉化疗栓塞联合微波消融治疗中晚期肝癌的疗效观察〔J〕.现代肿瘤医学,2015;23(16):2351-5.
7疏 云,王洪云,陶黎明,等.经肝动脉化疗栓塞联合微波消融治疗大肝癌的疗效观察〔J〕.实用癌症杂志,2014;29(8):996-8.
8邓 兴,胡 鸿,游 箭,等.TACE联合微波消融治疗原发性肝癌的效果分析〔J〕.西部医学,2016;28(4):524-7.
9李 征,米登海,杨克虎,等.经动脉化疗栓塞联合微波消融治疗肝癌有效性和安全性的系统评价〔J〕.介入放射学杂志,2015;24(11):957-63.
10宋 泽,李 虹,齐 翰,等.CT导向下微波消融治疗肝癌肺转移瘤的疗效〔J〕.实用医学杂志,2015;31(1):57-60.
11Chiang J,Cristescu M,Lee MH,etal.Effects of microwave ablation on arterial and venous vasculature after treatment of hepatocellular carcinoma〔J〕.Radiology,2016;281(2):617-24.
12Philips P,Groeschl RT,Hanna EM,etal.Single-stage resection and microwave ablation for bilobar colorectal liver metastases〔J〕.Br J Surg,2016;103(8):1048-54.
13姚 征,陈玉堂,郝伟远,等.经导管化疗栓塞联合经皮微波消融治疗中晚期肝癌临床分析〔J〕.中华全科医学,2015;13(5):731-3.
14Luo X,Zhang B,Dong S,etal.Hepatocellular carcinoma with tumor thrombus occupying the right atrium and portal vein:a case report and literature review〔J〕.Medicine(Baltimore),2015;94(34):e1049.
