4种常见毒(药)物GC-MS定性分析的保留时间
2018-02-26刘少丹张大明
刘少丹,闵 涛,王 玫,张大明
(1.山西医科大学法医学院,山西 太原 030001;2.北京市公安司法鉴定中心,北京 100192)
在色谱-质谱定性分析中,保留时间(retention time,RT)或相对保留时间(relative retention time,RRT)是定性结果判定的重要参数。不同应用领域的管理部门或专业组织因各自检测目的不同,对不同检测对象给出的化合物保留时间的规定(即目标物的保留时间与对照品的保留时间之间的最大允许偏差)具有很大差异。国外多数应用领域[1-8]关于GC-MS定性分析阳性结果中保留时间的规定,要求化合物RT的最大允许偏差为2%或±0.1 min。国内各应用领域有关生物样品中药物和农药残留检测的标准或规范中,色谱保留时间的规定多为“待测物与相应标准品的保留时间相同或一致”[9-13];在公共安全行业标准中则认为“生物检材中出现相应色谱峰且空白无干扰”即可[14-15]。2010年之后,生物样品中物质的定性判定标准陆续与国际接轨,将RT的最大允许相对偏差设定为±2%[16-18]。但这个指标能否真正满足法医毒物分析检测的需要,有待进一步商榷。特别值得关注的是,国内现行有效的有关生物样品中药物和农药残留检测的标准或规范中,部分还是在沿用“待测物与相应标准品的保留时间相一致”的要求。本研究通过采用GC-MS的全扫描模式对敌敌畏、甲拌磷、地西泮和艾司唑仑4种常见毒(药)物进行检测,以探讨法医毒物分析中GC-MS检测血样中常见毒(药)物的保留时间与对照品之间的最大允许偏差,以期为法医毒物分析中保留时间的判定指标确定提供科学可靠的实验数据,同时为其他领域中保留时间的规定提供思路。
1 材料与方法
1.1 主要仪器与试剂
GCMS-TQ8030三重四极杆气质联用仪(日本岛津公司),7890A-5875C气相色谱-质谱联用仪(美国Agilent公司),3-30K高速冷冻离心机(德国Sigma公司),PL2002-IC电子天平[梅特勒-托利多仪器(上海)有限公司],10-XC-88L医用低温箱(合肥市齐美电器有限公司)。
敌敌畏、甲拌磷、地西泮和艾司唑仑标准品(1 mg/mL)均购于中国计量科学研究院,磷酸三丁酯(99.8%)和盐酸双苯戊二氨酯(SKF525A,99.8%)均购于美国Sigma公司,甲醇、乙醇及乙酸乙酯为分析纯。
1.2 GC-MS条件
GC-MS条件1和GC-MS条件2在实验室1(Lab1)进行,GC-MS条件3在实验室2(Lab2)进行。
1.2.1 GC-MS条件1
GCMS-TQ8030三重四极杆气质联用仪,色谱柱为Rxi-5MS毛细管柱(30.0m×0.25mm,0.25μm);柱温:初始温度100℃,保持1min,升温速率为10℃/min,至280℃保持5min;载气为He,流速为1mL/min;分流进样,分流比为10∶1,进样体积为1μL。
质谱条件:EI电离源,电子束能量70eV,离子源温度250℃,接口温度270℃,溶剂延迟时间为2min;扫描方式为全扫描,扫描范围为m/z50~450。
1.2.2 GC-MS条件2
GCMS-TQ8030三重四极杆气质联用仪,色谱柱为DB-5MS毛细管柱(30.0 m×0.32 mm,0.25 μm);柱温:初始温度80℃,保持2min,升温速率为10℃/min,至280℃保持5 min;载气为He,流速为1 mL/min;分流进样,分流比为10∶1,进样体积为1μL。
质谱条件如1.2.1节所述质谱条件。
1.2.3 GC-MS条件3
7890A-5875C气相色谱-质谱联用仪,色谱柱为DB-5MS毛细管柱(30.0m×0.25mm,0.25μm);柱温:初始温度100℃,保持1min,升温速率为10℃/min,至230℃保持5min;载气为He,流速为1mL/min;分流进样,分流比为10∶1,进样体积为1μL。
质谱条件如1.2.1节所述质谱条件。
1.3 标准溶液的配制
用甲醇配制质量浓度为100 μg/mL的甲拌磷和敌敌畏混合标准储备液A,用乙醇配制质量浓度为100 μg/mL的地西泮和艾司唑仑混合标准储备液B,分别置于-20℃冰箱冷冻保存。使用时按需稀释成不同质量浓度的标准工作液。
用乙醇配制质量浓度均为1 mg/mL的磷酸三丁酯、SKF525A内标储备液,分别置于-20℃冰箱冷冻保存。使用时稀释成10μg/mL的内标标准工作液。
分别取适量混合标准储备液A,逐级稀释成质量浓度为0.5、1、2、5和10μg/mL的混合标准工作液,每个工作液中均含有2μg/mL的内标磷酸三丁酯。
分别取适量混合标准储备液B,逐级稀释成质量浓度为0.5、1、2、5和10μg/mL的混合标准工作液,每个工作液中均含有1μg/mL的内标SKF525A。
1.4 样品前处理
样品前处理程序:移取血液0.5mL,加1mL乙酸乙酯,超声10 min混匀,-4℃下以10 397×g离心5 min,移取上清液600 μL,添加200 μL不同质量浓度的标准工作液和200 μL内标工作液,摇匀后,取1 μL进样。甲拌磷和敌敌畏(内标为磷酸三丁酯)以Lab1的GC-MS条件1进样和Lab2的GC-MS条件3进样,地西泮和艾司唑仑(内标为SKF525A)以Lab1的GC-MS条件2进样。
抽取编号为1~20的20人份血样,每份血样分别按照上述前处理过程配制成质量浓度为0、1、2、5μg/mL的甲拌磷和敌敌畏的混合加标血样,同一质量浓度的加标血样在每份血样中制备3个。抽取编号为21的血样,按照上述前处理过程配制成质量浓度为0、0.5、1、2、5、10μg/mL的甲拌磷和敌敌畏的混合加标血样,同一质量浓度的加标血样制备11个。
抽取编号为1~20的20人份血样,每份血样分别按照上述前处理过程配制成质量浓度为0、0.5、1、2、5、10μg/mL的甲拌磷和敌敌畏或地西泮和艾司唑仑的混合加标血样,同一质量浓度的加标血样在每份血样中制备6个。
根据预实验,血样添加甲拌磷和敌敌畏的检出限(limit of detection,LOD,信噪比大于3)和2倍检出限(2LOD)分别为0.05 μg/mL和0.1 μg/mL,血样添加甲拌磷和敌敌畏的定量限(limit of quantitation,LOQ,信噪比大于10)和2倍定量限(2LOQ)分别为0.15μg/mL和0.3 μg/mL;血样添加地西泮和艾司唑仑的LOD和2LOD分别为0.03μg/mL和0.06μg/mL,血样添加地西泮和艾司唑仑的LOQ和2LOQ分别为0.1 μg/mL和0.2 μg/mL。配制相应质量浓度的血液添加样品,每个质量浓度制备12个,按照上述前处理方法进行前处理。同时按照1.3节标准溶液的配制,制备相应质量浓度的混合标准溶液,每个质量浓度制备12个。
1.5 进样顺序
按照空白试剂、混合标准工作液、不同浓度加标血样的顺序循环进样,进样过程中均按照0、0.5、1、2、5、10μg/mL的顺序进样,在10μg/mL质量浓度后添加洗针步骤。
1.6 数据处理
血液添加样品RT的绝对偏差即血液添加样品中的RT与标准对照品RT的差值;血液添加样品RT的相对偏差是其绝对偏差与标准对照品RT的比值。血液添加样品RRT的绝对偏差即血液添加样品中的RRT与标准对照品RRT的差值;血液添加样品RRT的相对偏差是其绝对偏差与标准对照品RRT的比值。
本实验中可以忽略样品制备、进样体积、仪器测量所带来的B类不确定度,因此其合成不确定度(UC)可以视为A类不确定度(UA),UA(n)=SD×n1/2,其中SD为标准偏差,n为样品量。扩展不确定度(U)的公式为U=k×UC(n),其中k为包含因子,k=3(置信区间为99%)[19]。
两个实验室保留时间的偏差经SPSS 20.0软件的两样本t检验,发现两个实验室保留时间的偏差差异无统计学意义(P>0.05)。因此分析数据时,将两实验室的数据合在一起处理。本实验中将不符合要求的数据(信噪比小于3或因人为及仪器因素所致不正常的数据)剔除,血液添加样品一共有2316个数据。
2 结 果
2.1 标准溶液保留时间的检测结果
敌敌畏、甲拌磷和内标磷酸三丁酯的RT分别为 5.549 min、11.005 min和 10.349 min(图1),地西泮、艾司唑仑和内标SKF525A的RT分别为19.079 min、22.673 min和17.981 min(图2)。

图1 0.5μg/mL敌敌畏、甲拌磷和磷酸三丁酯混合标准溶液GC-MS条件1总离子流色谱图
表1~2表明,同一质量浓度不同时间进样RT的标准差为0.001~0.015min,不同质量浓度不同时间进样RT 的合成不确定度为2.6×10-4~11.3×10-4,扩展不确定度为7.8×10-4~33.9×10-4。4种毒(药)物标准品RRT的标准差极小,最大的扩展不确定度为5.4×10-4。
表1 4种药物标准品的RT值(Lab1) (±s,min)

表1 4种药物标准品的RT值(Lab1) (±s,min)
注:“-”表示样本数据不符合,已剔除;1)在同质量浓度的12个样本中,符合实验要求的样本量;UC(n)表示合成不确定度
质量浓度/(μg·mL-1)LOD 2LOD LOQ 2LOQ 0.5 1.0 2.0 5.0 10.0合计敌敌畏RT 5.552±0.006 5.557±0.006 5.552±0.003 5.551±0.002 5.551±0.002 5.550±0.001 5.551±0.001 5.545±0.003 5.536±0.001 5.547±0.003 2.9×10-4样本量12 12 12 12 12 12 12 12 12 108 108甲拌磷样本量RT地西泮样本量艾司唑仑样本量--1 2--31)91)21)91)UC(n)12 12 12 12 12 12 84 84 10.999±0.003 10.998±0.001 11.004±0.001 11.004±0.001 11.005±0.001 11.001±0.003 10.993±0.001 11.001±0.005 5.5×10-4 12 12 12 12 12 12 12 96 96 RT 19.068±0.002 19.074±0.002 19.073±0.002 19.079±0.002 19.069±0.010 19.075±0.003 19.073±0.002 19.069±0.002 19.066±0.012 19.070±0.007 7.1×10-4 12 12 12 12 12 12 12 95 95 RT 22.692±0.011 22.681±0.007 22.672±0.003 22.679±0.004 22.671±0.004 22.661±0.011 22.666±0.002 22.662±0.002 22.659±0.015 22.664±0.011 11.3×10-4
表2 敌敌畏和甲拌磷标准品的RT值(Lab2) (±s,min)
表2 敌敌畏和甲拌磷标准品的RT值(Lab2) (±s,min)
注:UC(n)表示合成不确定度
质量浓度/(μg·mL-1)0.5 1.0 2.0 5.0 10.0合计敌敌畏 甲拌磷RT 10.639±0.004 10.639±0.004 10.638±0.003 10.639±0.004 10.639±0.004 10.639±0.004 5.2×10-4 UC(n)样本量12 12 12 12 12 60 60 RT 5.209±0.002 5.209±0.002 5.209±0.002 5.209±0.002 5.210±0.002 5.209±0.002 2.6×10-4样本量12 12 12 12 12 60 60
2.2 血液添加样品保留时间的检测结果
分析血液添加样品保留时间的检测结果时,发现RT和RRT的扩展不确定度分别为6.0×10-4~14.1×10-3和2.5×10-6~5.9×10-5(k=3),可以认为血液添加样品保留时间在同一浓度和不同浓度均比较稳定。
2.2.1 血液添加样品RT的绝对偏差
血液添加样品RT的绝对偏差中,95.42%(2 210/2316)的测试中目标物RT的绝对偏差在±0.02min范围内,100%的绝对偏差在±0.03min范围内。图3A是4种毒(药)物RT的绝对偏差与RT的关系图,发现RT的绝对偏差与RT本身的大小无明显关系。
2.2.2 血液添加样品RT的相对偏差
血液添加样品RT的相对偏差中,97.41%(2 256/2 316)的测试中目标物RT的相对偏差≤0.2%,100%的相对偏差≤0.4%。从图3B可以看出,血液添加样品RT的相对偏差随着RT的增加有减小趋势。
2.2.3 血液添加样品RRT的绝对偏差
所有血液添加样品RRT的绝对偏差在±0.003min范围内。从图4A可以看出,血液添加样品RRT的绝对偏差与RRT本身的大小无明显关系。
2.2.4 血液添加样品RRT的相对偏差
95.38%(2 209/2 316)血液添加样品RRT的绝对偏差≤0.1%,100%的绝对偏差≤0.3%。从图4B可以看出,血液添加样品RRT的相对偏差与RRT本身的大小无明显关系。
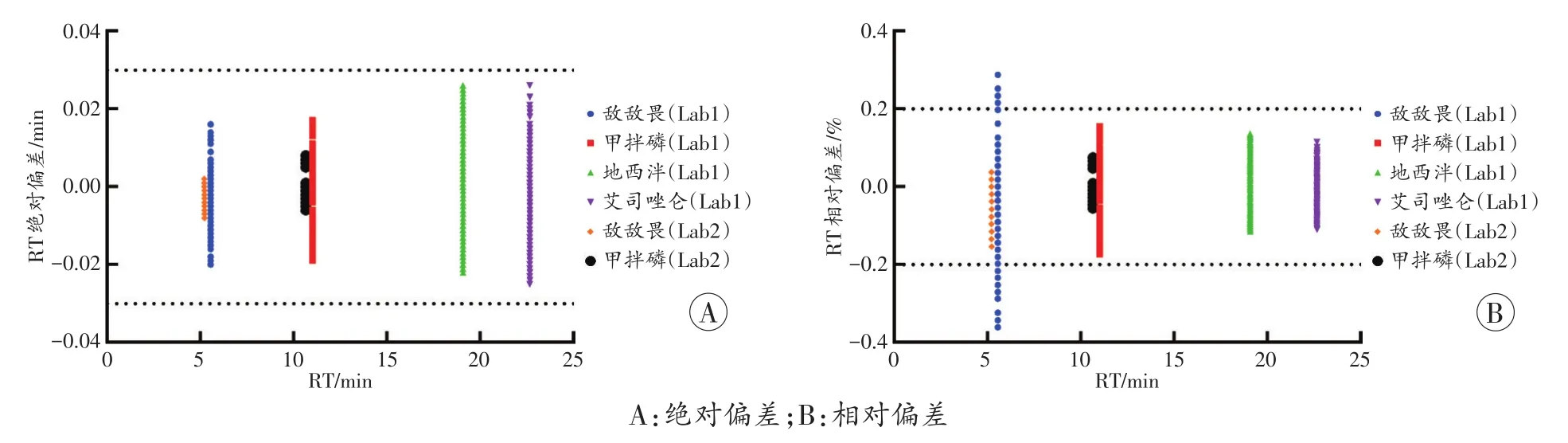
图3 血液添加样品RT的绝对偏差和相对偏差

图4 血液添加样品RRT的绝对偏差和相对偏差
3 讨 论
3.1 RT的判定
通过分析RT的扩展不确定度发现,即使是LOD附近的RT也比较稳定。因此可以认为两个实验室敌敌畏、甲拌磷、地西泮和艾司唑仑对照品的RT均比较稳定。
根据RT的偏差和趋势,用血液添加样品RT的相对偏差作为标准是不合理的。首先,如果采用相对偏差标准,即随保留时间的增加,相对偏差应该处于一个较稳定的变化范围,但是实验结果表明,相对偏差随保留时间的增加有减小趋势。其次,如果采用相对偏差标准,表示随保留时间的增加绝对偏差也在增加,但是实验结果表明,随保留时间的增加,绝对偏差相对独立。第三,国内司法鉴定技术规范[16-17]及公共安全行业标准[18]中,气相色谱RT的相对偏差标准为±2%,即当保留时间为1min时,相对偏差为±0.02min,当保留时间为20min时,相对偏差为±0.4min,这明显不符合实验结果。因此RT的参考标准推荐采用绝对偏差标准。本实验结果表明,RT的绝对偏差≤0.03min,而“指南”[2,4-5,20-22]中RT的绝对偏差判定为≤0.05~0.2min,因此,本研究认为血液添加样品RT绝对偏差的判定指标选择≤0.05min比较合理。
3.2 RRT的判定
通过对敌敌畏、甲拌磷、地西泮和艾司唑仑对照品RRT扩展不确定度的分析,发现RRT在同一浓度及不同浓度均比较稳定。
美国农业部农业市场服务署(United States Department of Agriculture/Agricultural Marketing Service,USDA/AMS)发布的《农药数据程序》(Pesticide Data Program,PDP)[20]给出RRT的绝对偏差标准为±0.01min,与本实验结果相比较,此标准过于宽松,判定范围相差较大。因此不建议采用RRT的绝对偏差来设立判定指标。在国际反兴奋剂机构(World Anti-Doping Organization,WADA)2010年发布的《色谱-质谱法定性分析的判定标准》[4]和《残留分析质量控制指南》[23]中,设立RRT的相对参考标准分别为≤1%和≤0.5%,本实验结果在±0.3%内变化,符合其规定。因此,血液添加样品RRT相对偏差的判定标准选择±0.5%较为合理。
对于色谱保留时间的“待测物与相应标准品的保留时间相同或一致”[9-13]及“生物检材中出现相应色谱峰且空白无干扰”[14-15]的判定指标不具备可操作性,而RT的最大允许相对偏差设定为≤2%[16-18]又显得过于宽松,可能造成假阳性结果。本研究在血样中添加敌敌畏、甲拌磷、地西泮和艾司唑仑,进行多次测试,根据测试结果推荐RT的最大允许偏差为±0.05min,即3.0s,血液添加样品RRT的最大允许偏差为±0.5%。需要指出的是,此结果系基于本实验室所用仪器、测试条件及所涉目标物得出。
